Se estudió la relación entre la calidad del sueño y la memoria en el envejecimiento sano.
MétodoParticiparon 99 personas mayores de 50 años, 69 mujeres y 30 hombres, con una media de edad de 68,74 años (DT=7,18) y sin patologías asociadas. Se aplicaron las pruebas aprendizaje de palabras y pares visuales asociados mediante versiones computarizadas así como el cuestionario índice de calidad de sueño de Pittsburgh para evaluar la calidad del sueño.
ResultadosLos resultados mostraron que el índice de calidad de sueño de Pittsburgh estaba relacionado negativamente con el rendimiento en las pruebas de pares visuales asociados y de aprendizaje de palabras. A peor calidad del sueño peor rendimiento en estas 2 pruebas de memoria. Además, el rendimiento en la prueba de pares visuales asociados estuvo negativamente relacionado con la calidad subjetiva de sueño, la duración y las perturbaciones del sueño. El rendimiento en la prueba de aprendizaje de palabras estuvo relacionado negativamente con la calidad subjetiva del sueño y la eficiencia. Se encontró un efecto débil del género de los participantes sobre el rendimiento en pares asociados y la latencia de sueño.
ConclusionesLos profesionales a cargo de personas de la tercera edad deberían tomar en consideración el efecto negativo de la baja calidad del sueño sobre la memoria. El deterioro de la cognición en estos pacientes puede ser manifestación del desequilibrio neuroendocrino asociado a la rotura de los ritmos circadianos. Sería necesaria más investigación para probar esta hipótesis.
To study the relationship between sleep quality and memory in healthy ageing.
MethodsThe study included 99 people older than 50 years (69 women and 30 men; mean age, 68.74±7.18 years) with no associated diseases. Patients completed digital versions of the Word Learning and Visual Paired Associates tests and the Pittsburgh Sleep Quality Index questionnaire to assess the quality of sleep.
ResultsPittsburgh Sleep Quality Index score was negatively correlated with Visual Paired Associates and Word Learning test performance. Performance in these 2 memory tests decreased in line with sleep quality. In addition, performance in Visual Paired Associates test was negatively correlated with subjective sleep quality, duration, and sleep disturbances. Performance on the Word Learning test was negatively correlated with subjective sleep quality and efficiency. Participants’ sex showed a weak effect on Visual Paired Associates performance and sleep latency.
ConclusionsMedical professionals working with elderly patients should take into consideration the effect of poor sleep quality on memory. Cognitive impairment in these patients may be a manifestation of a neuroendocrine imbalance due to a disrupted circadian rhythm. More research is needed to prove this hypothesis.
El aumento de la esperanza de vida se asocia a una mayor prevalencia de enfermedades neurodegenerativas. Un reto de las neurociencias aplicadas es el establecimiento de sistemas rápidos y sencillos para el diagnóstico temprano de los trastornos cognitivos. Sin embargo, el estudio de los cambios cognitivos asociados a la edad es una tarea metodológicamente compleja ya que la comorbilidad de trastornos del sistema nervioso durante el envejecimiento es un factor de confusión.
El envejecimiento normal presenta un incremento en la variabilidad interindividual de las funciones cognitivas y se sabe que la educación, los factores genéticos, los estados de salud previos, los estilos de vida, la historia ocupacional y elementos socioculturales, entre otros, son variables que influyen sobre las distintas capacidades a lo largo de la vida y determinan su estado en la vejez1-4.
En el envejecimiento sano ocurren cambios neurales que no necesariamente se manifiestan como discapacidades funcionales y se entiende que los cambios cognitivos asociados a la edad muestran un continuo relativamente estable que pocas veces evoluciona a la demencia5. Los cambios fundamentales detectados están en el rendimiento atencional, la memoria operativa, el aprendizaje, la memoria a largo plazo, el lenguaje, y las funciones visoespaciales y ejecutivas1.
La memoria a largo plazo presenta características distintivas durante el envejecimiento y su declive puede obedecer a alteraciones en los procesos de codificación, de almacenaje, de recuperación o de trastornos en la interacción de la codificación y la recuperación6-9. Durante esta etapa puede existir un déficit en el procesamiento atencional de la información con la que se opera para dar solución a las tareas10-12 y un déficit en las funciones ejecutivas13 que pudieran ser responsables del deterioro de la memoria operativa14.
Aunque son constructos diferentes, es difícil metodológicamente separar la evaluación de la atención y de la memoria operativa. Esta última es la representación consciente y manipulación temporal de la información necesaria para realizar operaciones cognitivas complejas, como el aprendizaje, la comprensión del lenguaje o el razonamiento15. Sus sistemas neurales presentan solapamiento. La corteza prefrontal y el hipocampo están conectados por diferentes circuitos que deben mantenerse íntegros para garantizar un envejecimiento cognitivo sano. Con la edad en el hipocampo se presenta una reducción de la densidad postsináptica, lo que indica tal vez la aparición de sinapsis silentes no funcionales16 y se han detectado cambios aberrantes en la trascripción genética que afecta a la capacidad del cerebro para aprender y recordar17. Sin embargo los sistemas prefrontales envejecen a un ritmo más rápido que los lóbulos temporales presentando pérdida de sinapsis y regresión de dendritas apicales18, lo que explicaría el patrón cognitivo de la tercera edad donde tempranamente se afectan los procesos de memoria operativa, atención y flexibilidad cognitiva19.
Sueño en la tercera edadLos patrones del sueño y su ritmo circadiano están modulados por los sexoesteroides para los cuales existen receptores en los núcleos supraquiasmáticos del hipotálamo. Los cambios en las concentraciones plasmáticas de estos esteroides en dependencia de la etapa del desarrollo del individuo (niñez, pubertad, vejez) producen cambios en el sueño20-22.
La prevalencia de una pobre calidad del sueño es alta en la población adulta, existiendo una relación directa entre la edad y el deterioro de la calidad y cantidad del sueño23,24. Estas alteraciones se producen en especial en las mujeres debido a la disminución en los niveles de esteroides sexuales22,25.
Durante el sueño tiene lugar una reorganización extensa del sistema nervioso central24 y, aunque no está claro si la calidad del sueño influye en la memoria, se ha encontrado que los trastornos del ritmo circadiano afectan a la alerta, la concentración y el rendimiento individual. Ambas etapas del sueño (REM y no REM) mantienen la integridad neuronal y se conoce que la etapa REM es necesaria para el desarrollo cerebral prenatal y el mantenimiento de las funciones cerebrales posnatalmente23,24.
Dado que mucha de la información disponible se obtiene de investigaciones en condiciones estandarizadas en poblaciones clínicas, existe una carencia de información de cómo se manifiesta el rendimiento en tareas de memoria y la calidad percibida del sueño en un entorno comunitario en población envejecida sana.
El presente trabajo constituye una aproximación a este problema.
MétodoParticipantesLa muestra estuvo compuesta por 99 pacientes adultos sanos mayores de 50 años; 69 (69,7%) eran mujeres y 30 (30,3%) hombres, que participaban de las actividades de los centros de la tercera edad «El Parque» y «Concepción Arenal» de Rivas-Vaciamadrid (España). El intervalo de edad fue de 52-87 años, con una edad media de 68,74 años (DT=7,18). El 53,5% tenían nivel escolar primario, el 29,3% nivel secundario y el 16,2% alcanzó el bachillerato. Uno de los participantes (1%) no informó sobre su formación. Todos los participantes fueron evaluados por un geriatra y un neurólogo para descartar la presencia de enfermedades concomitantes que modifiquen la cognición así como trastornos visuales refractarios y daltonismo, que no existía diagnóstico previo de alteraciones del sueño y que no consumían medicamentos que pudiesen interferir en su rendimiento en las pruebas neuropsicológicas. Dado que este estudio no tenía el propósito de diagnosticar desorden neurocognitivo, no se aplicó ningún test para la evaluación del mismo. Para garantizar que las instrucciones fueran comprendidas y las respuestas obtenidas reflejaran la ejecución real de las tareas cognitivas y de la valoración subjetiva del sueño ambos registros fueron hechos por uno de los autores. Las evaluaciones se realizaron en un local con las condiciones de aislamiento y uniformidad necesarias. Todas las sesiones de evaluación se realizaron en horario matutino con una duración aproximada de 35min. La participación fue voluntaria y todos los participantes firmaron el modelo de consentimiento informado. La investigación cumplió con los principios de la Declaración de Helsinki para el estudio con humanos. Al finalizar el estudio a cada participante se le facilitó un resumen de los resultados de su evaluación con sugerencias para su médico de cabecera si se hubiese encontrado alguna anomalía.
ProcedimientoEvaluación de la capacidad de memoria. Para este estudio se diseñó especialmente una batería computarizada (VINCI 1.0)26 que evalúa capacidad de memoria mediante 2 tareas: pares visuales asociados (PVA I y II), y aprendizaje de palabras (AP) inspiradas en subtest de la Escala de Memoria de Wechsler-Revisada27. El orden de administración de las pruebas fue: PVA I, AP y PVA II.
- -
PVA. La prueba se desarrolló en 2 fases. La fase i contó con 3 ensayos. En cada ensayo, 6 pares de colores y figuras abstractas en blanco y negro (125×80 pixeles, 7×4,5cm para cada figura y cada color) se presentan consecutivamente, sobre fondo gris, durante 6,000ms de visualización con 1.000ms de intervalo interestímulo. A continuación, los 6 colores se presentan simultánea y sostenidamente, mientras las figuras abstractas se suceden en orden aleatorio, durante 6.000ms de visualización cada una. La tarea de los participantes es identificar qué color se asocia a cada figura. Pasados 30min, la fase ii de la prueba presenta los 6 colores y la sucesión aleatoria de figuras abstractas. Los participantes deben volver a identificar qué color se asociaba a cada figura. Las variables registradas son: respuestas correctas en PVA I (cantidad) y respuestas correctas en PVA II (cantidad). Se calcula el rendimiento general en la prueba como la sumatoria de ambas variables. La puntuación máxima es de 24 puntos.
- -
AP. Esta prueba contempla 3 fases. En la primera aparecen sucesivamente 15 palabras (durante 1.500ms cada una), después aparece una ventana donde el sujeto o el operador escriben las que recuerdan. En la segunda fase aparecen las 15 palabras durante 90s para que el sujeto pueda visualizarlas. Después aparece una ventana donde el sujeto o el operador escriben las que recuerda. En la tercera fase aparecen en la pantalla sucesivamente 30 palabras, de ellas 15 son viejas y 15 nuevas, el sujeto debe oprimir enter cada vez que vea una palabra nueva y la barra de espacio cada vez que vea una palabra de las mostradas con anterioridad. Se calcula el rendimiento general en AP como la sumatoria de la cantidad de palabras recordadas en la primera y en la segunda etapa. La puntuación máxima es de 30 puntos.
Evaluación de calidad del sueño. Se aplicó el cuestionario Índice de calidad de sueño de Pittsburgh (PSQI)28, el cual fue rellenado por la autora (T. C.) para garantizar la comprensión del mismo y evitar errores en su llenado. Este cuestionario evalúa la calidad del sueño y sus trastornos durante el pasado mes. Consta de 19 preguntas auto-aplicadas (solo estas se incluyen en la puntuación) y 5 evaluadas por la pareja. Las 19 preguntas se agrupan en 7 componentes, cada uno con un rango de 0-3 puntos (puntuación 0 indica que no existe dificultad y 3 una dificultad severa). Los componentes evaluados son: calidad subjetiva del sueño, latencia del sueño, duración del sueño, eficiencia del sueño habitual, perturbaciones del sueño, uso de medicación hipnótica y disfunción diurna. La suma de los valores de los 7 componentes dan una puntuación global con un rango entre 0 y 21 (indicando 0 puntos la ausencia de dificultades y 21 severas dificultades en todas las áreas). Un valor total de PSQI mayor de 5 indica pobre calidad del sueño.
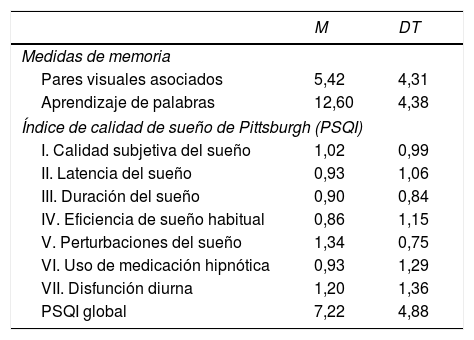
ResultadosLa tabla 1 recoge medias y desviaciones típicas de las puntuaciones obtenidas en PVA, AP y factores del sueño.
Medias (M) y desviaciones típicas (DT) para cada una de las medidas de memoria y factores de sueño
| M | DT | |
|---|---|---|
| Medidas de memoria | ||
| Pares visuales asociados | 5,42 | 4,31 |
| Aprendizaje de palabras | 12,60 | 4,38 |
| Índice de calidad de sueño de Pittsburgh (PSQI) | ||
| I. Calidad subjetiva del sueño | 1,02 | 0,99 |
| II. Latencia del sueño | 0,93 | 1,06 |
| III. Duración del sueño | 0,90 | 0,84 |
| IV. Eficiencia de sueño habitual | 0,86 | 1,15 |
| V. Perturbaciones del sueño | 1,34 | 0,75 |
| VI. Uso de medicación hipnótica | 0,93 | 1,29 |
| VII. Disfunción diurna | 1,20 | 1,36 |
| PSQI global | 7,22 | 4,88 |
Las puntuaciones medias de 5,42 y 12,60 en PVA y AP se sitúan en el percentil 50 de la distribución de valores por lo que el rendimiento puede considerase medio.
La calidad del sueño media es pobre (7,22 puntos). Todos los componentes evaluados mostraron medias cercanas a 1 punto, valor a partir del cual se considera un sueño alterado, predominando las alteraciones en los componentes calidad subjetiva del sueño, perturbaciones del sueño y disfunción diurna.
Se realizaron análisis de varianza (ANOVA) para determinar el efecto del género y nivel escolar sobre las medidas de memoria y factores de sueño del cuestionario PSQI, y se exploró el coeficiente de correlación de Pearson entre la edad, las medidas de memoria y los índices de calidad de sueño.
GéneroEl género afectó al rendimiento en pares visuales asociados, F(1, 98)=10,610;p<0,01; η2=0,103; y a la latencia de sueño, F(1, 98)=7,533; p<0,01; η2=0,076. En pares visuales asociados las mujeres puntuaron más (M=5,98; DT=4,72) que los hombres (M=4,33; DT=2,88). La latencia de sueño también fue mayor en mujeres (M=1,17; DT=1,14) que en hombres (M=0,43; DT=0,63). En ambos casos el tamaño del efecto fue bajo, lo que indicaría un efecto débil del género sobre estas 2 variables. No se encontraron efectos significativos del género sobre el aprendizaje de palabras ni factores de sueño.
Nivel escolarEl nivel escolar afectó significativamente al rendimiento en pares visuales asociados, F(2, 98)=4,559; p<0,05; η2=0,090. Los valores medios alcanzados en esta prueba fue menor en los participantes con formación primaria (M=4,28; DT=3,43) que en los que tenían secundaria (M=7; DT=4,89) y bachillerato (M=6,68; DT=4,77), aunque el tamaño del efecto fue bajo, indicando un efecto débil.
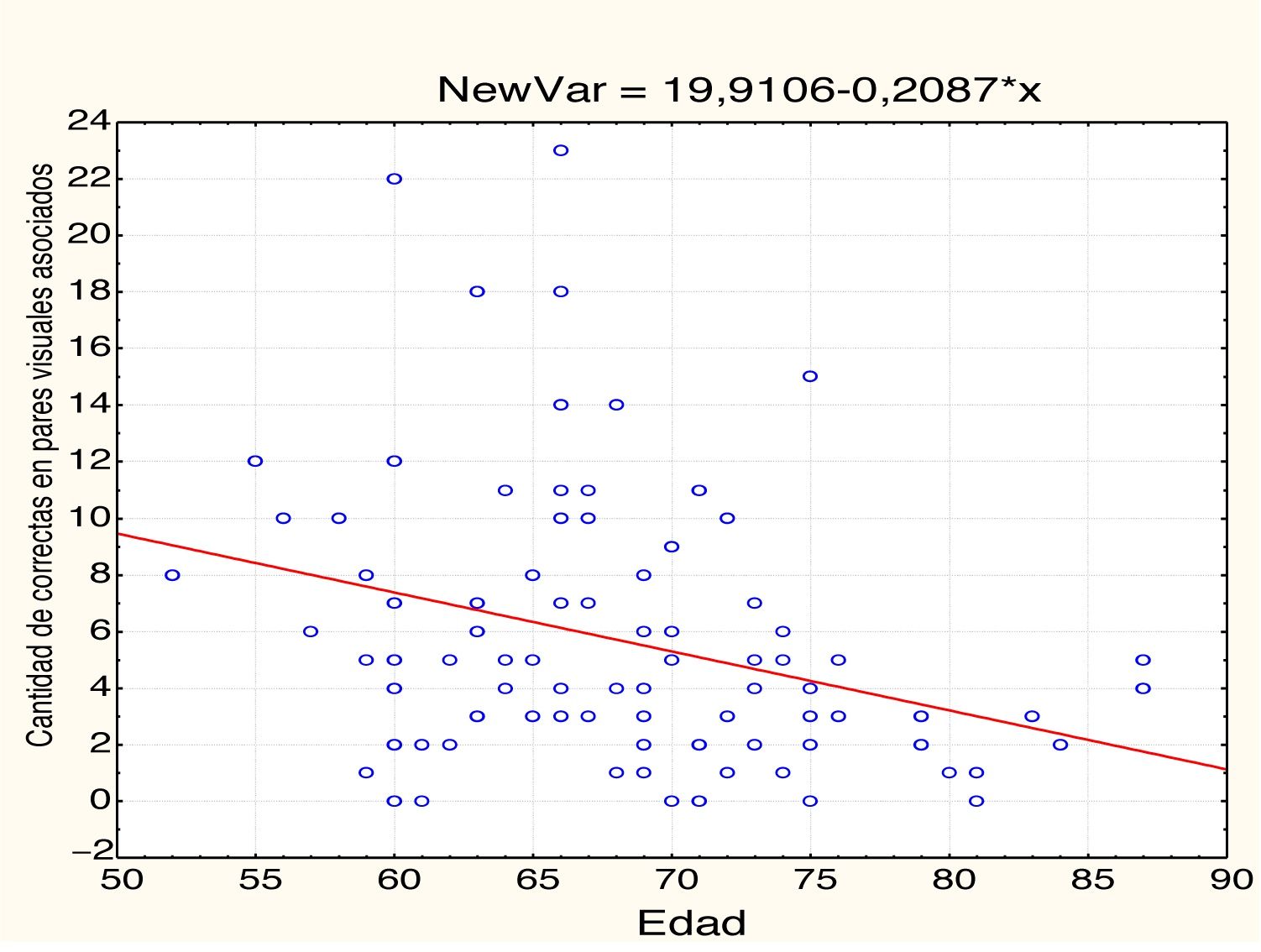
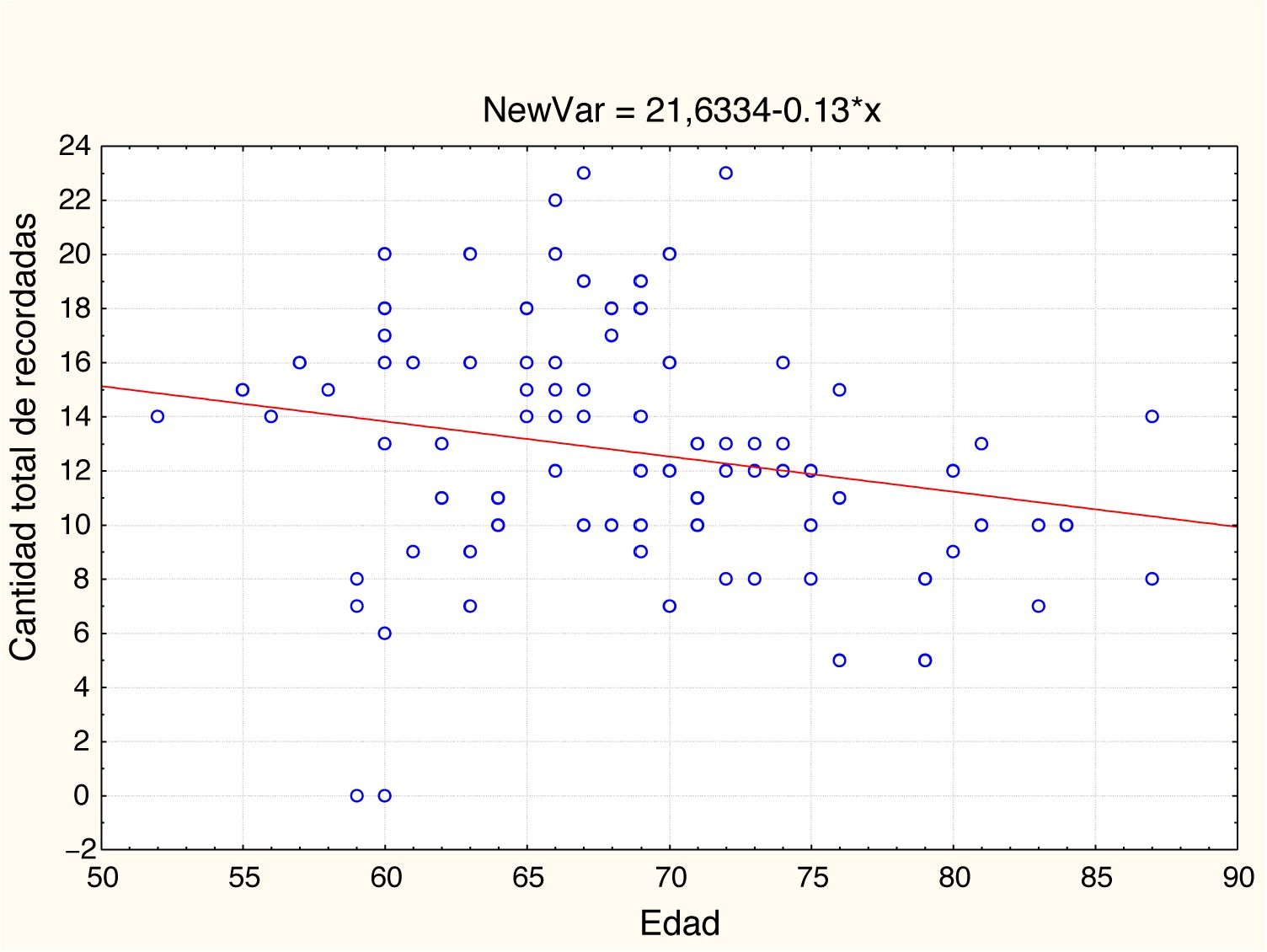
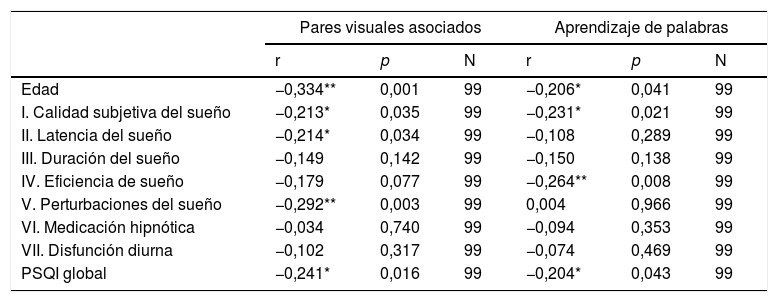
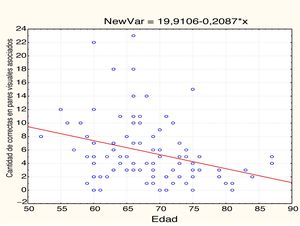
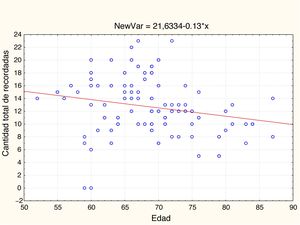
EdadEn la tabla 2 y las figs 1 y 2 se observa el análisis de correlaciones (Pearson bilateral) que muestra que la edad está relacionada negativamente con las 2 medidas de memoria: pares visuales asociados, r(99) =−0,334; p<0,01; y aprendizaje de palabras, r(99)=−0,206; p<0,05.
Correlaciones de Pearson (bilateral) de las puntuaciones de las pruebas de memoria, con la edad y los factores de calidad de sueño
| Pares visuales asociados | Aprendizaje de palabras | |||||
|---|---|---|---|---|---|---|
| r | p | N | r | p | N | |
| Edad | −0,334** | 0,001 | 99 | −0,206* | 0,041 | 99 |
| I. Calidad subjetiva del sueño | −0,213* | 0,035 | 99 | −0,231* | 0,021 | 99 |
| II. Latencia del sueño | −0,214* | 0,034 | 99 | −0,108 | 0,289 | 99 |
| III. Duración del sueño | −0,149 | 0,142 | 99 | −0,150 | 0,138 | 99 |
| IV. Eficiencia de sueño | −0,179 | 0,077 | 99 | −0,264** | 0,008 | 99 |
| V. Perturbaciones del sueño | −0,292** | 0,003 | 99 | 0,004 | 0,966 | 99 |
| VI. Medicación hipnótica | −0,034 | 0,740 | 99 | −0,094 | 0,353 | 99 |
| VII. Disfunción diurna | −0,102 | 0,317 | 99 | −0,074 | 0,469 | 99 |
| PSQI global | −0,241* | 0,016 | 99 | −0,204* | 0,043 | 99 |
La edad no está relacionada con el índice global del sueño en el PSQI, r(99)=0,070; p=0,491, ni con sus componentes, excepto con la eficiencia de sueño habitual, r(99)=0,203; p<0,05.
SueñoLa tabla 2 muestra que el índice global de calidad de sueño (PSQI) estaba relacionado negativamente con el rendimiento en las pruebas de pares visuales asociados y de aprendizaje de palabras. A peor calidad del sueño peor rendimiento en estas 2 pruebas de memoria. Además, el rendimiento en la prueba de pares visuales asociados estuvo negativamente relacionado con la calidad subjetiva de sueño, la duración y las perturbaciones del sueño. El rendimiento en la prueba de aprendizaje de palabras estuvo relacionado negativamente con la calidad subjetiva del sueño y la eficiencia.
DiscusiónEl principal resultado de este estudio es que el rendimiento en memoria para PVA y AP estuvo relacionado negativamente con la edad y el sueño, aunque la edad solo tuvo relación con la eficacia de sueño habitual.
El declinar de las puntuaciones en las pruebas de memoria no necesariamente implica un deterioro cognitivo con manifestaciones clínicas, pues el rendimiento cognitivo global es el resultado final de múltiples redes neuronales modificándose continuamente por los mecanismos de plasticidad.
Un posible factor implicado en el deterioro de la memoria en relación con la edad es el efecto deletéreo del sueño de ondas lentas. Durante el sueño de ondas lentas ocurre el podado de las sinapsis que se acumularon durante el día a partir de la experiencia29. En la tercera edad la densidad sináptica disminuye per se y se mantiene el podado durante esta fase del sueño nREM por lo que existe la teoría de un proceso de sobrepodado sináptico que afectaría la memoria30.
La relación entre escolaridad y cognición ha sido ampliamente estudiada mostrando el efecto protector del nivel de instrucción31-33 que facilita la formación de la reserva cognitiva34-40. El nivel educativo tiene un papel facilitador sobre tareas complejas mediante el incremento de la actividad sináptica, de su densidad en zonas neocorticales de asociación y del desarrollo de redes neurales alternativas, que permiten el establecimiento de circuitos eficientes para el desempeño de funciones cognitivas a través de estrategias más flexibles41. La complejidad de las tareas evaluadas requiere un sustrato neural eficiente que puede estar influenciado por la escolaridad, sobre todo en aquellas pruebas que requieren desempeño ejecutivo33. El efecto del nivel educativo en las tareas de memoria se explica a partir de su componente ejecutivo que puede determinar mejores estrategias de procesamiento32,35,37,38,42.
Aunque se encontró un efecto débil del género sobre la memoria, existen estudios que muestran un patrón diferencial según género en tareas que evalúan memoria verbal y visoespacial43, siendo mejor el rendimiento de las mujeres en tareas con información verbal44,45. La presencia de pobre calidad en el sueño en las mujeres está ampliamente documentada y se conoce que su prevalencia aumenta con la edad al compararlas con hombres de su mismo grupo etario23,46–48. Las mayores afectaciones son la presencia de insomnio, mayor latencia de sueño y mayor uso de medicación para dormir23.
El efecto del género sobre la calidad del sueño puede obedecer a factores hormonales y sus modificaciones durante las etapas del ciclo vital así como a diferencias morfológicas en genes que controlan el ritmo circadiano22,48–50. Los esteroides sexuales organizan los ciclos sueño-vigilia a través de su acción sobre el hipotálamo y el sistema orexina/hipocretina49 y sus receptores varían en dependencia de los niveles sanguíneos de estos51,52. Se ha descrito en la mujer una mayor sensibilidad del sueño a los cambios hormonales46 con un patrón del ritmo circadiano diferente al de los hombres49,50.
El hallazgo encontrado de la relación memoria y sueño tiene antecedentes en la literatura. Existe el consenso de que la pobre calidad en el sueño afecta el rendimiento cognitivo y la memoria de trabajo43,53. Sin embargo, esta relación ha sido poco estudiada en la tercera edad51,52 con metodologías diferentes y resultados variados51,54,55. El deterioro de la calidad del sueño y la memoria pudiera relacionarse con la disminución de neuronas colinérgicas del núcleo basal de Meynert que aparece con la edad. Estas neuronas son responsables de los ciclos de sueño-vigilia e intervienen en la memoria56. Las alteraciones del sueño dependientes del envejecimiento se han explicado también a partir de las modificaciones estructurales cerebrales y la disminución en el volumen cortical51; estas modificaciones pueden resultar también en afectación de la memoria, recordemos el envejecimiento temprano de las áreas prefrontales y su papel en la memoria18,19,57.
La consolidación de la memoria depende de la integridad del sueño52,58 mediante la activación de los circuitos entre el hipocampo y corteza prefrontal durante el sueño de ondas lentas. Esta activación está garantizada por ritmos eléctricos propios del sueño. En la senectud se presentan cambios en la latencia del sueño, despertares más frecuentes, reducción del sueño de ondas lentas y en los ciclos sueño REM/nREM que pueden reducir el rendimiento cognitivo y el proceso de consolidación de memoria52.
ConclusionesLa naturaleza transversal de este estudio no permite inferir el factor causal en la relación inversa encontrada entre sueño y memoria, pero brinda información básica y aplicada.
Desde un punto de vista básico, el deterioro de ambas áreas (cognición y sueño) pueden ser manifestaciones del desequilibrio neuroendocrino asociado a la rotura de los ritmos circadianos. De ser cierta esta hipótesis, podrían diseñarse intervenciones farmacológicas y ambientales para optimizar los ciclos de sueño y disminuir los cambios de memoria asociados a la edad.
Los profesionales a cargo de personas mayores deben tomar en consideración el efecto nocivo de la baja calidad del sueño sobre la memoria.
FinanciaciónFinanciado parcialmente por el Ayuntamiento de Rivas-Vaciamadrid, Concejalía de Asuntos Sociales. El presente trabajo forma parte del Proyecto de Investigación Santander-Universidad Complutense de Madrid PR75/18-21661.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la colaboración de la dirección de los centros «El Parque» y «Concepción Arenal» del municipio de Rivas-Vaciamadrid, y a todos los usuarios que voluntariamente participaron en el estudio.