El carboplatino es un agente quimioterápico utilizado en el tratamiento de tumores de pulmón, cabeza y cuello, riñón, ovarios y mama, y mejor tolerado que el cisplatino con una baja incidencia de complicaciones no hematológicas. Los efectos adversos más frecuentes están relacionados con la supresión medular induciendo anemia, trombocitopenia y neutropenia. La neurotoxicidad habitualmente se relaciona con la neuropatía periférica y ototoxicidad siendo poco frecuente la toxicidad oftalmológica, habitualmente producida con cisplatino. También depende de la vía de administración1: la intracarotídea puede producir edema y eritema palpebral, ptosis, hiperemia conjuntival, quemosis y edema corneal del ojo ipsilateral a la inyección, glaucoma agudo, neuropatía óptica, cambios pigmentarios maculares y desprendimiento de retina exudativo2–5. A nivel orbitario se han detectado casos de seudotumor ipsilateral a la infusión intracarotídea de carboplatino en pacientes con tumores cerebrales6. En cuanto a los efectos adversos derivados de la infusión intravenosa, como el caso que presentamos se han descrito ceguera cortical, dolor ocular, visión borrosa, coriorretinitis y neuritis óptica.
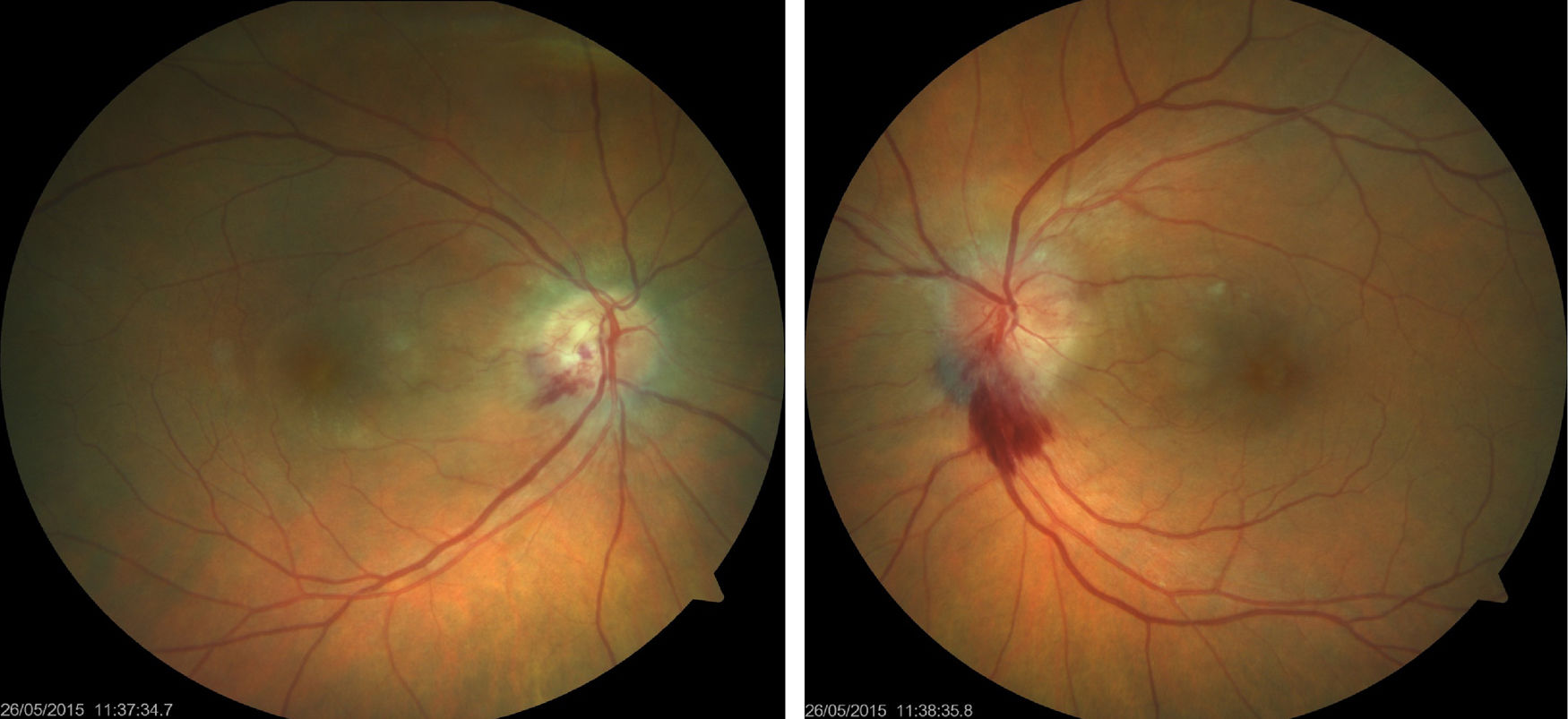
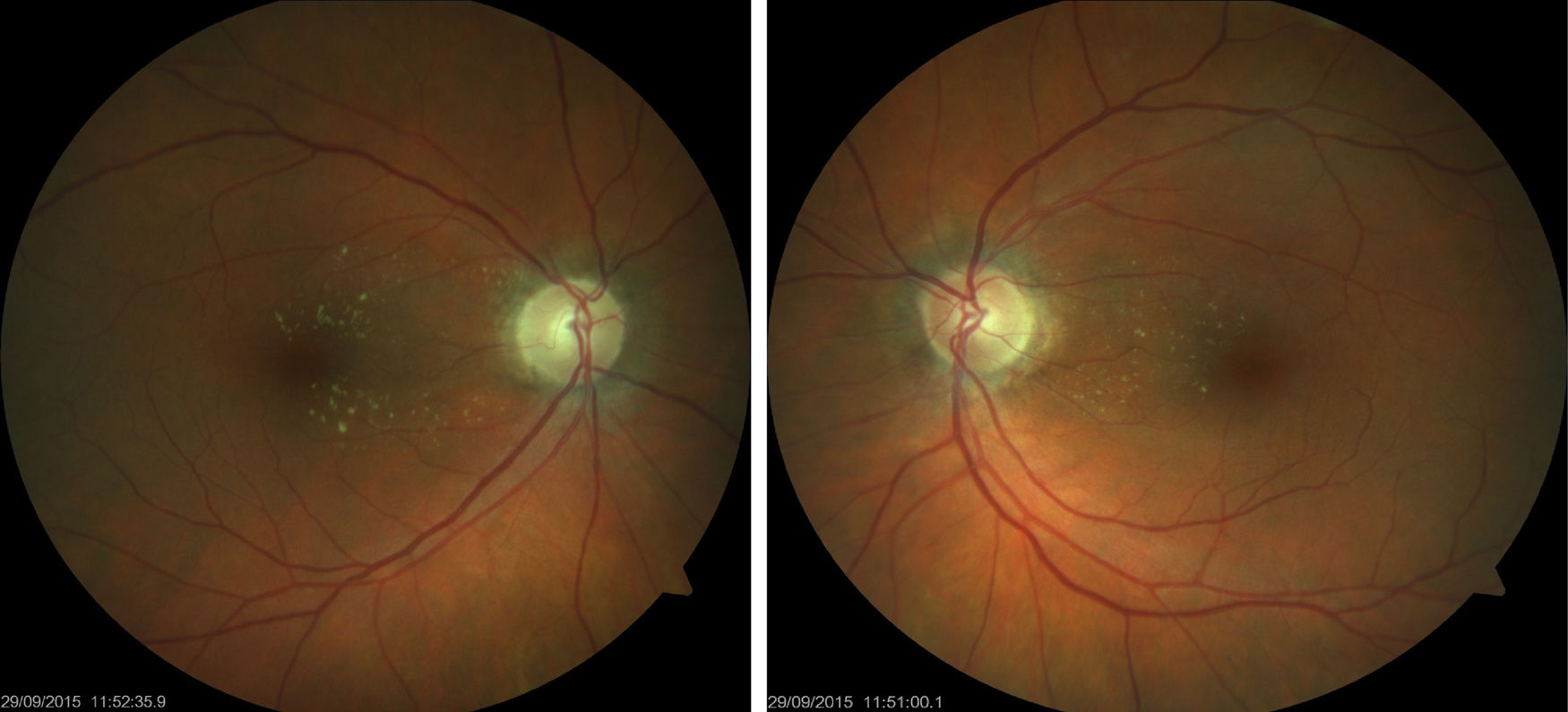
Mujer de 61 años diagnosticada de carcinoma ductal infiltrante de mama tratada con quimioterapia y radioterapia (doxorrubicina-ciclofosfamida, capecitabina-Avastin®) con respuesta inicial favorable pero con progresión posterior y metástasis. Finalmente fue tratada con 4 ciclos de carboplatino a dosis estándar (carboplatino área bajo la curva 6 [AUC6, por sus siglas en inglés] cada 21 días) con buena tolerancia excepto anemia y trombocitopenia. Fue derivada a la consulta de neurooftalmología por disminución de visión en el ojo derecho (OD) de un mes de evolución, coincidiendo con el fin del último ciclo de tratamiento. Su agudeza visual (AV) era de 0,5 en el OD y 0,8 en el ojo izquierdo (OI). La biomicroscopia era normal, así como la presión intraocular en ambos ojos (AO). En el fondo de ojo presentaba edema de papila bilateral con componente hemorrágico y predominio en el OI (fig. 1). La campimetría (Humphrey 24-2) presentaba un defecto en el hemicampo inferior más profundo en el OD. En la tomografía de coherencia óptica (Heidelberg, Engineering Inc, Heidelberg, Alemania) destacaba un engrosamiento de la capa de fibras nerviosas, fundamentalmente en el OI, y aumento de grosor macular en AO de predominio en el OD. Se realizaron pruebas complementarias (punción lumbar y analítica con serología completa) que resultaron normales. En la resonancia magnética destacaban lesiones puntiformes residuales por metástasis cerebrales tratadas, leucoencefalopatía secundaria a radioterapia y trombosis crónica de los senos cavernosos transverso y sigmoideo derechos, ya descritas y sin cambios respecto a resonancias previas, descartándose en el diagnóstico diferencial infiltración tumoral bilateral del nervio óptico, hipertensión intracraneal primaria o secundaria. El oncólogo decidió suspender el tratamiento con carboplatino y el edema de papila desapareció progresivamente en los 4 meses posteriores (fig. 2), con palidez papilar en el OD y cambios atróficos en polo posterior de AO. La AV era de 0,8 en el OD y 1,0 en el OI y en la campimetría (Humphrey 24-2) se apreciaban leve mejoría en la profundidad y extensión de los defectos localizados en hemicampo inferior. En la tomografía de coherencia óptica se observaba disminución del grosor de la capa de fibras del cuadrante superior en AO y mejoría del engrosamiento macular del OD.
En la literatura hay pocos casos descritos de edema de papila por carboplatino y fundamentalmente se asocian a dosis altas y a insuficiencia renal. O’Brien et al. describieron en 1992 dos casos de ceguera cortical en carcinomas ováricos tratados con altas dosis de carboplatino (720 y 900mg, respectivamente). Postulaban que la toxicidad en el sistema nervioso central (SNC) puede producirse por el paso del carboplatino a través de la barrera hemato-encefálica (BHE) en presencia de una excreción renal alterada. Hasta ese momento, los distribuidores de carboplatino solo habían descrito 10 casos de efectos secundarios a toxicidad ocular (dolor ocular, visión borrosa, coriorretinitis, neuritis óptica y alteraciones oculares), pero ninguno de ceguera cortical. En ambos casos se produjo una recuperación prácticamente completa7.
En 1993 Rankin y Pitts presentaron 2 casos de cáncer ovárico tratados con carboplatino que desarrollaron maculopatía, uno de ellos además con atrofia óptica bilateral, lo que podría plantear la presencia de un papiledema previo. La recuperación fue parcial y mayor en los ojos cuya mácula no estaba afectada8. Caraceni et al. publicaron en 1997 el caso de una paciente tratada de cáncer ovárico con asociación de cisplatino y carboplatino que desarrolló papiledema 13 semanas después de acabar el último ciclo. La recuperación no se produjo hasta un año después y fue parcial en el OD y total en el OI. En este trabajo los autores atribuyen dicha toxicidad al cisplatino9. Más recientemente Fischer et al. describieron un caso de papiledema bilateral tras 4 ciclos de tratamiento con carboplatino a dosis habituales. La reversión completa se produjo 2 años después de terminar el tratamiento, aunque con atrofia de fibras del nervio óptico como secuela. En este paciente se utilizaron corticoides sistémicos como tratamiento empírico10.
En 2014 Lewis et al. publicaron un caso de carcinoma ovárico endometrioide de alto grado que desarrolló edema unilateral de papila con fuga de contraste bilateral con 4 ciclos de carboplatino. La dosis utilizada fue estándar y la función renal de la paciente era normal. A los 5 meses de suspender el tratamiento, la paciente desarrolló atrofia de nervio óptico con disminución de AV e indemnidad del ojo adelfo11.
Existen pocos casos descritos de neurotoxicidad central asociada a carboplatino ya que los conocidos se relacionan con tratamiento de cisplatino12. En la mayoría de los pacientes existía una función renal alterada, hipertensión arterial no controlada o dosis elevadas del tratamiento. Aunque como se ha expuesto, tanto en el caso publicado por Lewis et al. como en el que presentamos, no siempre se dan estas circunstancias. La explicación a los posibles mecanismos de la toxicidad del carboplatino es incierta, aunque sí se asocian a la acumulación del mismo en el líquido cefalorraquídeo pues atraviesa la BHE. Los daños específicos del nervio óptico, así como de otras estructuras, podrían relacionarse con el mecanismo de muerte celular que ejerce a través de la alcalinización de los ácidos nucleicos, rotura de la doble cadena de ácido desoxirribonucleico, fallo en la replicación del mismo y en la transcripción del ácido ribonucleico conduciendo a la muerte celular11. La recuperación podría suceder meses o años tras la suspensión del tratamiento, con secuelas como atrofia de capa de fibras nerviosas. No existe ningún tratamiento establecido, aunque en algunos casos se utilizan corticoides orales de forma empírica.
Como conclusión, debe tenerse en cuenta la posible lesión del nervio óptico en pacientes en tratamiento con carboplatino que refieran disminución de la AV o cualquier otro síntoma visual. Además destacar que la supresión del tratamiento con carboplatino resuelve el cuadro clínico aunque con posibles secuelas por atrofia secundaria del nervio óptico.