Uno de los factores contribuyentes en la cronificación de la migraña son los trastornos del sueño que pueden actuar como un factor precipitante y/o perpetuador en estos sujetos. El objetivo primario de este estudio fue identificar los factores predictores relacionados con la calidad del sueño en pacientes con migraña crónica (MC) y el objetivo secundario fue identificar si existían diferencias en variables psicológicas y de discapacidad entre los pacientes con MC que presentaban menor o mayor calidad del sueño.
MétodosSe llevó a cabo un estudio observacional, transversal, formado por 50 participantes con MC. Se registraron una serie de variables demográficas, psicológicas y de discapacidad mediante cuestionarios de autorregistro.
ResultadosSe observaron correlaciones directas, moderadas-fuertes, entre las diferentes variables de discapacidad y psicológicas analizadas (p<0,05). En la regresión, se estableció como variable criterio la calidad del sueño y las variables predictores fueron los síntomas depresivos, la discapacidad relacionada con la cefalea y el catastrofismo ante el dolor que, en conjunto, explican el 33% de la varianza. En cuanto a la comparación de los grupos de mayor y menor afectación del sueño, se encontraron diferencias estadísticamente significativas en la variable de síntomas depresivos (p=0,016) y catastrofismo ante el dolor (p=0,036).
ConclusionesLos factores predictores de la calidad del sueño en pacientes con MC fueron los síntomas depresivos, la discapacidad relacionada con la cefalea y, en menor medida, el catastrofismo ante el dolor. Los sujetos con peor calidad de sueño presentaron mayores niveles de catastrofismo ante el dolor y síntomas depresivos.
One of the factors contributing to transformation of migraine are sleep disorders, which can act as a trigger and/or perpetuating factor in these patients. This study's primary objective was to identify predictive factors related to sleep quality in patients with chronic migraine (CM); the secondary objective was to identify any differences in psychological variables and disability between patients with CM with better or poorer sleep quality.
MethodsA total of 50 patients with CM were included in an observational, cross-sectional study. We recorded data on demographic, psychological, and disability variables using self-administered questionnaires.
ResultsA direct, moderate-to-strong correlation was observed between the different disability and psychological variables analysed (P<.05). Regression analysis identified depressive symptoms, headache-related disability, and pain catastrophising as predictors of sleep quality; together, these factors explain 33% of the variance. Statistically significant differences were found between patients with better and poorer sleep quality for depressive symptoms (P=.016) and pain catastrophising (P=.036).
ConclusionsThe predictive factors for sleep quality in patients with CM were depressive symptoms, headache-related disability, and pain catastrophising. Patients with poorer sleep quality had higher levels of pain catastrophising and depressive symptoms.
La migraña afecta a alrededor del 12,6% de la población adulta española1 y, según los últimos datos sobre el impacto de la migraña en Europa, se ha observado que afecta la calidad de vida (estado mental, físico y de salud), disminuye la productividad y causa elevados costes tanto al sistema sanitario como al paciente que la padece, sobre todo a los pacientes afectos de migraña crónica (MC) que es la forma más incapacitante en la que se presenta la migraña2. Está considerada como un importante problema de salud pública3, afecta aproximadamente a más del 10% de la población mundial adulta y es entre 2-3 veces más común en mujeres4. En 2016 el Global Burden Disease informó que la migraña es la primera causa de años de vida con discapacidad en mujeres y hombres entre 15-49 años en todo el mundo5.
Cada año un 2,5% de los sujetos con migraña episódica pasan a padecer MC6. Dicha transformación se realiza de forma gradual, pasando por un período intermedio en el que los ataques de migraña aumentan claramente en frecuencia para, finalmente, dar lugar a una situación donde se suceden más días padeciendo dolor que sin este. En este sentido se han identificado varios factores que contribuyen a la cronificación de la migraña y, entre ellos, destacan los trastornos del sueño7 que son altamente prevalentes entre los sujetos con migraña8, aumentan la discapacidad y disminuyen la calidad de vida relacionada con la salud de los sujetos9. Una frecuencia alta de ataques de migraña se correlaciona directamente con una peor calidad del sueño10.
Es más frecuente encontrar alteraciones del sueño en la MC que en la episódica11. La relación entre la MC y el sueño es compleja y la evidencia científica muestra que el insomnio es el trastorno del sueño más prevalente entre los pacientes con MC8. El insomnio se define como una dificultad para conciliar el sueño mayor de 30min en el momento en el que corresponde dormir que se presenta durante más de 3 días por semana en más de 3 meses12. El 68-84% de los pacientes con MC sufren síntomas de insomnio a diario o casi a diario11. La presencia de insomnio puede aumentar en un 40% el riesgo de padecer dolor de cabeza, incluida la migraña13.
Sin embargo, los trastornos del sueño en pacientes con MC y su relación con las variables psicológicas y de discapacidad aún no se han estudiado lo suficiente y los datos están limitados debido a la variación metodológica de los estudios. Para aportar más evidencia a la literatura científica, el presente estudio plantea 2 objetivos: el objetivo primario de este estudio fue identificar los factores predictores relacionados con la calidad del sueño en pacientes con MC y el objetivo secundario fue identificar si existían diferencias en variables psicológicas y de discapacidad entre los pacientes con MC que presentaban menor o mayor calidad del sueño.
Material y métodosDiseño del estudioPara llevar a cabo esta investigación se diseñó un estudio de tipo observacional, transversal con un grupo de pacientes con MC. Tras recibir la información detallada sobre el estudio, los participantes firmaron el consentimiento informado. Todos los procedimientos utilizados en este estudio se planificaron según los requerimientos éticos de la Declaración de Helsinki y el estudio fue aprobado por el Comité Ético de Aragón y del Hospital Universitario Miguel Servet de Zaragoza, con número CP03/2015. Este estudio se llevó a cabo de acuerdo a las directrices proporcionadas por la guía STROBE sobre los estudios de tipo observacional14.
Reclutamiento de los participantesLos pacientes se reclutaron en las consultas externas de Neurología del Hospital Universitario Miguel Servet, mediante un método no probabilístico (consecutivo). Todos ellos cumplían con los criterios de inclusión propuestos en el estudio, que fueron: a) diagnóstico de MC, evaluado por un neurólogo especialista en cefaleas y basándose en los criterios de la Clasificación Internacional para el Diagnóstico de las Cefaleas de la Sociedad Internacional de Cefaleas15 y b) edad comprendida entre 18 y 65 años.
Presentar una crisis de migraña en el momento de la evaluación, otro tipo de cefalea, patología crónica y/o neurológica, así como trastornos cognitivos, emocionales y/o psicológicos como trastornos depresivos, de estado de ánimo y/o de ansiedad diagnosticados por personal sanitario y traumatismo o cirugía previa en el cuadrante superior del cuerpo, se establecieron como criterios de exclusión del estudio.
Se evaluaron 65 pacientes, se incluyeron 50 y se excluyeron 15 sujetos, de los cuales 8 no cumplían los criterios de inclusión y 7 rechazaron participar en el estudio.
ProcedimientoEn el estudio se registraron una serie de variables demográficas como la edad, el peso, la altura para obtener el índice de masa corporal, tiempo con MC, situación laboral, así como el máximo nivel de estudios alcanzado. También se evaluaron variables autorregistro de carácter psicológico y de discapacidad utilizando cuestionarios especializados y validados científicamente, llevado a cabo por un evaluador especialista en cefaleas y trastornos craneofaciales.
Para dar respuesta al objetivo secundario, se hicieron 2 grupos en función del nivel de afectación de la calidad del sueño. La subdivisión se hizo en base a la puntuación obtenida en el cuestionario de calidad del sueño y se estableció en la mediana que fue de 11 puntos. En base a este criterio, los sujetos con una puntuación menor a 11 se clasificaron en el grupo de mayor calidad del sueño y, mayor de 11, menor calidad de sueño.
Variables- -
Se utilizó la versión española del Pittsburgh Sleep Quality Index (PSQI) para valorar la calidad de sueño de los participantes del estudio16. El PSQI contiene un total de 19 cuestiones, agrupadas en 10 preguntas. Las 19 cuestiones se combinan para formar 7 áreas con su puntuación correspondiente, cada una de las cuales muestra un rango comprendido entre 0 y 3 puntos. En todos los casos una puntuación de «0» indica facilidad, mientras que una de «3» revela dificultad severa, dentro de su respectiva área. Las áreas en las que se subdivide son: calidad del sueño, latencia del sueño, duración, eficiencia del sueño, uso de medicación para facilitar el sueño y la disfunción diurna. La puntuación de las 7 áreas se suma finalmente para dar una puntuación global, que oscila entre 0 y 21 puntos, donde las puntuaciones más altas representan una peor calidad subjetiva del sueño16. Esta escala ha demostrado propiedades psicométricas satisfactorias y un nivel de consistencia interna de 0,8116.
- -
Se utilizo la versión española del Headache Impact Test (HIT-6) para evaluar la discapacidad relacionada con la cefalea (severidad de la cefalea y repercusión en la vida del paciente). Este cuestionario consta de 6 ítems, ha demostrado propiedades psicométricas aceptables17 y ha sido validado en sujetos con MC18. Los resultados que se obtienen en este cuestionario oscilan entre una puntuación mínima de 36 y máxima de 78 y se pueden dividir en 4 grados dependiendo del grado de repercusión en la vida del paciente: poca o ninguna (HIT-6 puntuación: 36-49), moderada (HIT-6 puntuación: 50-55), importante (HIT-6 puntuación: 56-59) y severa (HIT-6 puntuación 60-78). El mínimo cambio clínicamente relevante en el HIT-6 en sujetos con cefalea crónica diaria se estima entre 2,3 y 2,719,20.
- -
Se utilizo la versión española del Pain Catastrophizing Scale (PCS)21 para evaluar el grado de catastrofización ante el dolor. El PCS está formado por 13 ítems y comprende 3 dimensiones: rumiación, magnificación y desesperanza. Cada ítem se puntúa de 0 (nunca) a 4 (siempre), y la puntuación va de 0 a 52, siendo las puntuaciones más elevadas donde se encuentra el mayor grado de catastrofismo ante el dolor. Esta escala ha demostrado propiedades psicométricas aceptables y un nivel de consistencia interna de 0,7921. El cambio mínimo detectable es de 10,4522. El punto de corte para la detección precoz de las personas con tendencia al catastrofismo ante el dolor es 1123.
- -
La versión española de la Tampa Scale of Kinesiophobia24 se utilizó para evaluar el dolor y el miedo al movimiento. Esta escala consta de 11 ítems y cada ítem presenta una puntuación basada en la escala Likert del 1 al 4 (1=totalmente en desacuerdo y 4=totalmente de acuerdo). La puntuación total se encuentra entre 11 y 44, siendo las puntuaciones más altas donde se encuentra mayor miedo al movimiento y al dolor. Esta escala presenta 2 subescalas: evitación de actividad y daño, y ha demostrado propiedades psicométricas aceptables24.
- -
La versión española del cuestionario Hospital Anxiety and Depression Scale (HADS)25 se utilizó para valorar los síntomas de depresión y ansiedad que presentaban los participantes. Esta escala está compuesta por 14 ítems, los cuales están estratificados por una escala tipo Likert que puntúa de 0 a 4. La depresión y la ansiedad se evalúan de forma independiente, donde la obtención de una puntuación mayor se identifica con un nivel más elevado de depresión y ansiedad. La consistencia interna del cuestionario completo es de 0,90; 0,84 en la subescala de la depresión y 0,85 en la subescala que evalúa la ansiedad25. La diferencia mínima que se considera relevante es alrededor de 1,526. Los puntos de corte para el cuestionario total del HADS oscila entre 8-11 para cada una de las subescalas27.
El tamaño de la muestra se calculó para detectar la fuerza de asociación entre la variable criterio establecida (calidad del sueño) y las variables predictoras. Se calculó la potencia estadística del 80% (1- β probabilidad de error) con una probabilidad de nivel de error de 0,05, se utilizó como prueba estadística una ANOVA y se tomó en cuenta un tamaño del efecto mediano de 0,29; además se planteó el calculó a partir de 5 variables criterio. Esto generó un tamaño total de la muestra de 51 participantes en total. El tamaño de la muestra se calculó con el Programa G*Power 3.1.7 para Windows (G*Power® por la Universidad de Dusseldorf, Alemania)28.
Otra directriz general para calcular el tamaño de la muestra fue la regla de análisis de regresión que explica que se debe de tener entre 5 y 10 participantes por cada variable predictora utilizada en el análisis29; teniendo en cuenta que en este estudio se utilizan 5 variables criterio, el cálculo del tamaño necesario siendo muy exigentes sería de 50 participantes.
Análisis estadísticoEl análisis estadístico se realizo en el programa SPSS versión 21.0 (IBM Co., Armonk, NY, EE. UU.). El nivel de significación para todas las pruebas se estableció en p<0,05. Para todos los resultados se presentan estadísticos descriptivos expresados en media±desviación estándar y rango (mínimo-máximo). Las variables categóricas se presentan en porcentajes de frecuencias relativas. La normalidad de los datos se comprobó con la prueba de Kolmogorov Smirnov (p>0,05).
Se realizó un análisis de regresión lineal múltiple para estimar la fuerza de las asociaciones entre los resultados de la media de la calidad del sueño (variable criterio) y las variables predictoras (discapacidad asociada a las cefaleas, síntomas depresivos y de ansiedad, catastrofismo ante el dolor y kinesiofobia). Se calcularon los factores de inflación de varianza para determinar si había problemas de multicolinealidad en cualquiera de los 2 modelos.
La fuerza de asociación se examinó utilizando coeficientes de regresión (β), valores p y R2 ajustado. Se informaron los coeficientes β estandarizados para cada variable predictora incluida en los modelos finales reducidos para permitir la comparación directa entre las variables predictoras en el modelo de regresión y la variable de criterio que se está estudiando.
Se realizó un análisis para determinar las posibles asociaciones entre las variables medidas mediante el coeficiente de correlación de Pearson. Con un coeficiente de correlación de Pearson mayor a 0,60 se considera que existe una fuerte asociación, entre 0,30 y 0,60 indica una asociación moderada y menor a 0,30 indica una asociación pobre30.
La prueba t de Student fue utilizada para comparar las variables de resultado para los 2 grupos subdivididos a partir de mediana de la variable calidad de sueño, teniendo como resultado un grupo de pacientes con menor calidad de sueño y otro grupo de mayor calidad de sueño. Para los resultados de esta comparación se calculó el tamaño del efecto (Cohen d). Según el método de Cohen, la magnitud del efecto se clasificó como pequeña (0,20-0,49), media (0,50-0,79) o grande (0,8)31.
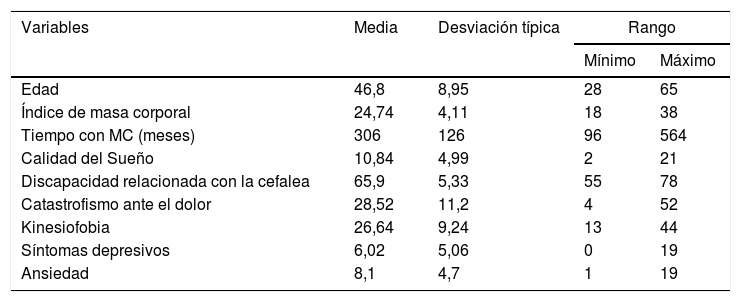
ResultadosUn total de 50 pacientes con MC cumplieron los criterios de inclusión y acordaron ingresar voluntariamente en el estudio. La mayoría de los pacientes del estudio eran mujeres (92,6%). El mayor porcentaje de los pacientes presentaban estudios secundarios (54%), un 24% estudios universitarios y el 22% estudios primarios. Con relación al estatus laboral, un 40% de los pacientes estaban desempleados, un 10% estaban de baja por la enfermedad, un 3% eran jubilados, y los demás pacientes eran trabajadores activos. Los estadísticos descriptivos de las demás variables demográficas y de las medidas de autorregistro se presentan en la tabla 1. El análisis de normalidad mostró que los datos cumplían una distribución normal (p>0,05).
Estadístico descriptivo variables demográficas y autorregistro
| Variables | Media | Desviación típica | Rango | |
|---|---|---|---|---|
| Mínimo | Máximo | |||
| Edad | 46,8 | 8,95 | 28 | 65 |
| Índice de masa corporal | 24,74 | 4,11 | 18 | 38 |
| Tiempo con MC (meses) | 306 | 126 | 96 | 564 |
| Calidad del Sueño | 10,84 | 4,99 | 2 | 21 |
| Discapacidad relacionada con la cefalea | 65,9 | 5,33 | 55 | 78 |
| Catastrofismo ante el dolor | 28,52 | 11,2 | 4 | 52 |
| Kinesiofobia | 26,64 | 9,24 | 13 | 44 |
| Síntomas depresivos | 6,02 | 5,06 | 0 | 19 |
| Ansiedad | 8,1 | 4,7 | 1 | 19 |
MC: migraña crónica.
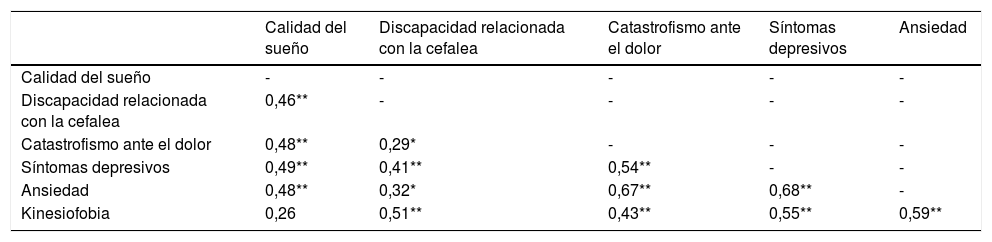
En la tabla 2 se exponen los resultados del análisis de correlación que examina las asociaciones bivariadas entre las medidas de resultado. Las correlaciones más fuertes que se encontraron en magnitud positiva fueron entre los datos de la ansiedad con respecto al catastrofismo ante el dolor (r=0,67; p<0,001) y los síntomas depresivos (r=0,68; p<0,001).
Coeficiente de correlación de Pearson
| Calidad del sueño | Discapacidad relacionada con la cefalea | Catastrofismo ante el dolor | Síntomas depresivos | Ansiedad | |
|---|---|---|---|---|---|
| Calidad del sueño | - | - | - | - | - |
| Discapacidad relacionada con la cefalea | 0,46** | - | - | - | - |
| Catastrofismo ante el dolor | 0,48** | 0,29* | - | - | - |
| Síntomas depresivos | 0,49** | 0,41** | 0,54** | - | - |
| Ansiedad | 0,48** | 0,32* | 0,67** | 0,68** | - |
| Kinesiofobia | 0,26 | 0,51** | 0,43** | 0,55** | 0,59** |
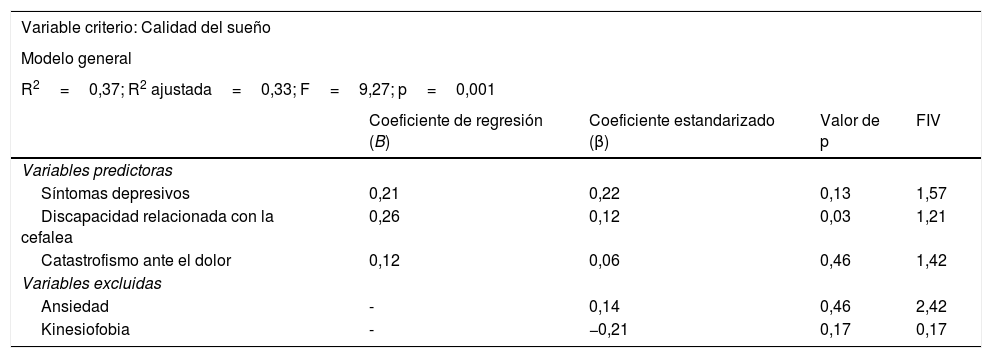
El modelo de regresión lineal para la variable criterio calidad del sueño se presenta en la tabla 3. Las variables predictoras que se encontraron fueron los síntomas depresivos, la discapacidad relacionada con las cefaleas y el catastrofismo ante el dolor que en conjunto explican el 33% de la varianza. Las variables ansiedad y kinesiofobia quedaron excluidas del análisis.
Análisis de regresión
| Variable criterio: Calidad del sueño | ||||
|---|---|---|---|---|
| Modelo general | ||||
| R2=0,37; R2 ajustada=0,33; F=9,27; p=0,001 | ||||
| Coeficiente de regresión (B) | Coeficiente estandarizado (β) | Valor de p | FIV | |
| Variables predictoras | ||||
| Síntomas depresivos | 0,21 | 0,22 | 0,13 | 1,57 |
| Discapacidad relacionada con la cefalea | 0,26 | 0,12 | 0,03 | 1,21 |
| Catastrofismo ante el dolor | 0,12 | 0,06 | 0,46 | 1,42 |
| Variables excluidas | ||||
| Ansiedad | - | 0,14 | 0,46 | 2,42 |
| Kinesiofobia | - | −0,21 | 0,17 | 0,17 |
FIV: factor de inflación de la varianza.
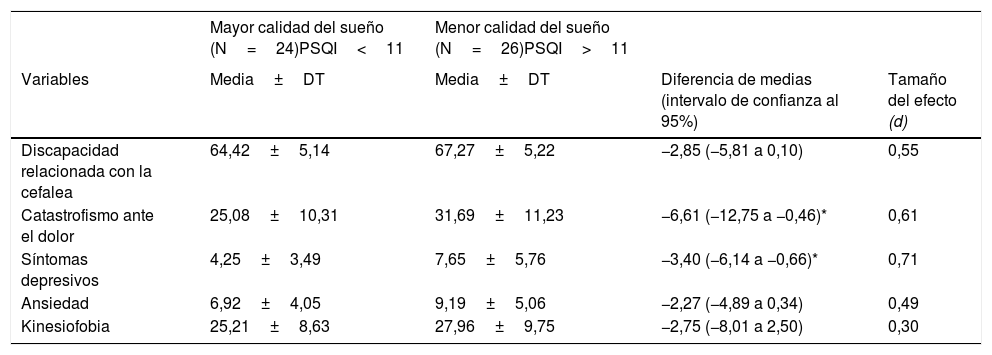
En el análisis comparativo de las variables de resultado de la comparación de los grupos de mayor y menor calidad del sueño solo se encontraron diferencias estadísticamente significativas en la variable de síntomas depresivos (t=−2,5; p=0,016) y catastrofismo ante el dolor (t=−2,16; p=0,036) siendo los resultados de estas variables mayores en el grupo de menor calidad del sueño (tabla 4).
Análisis comparativo entre las variables de discapacidad y psicológicas entre los grupos de mayor y menor calidad del sueño
| Mayor calidad del sueño (N=24)PSQI<11 | Menor calidad del sueño (N=26)PSQI>11 | |||
|---|---|---|---|---|
| Variables | Media±DT | Media±DT | Diferencia de medias (intervalo de confianza al 95%) | Tamaño del efecto (d) |
| Discapacidad relacionada con la cefalea | 64,42±5,14 | 67,27±5,22 | −2,85 (−5,81 a 0,10) | 0,55 |
| Catastrofismo ante el dolor | 25,08±10,31 | 31,69±11,23 | −6,61 (−12,75 a −0,46)* | 0,61 |
| Síntomas depresivos | 4,25±3,49 | 7,65±5,76 | −3,40 (−6,14 a −0,66)* | 0,71 |
| Ansiedad | 6,92±4,05 | 9,19±5,06 | −2,27 (−4,89 a 0,34) | 0,49 |
| Kinesiofobia | 25,21±8,63 | 27,96±9,75 | −2,75 (−8,01 a 2,50) | 0,30 |
DT: desviación típica; PSQI: Pittsburgh Sleep Quality Index.
El presente estudio se diseñó con el objetivo de determinar los factores predictores relacionados con la calidad del sueño en pacientes con MC e identificar las diferencias entre las variables psicológicas y de discapacidad entre los pacientes con MC con mayor o menor afectación de la calidad del sueño, así como para proporcionar mayor evidencia científica sobre la calidad del sueño en pacientes con MC.
Los resultados obtenidos en este estudio indican que la calidad del sueño en pacientes con MC está predecida en un 33% por variables de tipo psicológico y de discapacidad; estas son, de mayor a menor impacto: la discapacidad relacionada con la cefalea, los síntomas depresivos y el catastrofismo ante el dolor en pacientes con MC. Además, también se ha observado que los pacientes con MC que presentan peor calidad de sueño, es decir, un PSQI mayor a 11, muestran mayores niveles de síntomas depresivos y catastrofismo ante el dolor.
En el presente estudio se ha observado que la discapacidad relacionada con la cefalea puede predecir la calidad del sueño en pacientes con MC. En la migraña se ha demostrado que existe una excitabilidad de las vías del dolor de modo que las entradas de los estímulos normales producen respuestas anormales, representado así una ruptura en la relación estímulo-respuesta32. Este fenómeno se conoce como sensibilización central33. Se ha demostrado que factores de tipo psicológico, emocionales y/o físicos, pueden aumentar la excitabilidad del sistema nervioso central (SNC), aumentar la sensibilidad al dolor y provocar así el aumento de las cefaleas34. Según un estudio, en los pacientes que presentan cefalea crónica, la falta de sueño se asocia con un aumento del dolor34. Parece ser que la base de la relación entre la calidad del sueño y las cefaleas viene dada por las estructuras anatómicas cerebrales que comparten, como son el tálamo, el hipotálamo y los núcleos del tronco encefálico35,36. Una mala calidad de sueño puede favorecer un aumento de la sensibilidad al dolor al aumentar la frecuencia de las cefaleas dado que se ha observado que la gravedad y la frecuencia de los trastornos del sueño aumentan de manera acorde a la frecuencia de las cefaleas34.
Se ha encontrado también que los síntomas depresivos son predictores de la calidad del sueño en pacientes con MC y que los pacientes con MC con peor calidad de sueño presentan mayores niveles de síntomas depresivos que los pacientes con mejor calidad de sueño. Estudios epidemiológicos han demostrado que los pacientes con migraña son entre 2-5 veces más propensos a sufrir síntomas depresivos y ansiosos que individuos sin esta afectación37,38. Estos trastornos de carácter psicológico aumentan el impacto negativo de la migraña, agravando la discapacidad, la mala calidad de vida relacionada con la salud39,40 y, además, promueven la cronificación de la cefalea a lo largo del tiempo8.
En población pediátrica y adolescente las alteraciones del sueño son mayores en aquellos que presentan altos niveles de ansiedad y depresión41. La relación entre sueño y ansiedad-depresión parece ser bidireccional, ya que la alteración del sueño es un síntoma común cuando se padece un desorden depresivo y/o ansioso. Y, por otro lado, la falta de sueño afecta a la regulación emocional, pudiendo causar ansiedad y depresión41, considerando el insomnio una característica central de los trastornos del estado de ánimo42. En sujetos adultos con altos niveles de depresión la calidad del sueño es peor si, además, presentan migraña43.
El sueño es un proceso fisiológico fundamental del SNC y ocupa hasta un tercio de la vida humana. Como tal, puede considerarse uno de los procesos psicofisiológicos más importantes para el desarrollo de la función cerebral y la salud mental44. Los resultados obtenidos en este estudio están en línea con los que obtuvieron George et al. que demostraron que el dolor crónico, donde se incluyen las cefaleas crónicas, está asociado con una alteración de la calidad del sueño y la depresión45. En otro estudio se informó que una mala calidad de sueño está asociada con niveles más altos de síntomas depresivos46, al igual que se ha observado en el presente estudio. Esta asociación puede deberse a la capacidad que tienen la depresión y los trastornos del sueño de producir o desencadenar respuestas hiperalgésicas en el SNC al aumentar la excitabilidad de activación nociceptiva, favoreciendo así la sensibilización central33. Se podría considerar que la etiología de la cefalea, la depresión y el sueño comparten mecanismos centrales comunes47. Los trastornos psicológicos pueden contribuir a agravar o desencadenar el insomnio al provocar hipervigilancia, y otros procesos cognitivos y conductuales como la atención selectiva a amenazas y la evaluación negativa48 que también se pueden considerar los responsables de explicar la variabilidad de la calidad del sueño en pacientes con dolor crónico49.
La otra variable que se ha identificado como predictora de la calidad del sueño en pacientes con MC es el catastrofismo ante el dolor y, además, también es más notable en los pacientes con MC que presentan peor calidad del sueño. En la experiencia dolorosa es de gran relevancia tener en cuenta las respuestas cognitivas, afectivas y del comportamiento. El catastrofismo ante el dolor, que se clasifica generalmente como una estrategia de afrontamiento de dolor pasiva e inadaptada, es un proceso cognitivo y afectivo negativo que implica el aumento de los síntomas dolorosos, la impotencia, la rumiación y el pesimismo, y se considera un predictor a tener en cuenta en los procesos de dolor50,51. La relación entre el catastrofismo y la calidad de sueño se investigó por primera vez en 200352 y se observó que los sujetos con insomnio presentaban mayores niveles de catastrofismo ante el dolor que los sujetos con buena calidad de sueño. Este patrón se ha seguido estudiando y observando tanto en la población infantil53 como en la población adulta54.
En 2017, Costa et al. observaron que los sujetos que presentaban trastorno temporomandibular de tipo miofascial y cefalea presentaban menor calidad de sueño y mayores niveles de catastrofismo ante el dolor que los sujetos con trastorno temporomandibular pero sin la comorbilidad añadida de las cefaleas55. Otro estudio también demostró que los sujetos con MC presentan mayores niveles de catastrofismo ante el dolor que sujetos con trastorno temporomandibular de tipo crónico56. Se ha demostrado que el catastrofismo es un predictor del deterioro de la función y la disminución de la calidad de vida en sujetos con migraña57. El catastrofismo ante el dolor puede considerarse tanto un factor de riesgo como una consecuencia del dolor crónico y se ha asociado con un aumento de las cefaleas en la población general58.
Un estudio de neuroimagen reciente presentó asociaciones entre el catastrofismo ante el dolor y la migraña con la materia gris cortical en áreas implicadas en el procesamiento de los aspectos sensoriales, afectivos y cognitivos del dolor. Este estudio indica que esta asociación podría ser el resultado de los estímulos nociceptivos repetitivos a largo plazo, provocando una mayor sensibilidad, alteración del estado de ánimo y estrategias de adaptación inadaptadas para lidiar con el dolor persistente59.
La relación entre las alteraciones del sueño y la migraña parece que es bidireccional60. El insomnio puede actuar como un factor precipitante y/o como un factor perpetuador en sujetos con migraña60. Esta relación puede deberse al proceso de sensibilización central que implica una mayor respuesta neuronal a estímulos en el SNC. En este caso, el SNC puede cambiar, distorsionar o amplificar el dolor, produciendo alteraciones en el grado de dolor, la duración y la extensión de manera que ya no refleja directamente las cualidades específicas de las respuestas a los estímulos nociceptivos32. Desde un punto de vista clínico, la sensibilización central puede provocar alodinia que se define como una disminución del umbral del dolor de manera que los estímulos que normalmente no producen dolor empiezan a ser dolorosos o hiperalgesia que se define como la capacidad aumentada de respuesta del SNC de manera que los estímulos nocivos producen un dolor exagerado y prolongado en el tiempo61.
Se ha demostrado que una sola noche de privación total del sueño induce hiperalgesia generalizada y aumenta los trastornos psicológicos en sujetos asintomáticos62. La reducción del sueño afecta la función inhibidora nociceptiva endógena y aumenta el dolor en sujetos asintomáticos63. Estos hallazgos indican que las alteraciones del sueño podrían perpetuar la hiperexcitabilidad del SNC en sujetos con dolor crónico y también podrían actuar como un factor etiológico en esta misma cohorte. La presencia de insomnio puede aumentar en un 40% el riesgo de padecer dolor de cabeza, incluida la migraña13.
A partir de los resultados obtenidos en este trabajo, sería conveniente que en la valoración y tratamiento de los sujetos con MC se tuviera en cuenta la posible afectación del sueño y que el tratamiento de estos sujetos estuviera basado principalmente en un modelo biopsicosocial, el cual considera que es tan importante centrarse en los aspectos psicológicos como en los resultados de las variables físicas. En este estudio también se pone de manifiesto la importancia del impacto multidimensional de la MC en la calidad de vida relacionada con la salud del paciente.
LimitacionesUna limitación importante del estudio fue que el 92,6% de la muestra eran mujeres, lo que limita la generalización de los resultados del estudio, aunque la evidencia científica muestra una alta prevalencia de migraña en el género femenino. En este estudio no se tuvo en cuenta el estado menstrual de las participantes femeninas ni la medicación en el momento de la medición. Tampoco se registró la presencia de otros trastornos del sueño. Este estudio presenta un diseño transversal, sería necesario plantear un estudio longitudinal y así evaluar si las variables donde se ha encontrado una asociación presentan variaciones a lo largo del tiempo y si esto influye sobre la calidad del sueño. Finalmente, este estudio investiga las diferentes variables únicamente en un grupo de sujetos con MC, hubiese sido interesante haber estudiado sujetos con migraña episódica y sujetos controles.
Es importante que estas limitaciones se valoren como propuestas de mejora y se aborden en futuros estudios para establecer conclusiones más precisas y específicas.
ConclusiónLos factores predictores de la calidad del sueño en pacientes con MC son los síntomas depresivos, la discapacidad relacionada con la cefalea y, en menor medida, el catastrofismo ante el dolor.
Los sujetos con peor calidad de sueño presentan mayores niveles de catastrofismo ante el dolor y síntomas depresivos.
Conflicto de interesesNinguno. La presente investigación no ha recibido ninguna beca específica de agencias de los sectores público, comercial o sin ánimo de lucro.