El tiempo puerta-aguja (TPA) es el principal indicador del proceso del código ictus (CI). Según la guía de 2018 de la American Heart Association/American Stroke Association, el objetivo TPA debe ser inferior a 45minutos. Para conseguirlo son necesarios protocolos eficaces y revisados de actuación extrahospitalaria e intrahospitalaria.
MétodoAnalizamos la influencia de cambios organizativos entre 2011 y 2019 en el TPA y en la evolución clínica de los pacientes tratados con fibrinólisis. Utilizamos los datos de nuestro centro monitorizados y custodiados por el Pla Director en l’àmbit de la Malaltia Vascular Cerebral de la Generalitat de Catalunya. Entre otras medidas se han analizado las diferencias entre los años y las derivadas de la implantación del modelo Helsinki.
ResultadosSe estudiaron 447 pacientes, existiendo diferencias estadísticamente significativas en el TPA entre los diferentes años. La activación del CI de forma extrahospitalaria en 315 (70,5%) pacientes redujo el TPA una mediana de 14minutos. Sin embargo, el modelo de regresión lineal sólo evidenció una relación inversamente proporcional entre la adopción del modelo de CI Helsinki (MH) y el TPA (coeficiente beta −0,42; p<0,001). La eliminación de la figura del neurólogo vascular tras la adopción del MH empeoró el TPA y la mortalidad a los 90 días.
ConclusiónEl modelo organizativo influye en el TPA, siendo en nuestra muestra la aplicación del MH, la existencia de la figura del neurólogo vascular referente y la prenotificación del CI factores claves para la reducción del TPA y la mejora clínica del paciente.
Door-to-needle time (DNT) has been established as the main indicator in code stroke protocols. According to the 2018 guidelines of the American Heart Association/American Stroke Association, DNT should be less than 45minutes; therefore, effective and revised pre-admission and in-hospital protocols are required.
MethodWe analysed organisational changes made between 2011 and 2019 and their influence on DNT and the clinical progression of patients treated with fibrinolysis. We collected data from our centre, stored and monitored under the Master Plan for Cerebrovascular Disease of the regional government of Catalonia. Among other measures, we analysed the differences between years and differences derived from the implementation of the Helsinki model.
ResultsThe study included 447 patients, and we observed significant differences in DNT between different years. Pre-hospital code stroke activation, recorded in 315 cases (70.5%), reduced DNT by a median of 14minutes. However, the linear regression model only showed an inversely proportional relationship between the adoption of the Helsinki code stroke model and DNT (beta coefficient, –0.42; P<.001). The removal of vascular neurologists after the adoption of the Helsinki model increased DNT and the 90-day mortality rate.
ConclusionDNT is influenced by the organisational model. In our sample, the application of the Helsinki model, the role of the lead vascular neurologist, and notification of code stroke by pre-hospital emergency services are key factors for the reduction of DNT and the clinical improvement of the patient.
Según la Organización Mundial de la Salud, el ictus isquémico es la primera causa de mortalidad en varones y la tercera en mujeres. Es una de las tres enfermedades más letales, junto con el cáncer y las enfermedades cardiovasculares1. En 2017 fallecieron en España 26.937 personas a causa de las enfermedades cerebrovasculares2. El tratamiento fibrinolítico endovenoso (FIV) primero, hace 25 años3, y la trombectomía después, hace 5 años4, junto con el desarrollo de las unidades de ictus5, han supuesto una gran revolución en la atención de las personas que sufren un ictus isquémico en su fase aguda. Para ambas terapias de reperfusión, la rapidez en su aplicación es el principal factor pronóstico de recuperación funcional6,7. En el caso del FIV, el tiempo puerta-aguja (TPA) se ha erigido como un indicador de proceso de la atención de las personas con criterios de activación de código ictus (CI) en urgencias. Según las guías de 2018 de la American Heart Association/American Stroke Association, el TPA ha de ser inferior a 45minutos8. Existen reconocidas experiencias exitosas como la publicada por Meretoja et al. (modelo Helsinki) que tras la aplicación de 12 medidas como la implicación de urgencias, la prenotificación, el traslado rápido a la sala de tomografía computarizada (TC) o reducción en la demora en la interpretación de la TC reducen el TPA de forma significativa por debajo de los 30minutos9–11. Previamente, el grupo de estudio de enfermedades cerebrovasculares de la Sociedad Española de Neurología ya describió en 2006 y confirmó en 2010 en su plan de atención sanitaria al ictus aspectos claves en el proceso de la atención urgente de los pacientes con criterios de activación de CI, como la existencia de un equipo de ictus coordinado por un neurólogo experto en ictus o la recomendación de guardias de presencia física12,13.
Analizamos la influencia de los cambios en la gestión del proceso de atención de las personas con ictus isquémico agudo en el TPA y en la evolución clínica de los mismos en un hospital universitario considerado de referencia para la atención del ictus que dispone de unidad de ictus desde 2006.
Material y métodosIncluimos de forma retrospectiva los datos de pacientes consecutivos con criterios de activación de CI atendidos en nuestro centro y tratados a criterio del profesional que atendió a los pacientes con FIV siguiendo las recomendaciones de las guías nacionales e internacionales8,14. Los casos de ictus de horario desconocido fueron tratados con FIV por uso compasivo teniendo en cuenta la gravedad del ictus, la presencia de oclusión de gran vaso intracraneal y la ausencia de signos de isquemia aguda extensa. Todos los pacientes se registraron prospectivamente en el registro en línea de FIV del Pla Director en l’àmbit de la Malaltia Vascular Cerebral de la Generalitat de Catalunya15–17 en el periodo comprendido entre 2011 y 2019, ambos años inclusive. Dicho plan se encargó de custodiar la información que fue retornada al centro a fecha de 30 de abril de 2020. El registro ha sido monitorizado con exhaustividad de forma regular. Existe un proceso de auditoría externa con el fin de evitar sesgos de inclusión. Todos los hospitales implicados en la atención del ictus en Cataluña reciben un informe trimestral de forma regular17.
En el registro existen datos sobre las características clínicas de los pacientes, el TPA y la evolución de los pacientes a los 3 meses. De forma centralizada y mediante entrevista estructurada se determina la puntuación en la escala Rankin modificada (mRS).
El registro satisface todos los requerimientos legales de protección de datos personales. La inclusión de los pacientes se hace de acuerdo con el consentimiento informado17.
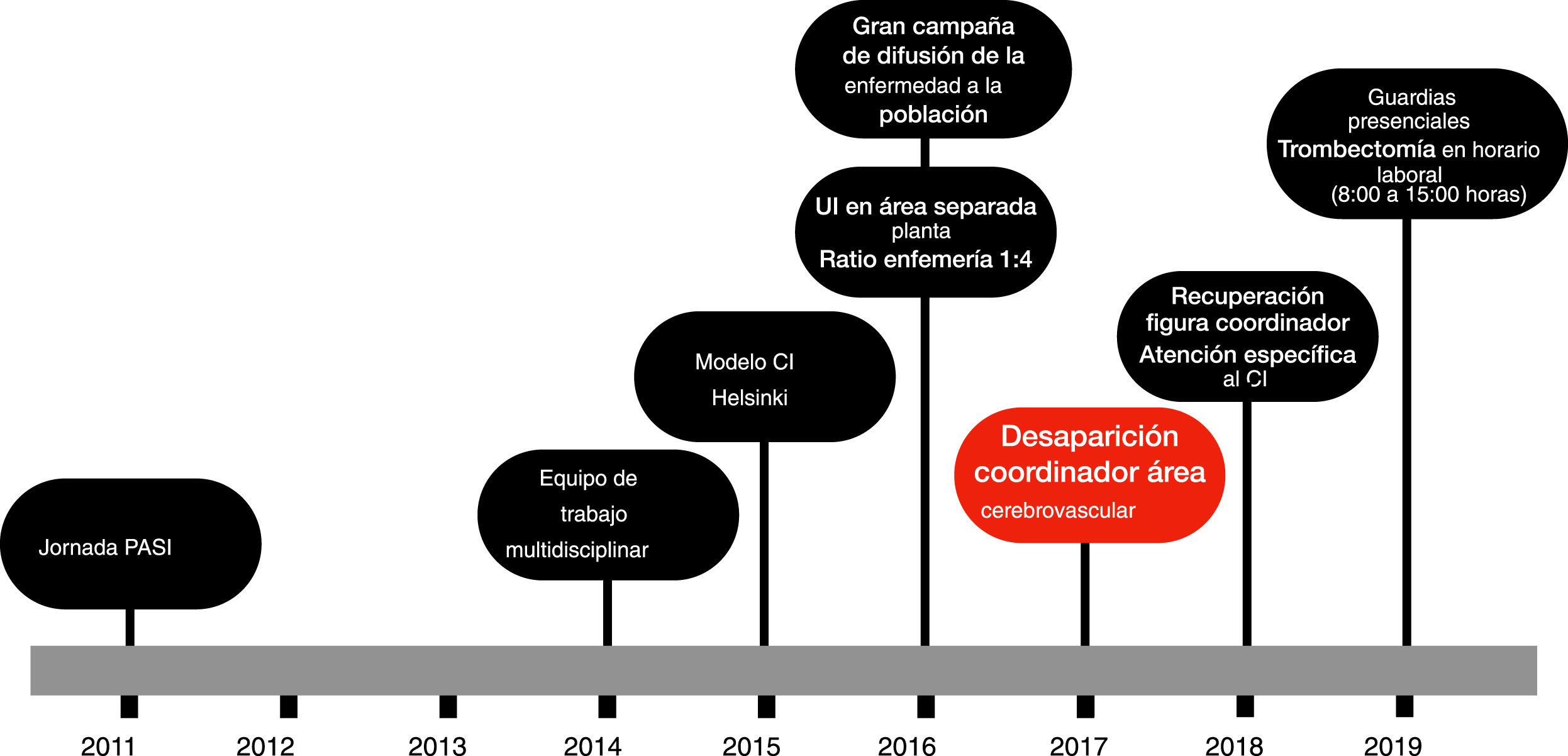
Las actuaciones llevadas a cabo desde que el paciente llega al hospital hasta la aplicación de FIV según nuestro actual protocolo intrahospitalario se resumen en la figura 1. En 2014 se creó un equipo multidisciplinar de trabajo implicando al servicio de urgencias y radiología, así como al servicio de emergencias médicas en la atención del CI. Se adoptó el modelo de CI de Helsinki a partir de 2015 a excepción de 2017 en el que desapareció la figura del coordinador del área cerebrovascular. En 2016, se creó una unidad de ictus en el área de semicríticos del hospital separada de la planta y con una dotación de enfermería suficiente para garantizar una ratio de pacientes 1:4. Finalmente, en 2019 se iniciaron las guardias presenciales y se empezó a ofrecer en el centro el tratamiento endovascular.
El análisis estadístico de los datos se realizó con el programa SPSS 20.0.
Se estudiaron las diferencias entre los pacientes en función del año en el que fueron tratados. Para la comparación entre variables categóricas se utilizó el test de la Chi2 de Pearson. Cuando se compararon variables numéricas se utilizó el test de la U de Mann-Whitney o el test ANOVA para las muestras independientes. Se analizaron las variables asociadas con el TPA. Aquellas con una asociación estadísticas se incluyeron en el estudio multivariante mediante la utilización de regresión logística lineal. Un valor de significación de p<0,05 se consideró como estadísticamente significativo en todas las comparaciones.
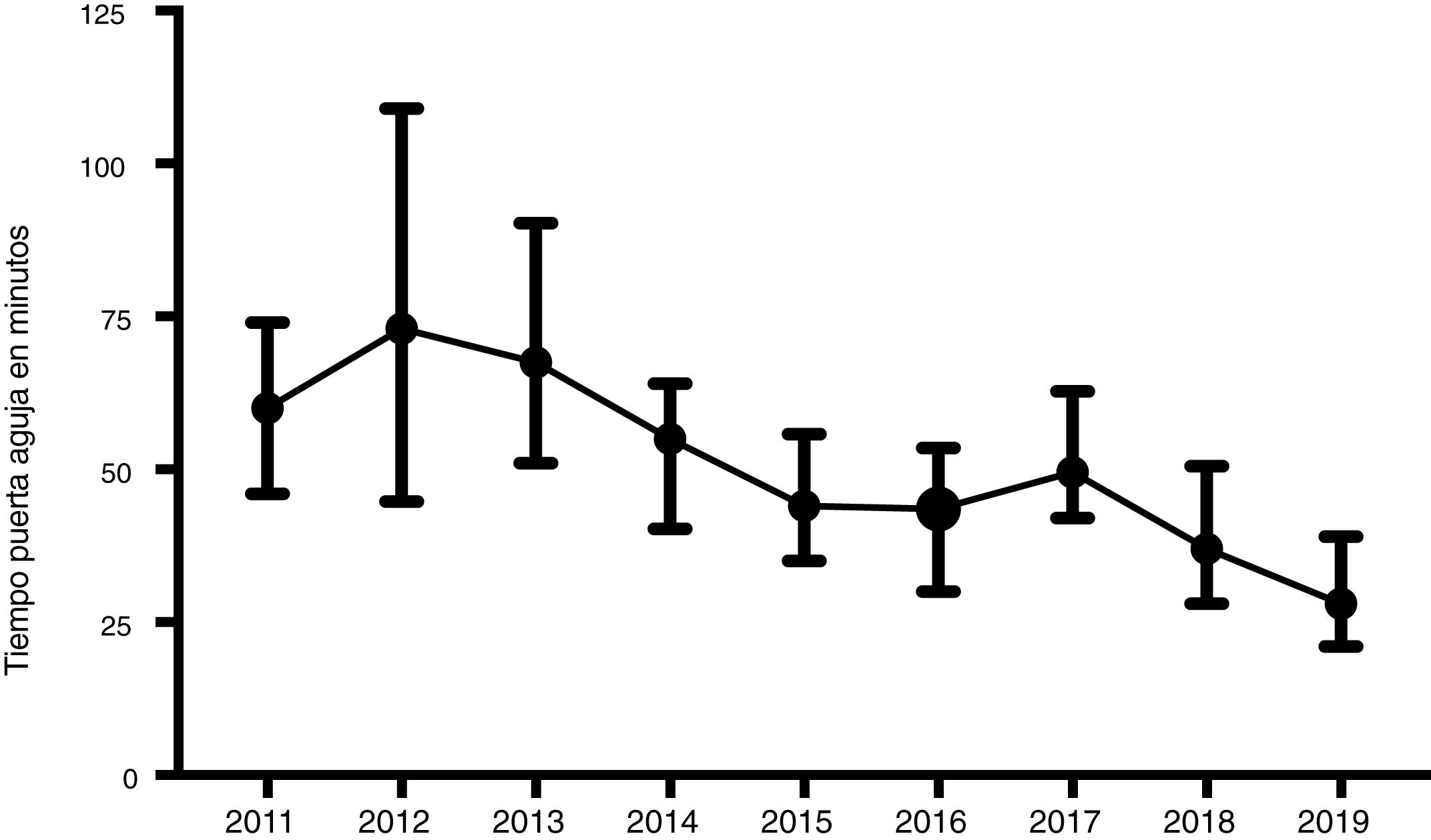
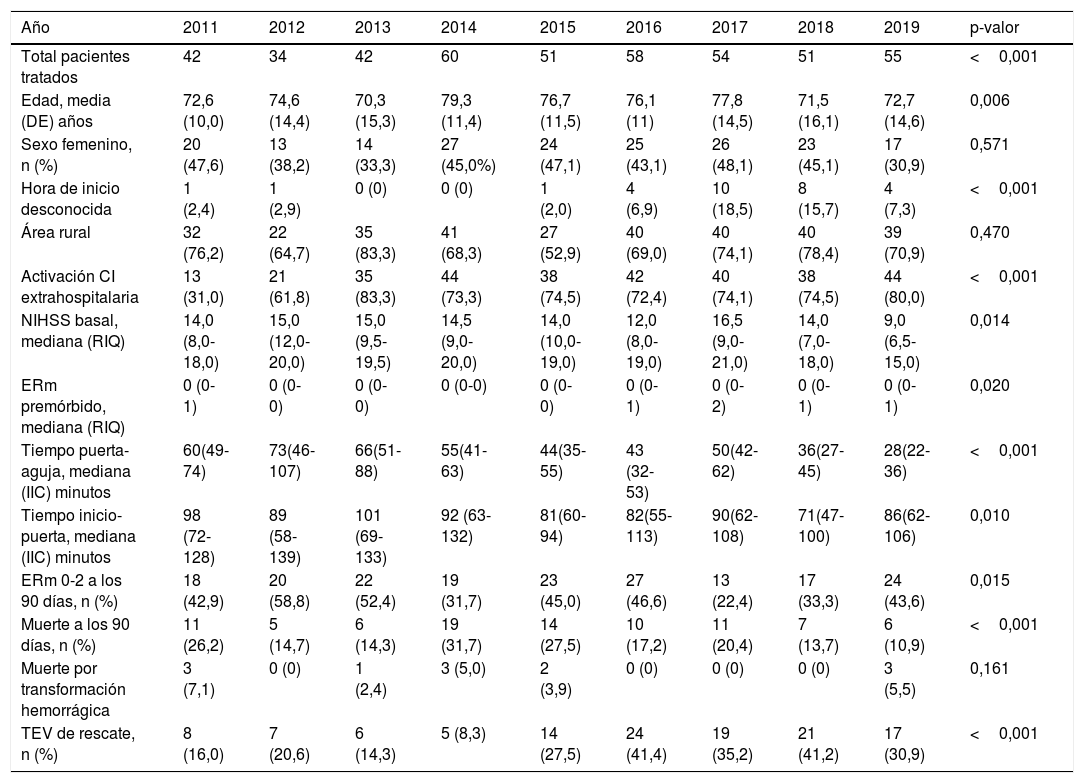
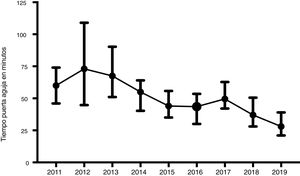
ResultadosSe incluyeron 447 pacientes. La edad media fue de 74,9 años (desviación estándar [DE] 13,5). Se observó un incremento significativo del número de pacientes tratados a partir del año 2014. Hubo un predomino de hombres tratados, 258 (57,7%). Solo 29 (6,5%) pacientes fueron tratados pese a no saberse el inicio exacto de los síntomas por uso compasivo. La mayoría de los pacientes, 316 (70,7%), procedieron del ambiente rural. El CI se activó de forma extrahospitalaria en 315 (70,5%). Como muestra la tabla 1, se observaron diferencias estadísticamente significativas entre los diferentes años en casi todas las variables analizadas. El TPA fue significativamente menor en los años con aplicación del modelo de CI Helsinki (fig. 2). Además, en dichos años, a diferencia de 2017, hubo una menor mortalidad. Igualmente, la proporción de pacientes con tratamiento endovascular se incrementó de forma significativa a partir de 2015; mientras disminuyó el tiempo inicio-puerta. La edad media de los pacientes tratados se ha reducido significativamente en los últimos dos años, así como la gravedad del ictus según la escala NIHSS en el último año. En cambio, las diferencias en la proporción de mujeres tratadas o de pacientes procedentes de áreas rurales no han variado de forma significativa entre los diferentes años analizados.
Características clínicas y demográficas de los pacientes tratados con fibrinólisis endovenosas durante el periodo estudiado
| Año | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | p-valor |
|---|---|---|---|---|---|---|---|---|---|---|
| Total pacientes tratados | 42 | 34 | 42 | 60 | 51 | 58 | 54 | 51 | 55 | <0,001 |
| Edad, media (DE) años | 72,6 (10,0) | 74,6 (14,4) | 70,3 (15,3) | 79,3 (11,4) | 76,7 (11,5) | 76,1 (11) | 77,8 (14,5) | 71,5 (16,1) | 72,7 (14,6) | 0,006 |
| Sexo femenino, n (%) | 20 (47,6) | 13 (38,2) | 14 (33,3) | 27 (45,0%) | 24 (47,1) | 25 (43,1) | 26 (48,1) | 23 (45,1) | 17 (30,9) | 0,571 |
| Hora de inicio desconocida | 1 (2,4) | 1 (2,9) | 0 (0) | 0 (0) | 1 (2,0) | 4 (6,9) | 10 (18,5) | 8 (15,7) | 4 (7,3) | <0,001 |
| Área rural | 32 (76,2) | 22 (64,7) | 35 (83,3) | 41 (68,3) | 27 (52,9) | 40 (69,0) | 40 (74,1) | 40 (78,4) | 39 (70,9) | 0,470 |
| Activación CI extrahospitalaria | 13 (31,0) | 21 (61,8) | 35 (83,3) | 44 (73,3) | 38 (74,5) | 42 (72,4) | 40 (74,1) | 38 (74,5) | 44 (80,0) | <0,001 |
| NIHSS basal, mediana (RIQ) | 14,0 (8,0-18,0) | 15,0 (12,0-20,0) | 15,0 (9,5-19,5) | 14,5 (9,0-20,0) | 14,0 (10,0-19,0) | 12,0 (8,0-19,0) | 16,5 (9,0-21,0) | 14,0 (7,0-18,0) | 9,0 (6,5-15,0) | 0,014 |
| ERm premórbido, mediana (RIQ) | 0 (0-1) | 0 (0-0) | 0 (0-0) | 0 (0-0) | 0 (0-0) | 0 (0-1) | 0 (0-2) | 0 (0-1) | 0 (0-1) | 0,020 |
| Tiempo puerta-aguja, mediana (IIC) minutos | 60(49-74) | 73(46-107) | 66(51-88) | 55(41-63) | 44(35-55) | 43 (32-53) | 50(42-62) | 36(27-45) | 28(22-36) | <0,001 |
| Tiempo inicio-puerta, mediana (IIC) minutos | 98 (72-128) | 89 (58-139) | 101 (69-133) | 92 (63-132) | 81(60-94) | 82(55-113) | 90(62-108) | 71(47-100) | 86(62-106) | 0,010 |
| ERm 0-2 a los 90 días, n (%) | 18 (42,9) | 20 (58,8) | 22 (52,4) | 19 (31,7) | 23 (45,0) | 27 (46,6) | 13 (22,4) | 17 (33,3) | 24 (43,6) | 0,015 |
| Muerte a los 90 días, n (%) | 11 (26,2) | 5 (14,7) | 6 (14,3) | 19 (31,7) | 14 (27,5) | 10 (17,2) | 11 (20,4) | 7 (13,7) | 6 (10,9) | <0,001 |
| Muerte por transformación hemorrágica | 3 (7,1) | 0 (0) | 1 (2,4) | 3 (5,0) | 2 (3,9) | 0 (0) | 0 (0) | 0 (0) | 3 (5,5) | 0,161 |
| TEV de rescate, n (%) | 8 (16,0) | 7 (20,6) | 6 (14,3) | 5 (8,3) | 14 (27,5) | 24 (41,4) | 19 (35,2) | 21 (41,2) | 17 (30,9) | <0,001 |
CI: código ictus; DE: desviación estándar; ERm: escala Rankin modificada; NIHSS: del inglés National Institute of Health Stroke Scale; RIQ: rango intercuartílico; TEV: tratamiento endovascular.
Se realizó un análisis de los factores asociados al TPA (tabla 2). La activación del CI a nivel extrahospitalario y el hecho de haber sido tratado en uno de los años en los que se aplicó el modelo Helsinki fueron variables asociadas a menor TPA de forma significativa. En cambio, no hubo una asociación significativa ni con la edad (coeficiente de Spearman [CS] –0,037; p=0,458) ni con la puntuación en la escala NIHSS (CS: 0,042; p=0,394) ni con la mRS (CS: 0,016; p=0,745) pero sí con el tiempo inicio-puerta (CS: 0,139; p=0,006), existiendo una relación directamente proporcional entre el TPA y el tiempo inicio-puerta. El modelo de regresión lineal sólo evidenció una relación inversamente proporcional entre el modelo de CI Helsinki y el TPA (coeficiente beta −0,42; intervalo de confianza del 95% −23,75 a –14,57; p<0,001).
Estudio de las variables asociadas al tiempo puerta-aguja
| Variable | No | Sí | p-valor |
|---|---|---|---|
| Sexo femenino | 47 (34-64) | 47 (36-63) | 0,787 |
| Hora de inicio desconocida | 48 (35-64) | 43 (33-61) | 0,334 |
| Área rural | 52 (36-73) | 47 (35-63) | 0,220 |
| Activación CI extrahospitalaria | 58 (44-77) | 44 (31-59) | <0,001 |
| Aplicación modelo de CI de Helsinki(años 2015, 2016, 2018 y 2019) | 58 (45-75) | 39 (28-53) | <0,001 |
CI: código ictus.
Presentamos los resultados de un estudio de pacientes prospectivos con la sospecha de ictus isquémico agudo tratados con FIV reclutados de forma consecutiva que muestran como los cambios organizativos influyen en el principal indicador de proceso, el TPA. Además, de forma paralela a la repercusión sobre el TPA, la evolución clínica de los pacientes también se altera. En nuestra cohorte de 9 años, el principal factor independiente relacionado con el TPA es la adopción del método de Helsinki y la existencia de un neurólogo coordinador del área de ictus. El modelo Helsinki se basa en el desarrollo del proceso ictus tanto desde el punto de vista intrahospitalario como extrahospitalario9–11. Así, son claves tanto la prenotificación por parte de los servicios de emergencias extrahospitalarias como el traslado precoz del paciente a la sala de radiología o la administración del bolus de FIV en la misma sala10. El coordinador es la figura referente encargada de mantener al día los protocolos y circuitos del área de patología cerebrovascular, reunir de manera periódica a los profesionales integrantes en la atención del CI, así como analizar y difundir los datos en la atención del CI y otros aspectos del cuidado del paciente con ictus. En nuestra experiencia, solo la formación de un grupo multidisciplinar con neurólogos vasculares como referentes que contó con la colaboración del personal sanitario de urgencias, del servicio de emergencias extrahospitalario y de radiología que permitió la revisión y actualización crítica de la trayectoria del ictus ya mejoró el TPA en 2014, ya incluso antes de la implantación del modelo Helsinki en 2015. Posteriormente, la disponibilidad de una unidad de ictus acorde con las recomendaciones nacionales e internacionles12,13,18 pudo ser clave junto con el descenso del TPA para la reducción de la mortalidad. Finalmente, la disponibilidad de una guardia presencial y la revisión de los protocolos de actuación ante el inicio del tratamiento endovascular propiciaron la optimización del TPA. Cabe destacar el empeoramiento del TPA y el incremento de la mortalidad en el año 2017 coincidiendo con un cambio organizativo que condujo a la desaparición de la figura del coordinador del área cerebrovascular. Este hecho respalda la importancia del liderazgo por parte de un profesional con experiencia en el campo neurovascular para garantizar tanto la coordinación del proceso del CI como la monitorización de los indicadores de proceso necesarios para la toma de decisiones tal como recomienda el Grupo de estudio de Enfermedades Cerebrovasculares de la Sociedad Española de Neurología12,13. Además, acredita la importancia del TPA como indicador de proceso asociado a los resultados clínicos7,9.
La adquisición de un modelo organizativo óptimo fue el único predictor independiente de TPA. Cabe resaltar como gran caballo de batalla la mejora de la atención de los pacientes a quienes no se ha activado el CI a nivel extrahospitalario. Con la adquisición del modelo de Helsinki la activación del CI extrahospitalario se asocia a una prenotificación que favorece la alerta de los profesionales implicados en la atención de los pacientes, lo que redunda positivamente en la reducción del TPA10,11,19,20. En cambio, esto no sucede cuando la activación es intrahospitalaria. Nuestros resultados respaldan la necesidad de la instauración de medidas específicas para la reducción del TPA en este grupo de pacientes. En nuestra serie, a diferencia de otras19,20, existe una relación directa entre el tiempo inicio-puerta y el TPA. Este hecho se puede justificar porque la adquisición del modelo de Helsinki y la difusión de la enfermedad entre profesionales del área de primaria y en la población general han reducido también el tiempo inicio-puerta junto con el TPA.
Nuestro estudio tiene ciertas limitaciones que deben ser comentadas. Un tamaño muestral mayor podría favorecer más la extrapolación de nuestros resultados y evitar diferencias entre años que se pueden atribuir al azar. Por otro lado, hay situaciones en años puntuales de no fácil explicación. Por ejemplo, en 2019 el NIHSS basal fue significativamente menor que el del resto de años o la activación extrahospitalaria en 2011 fue muy inferior a la del año siguiente.
En conclusión, el modelo organizativo es el principal factor que influye en el principal indicador de proceso del CI, el TPA. En este sentido, el modelo Helsinki junto con disponibilidad de una guardia presencial de neurología, de una unidad de ictus según criterios internacionales y de un coordinador experto en patología neurovascular construyen el mejor escenario para alcanzar un TPA óptimo con buenos resultados clínicos. Cualquier cambio en este paradigma se traduce en un empeoramiento del TPA y de los resultados clínicos.
FinanciaciónNo existe.
Conflicto de interesesNo existe.