Actualizar las recomendaciones de la Sociedad Española de Neurología relativas a la actuación sobre los hábitos de vida para la prevención del ictus.
DesarrolloSe ha realizado una revisión de los estudios más recientes relacionados con los hábitos de vida y el riesgo de ictus, incluyendo ensayos clínicos aleatorizados, estudios poblacionales y metaanálisis. Se ha analizado el riesgo de ictus asociado con determinados hábitos de vida como el tabaquismo, el consumo de alcohol, el estrés, la dieta, la obesidad y el sedentarismo, también se ha revisado el potencial beneficio que la modificación de esos hábitos de vida puede aportar en la prevención del ictus. Asimismo, se ha revisado el riesgo de ictus asociado a la exposición a la contaminación atmosférica. A partir de los resultados obtenidos se han redactado unas recomendaciones sobre cada uno de los hábitos de vida analizados.
ConclusionesLa actuación sobre los hábitos de vida constituye una piedra angular en la prevención primaria y secundaria del ictus. La abstinencia o cese del hábito tabáquico, el cese del consumo excesivo de alcohol, evitar la exposición a estrés crónico, evitar el sobrepeso o la obesidad, seguir una dieta mediterránea suplementada con aceite de oliva y frutos secos, así como la práctica regular de actividad física son medidas fundamentales para reducir el riesgo de sufrir un ictus. Además, se aconseja desarrollar políticas encaminadas a disminuir la contaminación atmosférica.
To update the recommendations of the Spanish Society of Neurology regarding lifestyle interventions for stroke prevention.
DevelopmentWe reviewed the most recent studies related to lifestyle and stroke risk, including randomised clinical trials, population studies, and meta-analyses. The risk of stroke associated with such lifestyle habits as smoking, alcohol consumption, stress, diet, obesity, and sedentary lifestyles was analysed, and the potential benefits for stroke prevention of modifying these habits were reviewed. We also reviewed stroke risk associated with exposure to air pollution. Based on the results obtained, we drafted recommendations addressing each of the lifestyle habits analysed.
ConclusionsLifestyle modification constitutes a cornerstone in the primary and secondary prevention of stroke. Abstinence or cessation of smoking, cessation of excessive alcohol consumption, avoidance of exposure to chronic stress, avoidance of overweight or obesity, a Mediterranean diet supplemented with olive oil and nuts, and regular exercise are essential measures in reducing the risk of stroke. We also recommend implementing policies to reduce air pollution.
La promoción de hábitos de vida saludables constituye una piedra angular en la prevención primaria y secundaria del ictus, puesto que repercutirá además en la optimización del control de otros factores de riesgo vascular establecidos. En este trabajo resumiremos las principales recomendaciones respecto al consumo de tabaco y alcohol, el estrés, la obesidad, hábitos dietéticos y la práctica de actividad física. Además revisaremos el riesgo de ictus asociado a la exposición a la contaminación atmosférica.
Para la actualización de recomendaciones, entre agosto y noviembre de 2019 se realizó una búsqueda bibliográfica en Pubmed con los términos: lifestyle habits AND stroke, smoking AND stroke, alcohol AND stroke, stress AND stroke, obesity AND stroke, diet AND stroke, physical activity AND stroke y air pollution AND stroke. Se seleccionaron los artículos más relevantes referentes a la prevención primaria y secundaria del ictus, dando prioridad a los metaanálisis, revisiones sistemáticas y estudios poblacionales, y priorizando los publicados en los últimos 10 años. Los niveles de evidencia se clasificaron según las recomendaciones de 2016 de la American College of Cardiology (ACC) y del American Heart Association (AHA) Task Force como: nivel de evidencia A (evidencia de alta calidad procedente de más de un ensayo clínico aleatorizado, metaanálisis de alta calidad, o uno o más ensayos clínicos aleatorizados corroborados por estudios de registro de alta calidad); nivel de evidencia B (evidencia de calidad moderada procedente de uno o más ensayos clínicos aleatorizados, o de uno o más estudios no aleatorizados, observacionales o registros de alta calidad, metaanálisis de ensayos clínicos de moderada calidad, o metaanálisis de estudios no aleatorizados), Nivel de evidencia C (datos limitados cuando los datos proceden de estudios observacionales o registros con limitaciones metodológicas en su diseño o ejecución). Se consideraron los siguientes grados de recomendación: Clase I-fuerte recomendación (beneficio muy superior al riesgo), Clase IIa-recomendación moderada (beneficio superior al riesgo), clase IIb-recomendación débil y clase III-no beneficio cuando el beneficio es equivalente al riesgo.
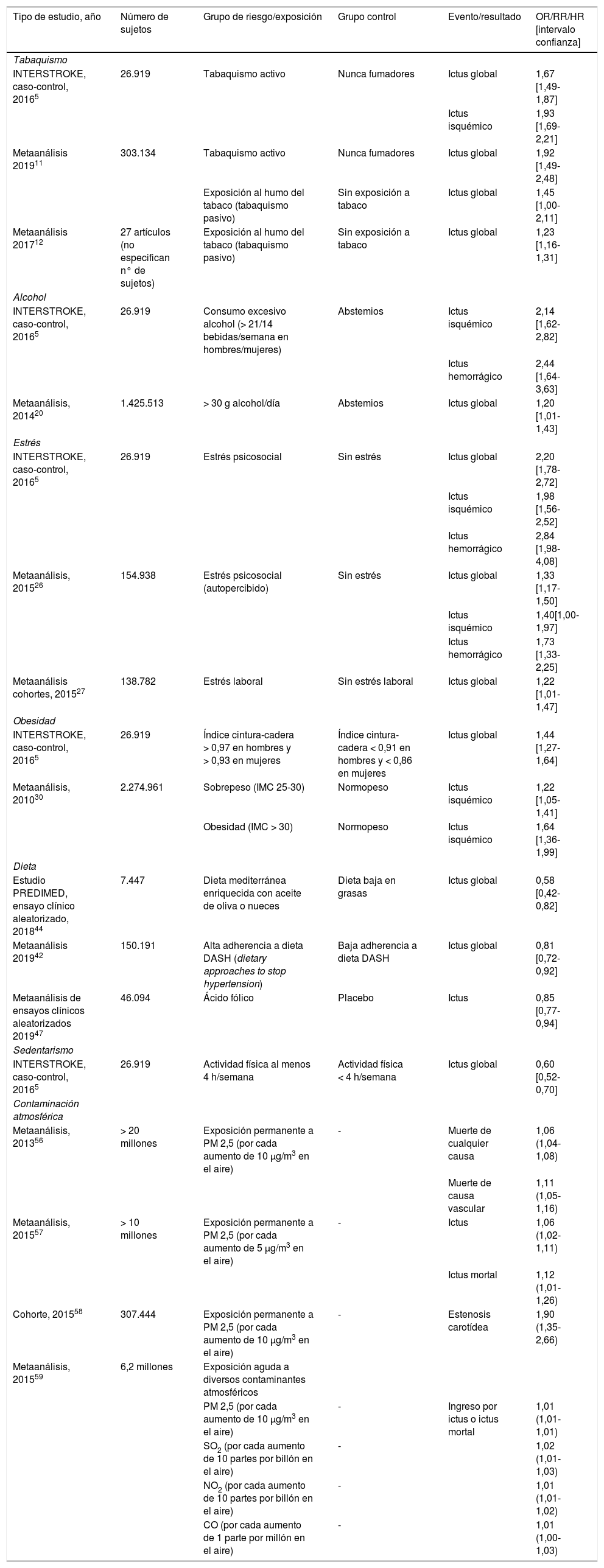
Dado que el capítulo trata de hábitos de vida y contaminación atmosférica, la mayor parte de los estudios revisados son observacionales, escaseando los ensayos clínicos de intervención aleatorizados, por lo que la mayor parte de las recomendaciones tienen como máximo el nivel de evidencia B. El resumen de los estudios más relevantes incluidos para cada hábito de vida y su asociación con el riesgo de ictus se muestra en la tabla 1.
Tabla resumen de los principales estudios que analizan la relación de determinados estilos de vida y la contaminación atmosférica y el riesgo de ictus
| Tipo de estudio, año | Número de sujetos | Grupo de riesgo/exposición | Grupo control | Evento/resultado | OR/RR/HR [intervalo confianza] |
|---|---|---|---|---|---|
| Tabaquismo | |||||
| INTERSTROKE, caso-control, 20165 | 26.919 | Tabaquismo activo | Nunca fumadores | Ictus global | 1,67 [1,49-1,87] |
| Ictus isquémico | 1,93 [1,69-2,21] | ||||
| Metaanálisis 201911 | 303.134 | Tabaquismo activo | Nunca fumadores | Ictus global | 1,92 [1,49-2,48] |
| Exposición al humo del tabaco (tabaquismo pasivo) | Sin exposición a tabaco | Ictus global | 1,45 [1,00-2,11] | ||
| Metaanálisis 201712 | 27 artículos (no especifican n° de sujetos) | Exposición al humo del tabaco (tabaquismo pasivo) | Sin exposición a tabaco | Ictus global | 1,23 [1,16-1,31] |
| Alcohol | |||||
| INTERSTROKE, caso-control, 20165 | 26.919 | Consumo excesivo alcohol (> 21/14 bebidas/semana en hombres/mujeres) | Abstemios | Ictus isquémico | 2,14 [1,62-2,82] |
| Ictus hemorrágico | 2,44 [1,64-3,63] | ||||
| Metaanálisis, 201420 | 1.425.513 | > 30 g alcohol/día | Abstemios | Ictus global | 1,20 [1,01-1,43] |
| Estrés | |||||
| INTERSTROKE, caso-control, 20165 | 26.919 | Estrés psicosocial | Sin estrés | Ictus global | 2,20 [1,78-2,72] |
| Ictus isquémico | 1,98 [1,56- 2,52] | ||||
| Ictus hemorrágico | 2,84 [1,98-4,08] | ||||
| Metaanálisis, 201526 | 154.938 | Estrés psicosocial (autopercibido) | Sin estrés | Ictus global | 1,33 [1,17-1,50] |
| Ictus isquémico | 1,40[1,00-1,97] | ||||
| Ictus hemorrágico | 1,73 [1,33-2,25] | ||||
| Metaanálisis cohortes, 201527 | 138.782 | Estrés laboral | Sin estrés laboral | Ictus global | 1,22 [1,01-1,47] |
| Obesidad | |||||
| INTERSTROKE, caso-control, 20165 | 26.919 | Índice cintura-cadera > 0,97 en hombres y > 0,93 en mujeres | Índice cintura-cadera < 0,91 en hombres y < 0,86 en mujeres | Ictus global | 1,44 [1,27-1,64] |
| Metaanálisis, 201030 | 2.274.961 | Sobrepeso (IMC 25-30) | Normopeso | Ictus isquémico | 1,22 [1,05-1,41] |
| Obesidad (IMC > 30) | Normopeso | Ictus isquémico | 1,64 [1,36-1,99] | ||
| Dieta | |||||
| Estudio PREDIMED, ensayo clínico aleatorizado, 201844 | 7.447 | Dieta mediterránea enriquecida con aceite de oliva o nueces | Dieta baja en grasas | Ictus global | 0,58 [0,42-0,82] |
| Metaanálisis 201942 | 150.191 | Alta adherencia a dieta DASH (dietary approaches to stop hypertension) | Baja adherencia a dieta DASH | Ictus global | 0,81 [0,72-0,92] |
| Metaanálisis de ensayos clínicos aleatorizados 201947 | 46.094 | Ácido fólico | Placebo | Ictus | 0,85 [0,77-0,94] |
| Sedentarismo | |||||
| INTERSTROKE, caso-control, 20165 | 26.919 | Actividad física al menos 4 h/semana | Actividad física < 4 h/semana | Ictus global | 0,60 [0,52-0,70] |
| Contaminación atmosférica | |||||
| Metaanálisis, 201356 | > 20 millones | Exposición permanente a PM 2,5 (por cada aumento de 10 μg/m3 en el aire) | - | Muerte de cualquier causa | 1,06 (1,04-1,08) |
| Muerte de causa vascular | 1,11 (1,05-1,16) | ||||
| Metaanálisis, 201557 | > 10 millones | Exposición permanente a PM 2,5 (por cada aumento de 5 μg/m3 en el aire) | - | Ictus | 1,06 (1,02-1,11) |
| Ictus mortal | 1,12 (1,01-1,26) | ||||
| Cohorte, 201558 | 307.444 | Exposición permanente a PM 2,5 (por cada aumento de 10 μg/m3 en el aire) | - | Estenosis carotídea | 1,90 (1,35-2,66) |
| Metaanálisis, 201559 | 6,2 millones | Exposición aguda a diversos contaminantes atmosféricos | |||
| PM 2,5 (por cada aumento de 10 μg/m3 en el aire) | - | Ingreso por ictus o ictus mortal | 1,01 (1,01-1,01) | ||
| SO2 (por cada aumento de 10 partes por billón en el aire) | - | 1,02 (1,01-1,03) | |||
| NO2 (por cada aumento de 10 partes por billón en el aire) | - | 1,01 (1,01-1,02) | |||
| CO (por cada aumento de 1 parte por millón en el aire) | - | 1,01 (1,00-1,03) |
El tabaquismo representa un problema sociosanitario a escala global. En España se estima que el 23,3% de la población es fumadora y que casi la mitad de los fumadores tienen menos de 30 años de edad1. La asociación entre tabaquismo e ictus ha sido ampliamente demostrada en la práctica totalidad de estudios poblacionales realizados en las últimas décadas2-5. Las personas fumadoras tienen el doble de riesgo de sufrir un ictus isquémico y entre dos y cuatro veces más de padecer una hemorragia subaracnoidea6.
Los posibles mecanismos por los cuales la exposición al humo del tabaco puede aumentar el riesgo de ictus isquémico y de otras enfermedades vasculares son numerosos e incluyen el aumento de la agregación plaquetaria, el aumento de los niveles de fibrinógeno, la reducción del colesterol HDL, los efectos tóxicos directos de compuestos como el 1,3-butadieno y el efecto de la carboxihemoglobinemia7,8. El humo del tabaco también se ha relacionado con la progresión de la aterosclerosis y el daño arterial temprano9. Además, también se ha observado que fumar predispone a sufrir fibrilación auricular10. El riesgo de hemorragia subaracnoidea se relaciona con el aumento de la incidencia de aneurismas intracerebrales en fumadores. El tabaco además puede dañar las paredes de arterias cerebrales de pequeño calibre, favoreciendo las hemorragias intraparenquimatosas7.
El estudio INTERSTROKE, un estudio casos-controles desarrollado a escala mundial en 32 países de los cinco continentes y que incluyó a casi 30.000 participantes, mostró que el tabaquismo se asocia con un mayor riesgo de sufrir cualquier tipo de ictus con una Odds Ratio (OR) de 1,67 (intervalo de confianza [IC] al 95% 1,49-1,87), y alcanza hasta el 1,93 (IC 95% 1,69-2,21) para el ictus isquémico. Este efecto del tabaco se observa en todas las poblaciones estudiadas, pero su efecto es más evidente en la población de Europa occidental, Norteamérica y Australia, con una OR de 2,97. Además, en este estudio se observó que el riesgo del tabaco es «dosis dependiente», alcanzando una OR cercana a cuatro en el grupo de personas que fuman más de 20 cigarrillos diarios5. Un reciente metaanálisis que incluyó más de 300.000 participantes muestra una OR de ictus del 1,92 (IC 95% 1,49-2,48) en el grupo de fumadores activos, y confirma la relación lineal que existe entre el número de cigarrillos fumados diariamente y el riesgo, de tal forma que se calcula un incremento de 12% por cada aumento de cinco cigarrillos diarios11. Esta relación dosis-dependiente no es tan evidente para el ictus hemorrágico pero también podría existir5.
La exposición al humo del tabaco en personas no fumadoras («fumadores pasivos»), también se ha asociado con un incremento del riesgo de ictus en numerosos estudios, con una OR de 1,45 comparada con la de personas no expuestas al humo del tabaco11. El efecto del tabaco en los fumadores pasivos es también dosis-dependiente, alcanzando OR de 1,56 en el grupo de personas con los niveles de exposición más altos12.
El riesgo de ictus se reduce al abandonar el tabaco. Los fumadores activos tienen más riesgo de ictus que los exfumadores (OR 1,54) y esta diferencia es mayor en las mujeres, con una OR que alcanza el 1,8811. Se ha calculado que al cabo de un año de abandonar el tabaco el riesgo de ictus se reduce a la mitad y que a los cinco años el riesgo se iguala al de los no fumadores13. El abandono del tabaco como medida de prevención secundaria tras un ictus o un evento vascular también ha demostrado ser beneficioso. Un estudio que incluyó casi 4.000 pacientes que habían sufrido un ictus o AIT mostró que el grupo de pacientes fumadores que habían abandonado el tabaco tras el evento índice presentaban menor incidencia de ictus, infarto de miocardio o muerte comparado con los pacientes que seguían fumando (15,7 frente a 22,6%, Hazard Ratio [HR] ajustado de 0,66)14. Asimismo, en un reciente estudio holandés se observó que las personas que dejaban de fumar tras sufrir un primer evento vascular, además de presentar menor riesgo de sufrir nuevos eventos y de fallecer (HR ajustada 0,66 y 0,63, respectivamente), vivían de media cinco años más y retrasaban una media de 10 años la aparición de un nuevo evento vascular15.
El tratamiento conductual, asesoramiento psicológico y el empleo de fármacos como los parches de nicotina, el bupropion, la vareniclina y la citisina pueden resultar útiles para el abandono del tabaco16. La vareniclina y citisina parecen ser los fármacos más eficaces para este cometido. Desde enero de 2020, en España, el tratamiento con vareniclina (agonista parcial, y antagonista en presencia de nicotina, de los receptores neuronales para acetilcolina de tipo nicotínico alfa-4, ß-2) y bupropion (inhibidor selectivo de la recaptación neuronal de catecolaminas y análogo simpaticomimético) está financiado por el Sistema Nacional de Salud en fumadores con alta dependencia y deseos expresos de abandonar el hábito. El tratamiento tiene una duración entre 9-12 semanas y se podrá financiar como máximo una vez al año. Si bien no existe una expresa contraindicación en la ficha técnica para pacientes que han sufrido un ictus, el bupropion no está aconsejado si hay historia de crisis comiciales.
El uso de cigarrillos electrónicos, debido a su contenido en nicotina, también se asocia con mayor riesgo de sufrir eventos vasculares, aunque probablemente el riesgo sea menor que con el consumo de cigarrillos convencionales. Por otro lado, no está todavía plenamente establecido el efecto que puede tener sobre la salud la exposición prolongada a determinados componentes químicos potencialmente tóxicos (como el propilenglicol, aldehídos, aromas y partículas)17,18.
RecomendacionesSe recomienda la abstinencia del tabaco como prevención primaria y secundaria del ictus. Recomendación clase I, nivel de evidencia B.
Se recomienda aconsejar el abandono del tabaco a todos los fumadores que han sufrido un ictus o AIT. Recomendación clase I, nivel de evidencia B.
Es razonable evitar la exposición pasiva al tabaco como prevención del ictus. Recomendación IIa, nivel de evidencia B.
AlcoholExiste una clara relación entre el consumo excesivo de alcohol y el riesgo de ictus. En este caso la relación entre la cantidad de alcohol consumida y el riesgo de ictus no es lineal, como ocurre con el tabaco. Varios estudios confirman que la relación entre alcohol y riesgo de ictus se podría representar gráficamente como una curva en forma de «J», observándose en algunos estudios menor riesgo de ictus para las personas que beben cantidades bajas o moderadas de alcohol en comparación con personas abstemias, mientras que el riesgo aumenta de forma significativa con el consumo excesivo de alcohol19. El efecto «protector» asociado al consumo de cantidades bajas o moderadas de alcohol podría estar relacionado con el aumento de los niveles de colesterol HDL, reducción de la agregación plaquetaria y reducción de los niveles de fibrinógeno en plasma20. Además, el consumo de cantidades moderadas de vino tinto parece mejorar la resistencia a la insulina, el perfil lipídico y la función endotelial en comparación con otras bebidas alcohólicas21.
El consumo excesivo de alcohol se asocia sobre todo con un aumento del riesgo de hemorragia intracerebral. Esta asociación puede estar relacionada con el aumento de cifras de presión arterial, reducción de la agregación plaquetaria y aumento de la secreción por las células endoteliales de activadores del plasminógeno observada en los individuos consumidores de grandes cantidades de alcohol20. Por otro lado, el consumo de grandes cantidades de alcohol en cortos periodos de tiempo se asocia con la aparición de arritmias cardiacas, entre ellas la fibrilación auricular que puede ser responsable de ictus isquémicos cardioembólicos22.
En un metaanálisis que incluyó 27 estudios con casi un millón y medio de individuos, se observó que las personas que bebían cantidades bajas de alcohol (<15 g diarios) tenían menor riesgo relativo (RR) de sufrir un ictus (RR 0,85 para cualquier tipo de ictus, y 0,81 para el ictus isquémico), y un riesgo 33% menor de fallecer por un ictus comparado con individuos abstemios. El consumo moderado de alcohol (15-30 g diarios) se asoció con cifras de RR similares a las observadas en personas abstemias, mientras que el consumo excesivo (> 30 g/día, y sobre todo a partir de 45 g/día) se asoció a un mayor riesgo de ictus (isquémico y hemorrágico, con un RR de 1,20). El efecto de la dosis de alcohol fue mayor en las mujeres que en los varones20.
El estudio INTERSTROKE confirmó estos resultados, observando un aumento del riesgo de ictus global, ictus isquémico y hemorrágico con unas OR de 2,09; 2,14 y 2,44, respectivamente en el grupo de individuos que consumían cantidades excesivas de alcohol (definido consumo excesivo como > 14 bebidas/semana en mujeres y > 21 bebidas/semana en hombres o bien consumo de > 5 bebidas en un día al menos una vez al mes) respecto a los abstemios. Por otro lado, también se observó que el efecto «protector» del consumo de cantidades bajas o moderadas de alcohol ocurría únicamente en población de raza caucásica5.
RecomendacionesSe recomienda abandonar el consumo excesivo de alcohol (> 30 g diarios) como prevención del ictus. Grado de recomendación I, nivel de evidencia B.
Estrés e ictusEl estrés es un sentimiento de tensión física o emocional producido por situaciones o pensamientos que generan frustración en el individuo. El estrés crónico está muy presente en el modo de vida occidental. La exposición a estrés crónico se ha relacionado con un mayor riesgo de padecer enfermedades vasculares23-25.
El mecanismo por el cual el estrés aumenta el riesgo de ictus y otras enfermedades vasculares no es todavía bien conocido, aunque se cree que podría relacionarse con la activación del sistema nervioso simpático y del eje hipotálamo-hipofisario. La activación del sistema nervioso simpático que se produce ante estímulos estresantes externos da lugar a la liberación de catecolaminas en sangre, este hecho produce un aumento de la resistencia a la insulina, aumento de la presión arterial y frecuencia cardiaca y mayor respuesta inflamatoria. La activación del eje hipotálamo-hipofisario por su parte da lugar a un aumento del cortisol circulante que también favorece la resistencia a la insulina, aumenta las cifras de presión arterial y altera la respuesta inmunitaria. Todos estos fenómenos conducirían a una disfunción endotelial implicada en la enfermedad aterosclerótica23.
En un metaanálisis que incluyó 14 estudios y más de 150.000 participantes se observó que las personas expuestas a estrés psicosocial asociaron mayor riesgo de ictus con un HR de 1,33 (similar al efecto de la diabetes sobre el riesgo de ictus). El efecto del estrés fue mayor sobre el riesgo de ictus hemorrágico que sobre el isquémico (HR de 1,73 y 1,40 respectivamente). Asimismo, el riesgo de ictus asociado al estrés fue mayor para las mujeres comparado con los hombres (HR de 1,90 y 1,24, respectivamente)26.
El estrés psicosocial también fue identificado en el estudio INTERSTROKE como un factor asociado de forma independiente con mayor riesgo de ictus, tanto al considerar el ictus de forma global (OR 2,20), como al diferenciar entre ictus isquémico (OR 1,98) o hemorrágico (OR 2,84). La asociación entre estrés e ictus fue especialmente evidente en la población asiática5.
El estrés laboral también se ha relacionado con un aumento en el riesgo de sufrir ictus. Las personas sometidas a alta presión en su trabajo (alta demanda con bajo control de sus funciones laborales) presentan mayor riesgo de ictus comparado con personas que desempeñan trabajos no estresantes (RR 1,22). El efecto del estrés laboral es mayor en las mujeres (RR 1,33) y se relaciona sobre todo con el riesgo de ictus isquémico (RR 1,58) mientras que no se observa una relación estadísticamente significativa entre el estrés laboral y el ictus hemorrágico27.
RecomendacionesEs razonable evitar la exposición a estrés crónico tanto a nivel personal, familiar como laboral. Grado de recomendación IIa, nivel de evidencia B.
ObesidadLa obesidad, definida como un índice de masa corporal (IMC) > 30 kg/m2, es un factor de riesgo establecido para enfermedad cardiovascular e ictus28-30. La obesidad es un problema de salud a escala mundial, especialmente en países desarrollados. Según la Encuesta Nacional de Salud de 2017, la prevalencia de obesidad en España es del 16,7% en mujeres adultas y del 18,2% en hombres, y la de sobrepeso (IMC 25-30 kg/m2) es del 30% en mujeres y 44% en hombres. En un metaanálisis incluyendo más de dos millones de individuos, tanto el sobrepeso como la obesidad se asociaron a un mayor riesgo de ictus isquémico, esta asociación no fue estadísticamente significativa con el ictus hemorrágico3. La obesidad está directamente relacionada con otros factores de riesgo como el sedentarismo, la hipertensión arterial, la dislipemia, la resistencia insulínica y la diabetes. La obesidad central, medida mediante la cintura abdominal (> 102 cm en hombres y > 88 cm en mujeres) está más relacionada con el riesgo vascular que la obesidad global medida mediante el IMC31, y es la que suele incluirse en la definición de síndrome metabólico. En el estudio INTERSTROKE5 un mayor índice cintura-cadera se asoció significativamente con el riesgo de ictus, tanto isquémico como hemorrágico.
En cuanto a la prevención secundaria tras un primer ictus, algunos estudios en la última década revelaron un posible efecto paradójico de la obesidad y el sobrepeso, actuando como protectores de la mortalidad en los supervivientes de un ictus32-34. En una reciente revisión sistemática se concluye que existen diferencias metodológicas entre los estudios publicados que dificultan la extracción de conclusiones al respecto, por lo que son necesarios más estudios y con diseños más robustos para confirmar dicha asociación35.
La pérdida de peso puede conseguirse con: 1) cambios en los hábitos de vida (dieta y ejercicio); 2) fármacos, como los inhibidores de las lipasas gastrointestinales (orlistat), el combinado de bupropion-naltrexona o la liraglutida subcutánea; 3) cirugía bariátrica en casos de obesidad mórbida (IMC > 40)36.
El estudio look AHEAD evaluó los efectos de la reducción de peso mediante un programa intensivo de modificación de estilos de vida (comparado con un grupo control) sobre la disminución del riesgo vascular en más de 5.000 sujetos diabéticos con sobrepeso/obesidad. El brazo de intervención consiguió al cabo de ocho años una reducción significativa en el peso (≥ 5%) en el 50% de participantes37. Aquellos participantes que consiguieron una disminución de al menos un 10% de su peso original presentaron una reducción del 21% del riesgo de sufrir un evento vascular combinado (muerte de origen vascular, ictus, angina y/o cardiopatía isquémica no fatal)38. En este estudio no se analizó por separado el riesgo de sufrir un nuevo ictus.
El tratamiento con liraglutida subcutánea (un análogo de las incretinas, agonista del receptor GLP-1 y utilizado en la diabetes) contribuyó a la reducción de peso comparado con orlistat y con placebo en sujetos no diabéticos39. Además, la liraglutida ha demostrado ser protector frente a eventos vasculares incidentes (muerte de origen vascular, ictus no fatal y/o evento coronario no fatal) en pacientes diabéticos, si bien no se demostró la protección frente al ictus por separado40.
RecomendacionesSe recomienda evitar el sobrepeso y la obesidad para reducir el riesgo de sufrir un ictus. Grado de recomendación I, nivel de evidencia B.
Dieta y nutriciónDiferentes hábitos nutricionales han sido estudiados en el ámbito de la prevención primaria de la cardiopatía isquémica y el ictus. Una dieta baja en sal (menos de 1,5 g/día) y en grasas saturadas y rica en frutas y vegetales, en inglés conocida por el acrónimo DASH (dietary approaches to stop hypertension) se considera efectiva en el control de la hipertensión arterial41. Además, en una revisión sistemática y metaanálisis reciente, la dieta DASH se asoció no sólo con mejoría en el control tensional, del peso corporal, de las cifras de colesterol y de la diabetes, sino también a reducción de eventos vasculares, siendo el riesgo relativo de ictus de 0,81 (0,72-0,92)42. El patrón de dieta mediterránea es un enfoque dietético similar que consiste en el consumo abundante de alimentos como frutas, verduras, legumbres, frutos secos, aceite de oliva como fuente principal de grasa, cantidades moderadas/altas de pescado, reducción del consumo de carne roja y de bebidas azucaradas. En una revisión actual sobre la dieta mediterránea y la prevención del ictus, incluyendo nueve revisiones sistemáticas y seis revisiones con metaanálisis, se concluye que una alta adherencia a la dieta mediterránea se asocia inversamente con el riesgo de ictus43. En España, cabe destacar el ensayo clínico aleatorizado PREDIMED (PREvención con DIeta MEDiterránea), que incluyó 7.447 participantes con alto riesgo vascular; los sujetos que recibieron dieta mediterránea suplementada con nueces, aceite de oliva (o ambos) presentaron un riesgo significativamente menor de eventos vasculares (muerte vascular, evento coronario y/o ictus) que los sujetos control, los cuales recibieron una dieta baja en grasas, tras cinco años de seguimiento. Específicamente, el riesgo de ictus fue evaluado como resultado secundario con una HR de 0,58 [0,42-0,82] en el grupo asignado a dieta mediterránea44. En un estudio de caso s y controles desarrollado en Barcelona, incluyendo 300 pacientes con ictus isquémico y 300 controles sanos, se detectaron diferencias significativas en los patrones alimentarios entre los pacientes que habían sufrido un ictus y los controles sanos. En concreto, la dieta de los pacientes con ictus contenía más proteínas, más colesterol, más alimentos empanados y menos probióticos45.
Respecto a los suplementos vitamínicos del grupo B (vitaminas B6, B12 y ácido fólico-B9), que producirían como efecto intermedio una disminución en las concentraciones de homocisteína, en las últimas dos décadas se han publicado diferentes ensayos clínicos, revisados en 2017 por la librería Cochrane, sin demostrarse un beneficio neto en la prevención de eventos vasculares ni muerte vascular46. En referencia a la prevención del ictus, se realizó un metaanálisis de 10 ensayos clínicos (más de 44.000 pacientes con antecedente de enfermedad vascular y sin insuficiencia renal), con seguimiento medio de siete años, y se observó un pequeño beneficio neto de dichos suplementos (solos o en combinación) frente al placebo, con un RR 0,90 [0,82-0,99]46. Sin embargo, existen diferencias metodológicas importantes en cuanto a las dosis y combinaciones de suplementos usadas en los diferentes estudios y los autores comunicaron estos resultados con cautela, sin poder dar recomendaciones explícitas. En 2019 se publicó un metaanálisis de nueve ensayos clínicos centrado en los suplementos de ácido fólico, incluyendo 46.094 pacientes con enfermedad cardio- o cerebrovascular previa, y se concluyó que la suplementación con ácido fólico reduce el riesgo de ictus con un RR 0,85 [0,77-0,94], pero no el de eventos coronarios o muerte de origen vascular47. En este metaanálisis solo se observó beneficio frente al ictus tras la administración aislada de ácido fólico, y no en combinación con otros suplementos del grupo B. En cuanto a la dosis, se observó que este beneficio solo se producía con suplementación < 2 mg/día y no en los que recibieron > 2 mg/día. Asimismo, el beneficio solo se observó en seguimientos mayores de 40 meses.
RecomendacionesSe recomienda seguir una dieta mediterránea con suplementos de frutos secos y aceite de oliva virgen para reducir el riesgo de ictus. Grado de recomendación I, nivel de evidencia A.
La suplementación con bajas dosis de ácido fólico podría ser beneficiosa para reducir el riesgo de ictus en pacientes con enfermedad vascular previa. Grado de recomendación IIa, nivel de evidencia B.
SedentarismoEl sedentarismo es altamente prevalente en las sociedades occidentales y está asociado, además, con otros factores de riesgo como la obesidad, dislipidemia, hipertensión arterial o el síndrome metabólico. Según la Encuesta Nacional de Salud 2017, un 40,0% de mujeres españolas se declaran sedentarias frente a un 31,9% de hombres. En el estudio INTERSTROKE, la práctica regular de actividad física moderada o intensa (al menos 4 h a la semana) se asoció con menor riesgo de ictus global con una OR 0,60 [0,52-0,70], siendo similar en la prevención de ictus isquémicos y hemorrágicos5. Múltiples revisiones y metaanálisis han demostrado que la práctica regular de ejercicio está asociada con una menor incidencia de enfermedad cardio- y cerebrovascular, así como con menor mortalidad vascular y de cualquier causa48. La actividad física se puede medir en equivalentes metabólicos o MET. Un MET es la energía consumida mientras se permanece sentado en estado de reposo. El valor MET de una actividad o un ejercicio se calcula en relación al reposo y se suele multiplicar por los minutos que se realiza dicha actividad en la semana. Se considera actividad física moderada la que equivale a 3-6 MET-minuto y nos lleva a sudar o a aumentar el ritmo cardiaco (p.ej caminar rápido) y actividad física vigorosa cuando equivale a > 6 MET-minuto (p.ej correr o hacer aerobic). En un metaanálisis, la actividad física de más de 8.000 MET/semana se asoció a un menor riesgo de ictus incidente, con un RR 0,74 [0,66-0,81], comparada con la actividad física < 600 MET/semana48. Cualquier actividad es mejor que nada y, en la población general, se recomienda realizar al menos 150 minutos/semana de actividad moderada (que se conseguirían p. ej. caminando 30 minutos cinco días a la semana), 75 minutos/semana de actividad vigorosa o una combinación equivalente; tanto las actividades aeróbicas como las de resistencia muscular son beneficiosas49. Además de sus efectos en la prevención del ictus, la práctica de ejercicio previo al ictus podría actuar como un factor protector en la isquemia cerebral, mejorando el pronóstico del mismo50.
Existen menos datos en cuanto al impacto del ejercicio en la prevención secundaria del ictus, más allá de su efecto beneficioso sobre el control de los factores de riesgo vascular y sobre la capacidad cardiorrespiratoria de los pacientes. En un subanálisis del estudio SAMMPRIS (donde se incluyeron pacientes con ictus isquémico debido a aterosclerosis intracraneal asignados al brazo de tratamiento médico, en el cual se realizaba una intervención telefónica sobre los factores de riesgo modificables, incluyendo la actividad física), solo aquellos pacientes que realizaron más de 30 minutos de actividad física moderada al menos tres días por semana consiguieron una mayor reducción de eventos vasculares recurrentes (coronarios, cerebrales y/o muerte de origen vascular) a los tres años51.
En la relación con las posibles medidas de intervención para incentivar la realización de ejercicio físico (más allá del consejo médico), en prevención primaria el estudio PREDIMED-plus ha demostrado la eficacia de un programa educacional consiguiendo aumentar los niveles de actividad física diaria tras un año de seguimiento52; de forma similar, el estudio ICARUSS, que pretendía un control multidisciplinar de los factores de riesgo modificables tras un ictus, demostró beneficio en el control de muchos de ellos, incluida la promoción de actividad física53.
RecomendacionesSe recomienda la práctica de actividad física moderada 150 min/semana o actividad física vigorosa 75 min/semana para reducir el riesgo de ictus. Grado de recomendación I, nivel de evidencia B.
Contaminación atmosférica e ictusLa exposición a la contaminación del aire constituye un problema de salud pública de primer orden. En 2015 la contaminación atmosférica fue una de las principales causas mundiales de morbimortalidad, provocando 6,5 millones de muertes y 167,3 millones de años de vida perdidos ajustados por discapacidad. Multitud de estudios epidemiológicos han demostrado la existencia de una relación directa entre la contaminación del aire y la incidencia de enfermedades vasculares ateroscleróticas. Se atribuye a la contaminación atmosférica el 19% de la mortalidad vascular y el 21% de las muertes por ictus54,55.
Los principales agentes contaminantes que representan un riesgo para la salud son las partículas en suspensión en el aire (particulate matter, PM) y los contaminantes gaseosos como el ozono (O3), dióxido de azufre (SO2), monóxido de carbono (CO) y dióxido de nitrógeno (NO2). Las partículas en suspensión se clasifican en función de su tamaño en partículas gruesas o PM10 (diámetro menor o igual a 10 μm), partículas finas o PM2,5 (diámetro menor o igual a 2,5 μm) y partículas ultrafinas o nanopartículas (diámetro menor de 0,1 μm). Las nanopartículas y partículas finas (PM 2,5 μm) son las más frecuentemente implicadas en la aparición de enfermedades vasculares. Se han propuesto diferentes mecanismos para explicar la relación entre estos contaminantes y las enfermedades vasculares, incluyendo fenómenos inflamatorios, alteración de la función endotelial, cambios en la viscosidad de la sangre, alteración de la homeostasis vascular y mecanismos epigenéticos55.
Podemos distinguir dos tipos de exposición al aire contaminado: la exposición crónica y la exposición aguda («picos» de contaminación).
Múltiples estudios han mostrado que las personas que residen en zonas expuestas a altos niveles de contaminación atmosférica de forma permanente presentan mayor riesgo de sufrir eventos vasculares. En un metaanálisis se observó que por cada aumento de 10 μg/m3 de PM 2,5 μm en el aire, se aumentaba en un 6% el riesgo acumulado de mortalidad de cualquier causa, y en un 11% el riesgo de muerte vascular56. Otro metaanálisis también demostró que cada aumento de 5 μg/m3 de PM 2,5 μm en el aire se asociaba a un aumento del riesgo de ictus (HR 1,064) y de ictus mortal (HR 1,125)57. Además, un reciente estudio ha demostrado que la exposición crónica a PM2,5 se asocia de forma independiente con la enfermedad ateromatosa carotídea58.
En los grandes núcleos urbanos se producen ocasionalmente y durante cortos periodos de tiempos «picos» de contaminación durante los cuales se registra un aumento muy importante de los niveles de partículas y gases contaminantes en la atmósfera. Esta exposición aguda a agentes contaminantes se ha asociado con un aumento de la incidencia de eventos vasculares y en especial de ictus. En un metaanálisis en el que se revisaron más de seis millones de ictus en 28 países del mundo se observó que la tasa de ingresos hospitalarios y la mortalidad por ictus aumentaba en los días en los que se registraba un aumento de los niveles de contaminación atmosférica. La asociación fue especialmente evidente para los aumentos de niveles de PM 2,5 μm, SO2, NO2 y CO59.
Además de la contaminación atmosférica, se ha observado que otros aspectos de la contaminación ambiental como la exposición a contaminación acústica, el escaso acceso a espacios verdes o el calentamiento global pueden asociarse a mayor riesgo de ictus y/o mayor gravedad de los mismos60,61.
RecomendacionesSe recomienda aplicar políticas de salud pública que permitan disminuir la contaminación atmosférica por su potencial efecto en la prevención del ictus. Grado de recomendación I, nivel de evidencia B.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.