La conveniencia del implante de stent en lesiones carotídeas suboclusivas es un tema controvertido. Nuestro trabajo valoró las implicaciones clínicas y de procedimiento de la revascularización de lesiones carotídeas suboclusivas.
MétodosSe incluyó a 205 pacientes con enfermedad carotídea revascularizados con stent: los pacientes con lesiones suboclusivas (n = 54) fueron comparados con el resto de la población (n = 151).
ResultadosNo hubo diferencias entre grupos para la edad, el sexo y la tasa de pacientes sintomáticos (que constituían 3 cuartas partes de la población). El implante de stent en lesiones suboclusivas cursó con una alta tasa de éxito (96%), similar al resto de las lesiones (98%). La revascularización de las lesiones suboclusivas condicionó un mayor uso de protección proximal (54% vs. 20,5%, p < 0,001) y necesidad de predilatación (33% vs. 17%, p = 0,01). El abordaje de lesiones suboclusivas ocasionó un mayor desprendimiento de placa, manifestado por una mayor tasa de material embólico extraído (18,5% vs. 7%, p = 0,01) y de lesiones isquémicas cerebrales periprocedimiento (47% vs. 31%, p = 0,07). A los 30 días de la revascularización, la tasa de eventos neurológicos (muerte, ictus mayor, ictus menor) mostró tendencia a ser mayor para el grupo con lesiones suboclusivas (9,2% vs. 3,2%, p = 0,08).
ConclusionesLa revascularización con stent de lesiones carotídeas suboclusivas presenta una alta tasa de éxito de procedimiento; sin embargo, su mayor carga de placa ocasiona un superior porcentaje de lesiones isquémicas cerebrales, y de eventos neurovasculares en el primer mes.
The advisability of implanting a stent in carotid near-occlusion stenosis is a controversial topic. We have assessed procedural and clinical implications of stent implantation for carotid artery disease with near occlusion.
MethodsWe included 205 patients who underwent carotid artery revascularisation with a stent. The group of patients with near-occlusion stenosis (n=54)was compared to the rest of the population (n=151).
ResultsNo differences were found between groups for age, sex, and the percentage of symptomatic patients (three-quarters of the population). Carotid stent revascularisation for near-occlusion stenosis presented a high procedural success rate (96%) similar to that of revascularisation processes for other lesions (98%). Stenting in cases of near-occlusion stenosis required increased use of proximal protection (54% vs. 20.5%, P<.001) and predilation (33% vs. 17%, P=.01). The process to repair near-occlusion stenosis cause increased detachment of plaque, as shown by higher percentages of macroscopic plaque captured by protection devices (18.5% vs. 7%, P=.01) and of perioperative ischaemic brain lesions (47% vs 31%, P = .07). At 30 days of follow-up, the tendency toward adverse neurological events (death, major and minor stroke) was higher in the near-occlusion group (9.2% vs. 3.2%, P=.08).
ConclusionsStent revascularisation for near-occlusion carotid stenosis has a high procedural success rate; however, its higher plaque load was responsible for the increased rate of ischaemic brain lesions and adverse neurovascular events at 30 days post-procedure.
Las enfermedades cerebrovasculares presentan una alta incidencia en nuestro país (166,9 ictus y 36,7 accidentes isquémicos transitorios, por 100.000 habitantes-año), y constituyen la primera causa de muerte entre las mujeres españolas, y la segunda para los varones1. Aproximadamente un tercio de los ictus se deben a enfermedad carotídea extracraneal2. Las características de la placa carotídea (severidad obstructiva, presencia de úlcera o trombo, etc.), junto con su repercusión sintomática, son las variables que se relacionan de forma más estrecha con el riesgo de presentar un accidente cerebrovascular3,4.
Las lesiones suboclusivas de arteria carótida (SOAC) constituyen todavía un dilema de tratamiento5. Por un lado, las lesiones críticas carotídeas pueden ocasionar el agotamiento de la capacidad vasorreguladora intracraneal, y esto se ha asociado a un aumento del riesgo de eventos cerebrovasculares6. Sin embargo, el principal mecanismo de ictus por enfermedad carotídea es la embolia de material aterotrombótico desprendido de la placa; el riesgo de embolización es mayor conforme lo es la severidad de la obstrucción, pero se reduce en las lesiones suboclusivas al disminuir el flujo sanguíneo que se dirige al cerebro7.
El objetivo de este trabajo fue el estudio de las implicaciones clínicas y de procedimiento que suponen el abordaje con stent de lesiones suboclusivas de arteria carótida, en comparación con el del resto de las lesiones carotídeas sometidas a revascularización percutánea.
MétodosEstudio descriptivo y monocéntrico, en el que se han incluido de modo consecutivo los pacientes sometidos a revascularización carotídea con stent entre enero del 2008 y marzo del 2012 en el Hospital Virgen Macarena (Sevilla), comparando 2 poblaciones según el carácter suboclusivo o no de la lesión carotídea.
La revascularización con stent de las lesiones carotídeas se realiza en nuestro centro de una forma multidisciplinar, a través de un «neurovascular team», formado por neurólogos, radiólogos y cardiólogos intervencionistas. El papel del neurólogo consiste en indicar el procedimiento, monitorizar al paciente durante la intervención y revisar su estado neurológico a las 24h y 30 días. El intervencionismo carotídeo fue realizado por 2 cardiólogos intervencionistas (RR-S y CC), que han recibido una formación reglada para realizar este procedimiento (formación teórica monitorizada, visualización de procedimientos en centro de amplio volumen y ensayo de habilidades con simulador) y que fueron asistidos en los 5 primeros casos por un radiólogo intervencionista experto.
Se han evaluado la tasa de éxito del procedimiento (implante del stent en carótida interna sin la aparición de eventos neurovasculares —ictus menor, ictus mayor y muerte— en las primeras 24h) y la tasa acumulada de eventos neurovasculares a 30 días; también se ha registrado la presencia de infarto en estudio de resonancia magnética en los primeros 10 días tras el procedimiento.
Análisis cuantitativo de las lesiones carotídeas. Definición de lesión suboclusiva de arteria carótidaLas lesiones carotídeas y el resultado de su revascularización fueron medidos por el software de cuantificación de Siemens Artis Zee (CAAS II, Pie Medical, Holanda). La cuantificación de la severidad lesional no se realizó con criterio NASCET (relación entre el diámetro mínimo lesional y el de carótida interna de referencia), ya que en las lesiones subtotales es frecuente que la arteria carótida interna muestre una pérdida de calibre por disminución de flujo; por ello, hemos optado por considerar como diámetro de referencia el de la arteria carótida común previo a la lesión.
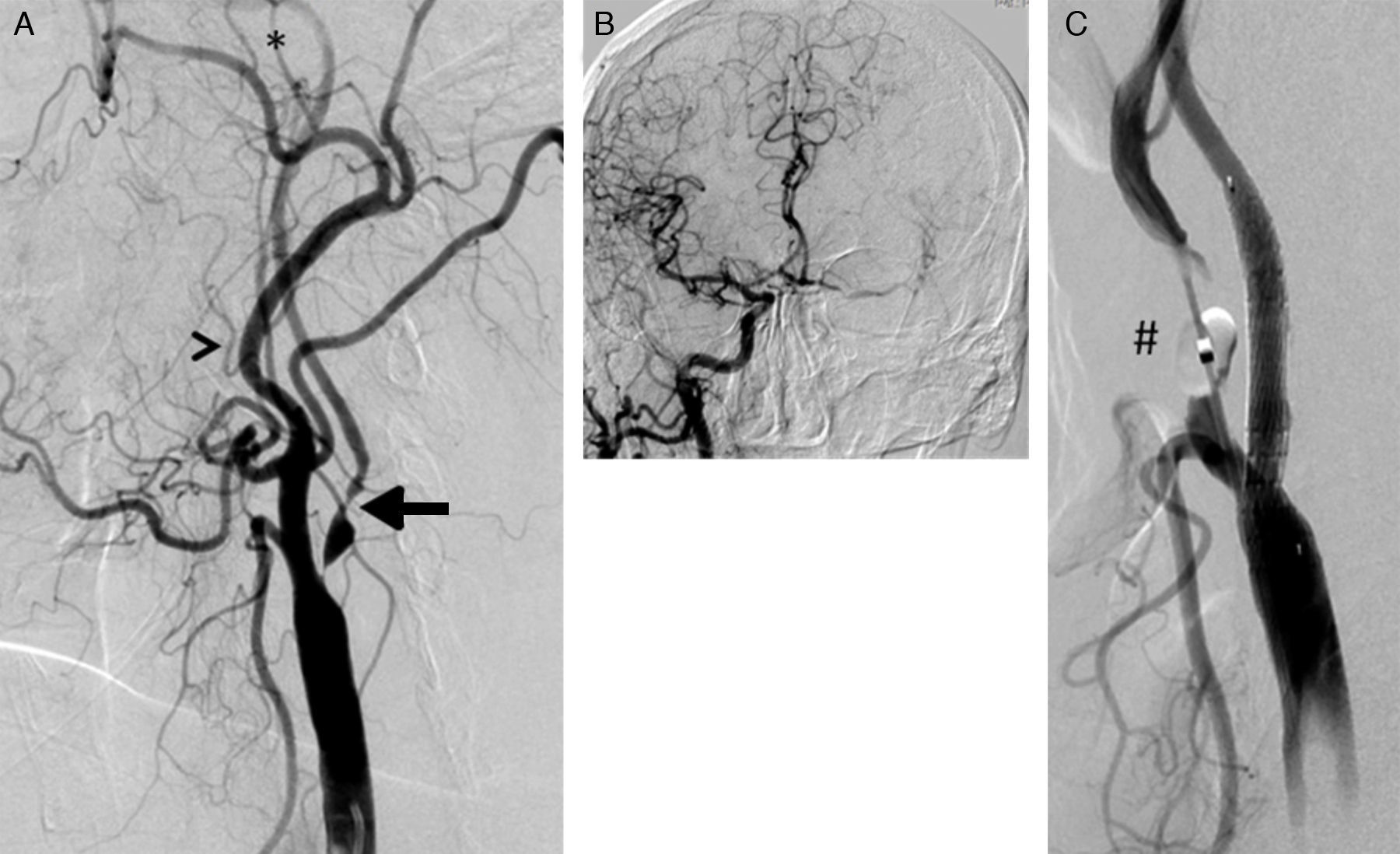
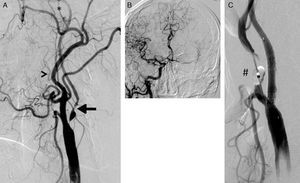
Las lesiones SOAC han sido definidas en previos trabajos mediante la aplicación de una serie de criterios cualitativos7: disminución del calibre de la arteria carótida interna con respecto a la común o la interna contralateral, menor velocidad de contrastación de la carótida interna con respecto a la externa, y/o evidencia de colaterales intracraneales. Estos criterios, signos indirectos de la severidad obstructiva de la placa carotídea, no son aplicables a toda la población con lesiones SOAC: la falta de continuidad en el polígono de Willis limita la presencia de circulación colateral; la enfermedad severa o la oclusión carotídea contralateral impide valorar tanto la presencia de colateralidad como la comparación del flujo o calibre entre ambas carótidas internas y, por otro lado, la lesión puede comprometer el origen de la arteria carótida externa y con ello su velocidad de llenado. Por ello, junto a los anteriores criterios cualitativos, nosotros hemos añadido la severidad obstructiva crítica (diámetro mínimo luminal inferior a 1mm) (fig. 1).
A) Lesión suboclusiva de la arteria carótida mostrando todos los criterios cualitativos para su definición: arteria carótida interna (flecha) de menor diámetro que la carótida externa (cabeza de flecha); opacificación distal en el territorio de la carótida interna, reducida con respecto a la externa (*); presencia de circulación colateral intracraneal compensadora (B). C) Resultado tras el implante de stent Cristallo (Invatec-Medtronic). Se aprecia el balón distal (#) del dispositivo MoMa (Invatec-Medtronic) inflado en el inicio de la arteria carótida externa.
La valoración de la presencia de circulación colateral intracraneal ipsolateral a la zona de lesión se ha clasificado en 3 grados: ausente, discreta (relleno único de la arteria cerebral anterior) y excelente (relleno de la arteria cerebral anterior y media ipsolaterales a la lesión).
Procedimiento de revascularización de la arteria carótida con implante de stentLa indicación de revascularización carotídea en nuestra Unidad se realizó basada en los siguientes criterios8: pacientes sintomáticos (clínica neurológica en los últimos 6 meses) con estenosis carotídea significativa (> 50%) y pacientes asintomáticos con estenosis carotídea > 60% y oclusión de carótida contralateral.
La única prueba diagnóstica que aportaron los pacientes antes de la revascularización fue una ecografía Doppler carotídea (severidad obstructiva y las características de la placa).
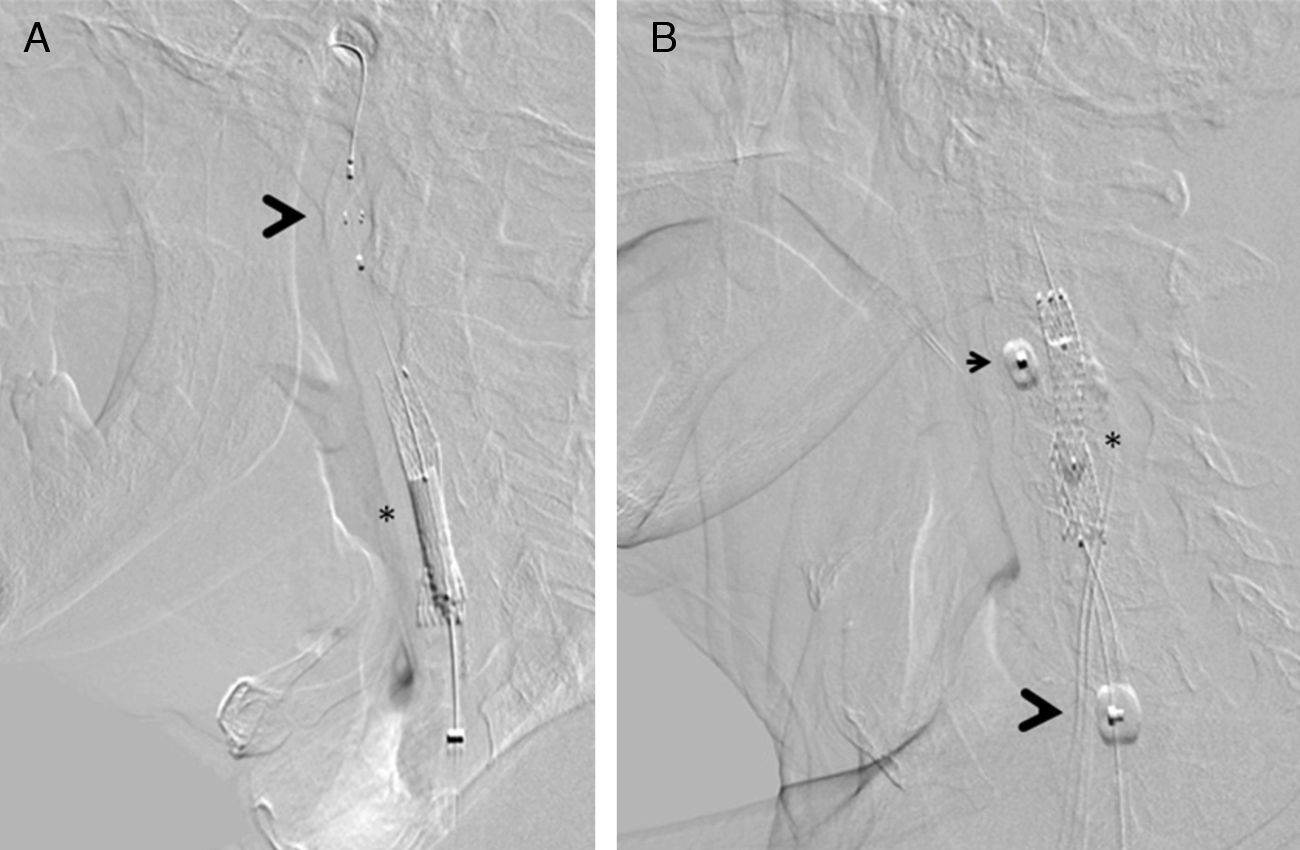
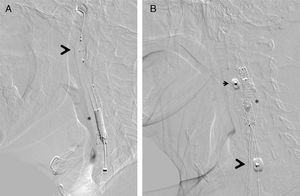
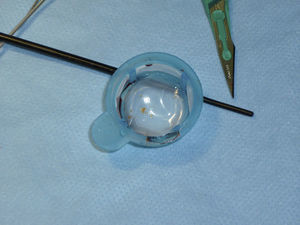
El procedimiento se realizó mediante el empleo rutinario de sistema de protección embólica. Nuestro grupo utiliza dispositivos de protección distal con filtro (Angioguard, Cordis, EE. UU.) y de protección proximal (MoMa, Medtronic, Italia) (fig. 2). La selección del tipo de protección quedó a criterio del operador, dependiendo de una serie de factores: severidad y características de la placa, tortuosidad del vaso y presencia de enfermedad significativa en la carótida contralateral.
Dispositivos de protección embólica, en el momento de procedimiento consistente en la posdilatación del stent implantado (*). A) Protección distal con filtro Angioguard (Cordis), que se posiciona en la porción vertical del segmento petroso de la arteria carótida interna cervical (cabeza de flecha). B) Protección proximal mediante MoMa (Invatec-Medtonic) con su balón distal inflado en el inicio de la arteria carótida externa (cabeza de flecha pequeña) y balón proximal en la arteria carótida común (cabeza de flecha grande): de esta forma se produce un bloqueo de flujo anterógrado a través de la zona lesional, con aparición retrógrada de flujo contralateral que protege contra la embolización.
Se realizó la predilatación únicamente cuando no fue posible el cruce de la lesión por el stent, independientemente del sistema de protección empleado; sin embargo, en todos los pacientes se posdilató empleando un balón de 5mm de diámetro. Se emplearon de forma indistinta stents de celda abierta (Protegè, eV3; Acculink, Abbott; Precise, Cordis; EE. UU.) y de diseño mixto (Cristallo, Medtronic, Italia).
Tras una fase inicial, realizamos 2 modificaciones al método de intervención: por un lado, se evitó la administración rutinaria de 1mg de atropina previo a la posdilatación, con el fin de conseguir un mejor control de la presión arterial en la fase inmediatamente posterior a la intervención. Además, se monitorizó al paciente durante 6 h tras la revascularización, enfatizando el control de la presión arterial. Por otro lado, también se produjo un cambio respecto a la pauta antitrombótica. En una fase inicial, los pacientes acudían doblemente antiagregados y recibían durante el procedimiento 100 U de heparina sódica/kg de peso y una dosis fija de 300mg de clopidogrel tras el implante del stent. A partir del año 2010, decidimos modificar la pauta antitrombótica de tal forma que el paciente recibía al inicio del procedimiento 50 U de heparina sódica/kg de peso y no se añadía dosis extra de clopidogrel. Durante el primer mes, el paciente continuó con doble antiagregación.
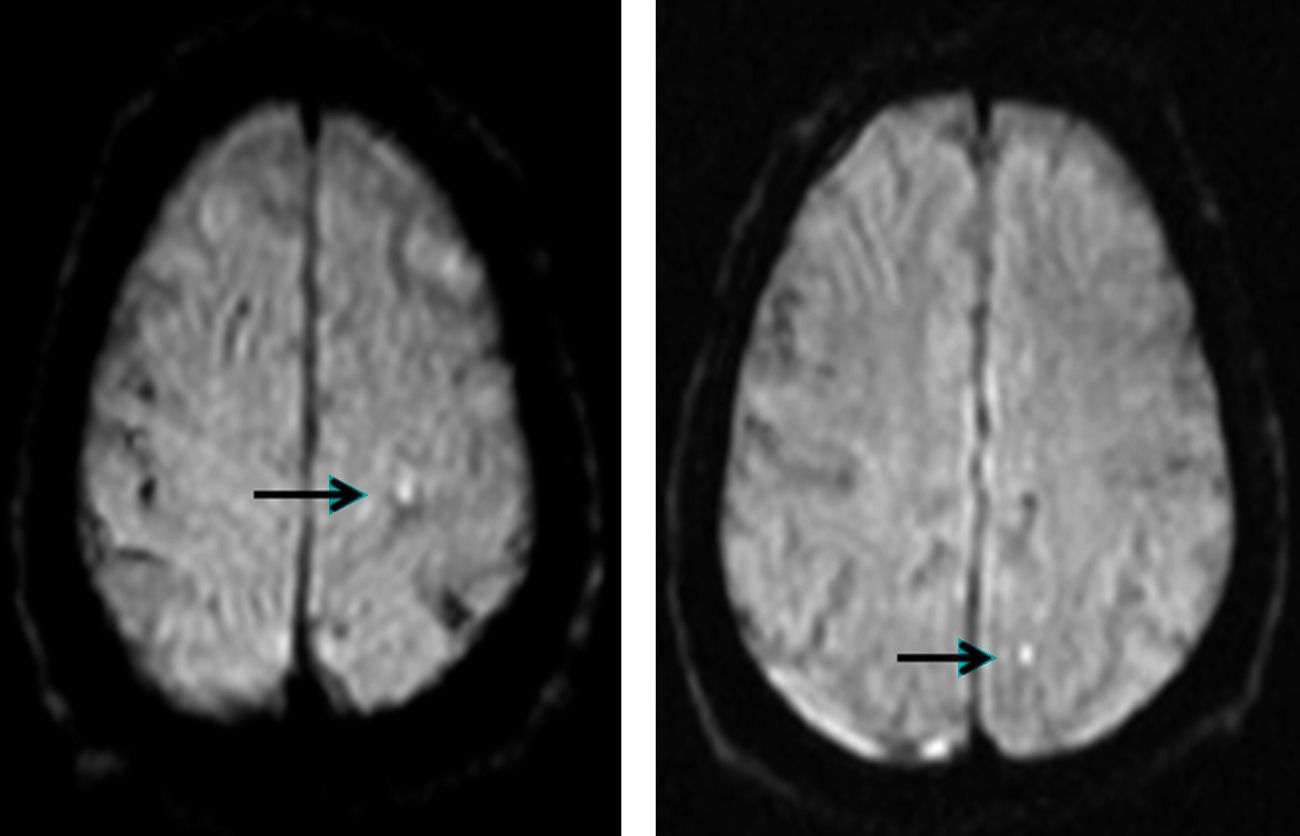
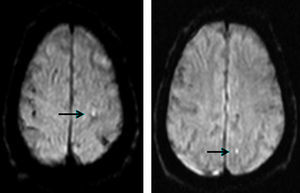
Evaluación de las lesiones isquémicas cerebrales periprocedimientoSe solicitó estudio de resonancia magnética cerebral (secuencias sagital T1, axial T2 y potenciada en difusión con mapa ADC, y finalmente, coronal Flair) a todos los pacientes en los 10 días siguientes al procedimiento, excepto criterio de contraindicación; finalmente, se evaluó a 137 pacientes (67% de la población), siendo el principal motivo de no realizarse la incapacidad logística para la cita en el periodo de tiempo establecido. La realización de estos estudios se efectuó por el equipo Magnetom Symphony 1,5T (Siemens, Alemania), empleando una secuencia potenciada en difusión. En cuanto a su comportamiento de señal, se consideraron lesiones isquémicas de reciente instauración aquellas áreas hiperintensas en secuencias de difusión e hipointensas en los mapas de ADC (fig. 3).
Resonancia magnética con secuencia ponderada en difusión, en la que aparecen en la sustancia blanca parietal izquierda (ipsolateral a la arteria carótida revascularizada) imágenes hiperintensas puntiformes que indican zonas de restricción de la difusión y, por tanto, infarto periprocedimiento (flechas).
Se han introducido los datos en la hoja de cálculo Excel (Microsoft Office 2007, EE. UU.) y se han analizado mediante el paquete estadístico SPSS versión 20.0. Para la descripción de las variables continuas se ha utilizado la media±desviación estándar, mientras que las variables categóricas se han expresado como número (%). Se han comparado las variables entre 2 muestras independientes (grupo de pacientes con lesiones SOAC y grupo formado por los demás pacientes revascularizados) mediante la prueba de la t de Student para las variables continuas y mediante el test de la chi al cuadrado de Pearson para las variables categóricas.
ResultadosEn estos 4 años de actividad, se han realizado 205 revascularizaciones carotídeas en nuestra Unidad, de las que 54 fueron realizadas sobre lesiones SOAC (26%), mientras que las 151 restantes lo fueron sobre lesiones significativas no suboclusivas (grupo no SOAC, 74%).
Características clínicasLas características clínicas basales de ambos grupos se expresan en la tabla 1. Las 2 poblaciones presentaron un alto y equiparable porcentaje de pacientes sintomáticos, que comprendieron 3 cuartas partes de la población. Respecto a los factores de riesgo cardiovascular, no existieron diferencias significativas para el hábito de tabaco, la hipertensión arterial y la diabetes; sin embargo, los pacientes con lesiones SOAC mostraron mayor tasa de dislipidemia (85% vs. 69%, p=0,02). Los 2 grupos también fueron diferentes en cuanto al antecedente de enfermedad cardiovascular extracarotídea (coronaria y/o vascular periférica): los pacientes el grupo no SOAC mostraron significativamente mayor frecuencia de presentación de enfermedad cardiovascular extracarotídea (63% vs. 48%, p=0,05).
Características clínicas basales
| Grupo SOAC (n = 54) | Grupo no SOAC (n = 151) | ||
| Edad (años) | 67 ± 11 | 69 ± 8 | ns (p=0,86) |
| Octogenarios (%) | 8 (15) | 12 (8) | ns (p=0,14) |
| Sexo varón (%) | 45 (83) | 122 (81) | ns (p=0,68) |
| Fumador (%) | 33 (61) | 102 (67,5) | ns (p=0,54) |
| Hipertensión arterial (%) | 39 (72) | 126 (83) | ns (p=0,14) |
| Dislipidémico (%) | 46 (85) | 104 (69) | p=0,02 |
| Diabetes (%) | 22 (41) | 76 (50) | ns (p=0,22) |
| Otra enfermedad cardiovascular (%) | 26 (48) | 95 (63) | p=0,05 |
| Sintomático (%) | 40 (74) | 111 (73,5) | ns (p=0,93) |
±: media ± DE.
La tabla 2 resume los hallazgos angiográficos y las características del procedimiento de implante de stent. En el grupo de lesiones SOAC, el diámetro mínimo luminal fue de 0,5±0,3mm. Para este grupo, junto con la severidad obstructiva (diámetro mínimo luminal < 1mm), se valoraron la presencia y la calidad de la circulación vicariante intracraneal. En 38 pacientes (70% de la población SOAC), la lesión SOAC se acompañó de circulación colateral intracraneal, que fue discreta para 14 pacientes (relleno único de la arteria cerebral anterior) y excelente para los otros 24 casos (aparición de arterias cerebrales anterior y media).
Datos angiográficos y de procedimiento
| Grupo SOAC (n=54) | Grupo no SOAC (n=151) | Significación | |
| Arco aórtico II/III (%) | 16 (30) | 48 (32) | ns (p=0,77) |
| Lado: Carótida Derecha (%) | 21 (39) | 77 (51) | Ns (p=0,11) |
| Enfermedad contralateral (%) | 24 (44) | 71 (47) | ns (p=0,74) |
| Ø Arteria carótida común (mm) | 8,0±1,7 | 7,7±1,1 | ns (p=0,43) |
| % Estenosis carótida | 93±4 | 72±12 | p<0,001 |
| Protección embólica (%) | |||
| Distal | 25 (46) | 120 (79,5) | p<0,001 |
| Proximal | 29 (54) | 31 (20,5) | p<0,001 |
| Intolerancia | 3 (5,5) | 10 (32) | p=0,04 |
| Material | 10 (18,5) | 11 (7) | p=0,01 |
| Predilatación (%) | 18 (33) | 26 (17) | p=0,01 |
| Stent (mm) | |||
| Ø mayor (mm) | 8±1 | 9±1 | p=0,05 |
| Longitud (mm) | 38±7 | 39±10 | ns (p=0,84) |
| Cónico (%) | 45 (83) | 116 (77) | ns (p=0,31) |
| DML prestent (mm) | 0,5±0,3 | 2,2±0,9 | p<0,001 |
| DML poststent (mm) | 4,1±0,8 | 4,5±0,8 | p=0,002 |
| Ganancia luminal aguda (mm) | 3,6±0,8 | 2,3±1,1 | p<0,001 |
±: media ± DE.
Hubo diferencias en el procedimiento de revascularización para los 2 grupos de lesiones. Las lesiones subtotales necesitaron predilatación en un mayor porcentaje (33% vs. 17%, p=0,01), aunque ciertamente no fue muy alto en general. Las mayores diferencias en el procedimiento aparecieron para el modo de protección: la utilización de protección proximal con MoMa fue significativamente mayor en las lesiones subtotales que en el resto (54% vs. 20,5%, p<0,001). Es interesante resaltar que la tasa de intolerancia al MoMa fue mayor en los pacientes del grupo no SOAC (5,5% vs. 32%, p=0,04). Por último, también hubo diferencias significativas entre grupos para la captura de material embolizado, con mayor tasa de material macroscópico en los casos de revascularización de lesiones SOAC (18,5% vs. 7%, p=0,01) (fig. 4).
Revascularización carotídea con stent según el grado de severidad lesional: implicaciones clínicasLa tasa de éxito de procedimiento en las lesiones SOAC fue del 96%; en 2 casos se produjo fracaso del procedimiento debido a la aparición de un déficit neurológico menor, en concreto una amaurosis fugax y una paresia leve de un miembro superior, ambos con resolución completa posterior. Por otro lado, el porcentaje de éxito de procedimiento en el grupo no SOAC fue del 98%; 3 procedimientos no cursaron con éxito: en un caso se produjo ictus mayor por embolización de material a la arteria cerebral media, que tuvo que ser extraído, con éxito, en el mismo procedimiento mediante trombectomía con stent Solitaire (eV3; EE. UU.); en los otros 2 casos los pacientes sufrieron un déficit neurológico menor, ambos transitorios.
Ambos grupos tuvieron un porcentaje idéntico de estudios de resonancia magnética cerebral (36 casos en el grupo SOAC y 101 en el no SOAC, 67% en ambos). La presencia de lesiones isquémicas periprocedimiento fue del 47% entre los pacientes con lesiones subtotales (88% silentes), mientras que en el grupo de pacientes no SOAC la presencia de lesiones isquémicas en la resonancia fue del 31% (90% silentes) (p=0,07).
Dentro del primer mes se produjeron 3 hemorragias intracraneales, con resultado de defunción entre los pacientes con lesión SOAC (tasa de defunción del 5,5%). Para el resto de los pacientes, se produjo un único caso de defunción por hemorragia intracraneal durante el primer mes (0,6%). El síndrome de hiperperfusión tras la revascularización debió ser el responsable del evento de hemorragia intracraneal. Todos estos casos se produjeron en pacientes sintomáticos, y en 3 de ellos con infarto reciente en el territorio de cerebral media ipsolateral.
La tasa de eventos neurológicos acumulados dentro del primer mes fue del 9,2% para el grupo SOAC (3 defunciones y 2 ictus menores) y del 3,2% para el grupo no SOAC (una defunción, un ictus mayor y 3 ictus menores —a los 10 días del procedimiento un paciente presentó trombosis de la arteria central de la retina—), lo que muestra una tendencia a mayor aparición de eventos entre los primeros (p=0,08).
DiscusiónEste trabajo recoge la experiencia en el abordaje de lesiones carotídeas suboclusivas de un «neurovascular team» formado por neurólogos, radiólogos y cardiólogos intervencionistas.
La revascularización de las lesiones SOAC mediante implante de stent se realizó con una alta tasa de éxito de procedimiento, pero conllevó un aumento de complicaciones neurológicas durante el primer mes comparado con la revascularización de lesiones menos severas. El mayor sustrato de placa en las lesiones suboclusivas ocasionó una mayor tasa de lesiones isquémicas intracraneales tras el procedimiento y, por otra parte, el paciente estuvo más expuesto al sangrado intracraneal debido al síndrome de hiperperfusión.
Población con enfermedad carotídea suboclusivaLas lesiones carotídeas suboclusivas formaron el 26% de nuestra población, lo que muestra que se trata de una situación frecuente en nuestra práctica habitual. En la literatura, el rango de presentación de lesiones SOAC pendientes de revascularización oscila entre el 14 y el 29%9,10, con una media en el metaanálisis de los estudios NASCET y ESCT del 21,5%7.
El dilema de si se deben abordar las lesiones SOAC todavía no está bien aclarado5-8. El riesgo de evento neurológico por enfermedad carotídea depende en gran medida del grado de severidad obstructiva. Las placas con mayor riesgo de ocasionar ictus son aquellas entre 90-99% de estenosis: dentro de estas, las lesiones suboclusivas (95-99%) presentan un riesgo de ictus menor que las lesiones entre 90-94%; esto se debe a que la mayor parte de los ictus se producen por embolización de material trombótico y no por bajo flujo ocasionado por la obstrucción: en cierta medida, la suboclusión podría «proteger» contra la embolización y el ictus. Sin embargo, la evolución de las lesiones SOAC es hacia la oclusión carotídea, cuyo impacto, en el mejor de las circunstancias, en las capacidades cognitivas del paciente puede estar infraestimado.
Angiografía y aproximación terapéutica a las lesiones suboclusivas de arteria carótidaEl criterio NASCET de cuantificación de la enfermedad carotídea infraestima el grado de severidad en presencia de lesiones SOAC, al reducirse el diámetro de la arteria carótida interna conforme mayor es el grado de obstrucción. Por ello, la identificación de lesión carotídea suboclusiva se ha realizado por otros autores basándose en criterios angiográficos exclusivamente cualitativos7; en nuestro caso, hemos añadido a los anteriores el criterio cuantitativo del diámetro mínimo luminal inferior a 1mm, ya que por diferentes motivos (generalmente por oclusión de la carótida interna contralateral) es posible que los signos indirectos de severidad obstructiva no se manifiesten con claridad.
La necesidad de aplicación de los dispositivos de protección embólica durante la revascularización con stent es todavía una cuestión controvertida, con escaso nivel de recomendación en las recientes guías europeas de práctica clínica8. Sin embargo, nuestro grupo utilizó los dispositivos de protección, distal o proximal, en todos los procedimientos. La mayor cantidad de placa y, posiblemente, su composición más inestable explican que el grupo de pacientes con SOAC presentara una mayor tasa de material macroscópico extraído por los dispositivos de protección embólica (18,5% vs. 7%) por un lado, así como una mayor presencia de lesiones isquémicas cerebrales (47% vs. 31%). Afortunadamente, este alto porcentaje de lesiones isquémicas cerebrales no tuvieron correlación clínica y sólo en 2 pacientes se produjo repercusión clínica, en concreto 2 ictus menores.
Revascularización con stent en las lesiones suboclusivasLa tasa de éxito del procedimiento en la revascularización con stent de lesiones SOAC fue, tal como se ha descrito en trabajos previos, alta y equiparable a la obtenida para las lesiones menos severas (96% vs. 98%). A pesar del éxito en el procedimiento, 3 pacientes con lesiones suboclusivas (5,5% de la población) presentaron dentro del primer mes un cuadro de hemorragia intracraneal que tuvo como consecuencia el fallecimiento. En ausencia de otra explicación, la hemorragia intracraneal se debe al síndrome de hiperperfusión, debido a la rotura de la barrera hematoencefálica al revascularizarse una lesión severa cuyo lecho arteriolar distal presenta una reserva vasodilatadora exhausta. Los factores que predisponen al síndrome de hiperperfusión tras la revascularización carotídea son el abordaje de lesiones críticas, la oclusión o lesión severa contralateral, la hipertensión periprocedimiento9, y el exceso de anticoagulación10. En nuestra población, se produjeron de forma global 4 casos de síndrome de hiperperfusión con hemorragia intracraneal y muerte: 3 en el grupo de lesiones SOAC (2 de ellos eran pacientes sin circulación vicariante intracraneal) y una en el grupo de pacientes restante, y todas ellas acontecieron durante los 2 primeros años de nuestra experiencia (años 2008 y 2009). Desde que se cambió la pauta antitrombótica, reduciendo la dosis anticoagulante y evitando la dosis de carga de clopidogrel, y se puso un mayor énfasis en el control de la presión arterial durante el procedimiento y en las horas posteriores, no se produjo ningún otro evento de hiperperfusión.
La tasa acumulada de defunción e ictus a los 30 días en el grupo de pacientes con lesiones SOAC fue del 9,2%, mostrando tendencia a la significación con respecto al 3,2% del resto de los pacientes. Esta superioridad en la tasa de eventos en las lesiones SOAC se debe a las defunciones por hemorragia intracraneal. Los 2 casos de ictus isquémico en este grupo fueron menores y a los 30 días estaban totalmente recuperados.
LimitacionesEste trabajo posee diversas limitaciones. En primer lugar, en la definición de lesión suboclusiva se ha añadido un criterio angiográfico cuantitativo no validado; sin embargo, de no haberlo hecho así, un tercio de los pacientes incluidos en el grupo de lesiones suboclusivas, precisamente aquellos con mayor riesgo de complicaciones clínicas graves en la revascularización, hubieran quedado fuera de este grupo. En segundo lugar, no se ha realizado un análisis según la repercusión sintomática o no de la lesión, aunque para ambos grupos el porcentaje de pacientes sintomáticos era mayoritario y similar. Por último, el seguimiento clínico se realizó a 30 días, y sería necesaria una evaluación a más largo plazo.
ConclusiónNuestra experiencia muestra que la revascularización con stent de lesiones SOAC es un procedimiento eficaz, pero conlleva una mayor tasa de morbimortalidad a 30 días comparado con el abordaje de lesiones menos severas: por un lado, con el implante del stent se desprende una mayor cantidad de material que, a pesar del uso de protección, ocasiona un porcentaje superior de lesiones isquémicas cerebrales; por otro lado, al mes de la revascularización, existe la tendencia a una mayor tasa de eventos neurológicos, fundamentalmente muerte por hemorragia intracraneal. Por todo ello, la revascularización con stent de lesiones SOAC debería hacerse tras un análisis individualizado de las características clínicas y angiográficas del paciente, extremando las precauciones durante el procedimiento (ajuste de la pauta antitrombótica, utilización de dispositivos de protección embólica, control de las cifras tensionales).
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés.