El asma es una enfermedad inflamatoria crónica que afecta alrededor del 5% de la población mundial y genera unos elevados costes sociosanitarios. Para un manejo adecuado de la enfermedad es necesario un correcto diagnóstico, basado en medidas objetivas de la afectación funcional, así como el control de los síntomas y la valoración del riesgo futuro de exacerbaciones.
Se ha estimado que un 18% de los pacientes asmáticos en Europa occidental tienen asma grave y aproximadamente el 50% de ellos cuentan con un mal control. La gravedad del asma se establece en función de las necesidades mínimas de tratamiento de mantenimiento para alcanzar el control. Las guías de práctica clínica de asma recomiendan clasificar a los pacientes graves en asma alérgica (T2); asma eosinofílica (T2) y asma no T2 con el fin de establecer el tratamiento más adecuado.
En las últimas décadas se han desarrollado nuevas terapias biológicas que pueden aplicarse según el fenotipo y el endotipo del asma, lo que permite hacer un tratamiento selectivo y personalizado. Estos fenotipos y endotipos pueden modificarse a lo largo del tiempo y por ello, la identificación de biomarcadores capaces de predecir la gravedad, el curso de la enfermedad y la respuesta a un determinado tratamiento parece imprescindible. En el asma se han estudiado una gran cantidad de biomarcadores, pero hasta ahora solo algunos pueden usarse fácilmente en la práctica clínica habitual. La aplicación de las tecnologías ómicas (epigenómica, genómica, transcriptómica, proteómica, metabolómica, lipidómica, etc.) que sirvan para este fin, todavía se encuentran en fase de investigación.
Asthma is a chronic inflammatory disease that affects about 5% of the world's population and generates high health and social costs. Proper management of the disease requires a correct diagnosis, based on objective measures of functional impairment, as well as symptom control and assessment of the future risk of exacerbations.
It has been estimated that 18% of asthma patients in Western Europe have severe asthma and approximately 50% of them have poor control. The severity of asthma is established based on the minimum maintenance treatment needs to achieve control. Asthma clinical practice guidelines recommend classifying severe patients into allergic asthma (T2); eosinophilic asthma (T2) and non-T2 asthma in order to establish the most appropriate treatment.
In recent decades, new biological therapies have been developed that can be applied according to the phenotype and endotype of asthma, allowing for selective and personalized treatment. These phenotypes and endotypes can change over time and therefore, the identification of biomarkers capable of predicting the severity, the course of the disease and the response to a given treatment seems essential. A large number of biomarkers have been studied in asthma, but so far only a few can be readily used in routine clinical practice. The application of omics technologies (epigenomics, genomics, transcriptomics, proteomics, metabolomics, lipidomics, etc.) for this purpose is still in the research phase.
El American College of Chest Physicians define al asma ocupacional (AO) como el asma de novo o la recurrencia de asma previamente inactiva, inducida bien por sensibilización a una proteína de alto peso molecular o a una sustancia química de bajo peso molecular (AO inmunológica), o bien por exposición a un irritante inhalado en el trabajo (AO no inmunológica o por irritantes)1.
La prevalencia real del AO es desconocida, pero se estima que entre el 16 y 18% de los casos de asma de inicio en la edad adulta tiene un origen ocupacional2,3, lo que la convertiría en la enfermedad respiratoria ocupacional más prevalente.
Los agentes causales más habituales del AO se muestran en la tabla 1. Aunque se han documentado más de 400 sustancias potencialmente productoras de AO, las harinas y los isocianatos siguen siendo las causas más frecuentes en los países industrializados, representando aproximadamente la mitad de los casos notificados4–6.
Agentes causales habituales de asma ocupacional
| Agente | Ejemplos | Trabajos relacionados |
|---|---|---|
| Alto peso molecular | ||
| Animales | Mamíferos (epitelios de ratas, ratones, vacas…) | Trabajadores de laboratorios, veterinarios, ganaderos |
| Mariscos (crustáceos, moluscos, pescados…) | Procesadores de marisco | |
| Insectos (moscas, gusanos, arañas, avispas, ácaros…) | Trabajadores de laboratorio, procesadores de alimentos para peces, productores de frutas, apicultores, control de plagas | |
| Productos de origen animal (proteínas de leche/huevo, albúmina sérica bovina, carmín de Dactlylopius coccus) | Procesadores de alimentos, panaderos, productores de tintes naturales | |
| Plantas | Harinas (trigo, cebada, centeno…) | Panaderos, reposteros, industria cervecera |
| Pólenes y plantas ornamentales | Trabajadores de invernaderos, floristerías | |
| Especias (anís, canela, nuez moscada…), semillas (café, soja…), hojas (té, manzanilla...) | Industria alimentaria | |
| Látex (caucho natural) | Personal sanitario y de laboratorio | |
| Enzimas | α-amilasa, alcalasa, papaína, bromelina, pancreatina | Producción de insumos de panadería, panaderos, producción de detergentes, industria farmacéutica, industria alimentaria |
| Bajo peso molecular | ||
| Isocianatos | Diisocianato de tolueno, diisocianato de metilendifenilo, diisocianato de hexametileno | Producción de poliuretano, industria del plástico, aislamientos, barnices, pintura en aerosol |
| Anhídridos ácidos | Ácido ftálico, ácido trimelítico, anhídrido maleico, anhídrido trimelítico | Resinas y plásticos |
| Acrilatos | Cianoacrilatos, metacrilatos, acrilatos simples | Fabricación de adhesivos, materiales dentales y ortopédicos, elaboración de uñas esculpidas, tintas de impresión, pinturas y revestimientos |
| Aminas | Etilendiamina, derivados de dimetilamina, etanolaminas | Detergentes, tensioactivos, fluidos para trabajar metales, endurecedores de resina de poliamina para resinas epoxi |
| Biocidas | Formaldehído, glutaraldehído, compuestos de amonio cuaternario, clorhexidina, triclosán | Trabajadores sanitarios, limpiadores, industria alimentaria |
| Resinas epoxi | Varios endurecedores de resina epoxi | Recubrimientos, adhesivos, fabricación de compuestos plásticos, revestimiento de tuberías |
| Metales | Cromo, níquel, cobalto, platino | Refinería de metales, producción de aleaciones metálicas, galvanoplastia, soldadura |
| Sales de persulfato | Decolorante para el cabello | Peluqueros |
| Fluidos para trabajar metales | Agentes causales inciertos: biocidas (isotiazolinona y derivados, metilen-bis-morfolina), microorganismos, metales | Corte de metales |
| Maderas | Cedro rojo, maderas tropicales (iroko, abachi), roble… | Trabajadores de aserraderos, carpinteros, ebanistas y fabricantes de muebles |
| Irritantes | ||
| Lejía, salfumán | Cloro, amoniaco, ácido clorhídrico | Limpieza |
| Humos | Mezcla de gases, hidrocarburos, productos químicos… | Bomberos |
El AO es el resultado de interacciones complejas entre factores ambientales y la susceptibilidad individual7,8. Son factores de riesgo conocidos para el desarrollo del AO el nivel de exposición (mayor riesgo a mayor exposición), la atopia (especialmente en trabajadores expuestos a agentes de alto peso molecular), la rinitis relacionada con el trabajo, el tabaquismo, la existencia de hiperrespuesta bronquial inespecífica previa y la presencia de ciertos marcadores genéticos6,9–12.
Habitualmente los trabajadores afectados experimentan síntomas de asma mientras están expuestos en el trabajo, con remisión o mejoría al finalizar su turno y durante los fines de semana y vacaciones. A medida que progresa la enfermedad, la remisión de los síntomas suele requerir periodos más largos fuera del trabajo. En algunos casos, los trabajadores llegan a presentar síntomas desencadenados por estímulos inespecíficos fuera del lugar de trabajo, como consecuencia del desarrollo de hiperreactividad bronquial.
La historia clínica tiene una alta sensibilidad (∼90%) pero una especificidad muy baja (27-50%) para diagnosticar el AO13,14. La presencia de sibilancias y rinoconjuntivitis en el trabajo se asocian con una mayor especificidad para el AO, especialmente cuando están involucrados agentes de alto peso molecular15.
Por tanto, debemos sospechar un posible AO en todo paciente con asma de debut en la edad adulta, o que presente un nuevo empeoramiento clínico tras años asintomático, especialmente en pacientes con alguno de los factores de riesgo previamente detallados. En estos casos debe interrogarse específicamente, y de la manera más detallada posible, sobre las potenciales exposiciones a sustancias en su lugar de trabajo y sobre la variabilidad de los síntomas del asma a lo largo del día y de la semana, para proceder a realizar los estudios específicos dirigidos al diagnóstico del AO.
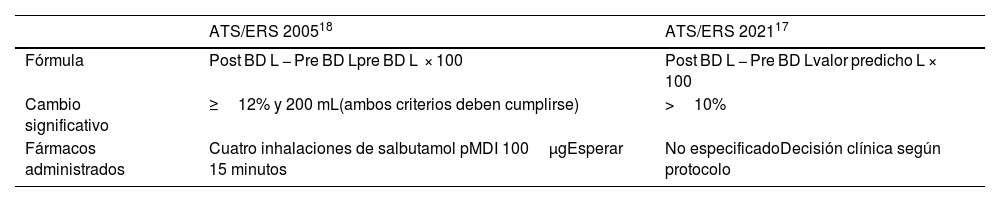
En el diagnóstico de asma, ¿qué implicaciones tienen los recientes cambios en la prueba broncodilatadora?En la última actualización de la American Thoracic Society/European Respiratory Society (ATS/ERS) sobre interpretación de pruebas de función pulmonar16 uno de los cambios destacables afecta a la prueba broncodilatadora. En la tabla 2 se recogen las novedades en la realización de la prueba broncodilatadora del Consenso de ATS/ERS de 2021 respecto a los previos de 200517.
Cambios en la realización de la prueba broncodilatadora presentes en el Consenso de ATS/ERS de 2021 respecto a los de 2005
| ATS/ERS 200518 | ATS/ERS 202117 | |
|---|---|---|
| Fórmula | Post BD L − Pre BD Lpre BD L × 100 | Post BD L − Pre BD Lvalor predicho L × 100 |
| Cambio significativo | ≥12% y 200 mL(ambos criterios deben cumplirse) | >10% |
| Fármacos administrados | Cuatro inhalaciones de salbutamol pMDI 100μgEsperar 15 minutos | No especificadoDecisión clínica según protocolo |
Abreviaturas: Post BD: post broncodilatador; Pre BD: pre broncodilatador; pMDI: inhalador de cartucho presurizado.
Estos cambios van a tener sus consecuencias sobre el diagnóstico y el seguimiento de los pacientes con asma. En primer lugar, el valor porcentual del cambio se informa respecto al valor de referencia en lugar del valor basal, y además se elimina de los criterios el valor absoluto, ya que al tener en cuenta el valor predicho se hace innecesario. Esta variación sirve para minimizar el sesgo del género y las medidas antropométricas18, y evita interpretaciones erróneas debidas a los valores de función pulmonar basal19. En los pacientes con valores dentro del rango de normalidad el resultado apenas se modifica, pero en aquellos con más obstrucción es necesario una mayor diferencia entre los valores pre y posbroncodilatador para alcanzar un valor de cambio significativo. La ecuación actual minimiza el problema de la anterior, en la que la respuesta broncodilatadora en los pacientes con obstrucción grave, mostraba una relación directa con la capacidad vital forzada (FVC), pero inversa con el Volumen espiratorio forzado en un segundo (FEV1). Por tanto, las nuevas recomendaciones minimizarán los sesgos, eliminarán dudas diagnósticas si hay discrepancia en los cambios producidos en ambas medidas (FEV1 y FVC) y evitarán el sobrediagnóstico en pacientes con obstrucciones graves.
El punto de corte del 10% se ajusta a lo publicado en estudios poblacionales internacionales, en los que esta cifra marca el percentil 95 y por tanto el límite superior de la normalidad en adultos sanos no fumadores20 y son consistentes con el previo 12%. Además, la relevancia clínica de este valor se ha mostrado en estudios que relacionan un cambio>8% con una menor supervivencia18. Sin embargo, debido a que las nuevas recomendaciones llevan en vigor menos de dos años, todavía son escasos los estudios que relacionen este nuevo punto de corte con la gravedad, el control del asma y los biomarcadores disponibles en esta patología21.
Finalmente, en lugar de ceñirse al uso de salbutamol, este último consenso recomienda protocolizar los fármacos, dosis, vías de administración, y tiempos de espera al realizar una prueba broncodilatadora según criterios clínicos basándose en las recomendaciones de 201922. Los fármacos que citan son el salbutamol (400μg) y el ipratropio (80-160μg), puntualizando que este último precisa aumentar la espera de 15 a 30 minutos para evaluar la respuesta. Esta relajación en las recomendaciones va a permitir protocolos personalizados para cada tipo de paciente, aunque es imprescindible que los mismos se ciñan a la evidencia científica.
En el futuro probablemente la broncodilatación significativa se definirá también mediante el Z-Score, y será posible relacionarla con otros marcadores pronósticos, las características inflamométricas y los fenotipos de asma.
¿Cuándo tratar el asma con anticolinérgicos de acción prolongada (LAMA)?En el asma está incrementada la actividad neuronal parasimpática, mediada por el nervio vago, a través de la mayor liberación de acetilcolina (principal neurotransmisor parasimpático en la vía aérea). La acetilcolina es liberada por neuronas localizadas en la vía aérea y por células no neuronales como las células epiteliales e inflamatorias. Este neurotransmisor se une a los receptores muscarínicos para activar la secreción mucosa y producir la contracción del musculo liso23,24. Los receptores muscarínicos M1, M2 y M3 tienen un rol importante en la fisiología de la vía aérea23. Los receptores M1 se encuentran en el ganglio parasimpático donde despolarizan el potencial de membrana en reposo, facilitando la neurotransmisión mediada por el receptor nicotínico y promoviendo la broncoconstricción25. Los receptores M2, expresados en el músculo liso de la vía aérea y en las neuronas parasimpáticas, actúan como autorreceptores en las neuronas parasimpáticas para limitar la liberación de acetilcolina, reducir la broncoconstricción inducida por el reflejo vagal y la secreción mucosa. Mientras que los receptores M3, localizados en el músculo liso y las glándulas submucosas, están implicados en la contracción del músculo liso bronquial y la secreción mucosa23,24. La mayor señalización de acetilcolina en los receptores M1 y M3 y la disfunción del autorreceptor M2 contribuyen a la mayor broncoconstricción, la hipersecreción mucosa (a través de la estimulación de las glándulas mucinosas inervadas por nervios parasimpáticos), la inflamación y el remodelado de la vía aérea24. Los LAMA se disocian más lentamente de los receptores M3 que de los M2, por lo tanto, tienen mayor selectividad cinética hacia los receptores M3.
El tiotropio añadido a un corticoide inhalado (CI) y a un beta 2 de acción prolongada (LABA) en pacientes con asma mal controlada, disminuyó el área y el grosor de la pared de la vía aérea y mejoró la limitación al flujo aéreo26. Estos resultados sugieren que el tiotropio puede tener un efecto protector frente a la broncoconstricción y el remodelado26. Además, el uso de un LAMA añadido a CI-LABA ha demostrado mejorar la función pulmonar, reducir las exacerbaciones y mejorar, aunque de forma modesta, el control del asma en pacientes con asma moderada-grave no controlada a pesar de CI-LABA25,27. Estudios realizados en animales e in vitro sugieren que el uso añadido de un LAMA con CI o CI-LABA tiene interacciones sinérgicas25.
¿Qué nos dicen las guías de práctica clínica respecto al uso de LAMA en el asma?La GINA 202328 sugiere añadir un LAMA, desde el escalón 4 de tratamiento, en pacientes mal controlados a pesar de un CI a dosis medias/altas-LABA. Mientras que la GEMA 5.329 sitúa el uso de LAMA (tiotropio o glicopirronio), desde el escalón 4 de tratamiento, añadido a CI a dosis medias-LABA en pacientes no controlados. Sin embargo, advierten de que esta opción no se ha comparado con la estrategia habitual de aumentar la dosis de CI en la combinación CI-LABA, de probada eficacia en la prevención de las exacerbaciones graves. En el escalón 5, sugieren añadir LAMA, en pacientes insuficientemente controlados con la combinación de un CI a dosis altas-LABA y que cursan con un FEV1/FVC posbroncodilatador ≤ 70% ya que proporciona una mejoría de la función pulmonar y una reducción de las exacerbaciones. Por tanto, aunque todos los datos avalan el uso precoz de un LAMA asociado a CI a dosis medias/altas-LABA, en la actualidad se requieren de nuevos estudios que proporcionen una mayor evidencia científica.
¿Qué cuestionarios y escalas podemos utilizar en la valoración del paciente asmático?En los últimos años, los cuestionarios han adquirido importancia en el ámbito de las enfermedades respiratorias, ya que ofrecen múltiples ventajas al ser unos instrumentos sencillos que no requieren un equipamiento especial, aportando la información objetiva desde la propia perspectiva del paciente. Para que sean unas buenas herramientas deben situarse en el contexto para el que se diseñaron y tener una versión validada y traducida al español.
Las guías de práctica clínica recomiendan evaluar los síntomas del paciente mediante cuestionarios validados como el Asthma Control Test (ACT) y el Asthma Control Questionnaire (ACQ), así como valorar la adhesión al tratamiento inhalado, utilizando el Test de adhesión a los inhaladores (TAI).
Recientemente se han desarrollado el Cuestionario de Riesgo y deterioro del Asma (AIRQ), que evalúa los síntomas relacionados con un mal control de la enfermedad y el riesgo de exacerbaciones, además del score FEOS y la escala EXACTO que valoran la respuesta a los tratamientos biológicos en los pacientes con asma grave no controlada (AGNC). A continuación, se describen brevemente estas herramientas.
Test de control del asmaTest de control del asma (ACT) es un cuestionario recomendado por GINA y GEMA para valorar el control del asma, se creó en el 2004 y se encuentra validado al español30,31. Consta de cinco preguntas referidas a las últimas cuatro semanas e interroga sobre los síntomas, la medicación de rescate y la autopercepción de control de la enfermedad por el paciente. Cada pregunta se puntúa con un valor numérico de 1 a 5, la puntuación final va de 5 (peor control) a 25 (buen control). La diferencia mínima relevante es de 3 puntos. La clasificación de la enfermedad según la puntuación obtenida es de asma controlada con más de 20 puntos; no bien controlada con 16-19 puntos y mal controlada por debajo de 15 puntos.
Cuestionario de control del asmaEl cuestionario de control del asma ACQ32,33 incluye las preguntas relacionadas con el control de los síntomas y la medición de la función pulmonar mediante el porcentaje del volumen espiratorio máximo del primer segundo (FEV1). Tiene siete apartados con una puntuación de 0 a 6, y las preguntas se refieren a la última semana. La última pregunta es sobre la función pulmonar del paciente. La puntuación final es la media de los siete ítems y se clasifica en: asma bien controlada con puntuación menor de 0,75; asma parcialmente controlada con valores entre 0,75 y 1,5; asma mal controlada con una puntuación mayor de 1,5.
Test de adhesión a los inhaladoresEl test de adhesión a los inhaladores (TAI) es un cuestionario que determina el grado de adhesión al tratamiento inhalado en pacientes con asma o con enfermedad pulmonar obstructiva crónica (EPOC)34. Además, permite identificar el tipo de incumplimiento del paciente: errático, deliberado o inconsciente, y al mismo tiempo incorpora la valoración de la técnica inhalatoria. Es un test compuesto por dos cuestionarios complementarios, un TAI de 10 preguntas que identifica al paciente con una baja adhesión y otro de 12 preguntas con el que se determina el grado de incumplimiento. La primera parte de 10 preguntas es autoadministrada y establece el dominio del paciente. Cada una de las preguntas se califica de 1 a 5 (de menor a mayor cumplimiento, respectivamente) con una puntuación total entre 10 y 50. El cuestionario establece que una calificación de 50 puntos conlleva un buen cumplimiento, entre 46-49 un cumplimiento intermedio y 45 puntos o menos indicaría un mal cumplimiento. El TAI de 12 ítems incluye las 10 preguntas del primero más otras dos cuestiones que requieren la participación del profesional sanitario.
Cuestionario de riesgo y deterioro del asmEl cuestionario de riesgo y deterioro del asma (AIRQ) se utiliza para determinar el grado de control actual, así como el riesgo futuro de la enfermedad en pacientes mayores de 12 años. Consta de 10 ítems con respuesta dicotómica (sí/no) que evalúan los síntomas en las dos semanas previas y el número de exacerbaciones en los 12 meses anteriores35, se encuentra validado al español36. La clasificación es bien controlada si obtiene 0-1 puntos, no bien controlada de 2 a 4 puntos y muy mal controlada si puntúa más de 5 puntos (tabla 3).
Cuestionario de riesgo y deterioro del asma (Asthma Impairment and Risk Questionnaire-AIRQ)
| Cuestionario sobre el Deterioro y el Riesgo de Asma (Asthma Impairment and Risk Questionnaire, AIRQ®) | |
| En las últimas 2 semanas, la tos, las sibilancias, la dificultad para respirar o la opresión en el pecho: | |
| 1. ¿Le molestaron durante el día en más de 4 días? | SÍ/NO |
| 2. ¿Lo despertaron más de 1 vez? | SÍ/NO |
| 3. ¿Limitaron las actividades que desea hacer todos los días? | SÍ/NO |
| 4. ¿Le hicieron usar su inhalador de rescate o nebulizador todos los días? | SÍ/NO |
| En las últimas 2 semanas: | |
| 5. ¿Tuvo que limitar sus actividades sociales (como visitar a amigos, familiares o jugar con niños o mascotas) debido a su asma? | SÍ/NO |
| 6. ¿La tos, la respiración sibilante, la dificultad para respirar o la opresión torácica limitaron su capacidad para hacer ejercicio? | SÍ/NO |
| 7. ¿Sintió que era difícil controlar su asma? | SÍ/NO |
| En los últimos 12 meses, la tos, las sibilancias, la dificultad para respirar u opresión torácica: | |
| 8. ¿Le llevaron a tomar comprimidos o inyecciones de esteroides, como prednisona? | SÍ/NO |
| 9. ¿Le hicieron acudir al servicio de urgencias o acudió a consultas no previstas con un proveedor de atención médica? | SÍ/NO |
| 10. ¿Hicieron que tuviera que pasar la noche en el hospital? | SÍ/NO |
| Puntuación total: Número de SÍ | |
| 0-1: bien controlada | |
| 2-4: no bien controlada | |
| 5-10: muy mal controlada |
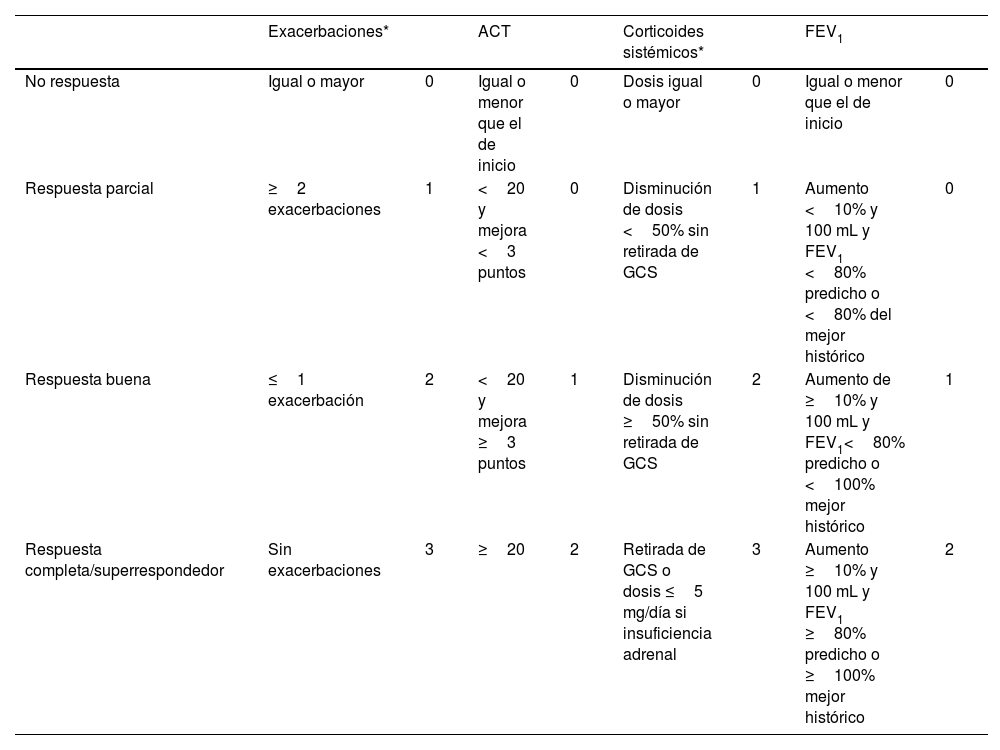
La escala multidimensional EXacerbaciones, ACT, CorticosTeroides sistémicos y Obstrucción-FEV1 (EXACTO), evalúa de forma sencilla la respuesta de los pacientes con AGNC a los anticuerpos monoclonales (mAb) categorizándola como no respuesta, respuesta buena, parcial y completa37. Esta escala define como superrespondedor al paciente con una respuesta completa. EXACTO valora el uso de glucocorticoides sistémicos (GCS), exacerbaciones, síntomas medidos por ACT, y la función pulmonar (pre-BD FEV1) asignando puntuaciones de 0 a 3 a cada item (tabla 4). La clasificación según la puntuación obtenida depende de si el paciente se encuentra en tratamiento con GCS de mantenimiento.
Escala EXACTO
| Exacerbaciones* | ACT | Corticoides sistémicos* | FEV1 | |||||
|---|---|---|---|---|---|---|---|---|
| No respuesta | Igual o mayor | 0 | Igual o menor que el de inicio | 0 | Dosis igual o mayor | 0 | Igual o menor que el de inicio | 0 |
| Respuesta parcial | ≥2 exacerbaciones | 1 | <20 y mejora <3 puntos | 0 | Disminución de dosis <50% sin retirada de GCS | 1 | Aumento <10% y 100 mL y FEV1 <80% predicho o <80% del mejor histórico | 0 |
| Respuesta buena | ≤1 exacerbación | 2 | <20 y mejora ≥3 puntos | 1 | Disminución de dosis ≥50% sin retirada de GCS | 2 | Aumento de ≥10% y 100 mL y FEV1<80% predicho o <100% mejor histórico | 1 |
| Respuesta completa/superrespondedor | Sin exacerbaciones | 3 | ≥20 | 2 | Retirada de GCS o dosis ≤5 mg/día si insuficiencia adrenal | 3 | Aumento ≥10% y 100 mL y FEV1 ≥80% predicho o ≥100% mejor histórico | 2 |
| Respuesta mAbs | Puntuación sin GCS | Puntuación con GCS (corticoides continuos) |
|---|---|---|
| NoParcialBuenaCompleta/superrespondedor | 0-12-45-67 | 0-23-67-910 |
EXACTO: EXacerbaciones, ACT, CorTicosteroides sistémicos y Obstrucción – FEV1%; ACT: Asthma Control Test; FEV1: volumen espiratorio forzado en el primer segundo; GCS: glucocorticoides sistémicos; mAbs: anticuerpos monoclonales.
Se hará una valoración de la respuesta al tratamiento con mAbs a las 16 semanas y a los 12 meses. Para el seguimiento del paciente, se recomienda aplicar la herramienta cada seis meses a partir del primer año de tratamiento.
Modificado de Álvarez-Gutiérrez et al.37
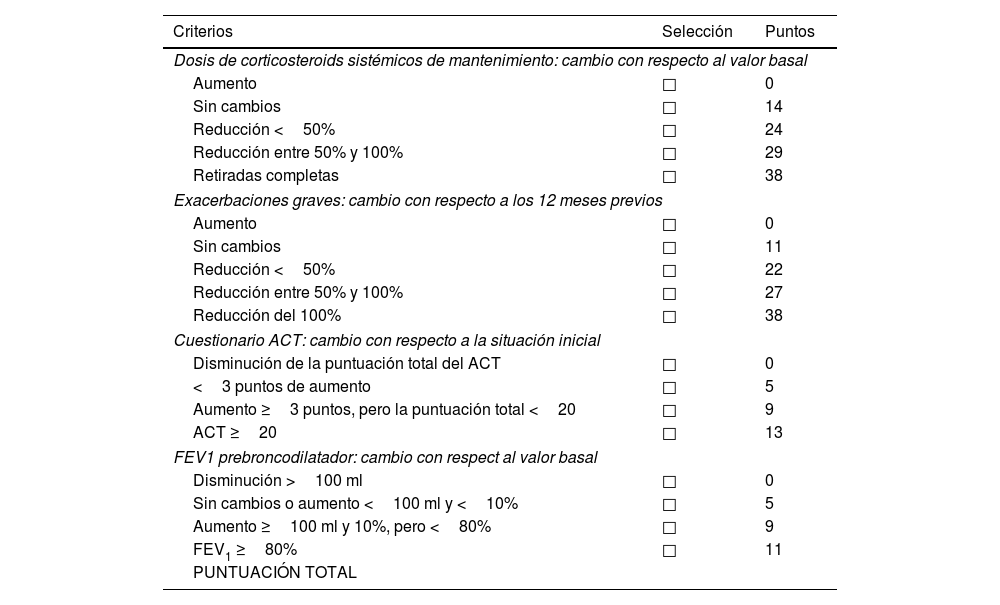
El score FEV1, Exacerbaciones, Orales corticoides, Síntomas (FEOS)38 es otra herramienta reciente que se utiliza para cuantificar la respuesta al tratamiento biológico en los pacientes con AGNC. Evalúa los cambios desde la situación basal (previa al inicio de la terapia) hasta el momento del seguimiento en el que se desee cuantificar la respuesta (tabla 5). La puntuación que se obtiene va desde 0 (empeoramiento) hasta 100 (mayor respuesta). Cuanto mayor es el resultado, mayor es la respuesta a los mAb. A diferencia con la escala EXACTO esta herramienta no aporta una clasificación de la respuesta obtenida después del tratamiento biológico, pero refleja cuánto ha mejorado el paciente respecto al punto de partida.
FEOS score
| Criterios | Selección | Puntos |
|---|---|---|
| Dosis de corticosteroids sistémicos de mantenimiento: cambio con respecto al valor basal | ||
| Aumento | □ | 0 |
| Sin cambios | □ | 14 |
| Reducción <50% | □ | 24 |
| Reducción entre 50% y 100% | □ | 29 |
| Retiradas completas | □ | 38 |
| Exacerbaciones graves: cambio con respecto a los 12 meses previos | ||
| Aumento | □ | 0 |
| Sin cambios | □ | 11 |
| Reducción <50% | □ | 22 |
| Reducción entre 50% y 100% | □ | 27 |
| Reducción del 100% | □ | 38 |
| Cuestionario ACT: cambio con respecto a la situación inicial | ||
| Disminución de la puntuación total del ACT | □ | 0 |
| <3 puntos de aumento | □ | 5 |
| Aumento ≥3 puntos, pero la puntuación total <20 | □ | 9 |
| ACT ≥20 | □ | 13 |
| FEV1 prebroncodilatador: cambio con respect al valor basal | ||
| Disminución >100 ml | □ | 0 |
| Sin cambios o aumento <100 ml y <10% | □ | 5 |
| Aumento ≥100 ml y 10%, pero <80% | □ | 9 |
| FEV1 ≥80% | □ | 11 |
| PUNTUACIÓN TOTAL | ||
ACT: test de control del asma; FEV1: volumen espiratorio forzado en un segundo.
Modificado de Pérez de Llano et al.38
La evolución en los últimos años de las terapias para el asma ha obligado a definir de forma exhaustiva los fenotipos y endotipos en cada caso y de este modo lograr alcanzar una medicina lo más personalizada y minuciosa posible39. Estos fenotipos y endotipos pueden modificarse a lo largo del tiempo y por ello, la identificación de biomarcadores capaces de predecir la gravedad, el curso de la enfermedad y la respuesta a un determinado tratamiento parece imprescindible. Un biomarcador ideal, además de cumplir estas características mencionadas; tendría que ser sencillo de obtener, reproducible y poco invasivo40.
Durante la última década se han multiplicado los estudios sobre los mecanismos celulares y moleculares de esta patología. La inflamación T helper tipo 2 (Th2) es el proceso patológico más importante en el asma, mediado por citocinas Th2 como la interleucina (IL) -5, IL-4 e IL-13. El asma con niveles bajos de Th2 está mediado por citocinas distintas como la IL-17 y el factor de necrosis tumoral α. Los eosinófilos, la IgE sérica, la fracción exhalada de óxido nítrico (FeNO) y la periostina son de utilidad en el asma Th2 alta, mientras que los neutrófilos en esputo pueden utilizarse en los pacientes con Th2 bajo41, aunque bien es cierto que existe una clara necesidad de definir muchos otros en este último grupo de pacientes.
En el asma, y particularmente en el asma grave, se han estudiado gran cantidad de biomarcadores, pero hasta ahora solo algunos pueden usarse fácilmente en la práctica clínica habitual, como son los eosinófilos, la IgE sérica, el FeNO y la periostina42. Aunque se ha propuesto que las tecnologías ómicas (epigenómica, genómica, transcriptómica, proteómica, metabolómica, lipidómica, etc.) y el microbioma sirvan para este fin43, todavía se encuentran en fase de investigación.
EosinófilosLa determinación de los eosinófilos en el esputo inducido es más fiable que en sangre, pero se trata de un procedimiento laborioso y difícil de realizar. Niveles de eosinófilos en esputo de>1% se considera eosinofilia y>3% se asocia con una inflamación elevada de las vías respiratorias, exacerbaciones frecuentes y un control deficiente del asma44.
Un valor sérico de eosinófilos de ≥ 0,30 × 109/L se relaciona con inflamación Th2 (que también puede suceder en otras entidades distintas al asma) y mayor riesgo de exacerbaciones. Valores <0,15 × 109/L hacen pensar que no vaya a existir eosinofilia en el esputo, especialmente cuando el FeNO es bajo (< 25 ppb)45, según describen algunos autores. Sin embargo, todavía se desconoce el punto de corte.
Fracción exhalada de óxido nítricoLa fracción exhalada de óxido nítrico (FeNO) se trata de un biomarcador más específico de inflamación Th2 en las vías respiratorias y de la actividad epitelial, además de ser fácil de realizar y no invasivo. Asimismo, es un excelente predictor de la respuesta a los CI46. Niveles <25 ppb parecen excluir inflamación Th2 y> 50 ppb se relacionan con inflamación Th2 eosinofílica y buena respuesta a los CI. Sin embargo, su valor puede verse afectado por factores de confusión como el tabaquismo, la dieta, patología nasosinusal o la atopia, por lo que es necesario utilizarlo con cautela47.
Inmunoglobulina E séricaLa inmunoglobulina E (IgE) sérica media las reacciones de hipersensibilidad tipo 1 y desempeña un papel clave en la patogénesis del asma alérgica, sin embargo, no ha demostrado relación con la obstrucción bronquial ni con la gravedad del asma. Es de gran utilidad para dosificar el tratamiento con omalizumab48.
PeriostinaEs una proteína de la matriz extracelular secretada por las células epiteliales de las vías respiratorias en respuesta a la IL-13 que regula las interacciones epitelial-mesenquimales49. Se ha asociado con la producción de moco y es probable que juegue un papel en la inflamación eosinofílica de la vía aérea, pero todavía son necesarios estudios para confirmarlo.
Desafortunadamente no existe un biomarcador ideal y la superposición entre ellos dificulta un manejo más específico. Por lo que son necesarios más estudios que demuestren la validación de biomarcadores emergentes para definir cada vez mejor el fenotipo molecular del asma y dirigir de este modo la terapia en cada caso.
¿Cuáles son los fármacos biológicos disponibles en la actualidad para el tratamiento del asma grave no controlada?Los tratamientos biológicos son fármacos indicados en pacientes con AGNC. Presentan un buen perfil de seguridad y tienen la capacidad de bloquear diferentes mediadores o vías de inflamación, que poseen un papel fundamental en la fisiopatología de la enfermedad28,29.
Actualmente, seis mAb con mecanismos de acción diferentes, están aprobados para el tratamiento del AGNC. En la elección del tratamiento biológico es necesario considerar algunos biomarcadores asociados a la inflamación T2 (recuento de eosinófilos, IgE y FeNO), la función pulmonar, el uso de GCS de mantenimiento, y las comorbilidades o enfermedades asociadas a la enfermedad28,31,37.
Anti-inmunoglobulina E: omalizumabEl omalizumab es el primer mAb que fue aprobado para el tratamiento del asma grave, hace ya más de 15 años. Actúa reduciendo parte de la inflamación T2 al unirse a la IgE, impidiendo la unión al receptor de alta y baja afinidad para la IgE50,51.
Está indicado en pacientes con AGNC alérgica con sensibilización a alérgenos perennes en pacientes> 6 años con valores de IgE total entre 30-1.500 UI y FEV1 <80%. La vía de administración es subcutánea (sc) cada dos a cuatro semanas, en función de los niveles de IgE y del peso corporal.
Los ensayos clínicos aleatorizado (ECA) han mostrado que reduce las exacerbaciones graves, la intensidad de los síntomas, el uso de los CI y mejora la calidad de vida50,51. Estudios posteriores realizados en práctica clínica, han demostrado su papel en la reducción de los GCS, independientemente de los niveles basales de eosinófilos y FeNO52.
Anti-interleucina 5: mepolizumabEl mepolizumab es el segundo mAb que surgió aproximadamente 10 años después del omalizumab, y está aprobado para pacientes con AGNC eosinofílica> 6 años con eosinófilos en sangre ≥ 500/μl, o <500/μl con dos exacerbaciones graves o una hospitalización en el año previo. La vía de administración es sc, en dosis fijas de 100mg cada cuatro semanas, en sujetos> 12 años.
Los ECA han demostrado reducir el número de las exacerbaciones (en pacientes con eosinófilos en sangre> 300 eosinófilos/μL el año previo o con ≥ 150/μL en el momento del tratamiento, pero con valores históricos elevados)53,54, y la dosis de GCS55.
Anti-interleucina 5: reslizumabEl reslizumab es el segundo mAb comercializado frente a la anti-interleucina 5 (IL-5), y a diferencia del mepolizumab, su vía de administración es intravenosa (iv) a dosis de 3mg/kg cada cuatro semanas. Está indicado en pacientes con AGNC eosinofílico ≥ 18 años, en tratamiento con glucocorticoides inhalados (GCI) más otro controlador, con eosinófilos en sangre ≥ 500/μL, o entre 400-500/μl con dos exacerbaciones graves o una hospitalización en el año previo.
Los ECA realizados obtuvieron una reducción de las exacerbaciones y una mejoría en las variables de control56, independiente de la sensibilización alérgica57. Un análisis post hoc de los ensayos pivotales evidenció un efecto ahorrador de GCS, en aquellos pacientes con asma corticodependiente58.
Anti-receptor IL-5: benralizumabEl benralizumab es el único mAb comercializado, actualmente, con efecto anti-eosinófilico, ya que se une a la subunidad α del receptor de la IL-5, con un mecanismo de acción, diferente al mepolizumab y reslizumab. Es capaz de impedir la activación e inducir la eliminación directa de los eosinófilos y basófilos, por citotoxicidad celular a través de las células natural killer59.
Está aprobado su uso para pacientes con AGNC eosinofílica ≥ 18 años, en tratamiento con GCI a dosis altas más LABA, con eosinófilos en sangre ≥ 500/μL, o <500/μL con dos exacerbaciones graves o una hospitalización en el año previo. La vía de administración es sc y la dosis de 30mg cada cuatro semanas las primeras tres dosis y posteriormente cada ocho semanas.
En los ECA se han objetivado la reducción de las exacerbaciones graves, la dosis de GCS, y los síntomas de asma, junto con una mejoría del FEV159,60.
Anti-interleucina 4/interleucina 13: dupilumabEl dupilumab es el único mAb, actualmente disponible, que se une a la cadena α del receptor de la IL-4, bloqueando tanto la IL-4 como la IL-13, ya que ambas citocinas comparten dicho receptor61.
Está indicado en pacientes con AGNC ≥ 6 años corticodependiente, o con marcadores T2 (eosinófilos en sangre ≥ 300 y/o FeNO ≥ 25 ppb)61. La vía de administración es sc cada 15 días, con una dosis diferente en función del perfil del paciente. En aquellos sujetos con asma corticodependiente o con dermatitis atópica, la dosis habitual es de 300mg, con una dosis de carga de 600mg. En el caso de pacientes con sobreexpresión de los marcadores T2, la posología del fármaco es de 200mg, con una dosis de carga de 400mg.
Los ECA han mostrado su efectividad en la reducción de las exacerbaciones y la mejora de los síntomas, de la función pulmonar, así como la calidad de vida de los pacientes tratados con dupilumab61. Además de lograr un descenso de GCS en pacientes corticodependientes62.
Anti-linfopoyetina estromal tímica: tezepelumabTezepelumab es el último biológico aprobado para el AGNC, y el primer mAb dirigido contra una citocina del grupo de las alarminas. Concretamente, es capaz de bloquear la linfopoyetina estromal tímica (TSLP), secretada por el epitelio bronquial.
Está indicado, como tratamiento adicional, en pacientes ≥ 12 años con AGNC a pesar de tratamiento con GCI a dosis altas asociado a otro fármaco controlador. La forma de administración es sc y la posología de 210mg cada cuatro semanas.
En los ECA de tezepelumab se logra reducir las exacerbaciones y la hiperrespuesta bronquial además de mejorar la función pulmonar, el control de la enfermedad y la calidad de vida63,64. La principal diferencia, con respecto a los anteriores tratamientos biológicos, indicados únicamente para el asma fenotipo T2, es que, además, es eficaz, en pacientes con un recuento de eosinófilos en sangre <150 células/μl y FeNO <25 ppb. Por lo tanto, es el único mAb que ha demostrado eficacia tanto en el asma con inflamación T2 como no T264.
Contribuciones de los autoresTodos los autores han contribuido en la elaboración y redacción del manuscrito.
FinanciaciónLos autores declaran que el presente manuscrito no cuenta con financiación por ninguna entidad pública ni privada.
Conflictos de interésLos autores declaran no tener ningún conflicto de intereses respecto al tema tratado.