El asma grave constituye un síndrome heterogéneo con múltiples variantes clínicas y representa el último peldaño en la patología asmática en relación con su gravedad. La prevalencia del asma grave entre los pacientes asmáticos varía de un país a otro, y se estima que el 50% de estos pacientes graves tienen un mal control de su enfermedad. Para el mejor manejo del paciente es necesario un correcto diagnóstico, el seguimiento y sin duda ofrecerle el mejor tratamiento disponible, incluyendo los nuevos avances farmacológicos, como son los anticuerpos monoclonales. Con este afán nació este proceso de consenso, cuya finalidad última es ofrecer al paciente el mejor manejo posible de su enfermedad para así minimizar su sintomatología. Las recomendaciones que se proponen son el resultado de un consenso de tipo nominal desarrollado a lo largo del año 2019 y fueron validadas en sucesivas revisiones posteriores.
Severe asthma is a heterogeneous syndrome with multiple clinical variants, and is the last step in terms of disease severity. The prevalence of severe asthma among asthmatic patients varies from country to country and it is estimated that 50% of these severe patients have poor disease control. Optimal management requires correct diagnosis and follow-up, and the patient must be offered the best treatment available, taking into account new pharmacological advances such as monoclonal antibodies. This consensus process emerged from the desire to offer our patients the best possible management and the chance to minimize symptoms. The proposed recommendations are the result of a nominal consensus process performed throughout 2019, and validated in successive revisions.
Para la versión original de 2018 de este consenso se constituyó un Comité Coordinador (CC), compuesto por tres expertos, que supervisó la calidad y la idoneidad de los procesos y la metodología de consenso, así como la identificación del marco temático de los contenidos a validar. Se constituyó también un Grupo Elaborador de las Recomendaciones (GER), con siete expertos, cuya principal función fue revisar y sintetizar la evidencia disponible hasta finales de 2017 y formular conclusiones (C) y recomendaciones (R). Para validar la evidencia y las C y R formuladas, se constituyó un Grupo Validador de las Recomendaciones (GVR), formado por 30 expertos de diferentes sociedades autonómicas. El CC, el GER y el GVR valoraron las C y las R en una reunión presencial en el marco del congreso de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) de 2017.
Para esta actualización se realizó una revisión de la literatura recopilada hasta abril de 2019 y se ha seguido una metodología de validación similar en una reunión convocada durante el congreso de la SEPAR de 2019. En ambos casos se valoraron las C y las R utilizando un sistema de televotación mediante el que los expertos expresaron su grado de acuerdo o desacuerdo con cada una de las R y las C propuestas, con una escala del 1 al 4 (significando 1 muy en desacuerdo y 4 muy de acuerdo). En la primera ronda se valoraron todas las conclusiones o recomendaciones realizadas por el GER, se agregaron los resultados y se calcularon los porcentajes de acuerdo de los votos de 1 y 2 (desacuerdo) y de 3 y 4 (acuerdo). Las R/C que obtuvieron más del 70% de acuerdo se consideraron consensuadas. Las C o R que obtuvieron entre el 35 y el 70% de acuerdo y las que tuvieron el 35% o menos de los votos se consideraron dudas o discrepancias, respectivamente, y fueron debatidas. En la primera versión de este consenso, para debatir los disensos se dividió el grupo en dos salas, y en cada una se organizó una reunión presencial con metodología participativa. En esta reunión las propuestas fueron defendidas por sus elaboradores, y el resto de los participantes aportaron acuerdos y discrepancias y, eventualmente, se formularon nuevas propuestas. A continuación se votaron en sesión plenaria (CC, GER y GVR) y de forma anónima las nuevas propuestas de C y R para decidir su inclusión o exclusión en el documento. Para la actualización, las C y R que no fueron consensuadas en la reunión presencial fueron debatidas y los comentarios recogidos para una elaboración posterior. Las propuestas modificadas fueron votadas de forma anónima en una segunda ronda mediante un sistema de televotación on-line.
Finalmente, el informe redactado fue sometido a una nueva ronda de validación por parte del CC y del GER, que revisaron tanto el texto como las recomendaciones formuladas.
Diagnóstico del asma graveDefiniciónEl asma grave es la que requiere múltiples fármacos y en altas dosis para mantener el control (escalones 5 y 6 de la Guía Española para el Manejo del Asma [GEMA]1 y 5 de la Global Initiative for Asthma [GINA]2), o la que permanece mal controlada a pesar de estos escalones de tratamiento. Mientras que en muchos pacientes el mal control se debe a un inadecuado cumplimiento terapéutico, o a comorbilidades tales como la rinosinusitis o la obesidad, la European Respiratory Society/American Thoracic Society Task Force on Severe Asthma3 considera que la definición de asma grave es, una vez confirmado el diagnóstico y abordadas las comorbilidades, «el asma que requiere altas dosis de corticosteroides inhalados […] además de un segundo tratamiento controlador (y/o glucocorticoides sistémicos) para evitar su “descontrol”, o que permanece “no controlada” a pesar de esta estrategia terapéutica».
Fenotipos en asma graveEl asma grave constituye un síndrome heterogéneo con múltiples variantes clínicas1. En el asma grave se han podido identificar al menos cuatro fenotipos/endotipos razonablemente bien definidos, atendiendo a la historia natural, la patobiología, las peculiaridades clínicas y la respuesta terapéutica4, si bien este concepto es dinámico y puede variar en un futuro cercano en base a nuevos hallazgos. El interés de identificar estos subtipos o perfiles de asmáticos reside en la posibilidad de establecer un tratamiento más dirigido o personalizado a las características de los pacientes:
- 1.
Asma alérgica grave.
- 2.
Asma eosinofílica de inicio tardío.
- 3.
Asma neutrofílica.
- 4.
Asma asociada a obesidad.
Para la GEMA1, el término asma grave no controlada (AGNC) aglutina dos variedades:
- –
Asma difícil de tratar. Es el AGNC por causas externas a la propia enfermedad. Básicamente por el bajo cumplimiento del tratamiento, la presencia de comorbilidades, los agravantes y la exposición a desencadenantes.
- –
Asma refractaria al tratamiento. Son el resto de los casos de AGNC en los que, tras descartar los factores externos de un asma de difícil control, la enfermedad sigue sin estar controlada por la respuesta parcial al tratamiento.
La gravedad del asma se evalúa retrospectivamente partiendo del nivel de tratamiento requerido para controlar los síntomas y las agudizaciones. La gravedad del asma no es una característica estática, sino que puede cambiar a lo largo de los meses o los años2.
Puesto que no existe suficiente evidencia, o la disponible resulta de baja calidad, la mayoría de las recomendaciones que se proponen se basan en opiniones de expertos.
Se define el AGNC como la enfermedad asmática que persiste mal controlada pese a recibir tratamiento en el último año con una combinación de glucocorticoides inhalados (GCI) y β2 agonistas de acción prolongada (long-acting β-agonist [LABA]) a dosis elevadas, o bien glucocorticoides orales durante al menos 6meses1.
EpidemiologíaLa prevalencia del asma grave entre los pacientes asmáticos varía de un país a otro (18% en Europa occidental, 19% en Estados Unidos y 32% en Europa central)5. Se estima que un 50% de estos pacientes graves tienen un mal control de su enfermedad5. En términos globales, la prevalencia de asma grave se ha estimado que corresponde al 5-10% de la población total asmática6.
En un estudio realizado en España en 2011, la prevalencia del AGNC según criterio médico fue del 3,9% sobre el total de asmáticos. Sin embargo, esta cifra era mayor si se aplicaban criterios de control de la GINA7. Estos pacientes suponen más de la mitad del gasto total en asma. Para el asma persistente grave (población adulta), el coste sanitario incremental anual del asma en España, considerando los costes directos respecto a no asmáticos, fue de 11.703euros, y el coste no sanitario incremental (costes indirectos) fue de 3.461euros8.
Requisitos mínimos para un correcto diagnósticoEl diagnóstico de asma grave debe realizarse en unidades o centros especializados en asma mediante un abordaje multidisciplinar1-3 que se llevará a cabo de forma secuencial, en una serie de visitas de seguimiento, durante un tiempo no inferior a 6meses.
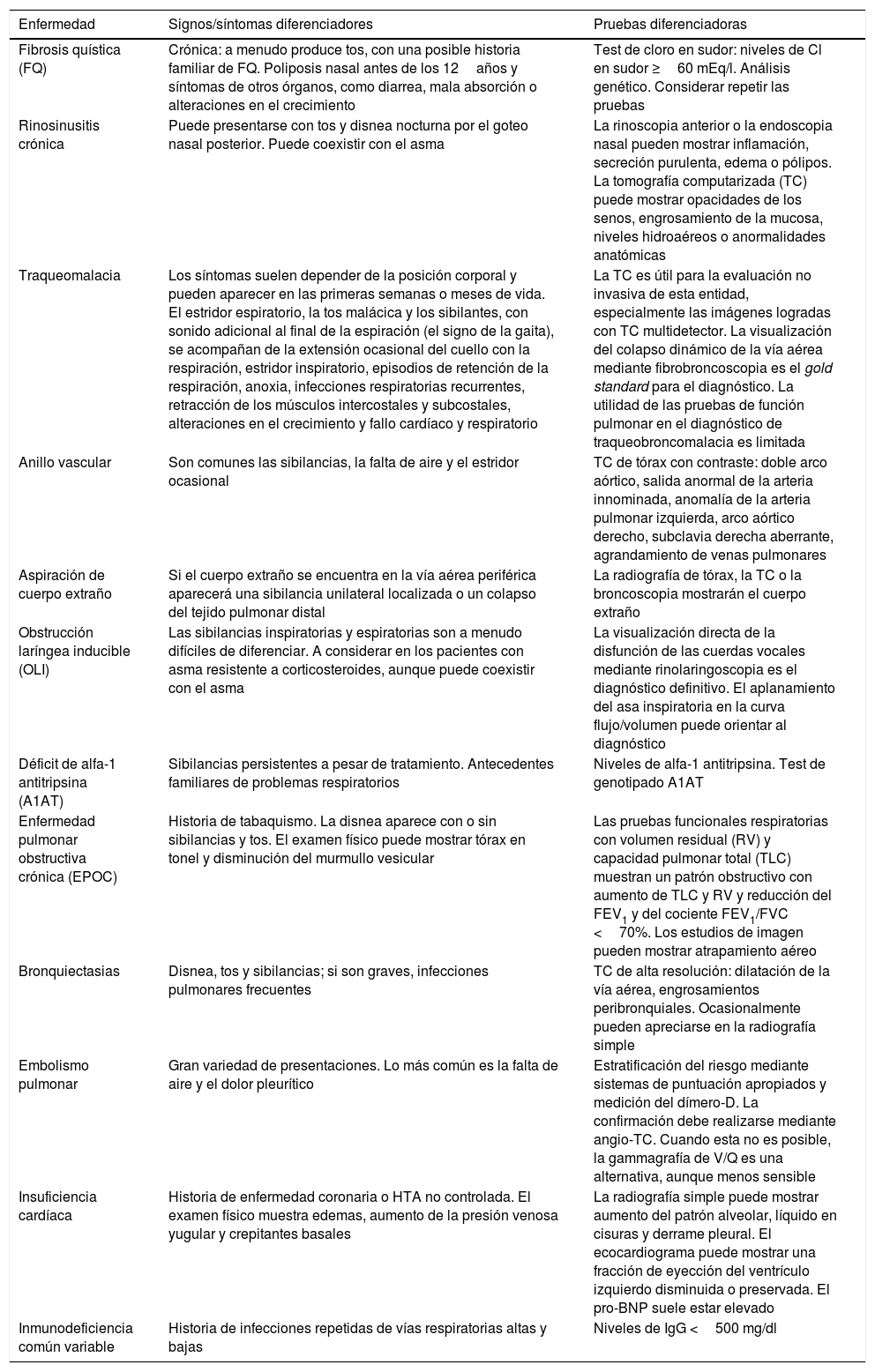
En un primer paso se debe intentar confirmar el diagnóstico de asma de manera objetiva, mediante las pruebas complementarias establecidas o recomendadas en las guías y consensos internacionales. Estas pruebas irán encaminadas a intentar demostrar preferentemente la existencia de variabilidad de los flujos espiratorios4 (tabla 1). Si no se logra confirmar, se descartará la existencia de otra posible enfermedad que pueda simular asma mediante un adecuado diagnóstico diferencial3 (tabla 2).
Pruebas complementarias establecidas o recomendadas en las guías y consensos internacionales para el diagnóstico del asma grave5
| Demostrar variabilidad excesiva en la función pulmonar (una o más de las siguientes pruebas) y documentar obstrucción al flujo aéreo | Cuanto mayores sean las variaciones, o más veces se observen, más fiable será el diagnóstico.Al menos una vez durante el proceso diagnóstico, ante un FEV1 bajo, confirmar que existe obstrucción (FEV1/FVC reducido) |
| Prueba broncodilatadora (PBD) positiva (más probable demostrarla si se suspende medicación BD antes: SABA 6 h / LABA 12 h o 24 h según LABA, anticolinérgicos/LAMA 36-48 h) | Adultos: aumento en FEV1 ≥12% y ≥200ml respecto al basal, 10-15min tras 200-400μg salbutamol o equivalente (mayor fiabilidad si es ≥15% y≥400 ml) |
| Variabilidad excesiva en el PEF domiciliario (mañana-noche) durante 2 semanas | Adultos: promedio de variabilidad diaria en el PEF ≥20% |
| Aumento significativo de la función pulmonar tras 4 semanas de tratamiento (GCO o GCI a dosis muy altas) | Adultos: aumento en el FEV1 ≥12% y ≥200ml (o una variación diurna circadiana de PEF ≥20%) respecto al basal tras 4 semanas de tratamiento, en ausencia de infección respiratoria |
| Prueba de ejercicio positiva | Adultos: caída en el FEV1 ≥10% respecto al basal |
| Test de provocación positivo (en adultos) | Caída en el FEV1 respecto al basal ≥20% (con metacolina o histamina) o ≥15% (con hiperventilación isocápnica, salino hipertónico o manitol) |
| Variación excesiva en la función pulmonar entre visitas (menor fiabilidad) | Adultos: variación en el FEV1 ≥12% y ≥200ml entre visitas, en ausencia de infección respiratoria |
BD: broncodilatador; FEV1: volumen espiratorio forzado en el primer segundo; GCI: glucocorticoides inhalados; GCO: glucocorticoides orales; LABA: β2 agonista de acción prolongada; PEF: pico flujo espiratorio (mejor de tres intentos); SABA: agonista beta 2 de acción corta.
Diagnóstico diferencial117
| Enfermedad | Signos/síntomas diferenciadores | Pruebas diferenciadoras |
|---|---|---|
| Fibrosis quística (FQ) | Crónica: a menudo produce tos, con una posible historia familiar de FQ. Poliposis nasal antes de los 12años y síntomas de otros órganos, como diarrea, mala absorción o alteraciones en el crecimiento | Test de cloro en sudor: niveles de Cl en sudor ≥60 mEq/l. Análisis genético. Considerar repetir las pruebas |
| Rinosinusitis crónica | Puede presentarse con tos y disnea nocturna por el goteo nasal posterior. Puede coexistir con el asma | La rinoscopia anterior o la endoscopia nasal pueden mostrar inflamación, secreción purulenta, edema o pólipos. La tomografía computarizada (TC) puede mostrar opacidades de los senos, engrosamiento de la mucosa, niveles hidroaéreos o anormalidades anatómicas |
| Traqueomalacia | Los síntomas suelen depender de la posición corporal y pueden aparecer en las primeras semanas o meses de vida. El estridor espiratorio, la tos malácica y los sibilantes, con sonido adicional al final de la espiración (el signo de la gaita), se acompañan de la extensión ocasional del cuello con la respiración, estridor inspiratorio, episodios de retención de la respiración, anoxia, infecciones respiratorias recurrentes, retracción de los músculos intercostales y subcostales, alteraciones en el crecimiento y fallo cardíaco y respiratorio | La TC es útil para la evaluación no invasiva de esta entidad, especialmente las imágenes logradas con TC multidetector. La visualización del colapso dinámico de la vía aérea mediante fibrobroncoscopia es el gold standard para el diagnóstico. La utilidad de las pruebas de función pulmonar en el diagnóstico de traqueobroncomalacia es limitada |
| Anillo vascular | Son comunes las sibilancias, la falta de aire y el estridor ocasional | TC de tórax con contraste: doble arco aórtico, salida anormal de la arteria innominada, anomalía de la arteria pulmonar izquierda, arco aórtico derecho, subclavia derecha aberrante, agrandamiento de venas pulmonares |
| Aspiración de cuerpo extraño | Si el cuerpo extraño se encuentra en la vía aérea periférica aparecerá una sibilancia unilateral localizada o un colapso del tejido pulmonar distal | La radiografía de tórax, la TC o la broncoscopia mostrarán el cuerpo extraño |
| Obstrucción laríngea inducible (OLI) | Las sibilancias inspiratorias y espiratorias son a menudo difíciles de diferenciar. A considerar en los pacientes con asma resistente a corticosteroides, aunque puede coexistir con el asma | La visualización directa de la disfunción de las cuerdas vocales mediante rinolaringoscopia es el diagnóstico definitivo. El aplanamiento del asa inspiratoria en la curva flujo/volumen puede orientar al diagnóstico |
| Déficit de alfa-1 antitripsina (A1AT) | Sibilancias persistentes a pesar de tratamiento. Antecedentes familiares de problemas respiratorios | Niveles de alfa-1 antitripsina. Test de genotipado A1AT |
| Enfermedad pulmonar obstructiva crónica (EPOC) | Historia de tabaquismo. La disnea aparece con o sin sibilancias y tos. El examen físico puede mostrar tórax en tonel y disminución del murmullo vesicular | Las pruebas funcionales respiratorias con volumen residual (RV) y capacidad pulmonar total (TLC) muestran un patrón obstructivo con aumento de TLC y RV y reducción del FEV1 y del cociente FEV1/FVC <70%. Los estudios de imagen pueden mostrar atrapamiento aéreo |
| Bronquiectasias | Disnea, tos y sibilancias; si son graves, infecciones pulmonares frecuentes | TC de alta resolución: dilatación de la vía aérea, engrosamientos peribronquiales. Ocasionalmente pueden apreciarse en la radiografía simple |
| Embolismo pulmonar | Gran variedad de presentaciones. Lo más común es la falta de aire y el dolor pleurítico | Estratificación del riesgo mediante sistemas de puntuación apropiados y medición del dímero-D. La confirmación debe realizarse mediante angio-TC. Cuando esta no es posible, la gammagrafía de V/Q es una alternativa, aunque menos sensible |
| Insuficiencia cardíaca | Historia de enfermedad coronaria o HTA no controlada. El examen físico muestra edemas, aumento de la presión venosa yugular y crepitantes basales | La radiografía simple puede mostrar aumento del patrón alveolar, líquido en cisuras y derrame pleural. El ecocardiograma puede mostrar una fracción de eyección del ventrículo izquierdo disminuida o preservada. El pro-BNP suele estar elevado |
| Inmunodeficiencia común variable | Historia de infecciones repetidas de vías respiratorias altas y bajas | Niveles de IgG <500 mg/dl |
En un segundo paso se deberán evaluar los factores que contribuyan a un mal control del asma, así como las posibles enfermedades asociadas o comorbilidades3,5:
- –
Se evaluará el cumplimiento del tratamiento prescrito de la forma más objetiva posible.
- –
Se deberá comprobar que se realiza correctamente la técnica inhalatoria con su dispositivo o, en su defecto, encontrar otro más adecuado al paciente.
- –
Se identificarán los posibles factores agravantes y/o desencadenantes de las exacerbaciones (exposición a alérgenos ambientales y ocupacionales, medicación broncoconstrictora, ácido acetilsalicílico [AAS] u otros antiinflamatorios no esteroideos [AINE], exposición a tóxicos o contaminantes, agentes infecciosos, tabaco, etc.).
- –
Se identificarán las posibles comorbilidades que puedan estar contribuyendo a un control inadecuado del asma. Las más habituales son enfermedad rinosinusal (con o sin pólipos asociados), reflujo gastroesofágico, obesidad, síndrome de apnea del sueño, disfunción de las cuerdas vocales, alteraciones psicopatológicas y/o disnea funcional. Para comprobar todas ellas, se realizarán las pruebas complementarias pertinentes.
Por último, en un tercer paso se intentará identificar el subtipo o fenotipo de asma con el fin de realizar un tratamiento individualizado y optimizado. Para ello pueden ayudar algunas características clínicas (edad de comienzo, obesidad, intolerancia a AINE), así como la medición de los eosinófilos en sangre y/o el esputo inducido, la determinación de la fracción de óxido nítrico exhalado (FENO) y los prick-test. Idealmente, los fenotipos de asma grave deberían ser fáciles de identificar en la clínica y ser indicativos de mecanismos patológicos (endotipos) que puedan guiar la personalización de la medicina. Sin embargo, la aplicación actual de biomarcadores para identificar fenotipos y endotipos de asma grave es limitada, ya que ninguno de los disponibles actualmente es específico para el diagnóstico o manejo de un fenotipo o endotipo determinado9. En la actualidad se están investigando multitud de posibles biomarcadores que podrían ayudarnos en un futuro en este sentido10.
De esta manera, según el panel de expertos:
- –
El diagnóstico de AGNC precisa llevar a cabo una evaluación sistematizada por pasos que asegure no dejar a un lado aspectos relevantes. Esta valoración se debería realizar en unidades de asma acreditadas o de referencia, por profesionales con experiencia clínica contrastada en el manejo de este tipo de pacientes y mediante visitas de seguimiento durante un tiempo no inferior a 6meses1,3.
- –
Ante la ausencia de confirmación diagnóstica, se descartará la existencia de otra posible enfermedad simuladora de asma1,3.
Por su condición de cronicidad, el asma requiere asistencia médica periódica en todos los niveles de gravedad. Este principio general resulta, sin duda, de obligado cumplimiento cuando nos enfrentamos a un asma grave. En esas visitas de seguimiento se interroga al paciente y se le realizan determinadas pruebas funcionales, analíticas o radiológicas con el fin de abarcar diversos objetivos1,2,4:
- •
Conocer el momento actual del proceso y compararlo con las condiciones previas para determinar si hay mejoría, empeoramiento o estabilidad.
- •
Prevenir (en la medida de lo posible) los problemas que puedan presentarse.
- •
Realizar un control clínico de los síntomas.
- •
Evitar agudizaciones y limitaciones en la vida diaria.
- •
Evaluar la situación de las comorbilidades ya conocidas y descartar la existencia de nuevas patologías concomitantes.
- •
Valorar la respuesta al tratamiento pautado comprobando su cumplimiento y el uso adecuado de los dispositivos de inhalación.
- •
Establecer un pronóstico.
- •
A la luz de todo lo anterior, planificar la atención terapéutica futura.
La consecución de buena parte de estos aspectos pasa, en esencia, por la aplicación de indicadores que monitoricen la situación clínica, funcional y de control del paciente, su cumplimiento terapéutico y el pronóstico a medio plazo.
Indicadores de la situación del pacienteLa situación clínica del paciente se interpreta en términos de control de la enfermedad, y dicho concepto difiere según la guía que se esté utilizando (GINA o GEMA).
Para la GINA2, el concepto de control clínico es dual: control actual (definido por los síntomas) y riesgo futuro. La GINA recomienda estimar los síntomas mediante cuestionarios validados —el Cuestionario de Control del Asma (Asthma Control Questionnaire [ACQ]), en sus diversas versiones, y el Test de Control del Asma (Asthma Control Test [ACT])—, que son útiles para reflejar cambios a lo largo del tiempo (algo fundamental para evaluar la eficacia de las intervenciones terapéuticas). Además, los resultados obtenidos con estos inventarios se relacionan muy estrechamente con los datos aportados por los instrumentos que miden la calidad de vida relacionada con la salud (CVRS) y que se consiguen con los diferentes cuestionarios de calidad de vida11. La GINA relega el resultado de la espirometría a ser un factor más de riesgo futuro (si hay obstrucción).
La GEMA mantiene la visión dual del concepto de control (control actual y riesgo futuro), aunque incluye el valor de volumen espiratorio forzado en el primer segundo (FEV1) como variable definitoria de control actual. Según la GEMA, un paciente asintomático con un valor de FEV1 bajo no estaría bien controlado, siempre y cuando revierta la obstrucción tras tratamiento esteroideo intenso, es decir, que no sea el suyo habitual (capítulo8 de la GEMA). Para la GINA sí lo estaría, pero tendría un riesgo aumentado de exacerbaciones en el futuro2. La GEMA también recomienda el uso de cuestionarios validados (ACT y ACQ)1. Conviene recordar asimismo que los síntomas deben ser interpretados con precaución, ya que las diferentes comorbilidades que acompañan a la enfermedad pueden en ocasiones causar síntomas similares.
Hoy por hoy, ninguna guía contempla la obligación de medir biomarcadores de inflamación para estimar esta faceta del seguimiento. La eosinofilia periférica es un biomarcador que ayuda a la indicación de algunos fármacos monoclonales que tienen como diana terapéutica interleucinas (mepolizumab, reslizumab, benralizumab y dupilumab) o la IgE (omalizumab, disponible para el asma alérgica). En pacientes con asma grave, especialmente en los que reciben glucocorticoides orales (GCO), hay baja correlación entre eosinofilia en sangre y esputo, y la persistencia de eosinofilia en el esputo puede reflejar respuesta insuficiente al tratamiento con un monoclonal12,13.
Indicadores de cumplimiento del tratamientoEl cumplimiento del tratamiento influye tanto en el control del asma como en el riesgo futuro. Se estima que el porcentaje medido de cumplimiento en asmáticos está entre el 30 y el 70%14. No obstante, la medición del cumplimiento es un problema, ya que los marcadores de incumplimiento son muy inexactos. La pregunta directa al paciente sobreestima su cumplimiento, y la prueba de Morisky-Green, usada tradicionalmente, es un cuestionario genérico, no específico para inhaladores. El recuento de la medicación tampoco es un método fiable, ya que muchos pacientes disparan el inhalador en el momento anterior a la consulta de revisión (dumpers). La SEPAR ha diseñado y validado un cuestionario, el Test de Adhesión a los Inhaladores (TAI), para estimar el cumplimiento de la terapia inhalada en pacientes con EPOC y con asma15. El TAI incluye dos preguntas adicionales sobre la técnica inhalatoria para comprobar su idoneidad. Recientemente se ha publicado un estudio en asma de control difícil que demuestra que la telemonitorización de los valores de FENO, y su supresión con dosis altas de GCI, pueden ayudar a identificar a los incumplidores16. Otro método también válido para valorar la adhesión al tratamiento es revisar la retirada del fármaco en la farmacia a través de la receta electrónica en aquellas autonomías donde esté disponible. Según un estudio recientemente publicado, el uso combinado del TAI con la evaluación de la retirada del fármaco en la farmacia supone una herramienta más sensible para detectar la falta de adhesión que el uso de un solo método17. Por último, un método novedoso de valoración de la adhesión será la posibilidad de que en un futuro cercano muchos nuevos modelos de inhaladores estén provistos de un chip que podrá conectarse con aplicaciones de smartphone y albergar los datos de cumplimiento para su posterior comprobación18.
Indicadores para establecer el pronósticoEl pronóstico se establece estimando el riesgo futuro. Este comprende el mal control de los síntomas, el desarrollo de exacerbaciones, el establecimiento de una obstrucción bronquial fija o pérdida de función pulmonar y los efectos adversos del tratamiento. Por lo tanto, los marcadores de riesgo futuro se obtendrán a través de la historia clínica o el uso de cuestionarios, si bien también hay que tener en cuenta dos particularidades: la eosinofilia en sangre o en esputo y el FEV1.
Un mal control de los síntomas de asma se asocia con mayor riesgo de exacerbaciones, de hospitalización y de uso de GCO19. Además, la presencia de obstrucción bronquial es un factor de riesgo independiente para sufrir exacerbaciones en el futuro, incluso si el ACT es ≥2020.
Por otra parte, aunque existen resultados contradictorios respecto la eosinofilia como biomarcador (valores superiores a 300células/mm3) dependiendo del tipo de paciente estudiado, en general se ha indicado que su persistencia a pesar de un tratamiento correcto con GCI es un factor de riesgo futuro21 y la concordancia de eosinofilia periférica y local (en esputo) identifica al grupo con mayor riesgo de ataques de asma22. En lo referente al FENO, la evidencia es menos consistente y no se puede asegurar en el momento actual que valores elevados impliquen un mayor riesgo futuro.
Con respecto al desarrollo de obstrucción fija al flujo aéreo, un metaanálisis ha encontrado los siguientes factores de riesgo: sexo masculino, tabaquismo, valores elevados de FENO y enfermedad respiratoria exacerbada por aspirina23. De ellos, solo serían modificables el tabaquismo y el FENO, pero tratar a los pacientes en base a los valores de este biomarcador requiere más evidencias.
Marcadores de planificación del ajuste terapéuticoLa planificación del ajuste terapéutico se hará teniendo en cuenta el concepto dual de control de la enfermedad, atendiendo a la situación actual y al riesgo futuro. La medicación se ajustará al alza o a la baja de acuerdo con el grado de control del paciente y siguiendo las recomendaciones de la GEMA1 o de la GINA2. Además, es importante actuar sobre los factores de riesgo futuro que sean modificables (tabaquismo, cumplimiento, comorbilidades, etc.). Por lo tanto, a la hora de planificar la medicación, debemos tener en cuenta todos los datos recogidos previamente con los marcadores ya comentados, considerando el fenotipo clínico de asma en cada caso concreto y las peculiaridades de cada enfermo. En la tabla 3 se recogen los marcadores que se recomiendan para el seguimiento. La generación de evidencia que respalda el uso de estos marcadores en ocasiones es escasa, inconsistente, o no lo suficientemente reciente. En el caso de la eosinofilia y el FENO, por ejemplo, con un metaanálisis reciente se observó que los pacientes cuyo ajuste del tratamiento del asma se basaba en el recuento de eosinófilos en esputo presentaban una reducción significativa de la probabilidad de sufrir exacerbaciones (OR: 0,36; IC95%: 0,21-0,62). La reducción también era significativa si la estrategia de ajuste se basaba en la medida de FENO, si bien menor (adultos OR: 0,60; IC95%: 0,43-0,84; niños OR: 0,58; IC95%: 0,45-0,75). Sin embargo, no se observaron cambios con ninguna de estas estrategias en cuanto a la función pulmonar o los síntomas24. Por lo tanto, estos biomarcadores podrían resultar de utilidad con pacientes en los que el objetivo terapéutico sea reducir exacerbaciones.
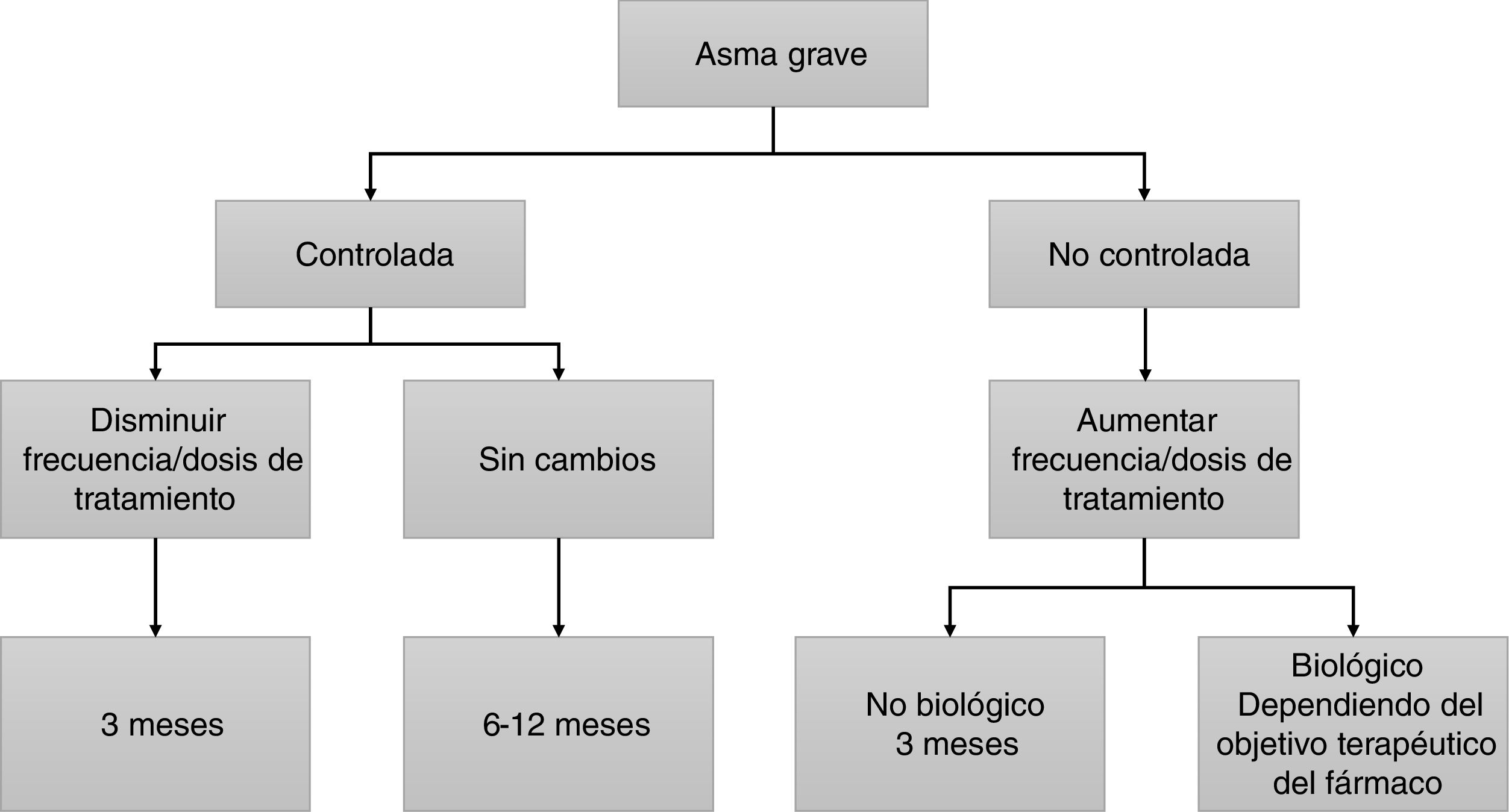
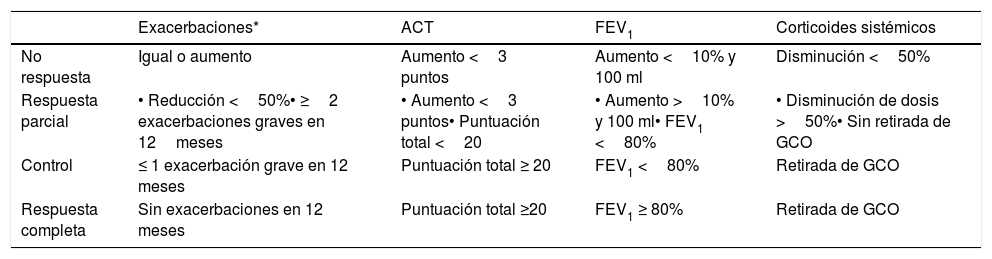
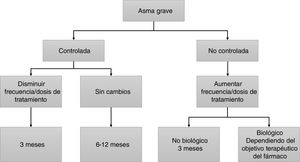
Las guías son muy ambiguas en lo referente al periodo de tiempo que debe mediar entre visita y visita y las pruebas a realizar obligatoriamente. Ello no debería sorprendernos, ya que es muy difícil agrupar bajo recomendaciones comunes toda la posible variedad de pacientes en lo referente a su gravedad, tratamiento y circunstancias personales. No obstante, la GEMA1 recomienda un control del paciente con periodicidad variable en función del grado de gravedad (anual en asma intermitente o persistente leve, semestral en asma persistente moderada, y trimestral en asma persistente grave). Asimismo, la GEMA1 indica una valoración clínica que incluye cuestionarios de control de síntomas, y la valoración de la función pulmonar con espirometría o flujo espiratorio máximo (peak expiratory flow [PEF]) (cuando la espirometría no sea posible). Se asume que los efectos del tratamiento sobre los síntomas y el FEV1 deberían ser evidentes a los 3meses, y por ello se propone este periodo de tiempo para reevaluar la respuesta al tratamiento inhalado25. En el caso de pacientes tratados con anticuerpos monoclonales, se postulan 4meses para una primera valoración de respuesta clínica, funcional e inflamatoria26. Finalmente, para comprobar la eficacia en la reducción de exacerbaciones es preciso alargar el horizonte temporal hasta 12meses (fig. 1). No existe en la actualidad una herramienta que permita graduar la respuesta a los anticuerpos monoclonales en el asma grave. La tabla 4 se aporta como sugerencia orientativa, a la espera de evidencia científica que permita determinar con precisión los umbrales para evaluación de la respuesta. Dada la ausencia de evidencia al respecto, en cada caso concreto se atenderá a los objetivos terapéuticos que muestre el paciente.
Sugerencias para la evaluación de la respuesta a anticuerpos monoclonales
| Exacerbaciones* | ACT | FEV1 | Corticoides sistémicos | |
|---|---|---|---|---|
| No respuesta | Igual o aumento | Aumento <3 puntos | Aumento <10% y 100 ml | Disminución <50% |
| Respuesta parcial | • Reducción <50%• ≥2 exacerbaciones graves en 12meses | • Aumento <3 puntos• Puntuación total <20 | • Aumento >10% y 100 ml• FEV1 <80% | • Disminución de dosis >50%• Sin retirada de GCO |
| Control | ≤ 1 exacerbación grave en 12 meses | Puntuación total ≥ 20 | FEV1 <80% | Retirada de GCO |
| Respuesta completa | Sin exacerbaciones en 12 meses | Puntuación total ≥20 | FEV1 ≥ 80% | Retirada de GCO |
ACT: Asthma Control Test; FEV1: volumen espirado forzado en el primer segundo; GCO: glucocorticoides sistémicos.
Los cuestionarios, la espirometría y el control del cumplimiento terapéutico y la técnica de inhalación son recomendables en cada visita de revisión de pacientes con asma grave4.
En cualquier caso, y a la vista de la información aquí expuesta, resulta evidente que el seguimiento del asma grave es un proceso continuo que exige una dedicación y una preparación capaces de dar respuestas coherentes, planificadas y personalizadas1. En este sentido, la creación de unidades especializadas de asma dotadas de medios y personal sanitario experto aparece como una opción muy razonable, tanto desde la perspectiva de eficiencia para el sistema como desde la perspectiva de mejora de resultados para el paciente27.
Finalmente, el papel de la telemedicina en el seguimiento y el control del asma grave está todavía por precisar. Una revisión sistemática concluye que diferentes estrategias (aplicaciones telefónicas, llamadas telefónicas, avisos por internet, etc.) logran habitualmente mejorías en el cumplimiento28.
Las recomendaciones formuladas en relación con el seguimiento del paciente con asma grave son las siguientes:
- –
En todo paciente con asma grave, el seguimiento de la evolución y de la respuesta terapéutica constituye una parte esencial de su manejo1.
- –
El periodo de tiempo que debe mediar entre visita y visita variará de unos casos a otros, pero se aconsejan 3meses para valorar los efectos del tratamiento inhalado sobre los síntomas y el FEV1, y se recomienda esperar un mínimo de 4meses para una primera valoración de respuesta clínica, funcional e inflamatoria en pacientes tratados con anticuerpos monoclonales. Se valorará la reducción de exacerbaciones a los 12meses.
- –
En cada visita se debe valorar el grado de control actual y el riesgo futuro4.
- –
Cada visita es una oportunidad para estimar el grado de cumplimiento terapéutico (reforzar el cumplimiento del tratamiento) y revisar la técnica de inhalación (corrigiendo los errores detectados). (Opinión de experto.)
- –
La remisión de los pacientes con asma grave a unidades especializadas dotadas de medios y personal sanitario experto es una opción muy razonable por su eficiencia y mejora de resultados27.
- –
De forma global, los marcadores mínimos aconsejados para el seguimiento de la mayoría de los pacientes con asma grave en cada visita son: ACT/ACQ, número e intensidad de exacerbaciones desde la última visita, espirometría, TAI, FENO y eosinofilia en sangre/esputo. (Opinión de experto.)
- –
La eosinofilia periférica es un biomarcador que ayuda a la indicación de fármacos monoclonales (mepolizumab, reslizumab, benralizumab, dupilumab y omalizumab).
- –
En pacientes con asma grave, especialmente en los que reciben GCO, hay baja correlación entre eosinofilia en sangre y esputo12,13.
- –
La persistencia de eosinofilia en el esputo puede reflejar respuesta insuficiente al tratamiento con un monoclonal12,13.
- –
La evidencia respecto a la utilidad del FENO para predecir riesgo futuro no es consistente y no se puede asegurar que valores elevados impliquen un mayor riesgo futuro.
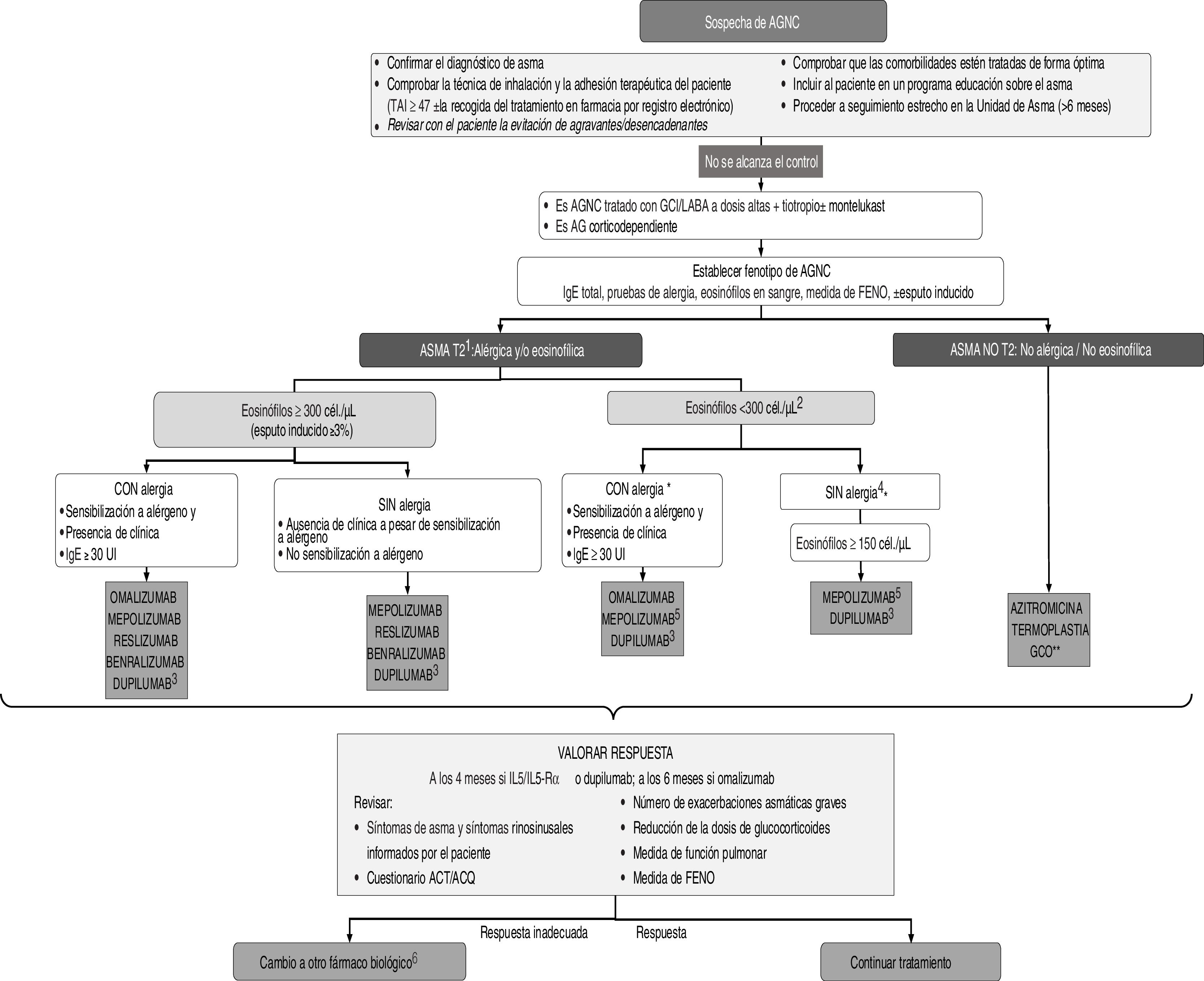
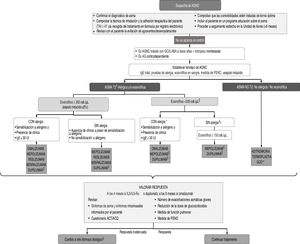
El objetivo principal del tratamiento del asma es lograr y mantener el control de la enfermedad lo antes posible, además de prevenir las exacerbaciones y la obstrucción crónica al flujo aéreo y reducir al máximo su mortalidad y los efectos secundarios de la medicación1. El tratamiento del asma se configura en un ciclo continuo que consta de evaluación, ajuste del tratamiento y revisión de la respuesta. En la figura 2 se muestra el algoritmo terapéutico del asma grave.
Algoritmo terapéutico del asma grave.
Abreviaturas: AGNC: asma grave no controlada; AG: asma grave; GCO:glucocorticoides orales; TAI: test de adhesión a inhaladores; GCI glucocorticoides inhalados; LABA: broncodilatadores de larga duración; ACT: test de control del asma; ACQ: cuestionario de control del asma. 1 Se suele caracterizar por niveles de eosinófilos o FENO elevados y puede acompañarse de atopia (GINA); 2 Tener en cuenta que en pacientes tratados con corticoides el nivel de eosinófilos puede ser muy bajo (ver notas); 3 El dupilumab tiene indicación si eosinófilos >300/ul y/o FENO ≥50 ppb y entre 150-300 eosinófilos y FENO > 25 ppb. Considerar al menos tres medidas de FENO. 4 Puede valorarse uso compasivo de omalizumab si los niveles de IgE ≥75 U/L y los de eosinófilos <150 cel./μL 5Mepolizumab indicado en pacientes con ≥150 eos /μl si existen valores históricos de ≥300 eos /μl 6En el asma T2 se puede optar por azitromicina en caso de no respuesta a monoclonales, intolerancia o reacciones alérgicas a estos; *En pacientes con < 300 eosinófilos/μL se puede considerar benralizumab como posible tratamiento alternativo, en especial si están en tratamiento con GCO. ** Ultima opción terapéutica en casos de necesidad por la situación clínica del paciente y a la mínima dosis posible.
NOTAS
Definiciones
AGNC: asma que precisa tratamiento con escalones terapéuticos 5-6 según la GEMA y presenta ≥1 de los siguientes criterios:
ACT < 20 o ACQ > 1.5
≥2 ciclos de glucocorticoides orales (GCO) de ≥3 días de duración en el año previo
≥1 ingreso hospitalario por agudización asmática en el año previo
FEV1 ≤ 80% de esperado
Inflamación refractaria de Tipo 2: ≥1 de los siguientes criterios mientras el paciente usa dosis altas de corticoides inhalados o bien GCO diarios:
≥150 eosinófilos por microlitro en sangre
FENO ≥25 ppb (American Thoracic Society Committe)
≥2% de eosinófilos en esputo
El asma está clínicamente impulsada por alérgenos
Los pacientes que requieren mantenimiento con corticoides orales también pueden tener una inflamación subyacente de Tipo 2. Sin embargo, los GCO a menudo suprimen los biomarcadores de la inflamación de Tipo 2 (eosinófilos en sangre, eosinófilos en esputo y FENO). Por lo tanto, si es posible, estas pruebas se deben realizar antes de comenzar un curso corto o tratamiento de mantenimiento con GCO, o cuando el paciente esté con la dosis más baja posible de GCO.
Umbrales de eosinofilia en sangre: Al menos una determinación de más de 300 eos./μl en el último año. En pacientes tratados con corticoides sistémicos de forma crónica o recientemente pueden aparecer cifras bajas de eosinófilos. En este caso puede ser de utilidad revisar valores históricos.
Umbrales de FENO. El punto de corte se establece en 25 ppb. No obstante, se debe considerar que la medida de FENO puede verse alterada por la toma reciente de corticoides sistémicos y la dosis total de corticoides inhalados, por la edad y tabaquismo (niveles más bajos en fumadores). Si aparecen niveles altos de FENO, verificar que el paciente se autoadministra correctamente la medicación inhalada (adhesión terapéutica y técnica inhalatoria).
Respuesta a fármaco biológico. Se define por:
Puntuación en ACT superior a 20 o cambio significativo en relación a puntuación basal (≥3 puntos)
Ausencia de ingresos hospitalarios o visitas a urgencias
Reducción de las exacerbaciones en más de un 50%
Supresión del uso de corticoides orales o disminución significativa de la dosis (≥50%)
Elección entre monoclonales
El orden en que aparecen los biológicos en el esquema, cuando coinciden en una indicación, obedece solo al tiempo que llevan comercializados.
En la elección deben considerarse: el recuento de eosinófilos en sangre, la función pulmonar, el uso de corticoides orales de mantenimiento, la presencia de comorbilidades: poliposis nasal/EREA, urticaria crónica, dermatitis atópica y enfermedades asociadas a asma (granulomatosis eosinofílica con poliangeítis, neumonía eosinófila, ABPA, esofagitis eosinofílica).
Benralizumab (mayor eficacia >300 eos./μl): Pacientes con mala función pulmonar, poliposis, corticoides orales de mantenimiento y dificultad para acceder a unidad de asma por largos desplazamientos.
Reslizumab (mayor eficacia >400 eos./μl): Mejora la función pulmonar. No se ha demostrado que sea eficaz para reducir la dosis de GCO. Administración intravenosa.
Mepolizumab (su indicación es a partir de 150 eos./μl, pero mayor eficacia >500 eos./μl): Indicado en pacientes con ≥150 eos. /μl si existen valores históricos de ≥300 eos./μl. Se ha demostrado que permite reducción o retirada de GCO.
Dupilumab (mayor eficacia >300 eos./μl y FENO > 50 ppb): Mejora la función pulmonar, la poliposis nasal y la dermatitis grave. Se ha demostrado que permite reducción o retirada de GCO y aumenta los valores de eosinófilos. La administración es quincenal.
Para elegir entre fármacos con potencial eficacia en un determinado paciente, se deben considerar criterios de comodidad posológica (preferible mensual en lugar de quincenal), vía de administración (preferible subcutáneo a intravenoso) y costes.
La termoplastia está indicada en pacientes sin enfisema/bronquiectasias/atelectasias ni comorbilidades importantes. Sin tratamiento con anticoagulantes o inmunosupresores y que no presenten infecciones recurrentes. La FEV1 debe ser mayor de 40% y no debe haber contraindicación para BFC con sedación.
De acuerdo con los criterios de asma grave, estos pacientes estarán recibiendo un tratamiento de mantenimiento con una combinación de GCI/LABA a dosis elevadas, correspondiente al escalón5 del tratamiento del asma según la GINA o 5-6 según la GEMA1,2. Si existe control insuficiente de la enfermedad, se añadirá por lo menos uno de los siguientes fármacos: tiotropio29-31, antileucotrieno32 o teofilina33. La elección del tratamiento debe tener en cuenta las opciones terapéuticas más efectivas, la seguridad, el coste de las distintas alternativas y la satisfacción del paciente con el nivel de control alcanzado2. Las recomendaciones formuladas en relación con estos tratamientos son:
- –
En el asma persistente grave se recomienda como tratamiento de elección un GCI a dosis altas en combinación con un LABA, correspondiente al escalón5 de la GINA2 o escalón terapéutico5-6 de la GEMA1.
- –
El tratamiento general del asma grave no controlada incluye la prescripción de los fármacos recomendados en los escalones5 y 6 (combinación de GCI/LABA a dosis elevadas y al menos un tercer fármaco —tiotropio, antileucotrieno o teofilina—), administración del programa de educación de asma, tratamiento de las comorbilidades/agravantes y prevención/tratamiento de los efectos secundarios de los glucocorticoides orales (actualmente último recurso terapéutico según la GEMA y la GINA)1,29,30,32,33.
En el caso de haberse confirmado la existencia de una comorbilidad o agravante, se iniciarán las oportunas medidas terapéuticas. Entre las comorbilidades y los factores agravantes más frecuentes debemos tener presentes la disfunción de las cuerdas vocales; factores psicológicos como ansiedad y depresión; el consumo de fármacos como AINE, betabloqueantes no selectivos o inhibidores de la enzima convertidora de la angiotensina (IECA); fibromialgia; hipertiroidismo; menstruación/menopausia; obesidad; reflujo gastroesofágico; rinosinusitis/poliposis nasal; síndrome de hiperventilación; síndrome de apnea-hipopnea del sueño; tabaquismo; traqueomalacia y otras traqueopatías1.
Tratamiento de los efectos secundarios de los glucocorticoidesEn los pacientes corticodependientes se evaluará de forma preventiva el metabolismo osteocálcico (osteoporosis), la glucemia (diabetes), la salud mental (ansiedad-depresión) y la visión (cataratas). También hay que considerar efectos adversos comunes como la dispepsia, la hipertensión arterial, la obesidad, el deterioro renal o la insuficiencia suprarrenal. Estas enfermedades serán oportunamente tratadas en caso de que aparezcan1. Hay que tener en cuenta que esto engloba no solo a pacientes con corticoides de mantenimiento, sino a pacientes que precisan 4 o más ciclos de corticoides sistémicos anuales, ya que también presentan riesgo de aparición de estos eventos adversos34.
Educación sanitaria en asmaNo se diferencia de la habitualmente recomendada para el resto de la población asmática. No obstante, se extremarán las medidas de evitación (se evitará la exposición a contaminantes y tóxicos, y a alérgenos en pacientes alérgicos, sobre todo a hongos, pólenes, epitelios, ácaros y cucarachas), se abandonará el tabaquismo —activo y pasivo—, se prescribirá el uso de AINE en pacientes con enfermedad respiratoria exacerbada por aspirina (EREA)1 y se evitará el consumo de los alimentos correspondientes en casos de alergia alimentaria confirmada. Se establecerán planes de acción basados en síntomas y en la medición del flujo espiratorio máximo (PEF). Además, se adiestrará a los pacientes en el correcto empleo de los dispositivos de inhalación y de los medidores de PEF1.
Otros tratamientos para el asma graveMacrólidosExisten muchas evidencias in vitro e in vivo que avalan el efecto inmunomodulador de los macrólidos; sin embargo, se requieren más estudios para determinar la dosis, el tiempo de administración y las posibles consecuencias de su empleo prolongado. En la mayoría de las publicaciones el uso de macrólidos se ha asociado con una mejoría de síntomas y la hiperrespuesta bronquial, aunque este efecto beneficioso es modesto y solo se da en algunos sujetos.
El tratamiento con macrólidos en asma grave durante tres o más semanas no está asociado a una mejoría significativa del FEV1 (aunque sí del PEF matutino), de los síntomas, de la hiperrespuesta bronquial y de la CVRS35. No existe suficiente evidencia en referencia al uso generalizado para disminuir el número de exacerbaciones, si bien algunos estudios recomiendan su utilización en el fenotipo de asma grave neutrofílica36. Sin embargo, los resultados de un estudio reciente37 objetivaron que la mejoría con azitromicina se dio independientemente del «endotipo inflamatorio», tanto en pacientes con T2-alto como en pacientes con T2-bajo en cuanto a la reducción de las exacerbaciones y mejoría de calidad de vida medida mediante el Asthma Quality of Life Questionnaire (AQLQ), así como síntomas medidos con el Asthma Control Questionnaire (ACQ6). Por tanto, según este estudio el tratamiento con azitromicina sería una opción que se puede ofrecer a pacientes mal controlados con GCI +LABA. El objetivo cínico principal sería reducir exacerbaciones, pero también mejorar síntomas.
En resumen, actualmente y desde un punto de vista clínico, el Task Force Report ERS/ATS Guidelines on Severe Asthma (2018)3, la GEMA1 o la normativa de asma grave no controlada4, entre otras guías, recomiendan el tratamiento con macrólidos a los pacientes con asma grave no controlada con un fenotipo inflamatorio neutrofílico, participación infecciosa de microorganismos atípicos, o con resistencia a los corticoesteroides.
La recomendación elaborada en relación con estos tratamientos es que:
- –
Se puede intentar tratamiento con azitromicina en pacientes mal controlados con triple terapia, especialmente si no reúnen criterios para un tratamiento biológico y cuando el objetivo terapéutico principal sean las exacerbaciones. (Opinión de experto +literatura1,3,36.)
La termoplastia consiste en la aplicación de calor generado por radiofrecuencia mediante un catéter que se introduce en el árbol bronquial con un broncoscopio flexible para reducir la cantidad y la contractilidad del músculo liso. El objetivo del tratamiento mediante termoplastia consistiría, por tanto, en la reducción de los síntomas del asma y sus exacerbaciones al reducir la contractilidad del músculo liso, lo que conllevaría un mejor control del asma y de la calidad de vida.
Esta técnica fue aprobada para el tratamiento del asma por la Food and Drug Administration (FDA) en abril de 2010 para los pacientes mayores de 18años con asma grave y persistente, no controlada con glucocorticoides inhalados y fármacos de acción prolongada beta-agonistas. Esta aprobación se obtuvo a raíz de los resultados obtenidos en el estudio AIR-238. En estudios más actuales se aplica en pacientes de más gravedad39.
A diferencia de otros ensayos40,41, los participantes en el grupo activo de tratamiento se sometieron a tres procedimientos de broncoscopia realizadas con el sistema Alair a intervalos de tres semanalmente, mientras que los participantes en el grupo control se sometieron a tres broncoscopias simuladas en los mismos intervalos de tiempo que los tratados con termoplastia bronquial. Los resultados mostraron en pacientes con asma moderada y grave una mejoría significativa de su calidad de vida, un incremento del control de la enfermedad y una reducción de las exacerbaciones, aunque también se observó mejoría en el 64% de los pacientes del grupo placebo. Sin embargo, cabe destacar que los estudios que llevaron a la aprobación de la técnica fueron realizados antes de la introducción sistemática y basada en la evidencia de los fármacos biológicos para el tratamiento de los pacientes con AGNC con fenotipo alérgico y/o eosinofílico, y también de la inclusión en las guías de los LAMA y la azitromicina en los últimos escalones terapéuticos. Por tanto, es aconsejable realizar un adecuado fenotipado para identificar subgrupos subsidiarios de beneficiarse de estos tratamientos antes de la indicación de termoplastia, ya que el porcentaje de pacientes con alergia en los estudios de termoplastia es elevado38,40,41 y ningún ensayo muestra los valores de IgE, de FENO, o el recuento de eosinófilos.
La eficacia sobre la reducción de exacerbaciones se mantiene como mínimo durante 5años sin efectos secundarios42-44.
En cuanto a los estudios farmacoeconómicos publicados, cabe destacar el de Koh et al.45 en 2014, con un análisis de coste-utilidad que comparaba el tratamiento de pacientes con asma grave con y sin termoplastia bronquial. La ratio coste-utilidad incremental resultante fue de 21.470dólares (12.339euros) por año de vida ajustado por la calidad (AVAC) ganado al usar termoplastia bronquial frente a no usarla. Por tanto, los autores afirmaron que el uso de termoplastia bronquial puede considerarse una intervención eficiente frente a no usarla, siendo, según los autores, los resultados robustos en los análisis de sensibilidad probabilísticos realizados. Cangelosi et al.46 presentaron en 2015 un análisis de coste-utilidad del uso de la termoplastia bronquial para pacientes con asma grave persistente, pobremente controlada, con un horizonte temporal de 5años. La termoplastia suponía un incremento de costes de 960dólares y la ratio coste-utilidad estimada fue de 5.495dólares por AVAC. Los autores concluyeron que la termoplastia bronquial es una intervención eficiente en el tratamiento de los pacientes con asma grave persistente.
La recomendación realizada en relación con el uso de esta técnica en el control del asma grave es que:
- •
La termoplastia podría ser recomendable en pacientes con fenotipos de AGNC no subsidiarios de tratamiento con fármacos biológicos, o en los que estos hayan fracasado, en unidades de asma con experiencia y pacientes sin contraindicación para la técnica.
Los GCO se utilizan en muchos pacientes con asma grave (adicionalmente a los inhalados) para mantener el control de la enfermedad, y una amplia proporción de ellos presentan «insensibilidad a glucocorticoides». Los mecanismos de esta presentación clínica en asma grave han sido relacionados con la presencia de obesidad, tabaco o inflamación T2-baja47.
La GEMA1 recomienda la adición de glucocorticoides orales en los pacientes cuya asma permanezca mal controlada a pesar de utilizar dosis altas de GCI y un LABA (escalón6), generalmente con otros fármacos de mantenimiento (antagonistas de los receptores de los leucotrienos [ARLT], tiotropio, teofilina, anticuerpos monoclonales) y siempre a la dosis más baja eficaz y durante el mínimo tiempo posible.
Tal y como se apunta en la sección anterior referente a los efectos secundarios de estos fármacos, los GCO se han asociado con frecuentes efectos adversos48,49. Las complicaciones están relacionadas con la dosis y la resistencia a la respuesta al tratamiento, y se ha documentado que esto aumenta el coste del manejo de la enfermedad50,51. Es destacable que hasta un 93% de los pacientes con asma grave presentan algún efecto secundario debido a los corticoides orales34, y los pacientes tratados con corticoides orales administrados en tandas no están exentos de riesgo. En este sentido, se ha demostrado que recibir cuatro o más tandas de corticoides orales en un año49 o corticoides orales más de 30días al año52 incrementa el riesgo de efectos secundarios. En un estudio retrospectivo que incluyó más de un millón y medio de pacientes, de los cuales un 21% habían recibido una tanda de corticoides orales, se comprobó un incremento de las tasas de sepsis, tromboembolismo pulmonar y fractura ósea en estos durante el mes siguiente al inicio del tratamiento, que luego disminuyó en los dos meses posteriores, si bien se mantuvo elevado en los pacientes tratados con dosis ≥20mg/día53. Además, hay que considerar el riesgo a largo plazo de osteoporosis, diabetes, alteraciones mentales y de la visión, así como efectos adversos comunes como la dispepsia, la hipertensión arterial, la obesidad, el deterioro renal o la insuficiencia suprarrenal1.
Por lo tanto, su uso debe reservarse siempre como último escalón terapéutico a las mínimas dosis necesarias (no debe pretenderse normalizar la función respiratoria sino permitir al paciente tener una calidad de vida aceptable). Debe valorarse siempre acompañar la administración de glucocorticoides sistémicos a la prevención o tratamiento de la osteoporosis.
Se ha demostrado que la inyección intramuscular de triamcinolona (Trigón® Depot 40mg) en asmáticos con insensibilidad a glucocorticoides mejora el control, reduce la cantidad de eosinófilos en el esputo, aumenta el FEV1 y previene las exacerbaciones54. Las razones para su eficacia pueden incluir el refuerzo del cumplimiento o la mayor potencia de la triamcinolona comparada con otros glucocorticoides de uso clínico55. La triamcinolona puede considerarse una opción útil para el tratamiento de pacientes con asma grave e inestable con poca o ninguna respuesta a la prednisona.
- –
No está bien definido el momento óptimo para iniciar tratamiento de mantenimiento con GCO, ni existe evidencia de que un tratamiento continuo con dosis bajas de GCO sea más eficaz que ciclos de GCO para disminuir el número de exacerbaciones. (Opinión de experto +literatura47,55.)
- –
El uso prolongado de corticosteroides sistémicos se suele asociar a efectos adversos, en ocasiones graves. (Opinión de experto +literatura47,55.)
- –
Se necesitan ensayos controlados que comparen la eficacia de triamcinolona frente a GCO en asma grave corticodependiente. (Opinión de experto +literatura47,55.)
Las recomendaciones relacionadas con el tratamiento con corticosteroides sistémicos de los pacientes con asma grave son las siguientes:
- –
El tratamiento con GCO debe reservarse para pacientes con AGNC como último escalón terapéutico, a la dosis más baja eficaz y durante el mínimo tiempo posible. (Opinión de experto +literatura47.)
- –
Los ciclos frecuentes de corticoides orales se asocian a riesgo de efectos secundarios19,52,53.
- –
Si bien no existe evidencia robusta para recomendar el uso de triamcinolona en el tratamiento del AGNC, se podría considerar su empleo en pacientes corticodependientes bien seleccionados. (Opinión de experto +literatura1.)
En la actualidad se considera que el asma es un síndrome que agrupa distintas entidades nosológicas con mecanismos fisiopatológicos diferentes. Se ha intentado describir distintos fenotipos de cara a la indicación de nuevos tratamientos, especialmente en el grupo de pacientes con asma grave. Entre estos fenotipos destacan por su prevalencia y sus posibilidades terapéuticas el asma eosinofílica y el asma alérgica o mediada por inmunoglobulinaE (IgE).
Tras la aparición de los fármacos anti-IgE se empezaron a entender mejor los mecanismos fisiopatológicos de la enfermedad y la relevancia de la IgE en estos procesos, así como la repercusión que tiene su bloqueo. El omalizumab fue el primero que se comercializó, en 200656.
El desarrollo de los anticuerpos monoclonales (monoclonal antibodies [mAb]) con efecto anti-IL-5 reslizumab y mepolizumab ha sido más lento, pues los primeros estudios se realizaron en asmáticos leves con poca o nula infiltración por eosinófilos. Los beneficios clínicos de estos fármacos se pusieron claramente de manifiesto cuando se empezó a seleccionar a los pacientes candidatos a recibirlos por padecer un asma eosinofílica, y a basar la indicación del fármaco en función de su concentración. Hay dos anticuerpos monoclonales recientemente comercializados: el benralizumab (mAb frente al receptor de la IL-5 que tiene efecto citotóxico directo sobre los eosinófilos) y el dupilumab (mAb frente al receptor de la IL-4, con efecto también anti-IL-13, al tratarse de un receptor heterodimérico).
Antes de iniciar un tratamiento con anticuerpos monoclonales se debe realizar una valoración objetiva del cumplimiento terapéutico. En la tabla 5 se resumen algunas características básicas de los anticuerpos monoclonales disponibles para asma grave.
Características básicas de los anticuerpos monoclonales disponibles para asma grave
| Anticuerpo monoclonal | Efecto farmacológico | Vía de administración | Lugar de administración |
|---|---|---|---|
| Omalizumab | Anti-IgE | Subcutáneo | Hospital de día/domicilio |
| Mepolizumab | Anti-IL-5 | Subcutáneo | Hospital de día/domicilio |
| Reslizumab | Anti-IL-5 | Intravenoso | Hospital de día |
| Benralizumab | Anti-receptor de IL-5 | Subcutáneo | Hospital de día/domicilio |
| Dupilumab | Anti-receptor de IL-4 (con efecto anti-IL-4 y anti IL-13) | Subcutáneo | Hospital de día/domicilio |
Es un mAb aprobado para pacientes con ≥6años con asma persistente de moderada a grave, siendo el paciente alérgico a un alérgeno perenne, con valores de IgE en sangre comprendidos entre 30 y 1.500UI/ml, no controlado con GCI a dosis altas +LABA57. Evita la unión de la IgE a los receptores de alta y baja afinidad58. Tanto la evidencia clínica59-62 como los estudios en vida real36,56,63-68 avalan sus resultados. Mejora las exacerbaciones, la calidad de vida, el consumo de GCO y discretamente el FEV1. Se administra por vía subcutánea y la dosis (máxima de 1.200mg/mes) se ajusta por peso y concentración de IgE en sangre periférica. Algunos estudios recientes indican la utilidad de este fármaco en pacientes con niveles altos de eosinófilos en sangre periférica69,70. Han seguido publicándose estudios en vida real avalando la seguridad del fármaco y su efectividad para conseguir un mejor control de pacientes asmáticos e insinuando su utilidad en pacientes con solapamiento asma-EPOC (Asthma-COPD Overlap [ACO]), aunque no son ensayos controlados con placebo71,72.
MepolizumabEs un mAb bloqueador de la IL-5 circulante (anti-IL-5). Después de unos inicios desalentadores, se publicaron dos estudios que mostraron que mepolizumab era capaz de disminuir el número de exacerbaciones73,74. Ha demostrado su eficacia en pacientes con ≥300 eosinófilos/μl en sangre en el último año o con ≥150/μl en el momento del tratamiento, pero con controles históricos de eosinofilia. Ha demostrado ser más eficaz en pacientes con más de 500 eosinófilos/μl. La fase clínica se inicia con el estudio DREAM43, seguido del SIRIUS75 y el MENSA76, que evidencian que el fármaco disminuye las exacerbaciones y el consumo de GCO y mejora la calidad de vida. La mejoría del FEV1 fue discreta. En el estudio COSMOS77, un estudio de seguimiento abierto, se ha demostrado la seguridad del fármaco, y posteriormente el estudio COLUMBA reafirma esta seguridad y eficacia a 4años78. Se administra por vía subcutánea y a dosis fija. En recientes trabajos se ha demostrado la efectividad de este fármaco tras un cambio de tratamiento en pacientes con asma grave sin respuesta completa a omalizumab79. En cuanto a comorbilidades, se ha probado que el mepolizumab es útil para reducir significativamente la gravedad de la poliposis nasal en comparación con placebo, mejorando los síntomas y los hallazgos endoscópicos y radiológicos. No obstante, el ensayo se realizó con dosis de 750mg por vía intravenosa, que no son las comercializadas actualmente80. Por último, la FDA estadounidense ha aprobado el uso de la dosis de 300mg cada 4 semanas por vía subcutánea en pacientes con granulomatosis eosinofílica con poliangitis, tras haberse demostrado que el fármaco consigue reducir las recidivas y el tratamiento de mantenimiento con GCO de estos pacientes81.
ReslizumabEs un mAb bloqueador de la IL-5 circulante. Se une a la misma región por la que la IL-5 se une a su receptor. Los estudios han demostrado que es eficaz en pacientes con asma grave de fenotipo eosinofílico con ≥400 eosinófilos/μl. En un estudio aleatorizado controlado con placebo que incluyó a 53 pacientes tratados con reslizumab, Castro et al.82 observaron que la disminución de eosinófilos en sangre periférica se acompañaba de una mejoría del FEV1 y de la calidad de vida (ACQ-5), especialmente en el grupo de pacientes con poliposis nasal. El desarrollo de la fase clínica incluyó varios estudios83-85, que han demostrado disminución de las exacerbaciones, mejoría en la calidad de vida y una mayor mejoría en el FEV1 que otros anticuerpos monoclonales, si bien debe tenerse en cuenta en la valoración de este último parámetro que las poblaciones de estudio en los diferentes trabajos no fueron exactamente superponibles. Un estudio abierto de dos años de seguimiento ha evidenciado la seguridad del fármaco86.
En un análisis post hoc de un estudio que incluyó a 480 pacientes con asma eosinofílica (≥400 eosinófilos/μl) no controlada de moderada a grave que fueron tratados con reslizumab (3mg/kg cada 4 semanas) durante 52 semanas se evaluó la respuesta según la atopia (IgE específica basal positiva o no)87. Tanto en los pacientes atópicos como en los no atópicos se observó reducción de exacerbaciones y mejoría en el FEV1, en el control del asma y en la calidad de vida. Estos resultados no eran dependientes de la sensibilización alérgica87.
El reslizumab también ha sido evaluado como alternativa en un cambio de tratamiento tras otro mAb. Se evaluó la respuesta al tratamiento con reslizumab (4 infusiones intravenosas de 3mg/kg cada 4semanas) en 10 pacientes corticodependientes (prednisona) que presentaban eosinofilia en esputo (≥3%) y en sangre (≥300células/μl) a pesar de que previamente habían sido tratados con mepolizumab (100mg subcutáneo cada 4semanas) durante un año13. El tratamiento con reslizumab con la pauta de este estudio disminuyó la inflamación eosinofílica de la vía aérea significativamente más que la dosis fija de mepolizumab subcutánea, lo que se asocia a una mejoría del control del asma en estos pacientes13. También se ha evaluado frente a omalizumab en un estudio prospectivo multicéntrico de 24semanas de seguimiento. Se evaluaron la eficacia y la seguridad del reslizumab intravenoso (3mg/kg) en 29 pacientes con asma eosinofílica (≥400 eosinófilos/μl) sin respuesta adecuada a omalizumab88. Los resultados mostraron una mejoría significativa en el ACT en la semana 24 de tratamiento, el objetivo principal, con un 60% del total de pacientes con buen control y sin exacerbaciones. Por lo tanto, el tratamiento con reslizumab aparece como una opción efectiva y segura para este perfil de pacientes88.
BenralizumabEs un mAb humanizado dirigido contra la subunidad alfa del receptor de la IL-5 que induce la eliminación directa de eosinófilos y basófilos a través de las células NK mediante la citotoxicidad mediada por anticuerpos89. Su uso está aprobado a partir de los 18años. Se ha demostrado su eficacia en AGNC eosinofílica en términos de reducción de exacerbaciones graves frente a placebo hasta en un 55%, la mejora del control de los síntomas y la reducción de la necesidad de tratamiento con GCO, así como incremento de la función pulmonar (FEV1) desde la visita basal en un 25% (398ml). Estos resultados son independientes de los niveles basales de IgE (≥30UI) o de la presencia de atopia90-92. Los resultados son coherentes también en el estudio ZONDA93, en el que se pudo reducir la dosis de GCO a asmáticos graves corticodependientes manteniendo el control en la mayoría (75% de reducción de dosis) e incluso interrumpir su uso (en el 52% de los pacientes). Los mayores beneficios se observaron en pacientes con recuento de más de 300eosinófilos/μl en sangre periférica y de más de 150 si se trataba de pacientes con GCO de mantenimiento. En los estudios de faseIII se identificaron varios factores clínicos basales asociados con una mayor eficacia de benralizumab, que eran independientes de los valores de eosinófilos. Estos comprendían el uso de GCO; el antecedente de poliposis nasal; la función pulmonar baja basada en la capacidad vital forzada (CVF<65%) antes de broncodilatador; las exacerbaciones frecuentes, y que la enfermedad se iniciara en la edad adulta94-96. El perfil de seguridad y efectos adversos a 2años es similar al observado en el primer año95.
DupilumabEs un anticuerpo totalmente humano que bloquea la subunidad α del receptor de la IL-4. Tiene efecto anti-IL-4 y anti IL-13. Disminuye la producción de IgE y la liberación de IL-5, por lo que inhibe el reclutamiento de eosinófilos97,98. Wenzel et al.98 demostraron que, además, disminuye otros marcadores de la vía T2. Además, observaron la eficacia del fármaco en pacientes con asma de moderada a grave con más de 300eosinófilos/μl en sangre o más del 3% en esputo. Posteriormente, Wenzel et al.99 desarrollaron un estudio en faseIIb aleatorizado y a doble ciego en el que reclutaron 769 pacientes para 24semanas de tratamiento con dosis de 200 y 300mg y 16semanas de seguimiento. Observaron una disminución de las exacerbaciones y una mejora del FEV1 a la semana12 que se mantuvo hasta la semana24, independientemente del valor basal de eosinófilos (categorizado ≥300 o <300células/μl).
El estudio aleatorizado en faseIII QUEST, a doble ciego y comparado con placebo, de Castro et al.100 comparó dos dosis de dupilumab (200 y 300mg) y placebo cada 2semanas a lo largo de las 52semanas del estudio. Con este trabajo, realizado en 1.902 pacientes a partir de 12años de edad y asma moderada-grave no controlada, se concluyó que el tratamiento disminuía significativamente las exacerbaciones en comparación con placebo, mejoró la función pulmonar y el control del asma. Los beneficios fueron mayores en los pacientes con mayor eosinofilia (≥300células/μl). El grupo con recuento entre 150 y 299eosinófilos por mililitro también presentó mejorías significativas con dupilumab respecto a los que recibieron placebo. La función pulmonar y el control del asma mejoraron a partir de la segunda semana y el beneficio se mantuvo a lo largo del seguimiento. El grupo con eosinófilos <150células/μl no mostró beneficios frente a placebo. Las variables exploratorias (FENO, valores basales de IgE, periostina, eotaxin-3 y TARC) también mostraron un mayor descenso en los pacientes tratados con dupilumab, comparado con los del grupo placebo.
Otro estudio reciente que apoya el uso del dupilumab en este contexto es VENTURE101. Es un ensayo aleatorizado y a doble ciego diseñado para demostrar que el uso del mAb disminuye el consumo de GCO, y tuvo resultado positivo al alcanzar este objetivo primario con disminución de las exacerbaciones graves y mejora del FEV1 en pacientes dependientes de GCO. Mejoraron más los que tenían valores más elevados de eosinófilos y FENO. De hecho, el recuento basal de eosinófilos y el resultado de FENO parecen ser los mejores marcadores de respuesta al fármaco102.
En cuanto a efectos adversos, cabe destacar que en VENTURE101 el 14% de los pacientes tratados con dupilumab presentaron eosinofilia (1% en el grupo placebo). De estos, el recuento fue superior a 3.000células/μl en un 13%, si bien no hubo repercusión clínica. En el estudio QUEST100 se registró eosinofilia en el 4,1% (54 pacientes) del grupo tratado frente al 0,6% (4 pacientes) en el grupo placebo. No obstante, únicamente 4 pacientes del grupo tratado con dupilumab presentaron sintomatología clínica100.
La EMA ha aprobado el uso del dupilumab en adultos y adolescentes (≥12años) como tratamiento de mantenimiento para asma grave tipo2 que no sea controlada con altas dosis de GCI acompañados de otro fármaco controlador y que curse con un alto recuento de eosinófilos y/o FENO.
Cambio de anticuerpo monoclonal en pacientes poco o no respondedores a un anticuerpo determinadoLa introducción de tratamientos biológicos en el campo del asma es sin duda reciente. En España se remonta al año 2006, cuando se comercializó omalizumab, y este fue el único anticuerpo disponible durante una década. Si bien esta situación ha favorecido notablemente el progreso en el conocimiento de la inmunología de la enfermedad, también ha favorecido el uso compasivo de omalizumab (situaciones fuera de ficha técnica), al tiempo que ha limitado las decisiones terapéuticas de los clínicos. Sin embargo, en 3años han aparecido 4 anticuerpos más que se disputan su indicación en un espacio común: el asma grave no controlada que conocemos como T2. En este documento hemos recogido la evidencia clínica de los estudios publicados y sugerido un árbol de decisión de cara a la elección del biológico adecuado (fig. 2). Sin embargo, en caso de no respuesta o respuesta insuficiente, aparecen también otras alternativas. Creemos que existe suficiente evidencia en la literatura13,79,88,103, así como experiencia clínica, para plantear un cambio de biológico en determinadas situaciones entendiendo que, aunque la indicación inicial fuera acertada, la respuesta al tratamiento no es nunca del 100%. Es de esperar, pues, que aparezcan progresivamente nuevos estudios que amplíen nuestros conocimientos sobre el cambio de tratamiento entre diferentes biológicos.
Las recomendaciones elaboradas en relación con el tratamiento del paciente con asma grave con monoclonales son:
- –
Se debe realizar una valoración objetiva del cumplimiento terapéutico antes de iniciar un tratamiento con anticuerpos monoclonales. (Opinión de experto.)
- –
Los resultados obtenidos con omalizumab, mepolizumab, reslizumab, benralizumab y dupilumab son similares, si bien las poblaciones estudiadas no son exactamente superponibles.
- –
En los asmáticos graves no controlados sensibilizados a un alérgeno estacional (con clínica estacional o persistente) el omalizumab podría ser una alternativa (indicación: uso compasivo). (Opinión de experto +literatura104.)
- –
En la mayoría de los pacientes con AGNC de fenotipo alérgico el omalizumab es la primera opción de tratamiento, independientemente de la concentración de eosinófilos2,57-59,105.
- –
En AGNC de fenotipo eosinofílico de inicio tardío están indicados los fármacos anti-IL-5 como primera opción2,76,85.
- –
En los pacientes que no responden adecuadamente a un primer mAb se debe valorar el cambio a otro, considerando las evidencias en cuanto a efectividad y seguridad de cada uno en este contexto para cada paciente en concreto.
- –
En asmáticos graves no controlados alérgicos con recuentos de eosinófilos entre 300 y 400células/μl en los que ha fracasado el omalizumab, los anti-IL-5 son una alternativa válida2.
- –
En los asmáticos graves no controlados eosinofílicos no alérgicos con IgE superior a 30UI/ml en los que han fracasado los anti-IL-5, el omalizumab podría ser una alternativa (indicación: uso compasivo). (Opinión de experto +literatura106-108.)
- –
La decisión última de la elección de un monoclonal concreto para un paciente corresponde exclusivamente a los especialistas (neumólogos o alergólogos) responsables de este. Esto no es óbice para que existan comisiones en las que participen además otros profesionales que evalúen los tratamientos con criterios de eficiencia.
Junto con el tratamiento farmacológico debemos tener en cuenta las estrategias de control ambiental para mejorar el control de los síntomas y/o reducir el riesgo futuro. Las medidas documentadas incluyen:
Evitar el tabaquismo activo y pasivoLos asmáticos fumadores presentan síntomas más graves, una peor respuesta a los glucocorticoides y una pérdida acelerada de la función pulmonar, por lo que a menudo es necesario incrementar su escalón terapéutico. Además, el consumo de tabaco se relaciona con el desarrollo de asma tanto en adultos como en adolescentes, siendo por tanto el primer objetivo del control ambiental conseguir que el paciente abandone el tabaquismo. Para ello se le debe informar sobre los métodos adecuados para conseguir la deshabituación. Además, la exposición pasiva al humo de tabaco empeora el curso del asma y es un factor de riesgo para desarrollar esta enfermedad en la infancia, por lo que se recomienda al paciente, o a los cuidadores de niños con asma, que las zonas donde van a permanecer (habitaciones, coche, etc.) permanezcan libres de humo1,2. Con relación al uso de cigarrillos electrónicos u otros dispositivos de inhalación, no hay evidencia de que estos dispositivos sean más seguros que el tabaco a largo plazo, por lo que no se debe respaldar su uso como una ayuda para dejar de fumar109. Además, recientemente se ha relacionado la exposición pasiva al humo de los dispositivos electrónicos que liberan nicotina con un aumento de los síntomas de asma en pacientes jóvenes además de un aumento de las agudizaciones110. Por ello, los clínicos deberíamos plantearnos incluir la exposición pasiva a estos dispositivos en la entrevista clínica y en las medidas de evitación.
La recomendación elaborada con relación a esto es:
- –
Los pacientes con asma deben evitar la exposición pasiva al cigarrillo electrónico y otros dispositivos de inhalación. (Opinión de experto.)
Hay que considerar que la polución atmosférica, tanto en el interior de viviendas y edificios como en el exterior, conlleva un aumento del riesgo de exacerbaciones. Un metaanálisis de 2017 reveló la asociación de un gran número de contaminantes ambientales, incluyendo partículas sólidas (PM2,5) y compuestos gaseosos (dióxido de nitrógeno, monóxido de carbono y ozono) con las exacerbaciones de asma111. Aparte del humo del tabaco en los hogares en los que se consume, otros agentes contaminantes frecuentes en interiores son el dióxido de nitrógeno, el monóxido de carbono y los compuestos orgánicos volátiles, algunos asociados al humo por combustión de biomasa (p.ej., chimeneas)112. Se suman a esto los alérgenos procedentes de mascotas, mohos y ácaros, que pueden influir en la calidad del aire de los entornos cerrados y se tratan más adelante. Se puede reducir la exposición a algunos de estos compuestos, como los procedentes de combustión de biomasa en entornos domésticos, residenciales, escolares y profesionales. Sin embargo, la presencia de muchas de estas sustancias en el aire solo puede abordarse mediante políticas medioambientales.
Antiinflamatorios no esteroideosEstos fármacos no están contraindicados de forma generalizada en los asmáticos, pero antes de prescribirlos se debe preguntar al paciente por su uso y los efectos secundarios previos1. Sin embargo, los sujetos con EREA, caracterizada por intolerancia a la aspirina, asma y pólipos nasales, evitarán tratamientos analgésicos o antiinflamatorios con fármacos de la clase terapéutica AINE que inhiben la COX-1, ya que muchas de estas reacciones son graves o incluso mortales. Estos pacientes podrán recibir paracetamol. No obstante, no se excederán dosis superiores a 650mg, pues podrían presentar también reacciones adversas. Si se precisa mayor poder analgésico, podrá utilizarse tramadol, opiáceos y AINE inhibidores selectivos de la COX-2 (celecoxib, etoricoxib), estos últimos siempre tras comprobar su tolerancia1.
AlérgenosEn el asma alérgica se deben considerar recomendaciones específicas, una vez que se hayan confirmado las sensibilizaciones a los distintos alérgenos en cada paciente. Las medidas más eficaces son las que permiten disminuir drásticamente los niveles de exposición, como son las que se pueden aplicar en muchos casos de asma ocupacional (cambio de puesto de trabajo) o asma por epitelios (retirar los animales del domicilio), por cucaracha (uso juicioso de plaguicidas) o por hongos aerógenos (reducir mohos en el domicilio). Las medidas individuales aisladas, como por ejemplo el uso de fundas de colchón o el de acaricidas, no son efectivas, ni siquiera en la reducción de los niveles de exposición. Por otro lado, la aplicación de intervenciones específicas combinadas ha proporcionado una reducción significativa del grado de exposición alergénica y, en consecuencia, mayor eficacia clínica. Así, dos revisiones sistemáticas con metaanálisis concluyeron que la eficacia de las medidas aisladas de control ambiental frente a ácaros es escasa en los pacientes con rinitis y nula en el asma. Sin embargo, una revisión sistemática posterior sobre el efecto de medidas combinadas mostró resultados favorables1.
Vacunación antigripalLa vacunación antigripal no ha demostrado la reducción del número o la gravedad de las agudizaciones en los asmáticos113. Sin embargo, debido a que es una estrategia coste-efectiva, al elevado riesgo de complicaciones en pacientes con procesos crónicos y a un mayor riesgo de fracaso terapéutico en niños114, debería ser considerada en pacientes con asma moderada o grave, tanto adultos como niños1,2.
Vacunación antineumocócicaLos pacientes con asma, especialmente los niños y ancianos, tienen un mayor riesgo de padecer enfermedad neumocócica invasiva. Además, deberíamos tener en cuenta que los pacientes con asma pueden presentar menor respuesta humoral frente a la vacunación antineumocócica 23-valente115. Sin embargo, a pesar de que no existe suficiente evidencia, diversos documentos de consenso de expertos116 y el Sistema Nacional de Salud recomiendan la administración de la vacuna antineumocócica en pacientes con asma grave1.
Las recomendaciones elaboradas en relación con las medidas preventivas en asma son las siguientes:
- –
Se recomienda el abandono del tabaquismo (incluido el pasivo) en los pacientes asmáticos1,2.
- –
Los pacientes con EREA evitarán el tratamiento con cualquiera de los fármacos de la clase terapéutica AINE y los inhibidores de la COX-11.
- –
Se debe informar sobre los beneficios potenciales de la vacunación antineumocócica a los pacientes con asma grave. (Opinión de experto +literatura116.)
FJAG ha recibido honorarios por labores de asesoría, impartir conferencias o ayudas para asistir a congresos y reuniones científicas por parte de ALK-Abelló, AstraZeneca, Bial, Boehringer-Ingelheim, Chiesi, GSK, Menarini, Mundipharma, Novartis, Orion Pharma y TEVA.
MBA ha recibido honorarios por impartir conferencias, cursos, participar en monografías y normativas o asesoramiento científico de AstraZeneca, Esteve, GSK, Menarini, Novartis y TEVA.
VP ha recibido honorarios por participar como orador en reuniones patrocinadas por AstraZeneca, Chiesi y Novartis; y como consultor de ALK, AstraZeneca, Bial, Boehringer, Mundipharma y Sanofi. Recibió ayudas económicas para la asistencia a congresos por parte de AZ y Chiesi. Recibió subvenciones para proyectos de investigación provenientes de AZ, Chiesi y Menarini.
CC recibió honorarios como conferenciante para AstraZeneca, GSK, TEVA, Menarini, Mundipharma y Novartis. Recibió ayuda para viajes a reuniones científicas de Chiesi, TEVA, Menarini, Novartis y Mundipharma. Ha actuado como consultora para ALK, AstraZeneca, Mundipharma, TEVA, GSK y Novartis.
JLGR ha recibido honorarios como conferenciante de Novartis, GSK, Boehringer-Ingelheim, AstraZeneca, Chiesi, ALK, Teva, Menarini, Rovi, Esteve y Pfizer; y ha actuado como consultor para Novartis, GSK, AstraZeneca, Teva, Boehringer-Ingelheim, ALK y Esteve.
AP ha recibido remuneración económica por participación en ponencias científicas y/o en asesoramiento científico y/o para la asistencia a congresos de las siguientes compañías: ALK-Abelló, AstraZeneca, Boehringer, Chiesi, Griphols, GSK, Menarini, Mundipharma, Novartis, Orion, Pfizer, Praxis, Teva, Zambon.
LPdLL ha recibido subvenciones o apoyos para investigación de TEVA, AstraZeneca, Chiesi. Ha participado como conferenciante para Novartis, TEVA, Boehringer-Ingelheim, Chiesi, Sanofi, Menarini, Zambon, Mundipharma, Esteve, Rovi, AstraZeneca y BIAL; como consultor para Novartis, TEVA, Boehringer-Ingelheim, Chiesi, Sandoz, Mundipharma, AstraZeneca y GSK; y ha recibido apoyo no financiero de Novartis, TEVA, Boehringer-Ingelheim, Chiesi, Menarini, Zambon, Mundipharma, Gebro, AstraZeneca y GSK.
MP declara que no tiene potenciales conflictos de intereses.
GSC ha recibido honorarios como conferenciante en reuniones patrocinadas por AstraZeneca, Boehringer, Novartis y como consultor de AstraZeneca, GSK, Chiesi, Novartis, Rovi y Bial. Recibió ayudas económicas para la asistencia a congresos por parte de Boehringer, Menarini y Novartis, y recibió ayudas para proyectos de investigación provenientes de Novartis, Boehringer y GSK.
Los autores agradecen el soporte técnico y metodológico prestado por GOC Networking durante el proceso de redacción del documento inicial y el soporte y colaboración de Medical Statistics Consulting (MSC) en el proceso de actualización de las recomendaciones, así como la colaboración de la Dra. Blanca Piedrafita (MSC) en la coordinación y edición del manuscrito actualizado. Los autores de este manuscrito no han recibido aportación económica. El soporte técnico y metodológico ha sido financiado por SEPAR a través de los fondos del Foro Autonómico del Asma.
Carlos Almonacid Sánchez SEPAR
Rubén Andújar Espinosa SOMUPAR
M. Teresa Antolín García SOCALPAR
Ebymar Arismendi SOCAP
Aurelio Arnedillo Muñoz NEUMOSUR
Enric Barbeta SOCAP
Irina Bobolea SEPAR
Ana Boldova Loscertales SADAR-PNEUMARAGON
Carlos Bujalance Cabrera SOCAMPAR
Francisco Javier Callejas González SOCAMPAR
Concepción Cañete Ramos SEPAR
José Ángel Carretero Gracia SEPAR
Francisco Casas Maldonado NEUMOSUR
Manuel Castilla Martínez SOMUPAR
José Antonio Castillo Vizuete SEPAR
Pilar Cebollero Rivas SVNPAR
Astrid Crespo Lessmann SEPAR
Alfredo de Diego Damiá SEPAR
Ana Isabel Enríquez Rodríguez ASTURPAR
Luis Manuel Entrenas Costa NEUMOSUR
Ana Fernández Tena SEPAR
Cleofé Fernández Aracil SVNEUMO
Marta María García Clemente ASTURPAR
Rocío García García SEPAR
Raúl Godoy SOCAMPAR
Ana Gómez-Bastero Fernández SEPAR
M. Teresa Gómez Vizcaíno SEAR
José Antonio Gullón Blanco ASTURPAR
Francisco Javier González Barcala SOGAPAR
Luis Hernández Blasco SVNEUMO
Javier Hueto SEPAR
Nieves Hurtado de Mendoza Rubio SVNPAR
Hemily K. Izaguirre Flores NEUMOCAN
Carlos Jiménez-Ruiz SEPAR
Alberto Levy Naón NEUMOSUR
Antolín López Viña SEPAR
Pedro J. Marcos SOGAPAR
Carlos Martínez Rivera SEPAR
Eva Martínez Moragón SVNEUMO
Juan F. Medina Gallardo SEPAR
Carlos Melero Moreno SEPAR
Francisco Javier Michel de la Rosa SVNPAR
Xavier Muñoz SOCAP
Abel Pallarés Sanmartín SOGAPAR
Gerardo Pérez Chica SEPAR
César Picado SEPAR
Ana Pueyo Bastida SOCALPAR
Jacinto Ramos González SOCALPAR
M. Jesús Rodríguez Nieto SEPAR
Berta Román Bernal NEUMOCAN
Auxiliadora Romero Falcón SEPAR
Pedro J. Romero Palacios SEPAR
Silvia Sánchez Cuéllar NEUMOMADRID
Fernando Sánchez-Toril López SEPAR
Antonio Sebastián Ariño SADAR-PNEUMARAGON
Joan Serra Batlles SOCAP
José Serrano Pariente AIRE
Ana Sogo Sagardía SEPAR
Manuel Agustín Sojo Gonzalez SEAR
Andrea Trisán Alonso SEPAR
Isabel Urrutia SVNPAR
Elisabet Vera Solsona SADAR-PNEUMOARAGON