El asma grave constituye un síndrome heterogéneo con diversas variantes clínicas, y representa en muchas ocasiones una enfermedad compleja con necesidad de un abordaje especializado y multidisciplinar, así como la utilización de múltiples fármacos. La prevalencia del asma grave varía de un país a otro, y se estima que el 50% de estos pacientes graves tienen un mal control de su enfermedad. Para el mejor manejo del paciente es necesario un correcto diagnóstico, un seguimiento adecuado y sin duda ofrecerle el mejor tratamiento disponible, incluyendo los tratamientos biológicos con anticuerpos monoclonales. Con este afán nació este proceso de consenso que se inició en su primera versión en el año 2018, cuya finalidad última es ofrecer al paciente el mejor manejo posible de su enfermedad para así minimizar su sintomatología. Para esta actualización del consenso 2020, se realizó por parte de los autores una revisión de la literatura. Posteriormente a través de un proceso interactivo tipo Delphi a 2 rondas un panel amplio de expertos en asma de SEPAR y las sociedades autonómicas de neumología propusieron las recomendaciones y las conclusiones que se recogen en el documento.
Severe asthma is a heterogeneous syndrome with several clinical variants and often represents a complex disease requiring a specialized and multidisciplinary approach, as well as the use of multiple drugs. The prevalence of severe asthma varies from one country to another, and it is estimated that 50% of these patients present a poor control of their disease. For the best management of the patient, it is necessary a correct diagnosis, an adequate follow-up and undoubtedly to offer the best available treatment, including biologic treatments with monoclonal antibodies. With this objective, this consensus process was born, which began in its first version in 2018, whose goal is to offer the patient the best possible management of their disease in order to minimize their symptomatology. For this 2020 consensus update, a literature review was conducted by the authors. Subsequently, through a two-round interactive Delphi process, a broad panel of asthma experts from SEPAR and the regional pulmonology societies proposed the recommendations and conclusions contained in this document.
Para la versión de este consenso 2022, basado en los previamente publicados en 2018 y 20201 se constituyó un comité coordinador (CC), compuesto por 4 expertos, que supervisó la calidad y la idoneidad de los procesos, y la metodología de consenso, así como la identificación del marco temático de los contenidos a validar. Se constituyó también un grupo elaborador de las recomendaciones (GER), con 11 expertos, cuya principal función fue revisar y sintetizar la evidencia disponible hasta finales de 2017 y formular conclusiones y recomendaciones. Para validar la evidencia, las conclusiones y las recomendaciones formuladas, se constituyó un grupo validador de las recomendaciones (GVR), formado por 78 expertos de diferentes sociedades autonómicas.
Para esta actualización del consenso 2020 previamente publicado, se realizó una revisión de la literatura recopilada desde abril de 2019 hasta julio de 2021. Posteriormente el GER realizó una lectura crítica de las publicaciones anteriormente seleccionadas y extrajo la evidencia pertinente. A partir de esa evidencia se formularon unos enunciados que respondían a las preguntas formuladas anteriormente.
El CC, el GER y el GVR a través de un proceso interactivo tipo Delphi a 2 rondas valoraron las conclusiones y las recomendaciones de manera telemática. Para ello, en un cuestionario online expresaron su nivel de acuerdo en una escala Likert de 1 a 9 (1: muy en desacuerdo; 9: muy de acuerdo). Se utilizó la metodología Rand/UCLA para el análisis del consenso en paneles Delphi2. Cada ítem del cuestionario queda clasificado en Apropiado (mediana del panel en el rango de 7 a 9), Incierto (mediana del panel en el rango de 4 a 6 o cualquier mediana en desacuerdo) o Inapropiado (mediana del panel en el rango de 1 a 3) en función de la puntuación mediana del panel y el grado de acuerdo mostrado por los panelistas. El acuerdo se logró si al menos un tercio de la muestra respondió dentro del mismo rango de puntuación que la mediana, desacuerdo si la puntuación mediana cayó en cualquiera de los 2 extremos y más de un tercio de la muestra respondió en el intervalo extremo opuesto, o si la mediana cayó en el intervalo central, y al menos un tercio de la muestra respondió en uno de los otros dos intervalos, y «neutral» si no cumplía alguno de los criterios anteriores2. Aquellos enunciados que no alcanzaron el grado de acuerdo, tras la valoración de los comentarios ofrecidos por los panelistas, los coordinadores valoraron realizar cambios en los enunciados. Un total de 36 (84%) de los 43 enunciados fueron validados por el panel de expertos.
Diagnóstico del asma graveDefiniciónEl asma grave (AG) es aquella que requiere múltiples fármacos y en altas dosis para mantener el control (escalones 5 y 6 de la Guía Española para el Manejo del Asma [GEMA]3 y 5 de la Global Initiative for Asthma [GINA]4), o aquella que permanece mal controlada a pesar de estos escalones de tratamiento. Mientras que en muchos pacientes el mal control se debe a un inadecuado cumplimiento terapéutico, o a comorbilidades tales como la rinosinusitis o la obesidad, la European Respiratory Society/American Thoracic Society Task Force on Severe Asthma5 considera que la definición de AG es, una vez confirmado el diagnóstico y abordadas las comorbilidades, el asma que requiere altas dosis de glucocorticoides inhalados (GCI)[…] además de un segundo tratamiento controlador (y/o glucocorticoides sistémicos [GCS]) para evitar su «descontrol», o que permanece «no controlada» a pesar de esta estrategia terapéutica.
El AG incluye tanto a pacientes controlados como no controlados6.
La gravedad del asma se evalúa retrospectivamente partiendo del nivel de tratamiento requerido para controlar los síntomas y las agudizaciones. La gravedad del asma no es una característica estática, sino que puede cambiar a lo largo de los meses o años6.
Según el grupo de panelistas«Se define asma grave no controlado (AGNC) cuando la enfermedad persiste mal controlada pese a recibir tratamiento en el último año con una combinación de glucocorticoides inhalados a dosis elevada/β2 agonistas de acción prolongada (GCI/LABA) y anticolinérgicos de acción prolongada (LAMA) o requiera GCS de mantenimiento (tratamiento con duración de 6 meses al año independientemente de la dosis, o dosis acumulada >1g de prednisona o equivalente, independientemente de la duración).»
EpidemiologíaLa prevalencia del AG entre los pacientes asmáticos varía de un país a otro (18% en la Europa occidental, 19% en los EE. UU. y 32% en la Europa Central)7. En un estudio reciente realizado en Suecia la prevalencia de AG en la población general fue del 1,1 y del 9,5% de todos los asmáticos8. Se estima que un 50% de estos pacientes graves tienen un mal control de su enfermedad7. En términos globales, la prevalencia de AG se ha estimado que corresponde al 5-10% de la población total asmática. En un estudio realizado en Holanda, se constató una prevalencia del 3,6%9. Un estudio realizado en España en 2011 en unidades hospitalarias de neumología y alergología comunicó una prevalencia del AGNC, según criterio médico de un 3,9% sobre el total de asmáticos. Sin embargo, esta cifra era mayor si se aplicaban criterios de control de la GINA10. Otro reciente estudio español con análisis de big data, arrojó una prevalencia de AGNC del 4,9% de todos los asmáticos11.
Estos pacientes originan más de la mitad del gasto total en asma. Para el AG (población adulta), el coste sanitario incremental anual del asma en España, considerando los costes directos respecto a no asmáticos, fue de 11.703€, y el coste no sanitario incremental (costes indirectos) fue de 3.461€12.
Abordaje diagnóstico estructurado/escalonadoEl diagnóstico de AG debe realizarse en unidades o centros especializados en asma, mediante un abordaje multidisciplinar3–5, que se llevará a cabo de forma secuencial, en una serie de visitas de seguimiento, durante un tiempo no inferior a 6 meses. Dicho abordaje ha demostrado buenos resultados clínicos y ser coste-efectivo13–15.
En un primer paso, se debe intentar confirmar el diagnóstico de asma de manera objetiva mediante las pruebas complementarias establecidas o recomendadas en las guías y consensos internacionales. Estas pruebas irán encaminadas a intentar demostrar preferentemente la existencia de variabilidad de los flujos espiratorios (tabla 1)4. Dado que lo habitual es que los pacientes4 cuando son remitidos ya estén realizando tratamiento con GCI, se han propuesto algoritmos de abordaje con desescalada de dosis controlada para confirmar dicho diagnóstico4,16. Si no se logra confirmar, se descartará la existencia de otra posible enfermedad que pueda simular asma mediante un adecuado diagnóstico diferencial (tabla 2)3,4,17.
Pruebas complementarias establecidas o recomendadas en las guías y consensos internacionales para el diagnóstico del AG
| Característica | Consideraciones, definiciones y criterios |
|---|---|
| Demostrar variabilidad excesiva en la función pulmonar (una o más de las siguientes pruebas) y documentar obstrucción al flujo aéreo. | Cuanto mayor sean las variaciones, o más veces se observen, más fiable será el diagnóstico.Al menos una vez durante el proceso diagnóstico, ante un FEV1 bajo, confirmar que existe obstrucción (FEV1/FVC reducido). |
| PBD positiva (más probable demostrarla si se suspende medicación BD antes: SABA, SAMA mín. 6h/LABA 12 o 24h según LABA, LAMA 36-48h). | Adultos: aumento en FEV1 de ≥12% y ≥200ml respecto al basal, 10-15min tras 200-400μg salbutamol o equivalente (mayor fiabilidad si es ≥15% y ≥400 ml). |
| Variabilidad excesiva en el PEF domiciliario (mañana-noche) durante 2 semanas. | Adultos: variabilidad >20% en >3 días de una semana en un registro de 2 semanas. |
| Aumento significativo de la función pulmonar tras 4 semanas de tratamiento (GCO o GCI a dosis altas). | Adultos: aumento en el FEV1≥12% y ≥200ml (o una variación diurna circadiana de PEF≥20%). respecto al basal tras 4 semanas de tratamiento, en ausencia de infección respiratoria. |
| Prueba de ejercicio positiva. | Adultos: caída en el FEV1 de ≥10% respecto al basal. |
| Test de provocación positivo (en adultos). | Caída en el FEV1 respecto al basal de ≥20% (con metacolina o histamina) o ≥15% (con hiperventilación isocápnica, salino hipertónico o manitol). |
| Variación excesiva en la función pulmonar entre visitas (menor fiabilidad). | Adultos: variación en el FEV1 de ≥12% y ≥200ml entre visitas, en ausencia de infección respiratoria. |
BD: broncodilatador; FEV1: volumen espiratorio forzado en el primer segundo; GCI: glucocorticoides inhalados; GCO: glucocorticoides orales; LABA: agonista β2 de acción prolongada; LAMA: agonista de acción prolongada; PBD: prueba broncodilatadora; PEF: pico flujo espiratorio (mejor de 3 intentos); SABA: agonista β2 de acción corta; SAMA: agonista muscarínico de acción corta.
Fuente: Global Initiative for Asthma4.
Diagnóstico diferencial
| Diagnóstico diferencial/seudoasmas | Síntomas/clínica | Pruebas diagnósticas |
|---|---|---|
| Enfermedad orgánica vía superiorColapso dinámico de la vía aérea-traqueomalacia | Disnea que no responde al tratamiento broncodilatador | Espirometría con asa inspiratoriaTC en inspiración/espiración de vía superiorFibrobroncoscopia |
| Tumores de la vía aérea | Estridor, hemoptisis, infecciones de repetición, síntomas dependiendo de localización | Broncoscopia, TC |
| Aspiración de cuerpo extraño | Si cuerpo extraño se encuentra en la vía aérea periférica aparecerá una sibilancia unilateral localizada o un colapso del tejido pulmonar distal | La Rx de tórax, TC o la fibrobroncoscopia mostrarán el cuerpo extraño |
| Obstrucción laríngea inducible (OLI) | Disnea con sibilantes inspiratorios/estridor | Laringoscopia/videoestroboscopia durante la crisis o tras provocación con metacolina o tras ergometría |
| Anillo vascular | Son comunes las sibilancias, la falta de aire y el estridor ocasional | TC tórax con contraste |
| Rinosinusitis crónica | Puede presentarse con tos y disnea nocturna por el goteo nasal posterior. Puede coexistir con el asma | Rinoscopia anterior o endoscopia nasalTC de senos puede mostrar opacidades de los senos, engrosamiento de mucosas, niveles hidroaéreos o anormalidades anatómicas |
| EPOC (enfisema) | Tos productiva/disnea de esfuerzo/exposición a tóxicos-humo de tabaco | TC de tóraxPletismografía y difusión |
| Déficit de A1AT | Sibilancias persistentes a pesar del tratamiento.Antecedentes familiares de problemas respiratorios | Niveles de A1AT. Genotipado A1AT |
| Bronquiolitis obliterante | Disnea de esfuerzo/tos seca/obstrucción no reversible | TC de tórax en inspiración/espiraciónPletismografía/atrapamiento aéreoBiopsia transbronquial/pulmonar |
| Disneas funcionales/síndrome de hiperventilación | Disnea suspirosa/mareo/parestesias | Cuestionario de hiperventilación (Nijmegen)Valoración psicológica |
| Insuficiencia cardiaca izquierda | Disnea de esfuerzo/síntomas nocturnos/edemas en MMII | TC de tóraxElectrocardiograma/ecocardiograma |
| BronquiectasiasFibrosis quísticaABPA | Tos productiva/infecciones de repetición | TC de tóraxTest del sudor/estudio genéticoIgE total y específica a Aspergillus/precipitinas |
| GEPAEosinofilias pulmonares | Infiltrados pulmonares transitorios/hipereosinofilia en sangre/síntomas sistémicos | ANCAp/biopsia de órgano(s) afectado(s)Fibrobroncoscopia (con lavado broncoalveolar) |
| Inmunodeficiencia común variable | Historia de infecciones repetidas de vías respiratorias altas y bajas | Niveles de IgG<500mg/dl |
| Embolismo pulmonar | Gran variedad de presentaciones. Lo más común es la falta de aire y el dolor pleurítico | Estratificación del riesgo, Dímero-DConfirmación por angio-TC. Cuando no es posible la gammagrafía de V/Q es una alternativa, aunque menos sensible |
ABPA: aspergilosis broncopulmonar aérea; ANCA: anticuerpos anti-citoplasma de neutrófilos; A1AT: α-1 antitripsina; EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado en el primer segundo; FQ: fibrosis quística; GEPA: granulomatosis eosinofílica con poliangeítis; HTA, hipertensión arterial; Ig: inmunoglobulina; TC: tomografía computarizada; TLC: capacidad pulmonar total; RV: volumen residual; Rx: radiografía; V/Q: ventilación/perfusión.
Fuente: Cheung Wong y Farne16.
En un segundo paso, se evaluarán los factores que contribuyan a un mal control del asma y las posibles enfermedades asociadas o comorbilidades5,18 debiéndose:
- •
Evaluar el cumplimiento del tratamiento prescrito de la forma más objetiva posible. En la actualidad se dispone de comprobación de dispensación en farmacia (receta electrónica) y del test de adhesión a inhaladores (TAI)19,20.
- •
Comprobar que se realiza correctamente la técnica inhalatoria con su dispositivo o, en su defecto, encontrar otro más adecuado.
- •
Identificar los posibles factores agravantes y/o desencadenantes de las exacerbaciones (exposición a alérgenos ambientales y ocupacionales, medicación broncoconstrictora, ácido acetilsalicílico [AAS] u otros antiinflamatorios no esteroideos [AINE], exposición a tóxicos o contaminantes, agentes infecciosos, tabaco, etc.).
- •
Identificar y tratar las enfermedades concomitantes y comorbilidades que puedan estar contribuyendo a un control inadecuado del asma. Las más habituales son enfermedad rinosinusal (con o sin poliposis asociada), reflujo gastroesofágico, obesidad, síndrome de apnea del sueño, obstrucción laríngea inducible, alteraciones psicopatológicas y/o disnea funcional. Para comprobar todas ellas, se realizarán las pruebas complementarias pertinentes3.
Por último, en un tercer paso, se intentará identificar el subtipo o fenotipo de asma con el fin de realizar un tratamiento individualizado y optimizado21. Para ello pueden ser de ayuda marcadores clínicos, biológicos y de función pulmonar. Varios estudios están evaluando marcadores de actividad biológica para seleccionar aquellos que identifiquen subtipos de enfermedades y sean capaces de predecir la progresión de la enfermedad22.
De esta manera, según el panel de expertos:- •
El diagnóstico de AGNC precisa llevar a cabo una evaluación sistematizada por pasos que asegure no dejar a un lado aspectos relevantes. Esta valoración se debería realizar en unidades de asma acreditadas o de referencia, por profesionales con experiencia clínica contrastada en el manejo de este tipo de pacientes y mediante visitas de seguimiento durante un tiempo en un plazo temporal adaptado a cada caso.
- •
Ante la ausencia de confirmación diagnóstica, se descartará la existencia de otra posible enfermedad simuladora de asma.
Todas las enfermedades complejas son heterogéneas y el asma no es una excepción. En el caso del AG, en base al mecanismo patogénico subyacente, consideramos el asma T2 alto (alérgico y/o eosinofílico) y el asma T2 bajo. Esta categorización considera la presencia o ausencia de ciertos marcadores inflamatorios, la historia natural y determinadas peculiaridades clínicas3. Actualmente GINA4 identifica la inflamación de tipo 2 (T2) cuando el asma está clínicamente inducida por alérgenos, y/o se demuestra una cifra de eosinófilos (Eos) en sangre ≥150/μl, y/o fracción de óxido nítrico exhalado (FENO) ≥20ppb, y/o Eos en esputo ≥2%, mientras se realiza tratamiento con GCS o GCI a dosis alta21. En base a estos conceptos consideramos 3 grandes fenotipos en el AG:
Asma alérgica grave. Supone un 40-50% del AG y posee una base atópica clara, guiada por la activación de las células T colaboradoras tipo 2, la producción de interleucina (IL) 4, IL-5 e IL-13 y el cambio de isotipo en los linfocitos B hacia la producción de IgE18. Se caracteriza por ser de comienzo precoz, tener pruebas alérgicas positivas (cutáneas o en suero) con concordancia clínica, rinitis alérgica, valores de IgE>100IU/ml, eosinofilia, FENO entre 30-50ppb y periostina sérica elevada3,18. En ocasiones el patrón inflamatorio además de eosinofílico puede ser neutrofílico, mixto o paucigranulocítico18.
Asma eosinofílica de inicio tardío. Se estima que algo más del 25% de los casos de AG pertenecen a este fenotipo y en su génesis está implicada una producción elevada de IL-53,18,23. Por lo general se manifiesta después de los 20 años o algo más tarde y no es extraño que venga precedida de infección del tracto respiratorio superior o inferior, e incluso de sinusitis crónica y poliposis nasal. Un subgrupo de ellos desarrolla adicionalmente enfermedad respiratoria exacerbada por ácido acetilsalicílico y antiinflamatorios no esteroideos (EREA), expresando alteraciones en el metabolismo del ácido araquidónico3,18. Los pacientes tienen pruebas alérgicas negativas (o positivas, pero sin concordancia clínica), IgE baja, y eosinofilia (≥300Eos/μl en sangre o >3% en esputo)3.
AG T2 bajo. Está presente en más de un tercio de los pacientes con AG. La patobiología de dicho fenotipo está orquestada por citocinas T2 bajo (IL-1ß, IL-6, IL-8, IL-17A/F, IFN-γ y TNF-α) y la existencia de anomalías estructurales del músculo liso de la vía aérea y activación neuronal errática en la pared bronquial24. Cursa sin eosinofilia (ni en sangre periférica, ni en esputo), y muestra un perfil paucigranulocítico o neutrofílico, con niveles bajos de FENO y una pobre respuesta a los glucocorticoides3,18. Tiende a acompañarse de limitación crónica del flujo aéreo con importante atrapamiento y, frecuentemente, tiene antecedentes de tabaquismo18. El rasgo neutrofílico puede deberse a enfermedad concomitante, la pervivencia de inflamación residual ligada a la reducción de los Eos tras tratamientos glucocorticoideos prolongados o al efecto inhibidor de éstos sobre la apoptosis de los neutrófilos18. El mecanismo del perfil paucigranulocítico está todavía por definir con exactitud.
Según algunos estudios puede haber importantes variaciones en los fenotipos a lo largo del tiempo. Así en el estudio de Kupczyk et al. se describe una variación de fenotipo en el AG en un año del 30% de pacientes cuando se consideran parámetros fisiológicos y de más del 48% cuando se consideran biomarcadores25.
De esta manera, según el panel de expertos las recomendaciones sobre este tema son:
- •
La coexistencia de fenotipo alérgico y eosinofílico puede tener implicaciones terapéuticas.
- •
En un paciente con fenotipo alérgico y eosinofílico un inicio precoz de la enfermedad (<12 años) es un dato sugestivo de predominio alérgico.
- •
En un paciente con fenotipo alérgico y eosinofílico un inicio tardío de la enfermedad es un dato sugestivo de predominio eosinofílico.
- •
Para definir asma eosinofílica en un paciente que no toma glucocorticoides sistémicos, se puede considerar un recuento de Eos en sangre (actual o histórico) ≥300cél/μl en ≥2 determinaciones.
- •
Para considerar inflamación T2 en un paciente con glucocorticoides sistémicos puede considerarse un recuento de Eos en sangre ≥150cél/μl.
- •
Para considerarse inflamación T2 en un paciente con AG que realiza su tratamiento correctamente puede considerarse un punto de corte de FENO>25ppb.
- •
La obesidad es un subfenotipo a considerar en pacientes con asma T2 bajo.
El asma requiere asistencia médica periódica en todos los niveles de gravedad. Este principio general resulta, sin duda, de obligado cumplimiento con el AG. Es importante que el sistema de salud implemente estrategias para mejorar el seguimiento y evaluar a estos pacientes de acuerdo con las guías de práctica clínica (GPC)8. En las visitas de seguimiento se evaluará clínicamente al paciente y se le realizarán pruebas funcionales, analíticas u otras dirigidas a3,4,18:
- •
Conocer el momento actual del proceso y compararlo con las condiciones previas para determinar si hay mejoría, empeoramiento o estabilidad.
- •
Prevenir (en la medida de lo posible) los problemas que puedan presentarse.
- •
Realizar un control clínico de los síntomas.
- •
Evitar agudizaciones y limitaciones en la vida diaria.
- •
Evaluar la situación de las comorbilidades ya conocidas y descartar la existencia de nuevas patologías.
- •
Valorar la respuesta al tratamiento pautado comprobando su cumplimiento y el uso adecuado de los dispositivos de inhalación.
- •
Establecer un pronóstico.
- •
Planificar la atención terapéutica futura.
La consecución de buena parte de estos aspectos (objetivos) depende, en esencia, de la aplicación de indicadores que monitoricen la situación clínica, funcional y de control del paciente, su cumplimiento terapéutico y el pronóstico a medio plazo.
Indicadores de la situación del pacienteLa situación clínica del paciente se interpreta en términos de control de la enfermedad y dicho concepto difiere según la GPC que se esté utilizando (GINA o GEMA).
Para la GINA4, el concepto de control clínico es dual: control actual (definido por los síntomas) y riesgo futuro. La GINA recomienda estimar los síntomas mediante cuestionarios validados —el Asthma Control Questionnaire (ACQ), en sus diversas versiones, y el Asthma Control Test (ACT)—, que son útiles para reflejar cambios a lo largo del tiempo (algo fundamental para evaluar la eficacia de las intervenciones terapéuticas). Además, los resultados obtenidos con la aplicación de estas herramientas se relacionan muy estrechamente con los datos aportados por los instrumentos que miden la calidad de vida relacionada con la salud y que se consiguen con los diferentes cuestionarios de calidad de vida26. La GINA contempla el resultado de la espirometría como un factor de riesgo futuro (si hay obstrucción).
La GEMA mantiene la visión dual del concepto de control (control actual y riesgo futuro), aunque incluye el valor del volumen espiratorio forzado en el primer segundo (FEV1) como variable definitoria de control actual. Según la GEMA, un paciente asintomático con un valor de FEV1 bajo no estaría bien controlado, siempre y cuando revierta la obstrucción tras tratamiento esteroideo intenso, es decir, que no sea el suyo habitual (capítulo 8 de la GEMA). Para la GINA sí lo estaría, pero tendría un riesgo aumentado de exacerbaciones en el futuro18. La GEMA también recomienda el uso de cuestionarios validados (ACT y ACQ)3. Conviene recordar asimismo que los síntomas deben ser interpretados con precaución, ya que las diferentes comorbilidades que acompañan a la enfermedad pueden en ocasiones causar síntomas similares, así como tener presente la valoración de estos en pacientes hiper- o hipoperceptores.
Hoy por hoy, ninguna guía contempla la obligación de medir biomarcadores de inflamación para estimar este aspecto del seguimiento. La eosinofilia periférica es un biomarcador que ayuda a la indicación de algunos anticuerpos monoclonales (mAb) que tienen como diana terapéutica interleucinas (mepolizumab, reslizumab, benralizumab y dupilumab) o la IgE (omalizumab, disponible para el asma alérgica). En este sentido, cabe destacar también el valor de la FENO como marcador de respuesta T2 y su emergente papel en la selección del tratamiento con mAb27,28. En pacientes con AGNC, especialmente en aquellos que reciben glucocorticoides orales (GCO), hay baja correlación entre eosinofilia en sangre y esputo, y la persistencia de eosinofilia en el esputo puede reflejar respuesta insuficiente al tratamiento con un mAb29,30.
Indicadores de cumplimiento del tratamientoEl cumplimiento del tratamiento influye tanto en el control del asma como en el riesgo futuro. Se estima que el porcentaje medido de cumplimiento en asmáticos está entre el 30 y el 70%31. No obstante, la medición del cumplimiento es un problema, ya que los marcadores de incumplimiento son muy inexactos. La pregunta directa al paciente sobreestima su cumplimiento y cuestionarios no específicos para terapia inhalada, como la prueba de Morisky-Green, han quedado en desuso. En su lugar, el TAI, diseñado y validado por la Sociedad de Neumología y Cirugía Torácica (SEPAR), permite estimar el cumplimiento de la terapia inhalada en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) y con asma a la vez que categoriza el tipo de incumplimiento del paciente con el fin de dirigir actuaciones concretas para mejorar la adhesión19. Además, el TAI incluye 2 preguntas adicionales sobre la técnica inhalatoria para comprobar su idoneidad.
El recuento de la medicación tampoco es un método fiable, ya que muchos pacientes disparan el inhalador en el momento anterior a la consulta de revisión (dumpers). Sin embargo, la valoración indirecta de la adhesión al tratamiento mediante la revisión de la retirada del fármaco en la farmacia a través de la receta electrónica es un método válido y cada vez más extendido, aunque no siempre disponible. El uso combinado del TAI con la evaluación de la retirada del fármaco en la farmacia supone una herramienta más sensible para detectar la falta de adhesión que el empleo de un solo método20.
Recientemente se ha publicado un estudio en asma de control difícil que demuestra que la telemonitorización de los valores de FENO, y su supresión con dosis altas de GCI, puede ayudar a identificar a los incumplidores32. Por último, un método novedoso de valoración de la adhesión será la posibilidad de que en un futuro cercano muchos nuevos modelos de inhaladores estén provistos de un chip que podrá conectarse con aplicaciones de smartphone, y albergar los datos de cumplimiento para su posterior comprobación33. En este sentido ya existen experiencias positivas en vida real con un producto de LABA/LAMA/GCI formulado como polvo para inhalación en cápsulas duras, para ser administrado mediante un inhalador de polvo seco de una sola dosis. El inhalador del producto incluye un sensor digital opcional que se conecta a la base del inhalador y se utiliza con una app móvil basada en una web34,35. El sensor electrónico recoge datos sobre el uso del inhalador por parte de los pacientes y se pueden compartir con el médico del paciente34.
Los resultados intermedios sobre el compromiso del paciente y la adhesión con el uso del sensor digital se han presentado en el último congreso de la European Respiratory Society (ERS)36.
Indicadores para establecer el pronósticoEl pronóstico se establece estimando el riesgo futuro. Este comprende el mal control de los síntomas, el desarrollo de exacerbaciones, el establecimiento de una obstrucción bronquial fija o la pérdida de función pulmonar y los efectos adversos (EA) del tratamiento. Por lo tanto, los marcadores de riesgo futuro serán obtenidos a través de la historia clínica o el uso de cuestionarios, si bien también hay que tener en cuenta 2 particularidades: los marcadores de inflamación bronquial y la función pulmonar.
Un mal control de los síntomas de asma se asocia con mayor riesgo de exacerbaciones, de hospitalización y de uso de GCO37. Además, la presencia de obstrucción bronquial es un factor de riesgo independiente para sufrir exacerbaciones en el futuro, incluso si el ACT es ≥2038. La reversibilidad en la prueba broncodilatadora también ha sido reportada como factor que aumenta el riesgo de exacerbaciones39.
Por otra parte, aunque existen resultados contradictorios respecto la eosinofilia como biomarcador (valores superiores a 300cél/mm3) dependiendo del tipo de paciente estudiado, en general se ha indicado que su persistencia a pesar de un tratamiento correcto con GCI es un factor de riesgo futuro40, y la concordancia de eosinofilia periférica y local (en esputo) identifica al grupo con mayor riesgo de ataques de asma41. En lo referente a la FENO la evidencia es menos consistente, pero existen indicios que sugieren que pueda tener un papel en la predicción de exacerbaciones en algunos pacientes, especialmente en combinación con otros marcadores de respuesta T2 o con el número de exacerbaciones previas42. En cualquier caso, son necesarios más estudios para poder considerar a la FENO como un marcador pronóstico independiente en el momento actual.
Con respecto al desarrollo de obstrucción fija al flujo aéreo, un metaanálisis ha encontrado los siguientes factores de riesgo: sexo masculino, tabaquismo, valores elevados de FENO y la EREA43. De ellos, solo serían modificables el tabaquismo y la FENO, pero tratar a los pacientes en base a los valores de este biomarcador requiere más evidencias.
Marcadores de planificación del ajuste terapéuticoLa planificación del ajuste terapéutico se hará teniendo en cuenta el concepto dual de control de la enfermedad, atendiendo a la situación actual y al riesgo futuro. La medicación se ajustará al alza o a la baja de acuerdo con el grado de control del paciente, y siguiendo las recomendaciones de la GEMA3 o de la GINA4. Además, es importante actuar sobre los factores de riesgo futuro que sean modificables (tabaquismo, cumplimiento terapéutico, comorbilidad, etc.). Por lo tanto, a la hora de planificar la medicación, se deben tener en cuenta todos los datos recogidos previamente con los marcadores ya comentados, considerando el fenotipo clínico de asma en cada caso concreto y las peculiaridades de cada paciente. En la tabla 3 se recogen los marcadores que se recomiendan para el seguimiento. La generación de evidencia que respalda el uso de estos marcadores en ocasiones es escasa, inconsistente, o no lo suficientemente reciente. En el caso de la eosinofilia y la FENO, por ejemplo, con un metaanálisis reciente se observó que los pacientes cuyo ajuste del tratamiento del asma se basaba en el recuento de Eos en esputo presentaban una reducción significativa de la probabilidad de sufrir exacerbaciones (OR: 0,36; IC 95%: 0,21-0,62). La reducción también era significativa, aunque menor (OR adultos: 0,60; IC 95%: 0,43-0,84; OR niños: 0,58; IC 95%: 0,45-0,75) si la estrategia de ajuste se basaba en la medida de FENO. Sin embargo, no se observaron cambios con ninguna de estas estrategias en cuanto a la función pulmonar o los síntomas44. Por lo tanto, estos biomarcadores podrían resultar de utilidad con pacientes en los que el objetivo terapéutico sea reducir exacerbaciones.
Marcadores recomendados para el seguimiento de pacientes con AG
| ACT/ACQ |
| Número de exacerbacionesa |
| Dosis diaria de GCS de mantenimiento |
| FEV1 |
| Cumplimiento (TAI, e-receta) |
| FENO |
| Eosinofilia en sangre |
| IgEb |
ACT/ACQ: Asthma Control Test/Asthma Control Questionaire; AG: asma grave; FEV1: volumen espirado forzado en el primer segundo; FENO: fracción exhalada de NO; GCS: glucocorticoides sistémicos; IgE: inmunoglobulina E; TAI: test de adhesión a inhaladores.
Las guías son muy ambiguas en lo referente al periodo de tiempo que debe mediar entre visita y visita, y las pruebas a realizar obligatoriamente. Ello no debería sorprendernos, ya que es muy difícil agrupar bajo recomendaciones comunes toda la posible variedad de pacientes en lo referente a su gravedad, tratamiento y circunstancias personales. No obstante, la GEMA3 recomienda un control del paciente con periodicidad variable en función del grado de gravedad (anual en asma intermitente o persistente leve, semestral en asma persistente moderada, y trimestral en asma persistente grave). Asimismo, la GEMA3 indica una valoración clínica que incluye cuestionarios de control de síntomas, y la valoración de la función pulmonar con espirometría o PEF (cuando la espirometría no sea posible). Se asume que los efectos del tratamiento sobre los síntomas y FEV1 deberían ser evidentes a los 3 meses, y por ello se propone este periodo de tiempo para reevaluar la respuesta al tratamiento inhalado45. En el caso de pacientes tratados con mAbs, se postulan 4 meses para una primera valoración de respuesta clínica, funcional e inflamatoria46. Finalmente, para comprobar la eficacia en la reducción de exacerbaciones, es preciso alargar el horizonte temporal hasta 12 meses (fig. 1). En la actualidad están surgiendo herramientas que intentan evaluar la respuesta a los mAb en el AGNC, considerando los parámetros descritos en la tabla 4. En esta tabla queda recogida la escala multidimensional EXACTO47 (EXacerbaciones, ACT, CorticosTeroides sistémicos y Obstrucción-FEV1), que evalúa de forma sencilla la respuesta del paciente con AGNC al tratamiento con un mAbs. Para la elaboración de EXACTO, y para la ponderación del peso de cada variable, una vez realizado el modelo teórico, se realizó una encuesta Delphi de 2 rondas en el que participaron finalmente 56 especialistas en neumología con experiencia en el tratamiento y seguimiento de pacientes con AGNC. Esta escala puede ser útil para la toma de decisiones terapéuticas, sobre todo en aquellos pacientes que logran una respuesta parcial al tratamiento con mAbs. EXACTO define como superrespondedor al paciente con respuesta completa.
Herramienta e instrumentos de medición con las puntuaciones de cada variable y los rangos establecidos para valorar la respuesta al tratamiento con mAbs en la escala multidimensional EXACTOa
| Exacerbacionesb | ACT | Corticoides sistémicosb | FEV1 | |||||
|---|---|---|---|---|---|---|---|---|
| No respuesta | Igual o mayor | 0 | Igual o menor que el de inicio | 0 | Dosis igual o mayor | 0 | Igual o menor que el de inicio | 0 |
| Respuesta parcial | ≥2 exacerbaciones | 1 | <20 y mejora <3 puntos | 0 | Disminución de dosis <50% sin retirada de GCO | 1 | Aumento <10% y 100ml y FEV1<80% predicho o <80% del mejor histórico | 0 |
| Respuesta buena | ≤1 exacerbación | 2 | <20 y mejora ≥3 puntos | 1 | Disminución de dosis ≥50% sin retirada de GCO | 2 | Aumento ≥10% y 100ml y FEV1<80% predicho o <100% mejor histórico | 1 |
| Respuesta completa/superrespondedor | Sin exacerbaciones | 3 | ≥20 | 2 | Retirada de GCO o dosis ≤5mg/día si insuficiencia adrenal | 3 | Aumento ≥10% y 100ml y FEV1≥80% predicho o ≥100% mejor histórico | 2 |
| RespuestamAbs | Puntuaciónsin GCO | Puntuacióncon GCO (corticoides continuos) |
|---|---|---|
| No | 0-1 | 0-2 |
| Parcial | 2-4 | 3-6 |
| Buena | 5-6 | 7-9 |
| Completa/superrespondedor | 7 | 10 |
EXACTO: EXacerbaciones, ACT, CorTicosteroides sistémicos y Obstrucción – FEV1%); ACT: Asthma Control Test; FEV1: volumen espiratorio forzado en el primer segundo; GCO: glucocorticoides sistémicos; mAbs: anticuerpos monoclonales (monoclonal antibodies).
Se hará una valoración de la respuesta al tratamiento con mAbs a las 16 semanas y a los 12 meses. Para el seguimiento del paciente, se recomienda aplicar la herramienta cada 6 meses a partir del primer año de tratamiento.
El número de exacerbaciones y la dosis de GCO se ajustará para el periodo evaluado, 16 semanas o 12 meses, comparándose con valores previos de dichas variables para un periodo previo de igual duración.
Fuente: Casas-Maldonado et al.47.
La evaluación de la rinosinusitis crónica con poliposis nasal (RSCcPN) se realiza mediante el cuestionario Sino-Nasal-Outcome-Test de 22 ítems (SNOT 22)48, que puntúa de 0 a 110 (peor calidad de vida cuanto mayor es la puntuación). Este cuestionario permite evaluar de forma muy satisfactoria el impacto de la RSCcPN sobre la calidad de vida relacionada con la salud y su uso, no sólo en investigación sino en la práctica clínica habitual, permite valorar mejor el grado de afectación de los pacientes. Es un cuestionario validado que permite interpretar las puntuaciones obtenidas desde un punto de vista clínico, ya que se ha determinado el valor de la mínima diferencia relevante para el paciente que es 8,9 puntos49, y valorar los niveles de gravedad en tres grados: leve (8-20 puntos), moderada (>20-50 puntos) y grave (>50 puntos)50. Además, predice qué pacientes se beneficiarán más de cirugía (probabilidad mayor de un 75% de mejorar más de un 45% con un SNOT-22 preoperatorio >30 puntos)51.
En la RSCcPN, al igual que sucede con el asma, también es importante disponer de una herramienta que permita valorar la respuesta a los fármacos biológicos. En las guías EUFOREA y EPOS20 existen sendas propuestas, pero no están validadas52,53. En la tabla 5 se expone una nueva propuesta consensuada entre un grupo de expertos.
Escala de valoración de la respuesta a fármacos biológicos en RSCcPN
| SNOT-22<30 y mejoría >8,9 |
| Puntuación de síntomas nasales totales (EVA: 0-10): <5 |
| Disminución de la necesidad de GCS>50% |
| Disminución del tamaño de los pólipos NPS |
| Respuesta completa: 3-4 criterios |
| Respuesta buena: 2 criterios |
| Respuesta parcial: un criterio |
| No respuesta: 0 criterios |
EVA: escala visual analógica; GCS: glucocorticoides orales; RSCcPN: rinosinusitis crónica con poliposis nasal; SNOT-22: Sino-Nasal-Outcome-Test de 22 indicadores.
Para la valoración del grado de satisfacción del paciente con la medicación existen cuestionarios validados, como el SATMED-Q para medicación oral54 o el FSI-10 para medicación inhalada55. Se ha considerado que estos cuestionarios, y otros similares, no son aplicables para evaluar el grado de satisfacción con un mAb, que se administra por vía subcutánea o intravenosa en Hospital de Día o autoadministrada en domicilio por vía subcutánea. Para la valoración del grado de satisfacción del paciente se han considerado 5 dominios: 1) efectos adversos de la medicación; 2) eficacia del tratamiento; 3) comodidad de uso; 4) impacto de la medicación en las actividades cotidianas; y 5) opinión general respecto a la medicación. En la tabla 6 se describe la puntuación de cada uno de los dominios, donde 0 es el peor grado de satisfacción y 10 el mejor posible. El grado de satisfacción del paciente con el mAb se definió como malo o insatisfecho (0-2 puntos), algo satisfecho (3-5 puntos), satisfecho (6-8 puntos) y muy satisfecho (9-10 puntos).
Escala de valoración del grado de satisfacción del paciente con el mAbs
| Dominio | Baremo |
|---|---|
| Efectos adversos de la medicación | 0: Efectos adversos importantes1: Efectos adversos leves2: No efectos adversos |
| Eficacia del tratamiento | 0: No eficaz o poco eficaz1: Eficaz2: Muy eficaz |
| Comodidad de uso de la medicación | 0: No cómodo o poco cómodo1: Cómodo2: Muy cómodo |
| Impacto de la medicación en las actividades cotidianas | 0: Poco o ningún impacto1: Impacto positivo2: Impacto muy positivo |
| Opinión general respecto a la medicación | 0: Mala1: Buena2: Muy buena |
mAbs: anticuerpos monoclonales.
Fuente: modificada de Campbell et al.56.
Las variables RSCcPN y grado de satisfacción del paciente con el mAb son complementarias pero independientes de la escala EXACTO, por lo que no modifican su puntuación total. El paciente que alcance la respuesta completa en la escala EXACTO se considera superrespondedor en asma”, y si además alcanza respuesta en la escala de poliposis (tabla 5), se define como superrespondedor para la vía respiratoria única. Estos conceptos necesitan ser validados y contrastados con futuros estudios.
A principios de 2021, se propuso un modelo multidimensional para evaluar la respuesta al tratamiento con mAbs57. Los autores seleccionaron los ítems y los instrumentos de medida mediante metodología Delphi, se le asignó un peso a cada ítem mediante un sistema de decisión multiparamétrico utilizando la metodología Potentially All Pairwise RanKings of All Posible Alternatives (mediante el software 1000 minds Ltd, New Zeland), y por último se realizó una validación externa para el score obtenido. Los ítems de mayor peso fueron las exacerbaciones graves, la utilización de GCO, los síntomas evaluados mediante el ACT y la obstrucción bronquial evaluada mediante el FEV1. En un estudio reciente de 2 años de seguimiento en vida real de pacientes tratados con biológicos anti IL-5, Eger et al.58 encontraron un 14% de pacientes con muy buena respuesta (superrespondedores), un 11% de no respondedores y un 69% de pacientes con respuesta parcial. Es en este amplio grupo de pacientes con respuesta parcial en el que es más necesaria la utilización de herramientas como la escala FEOS57 y otras, para ayudar al clínico en la toma de decisiones.
En el seguimiento del paciente con AG se recomienda aplicar en cada visita los cuestionarios de síntomas y/o calidad de vida, evaluar el cumplimiento terapéutico y la técnica inhalatoria, y realizar una espirometría18.
En cualquier caso, y a la vista de la información aquí expuesta, resulta evidente que el seguimiento del AG es un proceso continuo que exige una dedicación y una preparación capaces de dar respuestas coherentes, planificadas y personalizadas3. En este sentido, la creación de unidades especializadas de asma dotadas de medios y personal sanitario experto aparece como una opción muy razonable, tanto desde la perspectiva de eficiencia para el sistema como desde la perspectiva de mejora de resultados para el paciente13,59.
Aunque para evaluar el control del asma la visita médica presencial es fundamental, a causa de la pandemia se ha asistido a una reestructuración de las unidades de asma y servicios de neumología que ha imposibilitado la asistencia clínica tal y como se venía realizando. Surge así la necesidad de otras formas de atención a los pacientes asmáticos. La GEMA3 habla ya de teleasistencia médica (telehealthcare) como un término general, abarcando las diferentes formas de asistencia sanitaria con tecnología (teleconsulta, telemonitorización y telemedicina). El uso combinado de estas estrategias, que incluye el manejo de telecasos o la teleconsulta, mejora el control de la enfermedad y la calidad de vida de los pacientes con asma60,61.
Las recomendaciones formuladas con relación al seguimiento del paciente con AG son las siguientes:
- •
En todo paciente con AG, el seguimiento de la evolución y la respuesta terapéutica constituyen una parte esencial de su manejo.
- •
El periodo de tiempo que debe mediar entre visita y visita variará de unos casos a otros, pero se aconsejan 3 meses para valorar los efectos del tratamiento inhalado sobre los síntomas y FEV1, y se recomienda esperar un mínimo de 4 meses para una primera valoración de respuesta clínica, funcional e inflamatoria en pacientes tratados con mAbs. Se valorará la reducción de exacerbaciones a los 12 meses.
- •
En cada visita se debe valorar el grado de control actual y el riesgo futuro.
- •
Cada visita es una oportunidad para estimar el grado de cumplimiento terapéutico (reforzar el cumplimiento del tratamiento) y revisar la técnica de inhalación (corrigiendo los errores detectados). También es importante identificar los posibles factores agravantes y/o comorbilidades asociadas al asma, especialmente si la enfermedad no está controlada.
- •
La remisión de los pacientes con AG a unidades especializadas dotadas de medios y personal sanitario experto es una opción muy razonable por su eficiencia y mejora de resultados.
- •
De forma global, los marcadores aconsejados para el seguimiento de la mayoría de los pacientes con AG en cada visita son: ACT/ACQ, número e intensidad de exacerbaciones desde la última visita, FEV1, TAI, FENO, eosinofilia en sangre y consumo de esteroides sistémicos.
- •
La eosinofilia periférica es un biomarcador que ayuda a la indicación de mAb.
- •
En pacientes con AG, especialmente en aquellos que reciben GCO, hay baja correlación entre eosinofilia en sangre y esputo.
- •
La persistencia de eosinofilia en el esputo puede reflejar respuesta insuficiente al tratamiento con un monoclonal.
- •
Los nuevos inhaladores que incorporan sensores digitales para recoger datos sobre su uso pueden mejorar el cumplimiento del tratamiento del asma.
- •
Los nuevos inhaladores que incorporan sensores digitales para recoger datos sobre su uso deberían utilizarse preferentemente en pacientes con antecedentes demostrados de incumplimiento terapéutico.
- •
Algunos de los nuevos inhaladores que incorporan sensores digitales para recoger datos sobre su uso deberían utilizarse en pacientes con antecedentes de técnica inhalatoria incorrecta.
- •
La realización de prueba broncodilatadora es recomendable en el seguimiento de pacientes con AG.
- •
Registrar el mejor valor de FEV1 del paciente (si está disponible) es útil para establecer el objetivo de función pulmonar que se debe conseguir con su tratamiento.
- •
La prueba de glucocorticoides orales es útil para conocer el mejor valor de FEV1 del paciente.
- •
Debería incorporarse la FENO al seguimiento del AG.
Desde la consulta de enfermería respiratoria el seguimiento del paciente con AGNC se marca el objetivo principal de fomentar la autonomía del paciente para conseguir un mejor automanejo, autoeficacia y un mayor empoderamiento, consiguiendo de esta manera una mejor calidad de vida y un menor impacto de la enfermedad62.
De esta manera son varios los puntos a abordar en la consulta de enfermería respiratoria con un paciente con AGNC63: conocimientos de la enfermedad, etiopatogenia del asma, pruebas de diagnóstico y seguimiento, factores desencadenantes de exacerbaciones y medidas preventivas, y el manejo de fármacos.
Con estos objetivos en la tabla 7, se detallan las dimensiones que la enfermería de neumología tiene que valorar en todos los pacientes con AGNC. La enfermería, debe implementar cada una de las acciones de un programa de educación dirigido a pacientes con asma. Este programa debe de ser individualizado, progresivo, secuencial, dinámico y continuo64, y se debe implementar tras haber elaborado un diagnóstico educativo del paciente con AGNC65.
Funciones de enfermería
| Educacion en asma |
| - Información estructurada sobre la enfermedad, factores agravantes y desencadenantes |
| - Adiestramiento en la técnica inhalatoria |
| - Formación sobre administración de tratamientos con monoclonales |
| Valoración del control del asma: ACT/ACQ |
| Adhesion al tratamiento |
| - Cuestionarios: TAI |
| - Retirada de fármacos en farmacia |
| Otros cuestionarios según indicacion individualizada: Mini AQLQ, HADS, Nijmegen, etc. |
ACT/ACQ: Asthma Control Test/Asthma Control Questionaire; AQLQ: test de calidad de vida de pacientes con asma; HADS: test de ansiedad y depresión hospitalaria; TAI: test de adhesión a inhaladores.
La educación sanitaria en el paciente con AG no se diferencia de la habitualmente recomendada para el resto de la población asmática. No obstante, se extremarán las medidas de evitación (se evitará la exposición a contaminantes y tóxicos, y a alérgenos en pacientes alérgicos, sobre todo a hongos, pólenes, epitelios, ácaros y cucarachas). Se abandonará el tabaquismo —activo y pasivo—, se evitará el uso de AINE en pacientes con EREA3 y el consumo de los alimentos correspondientes en casos de alergia alimentaria confirmada3. Se establecerán planes de acción basados en síntomas y en la medición del flujo espiratorio máximo (PEF)3. Además, se adiestrará a los pacientes en el correcto empleo de los dispositivos de inhalación y de los medidores de PEF3,66,67. Asimismo, debe promoverse la realización de ejercicio físico que ha demostrado mejorar el control del asma68.
El paciente con AGNC precisa de tratamientos farmacológicos complejos y, más allá de la terapia inhalada y la medicación oral, el tratamiento con mAbs representa un factor más añadido en la complejidad de los tratamientos de este grupo de pacientes. La enfermería respiratoria es fundamental en la valoración de una serie de variables que marcan la idoneidad del inicio de estos tratamientos, siendo la variable principal, la valoración del grado de cumplimiento al tratamiento de base del paciente, y de esta manera poder implementar estrategias eficaces antes de iniciar el tratamiento con mAbs.
La preparación y entrenamiento del paciente es fundamental. En este sentido la autoadministración en domicilio es una propuesta que hay que hacer a todos los pacientes que cumplan unas condiciones mínimas (tabla 8). Después del entrenamiento estructurado y con el objetivo de seguir con el tratamiento biológico en el domicilio, se debe analizar si el paciente es candidato a este modo de administración del fármaco. De esta manera, el paciente que se incluye en un programa de autoadministración cumple unos requisitos mínimos de seguridad y control: correcta adhesión, persistencia y cumplimiento de todo el tratamiento indicado y grado de control óptimo. El paciente con AGNC en tratamiento con mAb en programa de autoadministración tiene una vía rápida y accesible a su equipo de seguimiento en todo momento para identificar cambios clínicamente relevantes o para la resolución de dudas69.
Criterios previos al programa de autoadministración de tratamiento biológico
| El paciente acepta autoadministrarse el fármaco o tiene cuidador principal entrenado |
| Ha recibido al menos 3 administraciones intrahospitalarias |
| Se ha administrado al menos una dosis supervisada por profesional sanitario |
| No tiene historial previo de anafilaxia |
| Paciente y/o cuidador han recibido entrenamiento sobre reacciones alérgicas graves en relación con el tratamiento biológico |
| Demuestra conocer el dispositivo de inyección (pluma o jeringa precargada) |
| Demuestra conocer el modo de conservación del fármaco, condiciones de seguridad, transporte y desecho |
En resumen, la evaluación de la enfermería respiratoria respecto a los fármacos biológicos debe incluir indicadores de impacto de la intervención en relación con las habilidades del paciente en la autoadministración, la correcta adhesión terapéutica, la implementación de programas de educación terapéutica y el uso de recursos sanitarios (visitas programadas/no programadas a atención primaria o neumología, servicio de urgencias, ingresos hospitalarios en neumología, etc.). La participación de enfermería mejora la atención de los pacientes con AGNC y reduce costes sanitarios70.
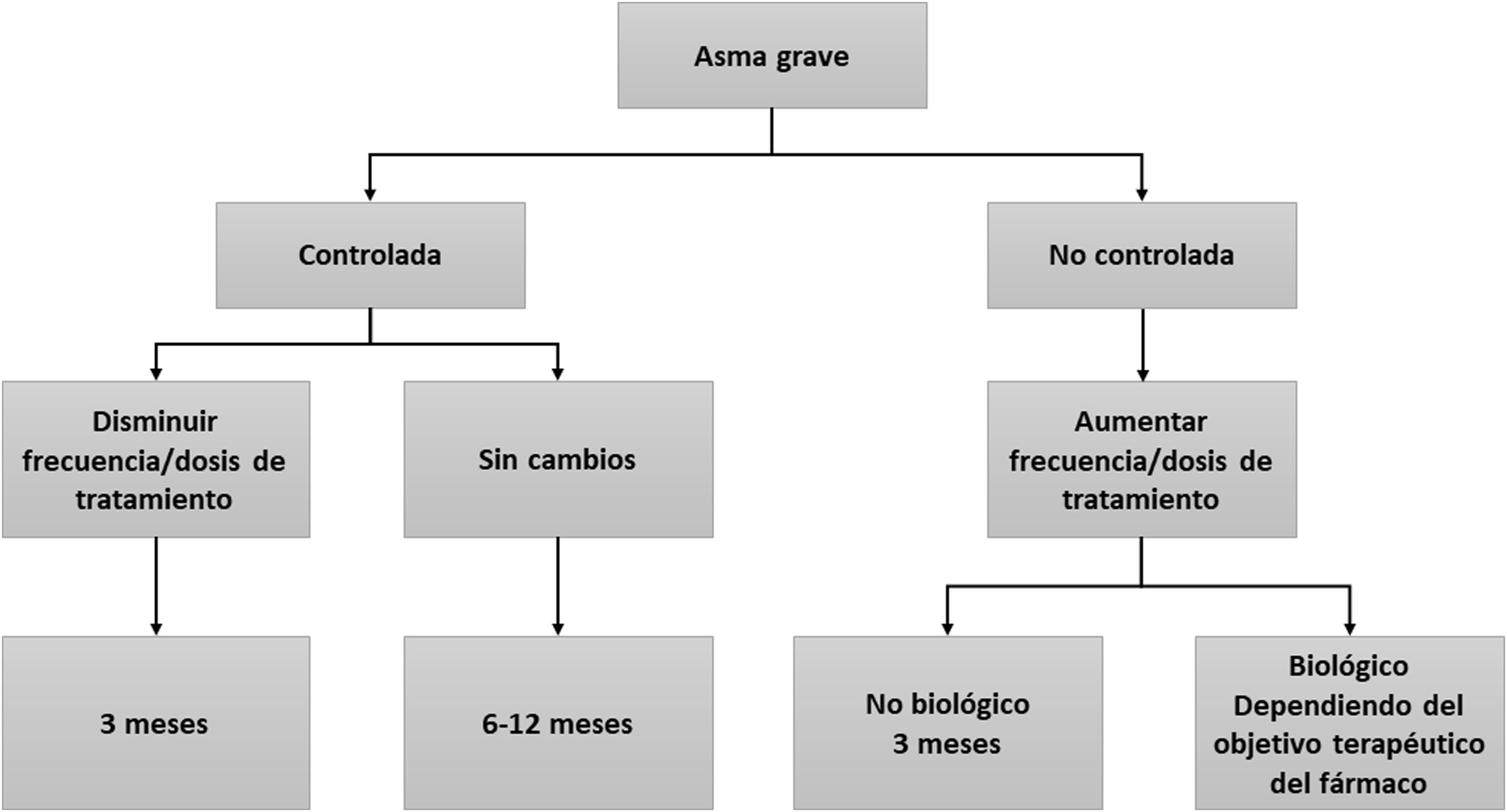
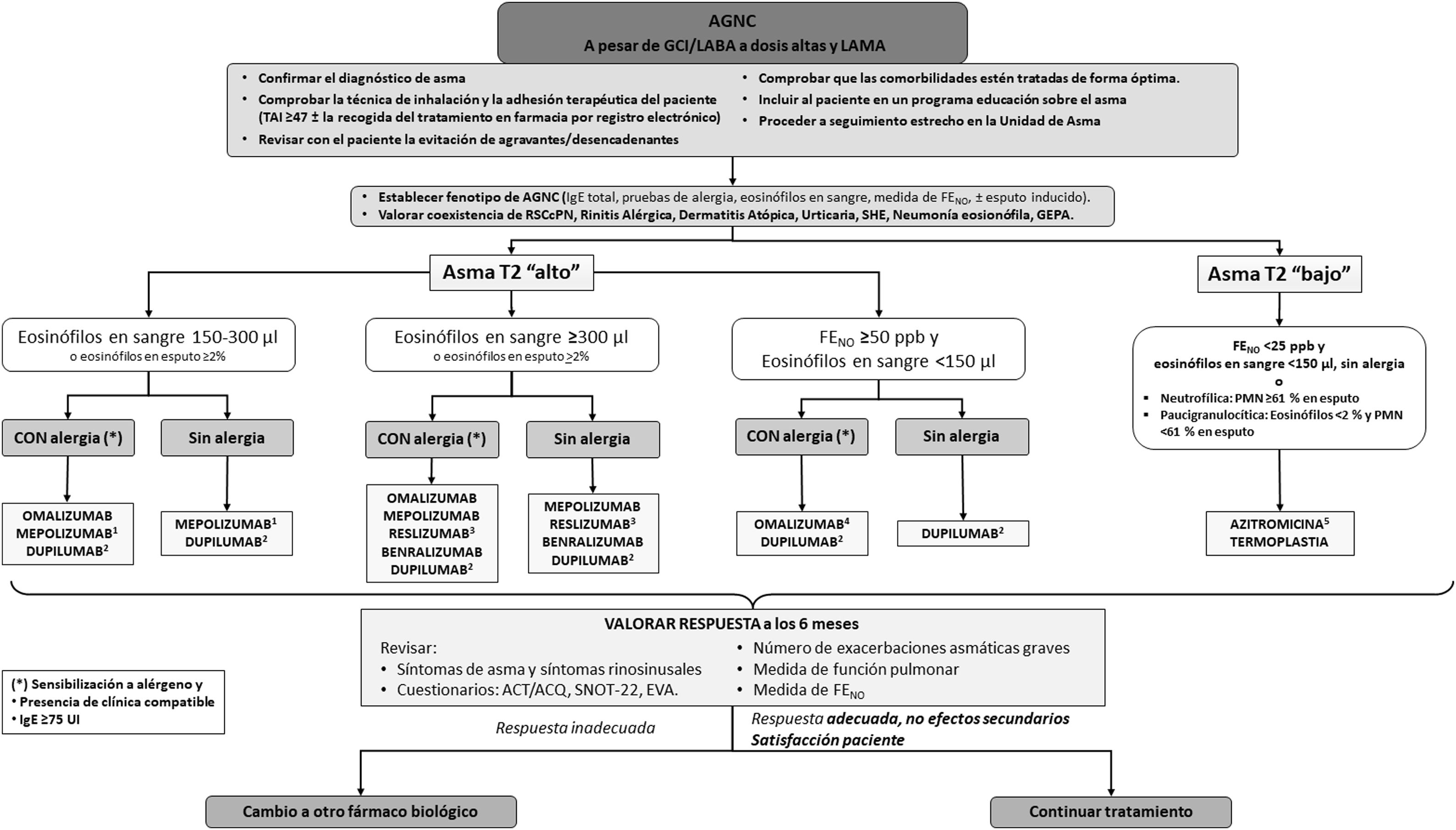
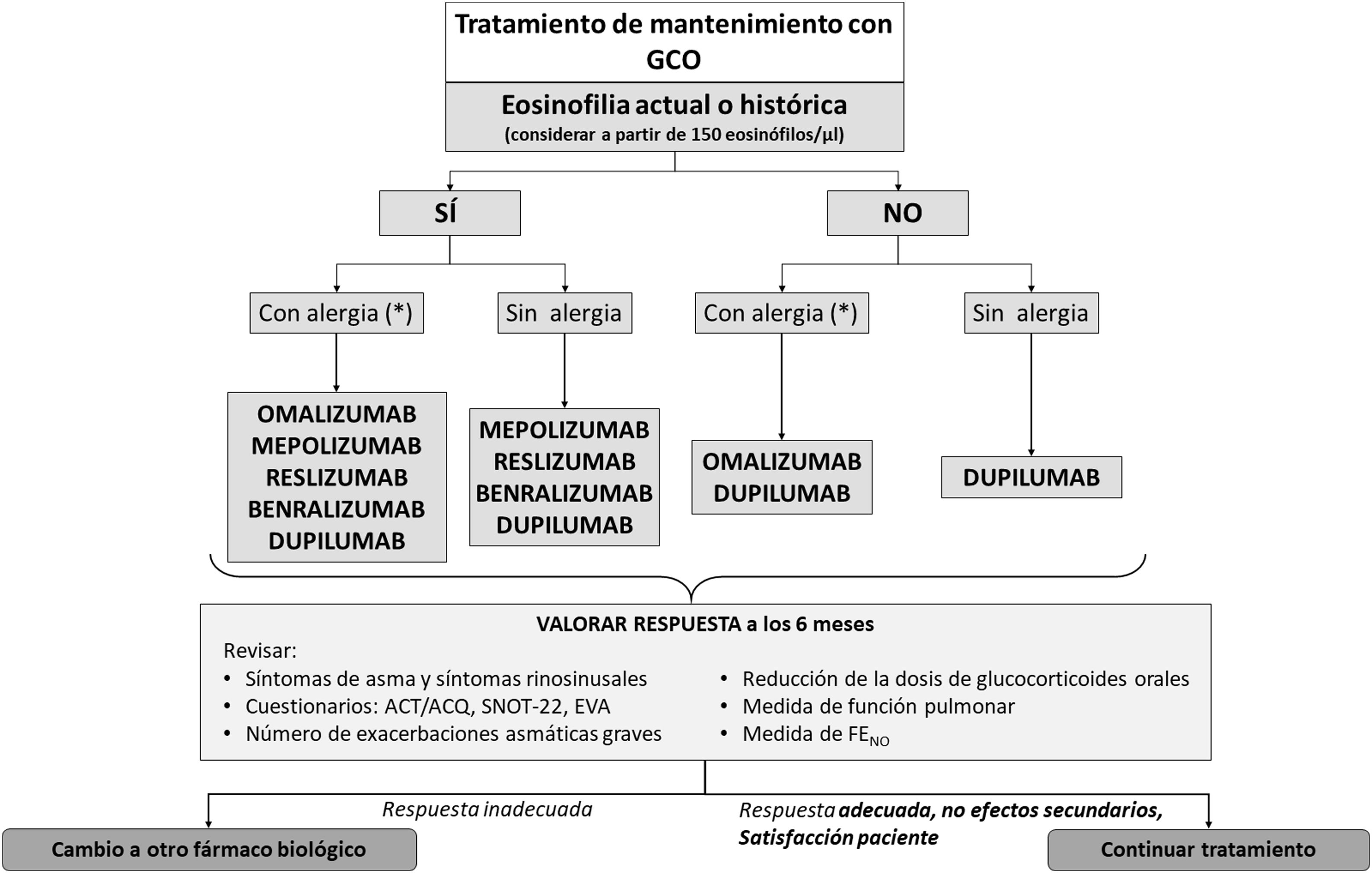
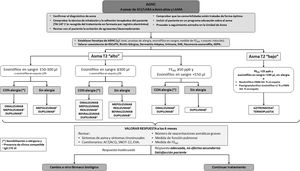
Tratamiento del asma graveIntroducciónEl objetivo principal del tratamiento del asma es lograr y mantener el control de la enfermedad lo antes posible, además de prevenir las exacerbaciones y la obstrucción crónica al flujo aéreo y reducir al máximo su mortalidad y los efectos secundarios de la medicación3. El tratamiento del asma se configura en un ciclo continuo que consta de evaluación, ajuste del tratamiento y revisión de la respuesta. En la figura 2 se muestra el algoritmo terapéutico del AGNC y en la figura 3 el algoritmo en tratamiento crónico con GCO.
Algoritmo terapéutico del AGNC.
ACQ: cuestionario de control del asma; ACT: test de control del asma; AGNC: asma grave no controlada; EVA: escala visual analógica; FENO: fracción exhalada del óxido nítrico; GEPA: granulomatosis eosinofílica con poliangeítis; GCI: glucocorticoides inhalados; LABA: broncodilatadores β2 de larga duración; LAMA: agonistas colinérgicos de larga duración; PMNN: neutrófilos polimorfonucleares; ppb: partes por billón; RSCcPN: rinosinusitis crónica con poliposis nasal; SHE: síndrome hipereosinofílico; SNOT-22: Sino-Nasal Outcome Test de 22 indicadores; TAI: test de adhesión a inhaladores
1 Mepolizumab tiene indicación si Eos actuales ≥150/μl y ≥300/ μl en los 12 meses previos, este fármaco también tiene indicación para granulomatosis eosinofílica con poliangeítis (GEPA) y síndrome hipereosinofílico.
2 Dupilumab tiene indicación si Eos≥300/μl y/o FENO≥50ppb y entre 150-300Eos y FENO ≥25ppb. Considerar al menos 3 medidas de FENO.
3 Reslizumab tiene indicación si Eos≥400/μl.
4 Puede valorarse uso compasivo de omalizumab si los niveles de IgE≥75U/l y los de Eos<150cél./μl.
5 En el asma T2 alto se puede optar por azitromicina en caso de no respuesta a monoclonales, intolerancia o reacciones alérgicas a estos.
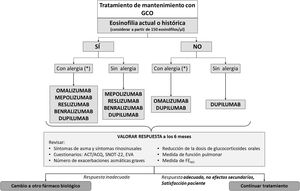
Algoritmo terapéutico del AGNC en tratamiento crónico con GCO.
* Sensibilización a alérgeno y presencia de clínica compatible IgE≥75UI.
Definiciones
AGNC: asma que precisa tratamiento con GCI dosis altas +LABA y LAMA y presenta ≥1 de los siguientes criterios:
• ACT <20 o ACQ >1.5
• ≥2 ciclos de glucocorticoides orales (GCO) de ≥3 días de duración en el año previo
• ≥1 ingreso hospitalario por agudización asmática en el año previo
• FEV1 ≤80% de esperado
Inflamación refractaria de T2: ≥1 de los siguientes criterios mientras el paciente usa GCO diarios:
• ≥150 Eos por microlitro en sangre
• FENO ≥25 ppb (American Thoracic Society Committe)
• ≥2% de Eos en esputo
• El asma está clínicamente provocada por alérgenos
Los GCO a menudo suprimen los biomarcadores de la inflamación de Tipo 2 (Eos en sangre, Eos en esputo y FENO). Por lo tanto, si es posible, estas pruebas se deben realizar antes de comenzar un curso corto o tratamiento de mantenimiento con GCO, o cuando el paciente esté con la dosis más baja posible de GCO.
Umbrales de eosinofilia en sangre: Al menos una determinación de más de 300 Eos/μl en el último año. En pacientes tratados con corticoides sistémicos de forma crónica o recientemente pueden aparecer cifras bajas de Eos. En este caso puede ser de utilidad revisar valores históricos.
Umbrales de FENO. El punto de corte se establece en 25 ppb. No obstante, se debe considerar que la medida de FENO puede verse alterada por la toma reciente de corticoides sistémicos y la dosis total de corticoides inhalados, por la edad y tabaquismo (niveles más bajos en fumadores). Si aparecen niveles altos de FENO, verificar que el paciente se autoadministra correctamente la medicación inhalada (adhesión terapéutica y técnica inhalatoria).
Respuesta a fármaco biológico (escalas multidimensionales EXACTO y FEOS)
Elección entre monoclonales
El orden en que aparecen los biológicos en el esquema, cuando coinciden en una indicación, obedece solo al tiempo que llevan comercializados.
En la elección deben considerarse: el recuento de Eos en sangre, la función pulmonar, el uso de corticoides orales de mantenimiento, la presencia de comorbilidades: poliposis nasal/EREA, urticaria crónica, dermatitis atópica y enfermedades asociadas a asma (granulomatosis eosinofílica con poliangeítis (GEPA), neumonía eosinófila, ABPA, esofagitis eosinofílica).
• Benralizumab (mayor eficacia >300 Eos/μl): Pacientes con mala función pulmonar, poliposis, corticoides orales de mantenimiento y dificultad para acceder a unidad de asma.
• Reslizumab (mayor eficacia >400 Eos/μl): Mejora la función pulmonar. No hay ensayos clínicos que demuestren que sea eficaz para reducir la dosis de GCO. Administración intravenosa.
• Mepolizumab (su indicación es a partir de 150 Eos/μl, pero mayor eficacia >500 Eos/μl): Indicado en pacientes con >150 Eos /μl si existen valores históricos de >300 Eos/μl. Se ha demostrado
que permite reducción o retirada de GCO.
• Dupilumab (mayor eficacia >300 Eos/μl y FENO >50 ppb): Mejora la función pulmonar, la poliposis nasal y la dermatitis atópica grave. Se ha demostrado que permite reducción o retirada de GCO y aumenta los valores de Eos. La administración es quincenal. Según IPT posible indicación en todos los pacientes corticodependientes.
Para elegir entre fármacos con potencial eficacia en un determinado paciente, se deben considerar criterios de comodidad posológica (preferible mensual/bimensual en lugar de quincenal), vía de administración (preferible subcutáneo a intravenoso) y costes.
La termoplastia está indicada en pacientes sin enfisema, bronquiectasias, atelectasias ni comorbilidades importantes. Sin tratamiento con anticoagulantes o inmunosupresores y que no infecciones recurrentes. La FEV1 debe ser mayor de 40% y no debe haber contraindicación para BFC con sedación. ACQ: cuestionario de control del asma; ACT: test de control del asma; EVA: escala visual analógica; FENO: fracción exhalada del óxido nítrico; GCO: glucocorticoides orales; SNOT-22: Sino-Nasal Outcome Test de 22 indicadores.
De acuerdo con los criterios de AG, estos pacientes estarán recibiendo un tratamiento de mantenimiento con una combinación de GCI/LABA a dosis elevadas, correspondiente al escalón 5 del tratamiento del asma según la GINA o 5-6 según la GEMA3,4. Si existe control insuficiente de la enfermedad, se añadirá por lo menos uno de los siguientes fármacos: LAMA3,4,71–73, antileucotrieno74, teofilina75 o azitromicina76,77. En caso de AGNC se estudiará el fenotipo del paciente para establecer la indicación de mAbs. La elección del tratamiento debe tener en cuenta las opciones terapéuticas más efectivas, la seguridad, el coste de las distintas alternativas y la satisfacción del paciente con el nivel de control alcanzado4. Las recomendaciones formuladas en relación con estos tratamientos son:
- •
En el asma persistente grave se recomienda como tratamiento de elección un GCI a dosis altas en combinación con un LABA, correspondiente al escalón 5 de la GINA4 o escalón terapéutico 5-6 de la GEMA.
- •
El tratamiento general del AGNC incluye la prescripción de los fármacos recomendados en los escalones 5 y 6 (combinación de GCI/LABA a dosis elevadas y LAMA); valorar asociar de forma individualizada otras opciones terapéuticas (antileucotrienos o azitromicina).
- •
En un paciente con AGNC en tratamiento con glucocorticoides inhalados a dosis media + LABA, añadir un LAMA es la primera opción en determinados casos, antes de escalar a dosis altas de GCI + LABA.
- •
En todos los casos es necesario un correcto programa de educación de asma, tratamiento de las comorbilidades/agravantes y prevención/tratamiento de los efectos secundarios de los GCO (actualmente último recurso terapéutico según la GEMA y la GINA). En los últimos años diversos estudios han demostrado la eficacia de la triple terapia en un único inhalador, incluyendo diferentes combinaciones de fármacos78,79.
En el caso de haberse confirmado la existencia de una comorbilidad o agravante, se iniciarán las oportunas medidas terapéuticas. Entre las comorbilidades y los factores agravantes más frecuentes debemos tener presentes la obstrucción laríngea inducible; factores psicológicos como ansiedad y depresión; el consumo de fármacos como AINE, betabloqueantes no selectivos o inhibidores de la enzima convertidora de la angiotensina (IECA); fibromialgia; hipertiroidismo; menstruación/menopausia; obesidad; reflujo gastroesofágico; rinitis alérgica y no alérgica, rinosinusitis crónica con/sin poliposis nasal; síndrome de hiperventilación; apnea obstructiva del sueño (AOS); tabaquismo; bronquiectasias, aspergilosis broncopulmonar alérgica, traqueomalacia y otras traqueopatías, enfermedades cardiovasculares y metabólicas3,80–91.
Manejo de los glucocorticoides sistémicos. Evaluación indicaciones, efectos secundarios y pauta de reducciónDurante mucho tiempo los pacientes con AG no controlados con GCI, LABA y un tercer fármaco han sido tratados con GCS (orales o intramusculares). La guía GEMA recomienda el uso de GCS exclusivamente como última opción terapéutica en aquellos pacientes que ya están en un escalón 6 de tratamiento y en los que todas las otras medidas terapéuticas han resultado ineficaces para controlar el asma o para reducir el número de exacerbaciones3. Los pacientes respondedores a GCS suelen tener inflamación tipo T2, mientras que el asma T2 bajo suele tener pobre respuesta, incluso a dosis altas95. También hay que tener en cuenta que algunos pacientes, especialmente obesos y/o fumadores, pueden presentar «insensibilidad a los glucocorticoides»92. La inyección intramuscular de triamcinolona mejora el control, reduce la cantidad de Eos en el esputo, aumenta el FEV1 y previene las exacerbaciones en algunos de estos pacientes93.
Es importante evaluar la respuesta a los GCS ya que varía considerablemente entre pacientes94. En este sentido, un panel de expertos internacionales consensuó su acuerdo en que, si la indicación es reducir el número de exacerbaciones, la respuesta deberá evaluarse en un periodo no inferior a 6 meses y, si la indicación ha sido la mejoría de síntomas, la respuesta puede evaluarse entre 1-3 meses una vez iniciado el tratamiento95. Por tanto, debería evaluarse la respuesta entre los 3 y 6 meses valorando síntomas, calidad de vida, exacerbaciones, función pulmonar y efectos secundarios, sustentando la decisión de mantener el tratamiento crónico con GCS cuando los beneficios superen los riesgos.
La prescripción de GCS se realiza sobre todo cuando la persistencia de síntomas y las exacerbaciones son los responsables del no control del asma, teniendo un papel menos preponderante en la obstrucción aislada del flujo aéreo96 y el uso a largo plazo no es apropiado en situaciones donde estén disponibles otras opciones de tratamiento debido al alto porcentaje de EA que pueden ocasionar97.
Actualmente existe una gran variabilidad en la dosis y duración del tratamiento y una revisión sistemática publicada por Cochrane (18 ensayos clínicos; n=2.438 pacientes), concluyó que la evidencia sobre el mejor esquema de tratamiento con GCS es aún débil98. Los problemas asociados con el tratamiento con GCS a largo plazo están bien establecidos e incluyen alteraciones cardiovasculares y metabólicas (obesidad, hipertensión arterial, hipercolesterolemia y diabetes), osteomusculares (osteoporosis, fracturas, sarcopenia), alteraciones psiquiátricas y síndrome de Cushing, además de restricción del crecimiento lineal en los niños. Sin embargo, los datos sobre los EA del uso de GCS en AG son limitados, en su mayoría retrospectivos y no están diseñados para estudiar los EA a largo plazo. Muchos EA importantes se asocian también con el uso de GCS a corto plazo en las exacerbaciones del asma (insomnio, náuseas, distensión abdominal, dispepsia, malestar general, vértigo, cefalea y, especialmente en niños, cambios conductuales)99,100. Independientemente del uso de GCS de forma fija o en ciclos, la mayoría de los autores coinciden en que la dosis de GCS acumulada anual no debería de sobrepasar los 0,5 a 1g97. Price et al.101 observaron que la diabetes asociada con el uso de GCS se presentaba con dosis acumuladas de 0,5 a 1g y que la mayoría de los demás EA se daban con dosis de 1 a 2,5g/año. Bourdin et al.102 indican que una dosis acumulada anual >1g debe considerarse inaceptable e indican la necesidad de derivación de estos pacientes a unidades especializadas en AG.
Se debe plantear la retirada de GCS cuando se constata que el tratamiento no es efectivo. Aunque, por ejemplo, la GINA recomienda dosis de mantenimiento no superiores a 7,5mg/día4 y por tanto el proceso de retirada debería ser simple, la realidad es que, en general, se usan dosis muy superiores, que de media pueden llegar a los 22mg/día96. En los pacientes que han sido tratados durante un tiempo prolongado con dosis fijas altas de GCS se debe ser especialmente cauto al intentar su retirada con el fin de evitar la aparición de una insuficiencia suprarrenal (IA) no reconocida101,103 que requiera tratamiento sustitutivo104. En el ritmo y velocidad de la reducción/retirada de los GCS deben tenerse en cuenta múltiples factores (duración del tratamiento con GCS, presentación de EA o riesgo de presentarlos y el tipo de EA)95,97. El riesgo de IA es mayor con dosis >5mg/día de prednisolona (o equivalente) durante >4 semanas y la recuperación es impredecible, pero generalmente tarda varios meses, lo que requiere un régimen lento de suspensión de GCS. En los pacientes que hayan recibido una dosis acumulada de GCS>2g en el último año, debe realizarse un estudio de cortisol plasmático a las 8 de la mañana cuando se quiera reducir la dosis de GCS˂5mg/día97.
Recientemente se ha propuesto una pauta de retirada en pacientes que ha sido tratados con benralizumab basada en las dosis de base de GCS que tomaban y los niveles de cortisol plasmático obtenidos al llegar a dosis de 5mg/día (valores menores de 5μg/dl o 100mmol/l indica una IA)105.
- •
Dosis diaria de GCS>20mg/día, se debe reducir la dosis en 5mg/día de forma semanal hasta llegar a la dosis diaria de 20mg.
- •
Dosis diaria de GCS>10mg/día hasta los 20mg/día, se debe reducir la dosis en 5mg/día de forma quincenal hasta llegar a la dosis diaria de 10mg.
- •
Dosis diaria de GCS>7,5mg/día hasta los 10mg/día, se debe reducir la dosis en 2,5mg/día de forma quincenal hasta llegar a la dosis diaria de 7,5mg.
- •
Dosis diaria de GCS>5mg/día hasta los 7,5mg/día se debe reducir la dosis en 2,5mg/día de forma mensual hasta llegar a la dosis diaria de 5mg.
Los pacientes tratados con GCS también deben evaluarse periódicamente en base a la prevención de posibles EA. Durante el primer año de su administración y probablemente de forma evolutiva, cada 3-6 meses debería monitorizarse la presión arterial, el sobrepeso, y la glicemia. También debería monitorizarse la posible afectación del sistema óseo, ocular y digestivo104.
Los GCI también pueden producir efectos secundarios sistémicos significativos. Una revisión sistemática y metaanálisis encontró que pacientes tratados únicamente con GCI tenían un 6,8% de riesgo de presentar IA106. El riesgo se incrementa con dosis más elevadas, con mayor duración del tratamiento, con la utilización concomitante de GCS o con el uso de otros fármacos como los inhibidores de la enzima CYP3A4106. También se debe considerar el tipo de GCI, ya que no son todos iguales y presentan importantes diferencias en cuanto a su potencia e índice terapéutico, y, por lo tanto, también en sus efectos secundarios107,108. Las recomendaciones con respecto a este tema son:
- •
El tratamiento con GCO debe reservarse para pacientes con AGNC en los que todos los demás tratamientos, incluidos los fármacos biológicos, hayan fracasado, como último escalón terapéutico, a la dosis más baja eficaz y durante el mínimo tiempo posible.
- •
En los pacientes que se opte por tratamiento con GCS de mantenimiento y también en aquellos en los que se prescriben ciclos de forma frecuente, las dosis acumuladas anuales deben ser especialmente monitorizadas, intentando no superar la dosis de 1g/año.
- •
La retirada de GCS debe ser gradual e intentando prevenir la aparición de IA.
- •
Los ciclos frecuentes de GCO se asocian a riesgo de efectos secundarios.
- •
Si bien no existe evidencia robusta para recomendar el uso de triamcinolona en el tratamiento del AGNC, se podría considerar su empleo en pacientes corticodependientes bien seleccionados.
- •
Es aconsejable determinar el cortisol plasmático en pacientes en tratamiento con GCS con dosis acumulada ≥1g/año.
- •
Es aconsejable determinar el cortisol plasmático en pacientes en tratamiento con GCS de mantenimiento en cualquier dosis durante >6 meses al año.
En un alto porcentaje de pacientes con asma no se consigue el control de la enfermedad a pesar de usar dosis altas de GCI asociados a un LABA y/o a un tercer controlador. En estos casos, diversas GPC proponen el uso de macrólidos, en especial la azitromicina, aprovechando el efecto inmunomodulador de estos3–5.
Un estudio inicial usando dosis de 250mg de azitromicina 3 días a la semana (estudio AZISAST) evidenció que se mejoraba la calidad de vida pero que no se reducían el número de exacerbaciones109. Sin embargo, Gibson et al. (estudio AMAZES)110 sí que observaron qué usando 500mg, también 3 días a la semana durante al menos 48 semanas, se conseguía mejorar la tos, el FEV1 y reducir de forma significativa el número de exacerbaciones. En este sentido, un metaanálisis reciente ha evidenciado que efectivamente la administración de azitromicina puede ser útil en estos pacientes al disminuir no solo el número de exacerbaciones, sino también el uso de GCS tanto en pacientes con respuesta T2 alto como T2 bajo. Los autores argumentan además que, al ser un fármaco económico, la relación coste/beneficio es favorable y que, en general, fue bien tolerado en todos los estudios111.
También, recientemente, se ha propuesto que la azitromicina puede tener una importante acción beneficiosa al evitar el remodelado bronquial aumentado tanto el diámetro como el área de la luz bronquial, aunque no se ha podido evidenciar que disminuya el grosor de la pared bronquial112.
- •
Se puede intentar tratamiento con azitromicina en pacientes mal controlados con triple terapia, especialmente si no reúnen criterios para un tratamiento biológico y cuando el objetivo terapéutico principal sean las exacerbaciones.
La termoplastia bronquial es un tratamiento endoscópico aprobado para el tratamiento del AGNC desde 2010 para pacientes mayores de 18 años tratados con GCI a dosis altas y LABA. Consiste en la aplicación de calor a la mucosa de la pared bronquial mediante radiofrecuencia para reducir la masa de músculo liso bronquial con el fin de conseguir una reducción de la hiperrespuesta bronquial, una disminución de las exacerbaciones y mejorar la calidad de vida de los pacientes con asma113.
Desde el punto de vista clínico se han desarrollado 3 ensayos clínicos, tan solo uno controlado con placebo, que han puesto de manifiesto que, la termoplastia consigue un mejor control del asma, reducir las exacerbaciones y mejorar la calidad de vida114–116. El efecto sobre el FEV1 es dudoso, ya que tan solo uno de estos estudios ha demostrado una mejoría de este115. Los 3 estudios demostraron que se trata de un procedimiento seguro y a los 5 años de seguimiento no se ha observado incremento en las hospitalizaciones por eventos respiratorios ni tampoco deterioro de la función pulmonar117,118. Así mismo, diversos estudios farmacoeconómicos han evidenciado que se trata de un procedimiento eficiente para el tratamiento de estos pacientes119.
Recientemente, el estudio TASMA, un ensayo clínico destinado básicamente a comprobar los efectos de la termoplastia en el musculo liso bronquial, ha puesto de manifiesto que la termoplastia reduce la masa de músculo liso cuando se compara de forma aleatorizada a pacientes en los que se aplica o no este tratamiento. Sin embargo, si bien se constataron efectos clínicos beneficiosos en los pacientes tratados, estos beneficios se relacionaron con los niveles de IgE y el número de Eos, pero no con la masa de músculo liso bronquial120.
Actualmente, tanto la guía GEMA3 como la GINA4 contemplan la termoplastia como opción terapéutica en el último escalón de tratamiento cuando no se consigue el control del asma con otros tratamientos. Probablemente para que esta terapia sea exitosa se debe seleccionar adecuadamente a los pacientes, en lo que, según el acrónimo inglés, se ha denominado las 3 «I»: «Identification, Implementation and Intense follow-up»121.
- •
La termoplastia podría ser recomendable en pacientes con fenotipos de AGNC no subsidiarios de tratamiento con fármacos biológicos, o en los que estos hayan fracasado, en unidades de asma con experiencia y pacientes sin contraindicación para la técnica.
Es un mAb aprobado para pacientes con ≥6 años con asma persistente de moderada a grave, siendo el paciente alérgico a un alérgeno perenne, con valores de IgE en sangre comprendidos entre 30 y 1.500UI/ml, no controlado con GCI a dosis altas + LABA122. Evita la unión de la IgE a los receptores de alta y baja afinidad123. Se administra por vía sc y la dosis (máxima de 1.200mg/mes) se ajusta por peso y concentración de IgE en sangre periférica. Tanto la evidencia clínica124–127 como los estudios en vida real109,128–134 avalan sus resultados. Mejora las exacerbaciones, la calidad de vida, el consumo de GCO y del FEV1. En un análisis post hoc se agruparon los datos de adolescentes de 12 a 17 años de 8 ensayos aleatorios de omalizumab124–126,135–139. En global se observó una mejoría estadísticamente significativa en el FEV1 de 120,9ml (3,0%) y de 101,5ml en la capacidad vital forzada136.
Estudios recientes indican la utilidad de este fármaco en pacientes con niveles altos de Eos en sangre periférica140,141. Han seguido publicándose estudios en vida real avalando la seguridad del fármaco y su efectividad para conseguir un mejor control de pacientes asmáticos e insinuando su utilidad en pacientes con solapamiento asma-EPOC, aunque no eran ensayos controlados con placebo142,143.
Una evaluación de estudios en vida real de duración comprendida entre 48 semanas y 9 años ha demostrado que omalizumab mejora la calidad de vida de pacientes con asma no controlada moderada/grave y que esta mejoría se mantiene en el tiempo144. Así mismo, estudios en vida real recientes indican que este fármaco puede hacer alcanzar una respuesta completa en pacientes con AG alérgica145 e incluso en pacientes sin base atópica146.
El registro EXPECT recogió información de 250 mujeres embarazadas (el 64,9% con AG y el 35,1% con asma moderada) tratadas con omalizumab y datos de una cohorte de 1.153 mujeres de Quebec (Canadá) (el 21,2% con AG y el 78,8% con asma moderada) sin tratamiento biológico. No hubo evidencia de un mayor riesgo de anomalías congénitas entre las mujeres embarazadas expuestas a omalizumab por lo que la exposición durante el embarazo no está asociada con un mayor riesgo147. Por último, la indicación en RSCcPN de omalizumab ha sido aprobada por la Food and Drugs Administration (FDA) desde diciembre de 2020, tras los resultados de los ensayos realizados en esta patología148.
MepolizumabEs un mAb bloqueante de la IL-5 circulante (anti-IL-5) aprobado para pacientes de ≥6 años con asma eosinofílica no controlada con Eos de >500 o <500 con 2 exacerbaciones graves o una hospitalización en el año previo. Ha demostrado disminución del número de exacerbaciones149,150, siendo más eficaz en pacientes con más de 500Eos/μl, aunque también se ha observado eficacia en pacientes con ≥300Eos/μl en sangre en el último año o con ≥150Eos/μl en el momento del tratamiento, pero con controles históricos de eosinofilia. La fase clínica se inició con el estudio DREAM151, seguida del SIRIUS152 y el MENSA153, que evidenciaron que el fármaco disminuye las exacerbaciones y el consumo de GCO y mejoró la calidad de vida con mejoría discreta del FEV1.
Recientemente se han publicado estudios en vida real que confirman los datos de eficacia de los estudios pivotales, así como seguridad y continuidad del tratamiento en un alto porcentaje de pacientes154–156.
El estudio abierto COSMOS157 que incluyó pacientes de los estudios MENSA y SIRIUS, demostró la seguridad del fármaco y, posteriormente, el estudio COLUMBA reafirmó esta seguridad y eficacia a 4 años158. Se administra por vía sc y a dosis fija. En trabajos recientes se ha demostrado la efectividad de este fármaco tras un cambio de tratamiento en pacientes con AG sin respuesta completa a omalizumab159.
La FDA aprobó mepolizumab como el primer tratamiento dirigido contra la granulomatosis eosinofílica con poliangeítis (GEPA), conocida antes como síndrome de Churg-Strauss. Recientemente, la European Medicines Agency (EMA) ha aprobado 3 nuevas indicaciones de mepolizumab que son el síndrome hipereosinofílico (SHE), la RSCcPN y la GEPA160.
GEPA: El estudio de Wechsler et al.161 es un ensayo multicéntrico, doble ciego, fase III en pacientes con GEPA recidivante o refractaria que tomaban una dosis estable de prednisolona o prednisona. El tratamiento consistió en 300mg de mepolizumab o placebo, administrado por vía sc cada 4 semanas, además del tratamiento de base que recibía el paciente. El grupo tratado con mepolizumab presentó un mayor número de semanas de remisión que el placebo, un mayor porcentaje de participantes en remisión tanto en la semana 36 como en la 48, menor tasa de recaída anualizada y una reducción significativa del consumo de GCO. El perfil de seguridad de mepolizumab fue similar al observado en estudios anteriores. En base a estos datos tanto la FDA como la EMA han aprobado el uso de la dosis de 300mg por vía sc/cada 4 semanas como tratamiento adicional en pacientes a partir de los 6 años con enfermedad recurrente-remitente o refractaria160.
La RSCcPN es una comorbilidad frecuente en el AG. En el estudio SYNAPSE162, de fase III, aleatorizado, doble ciego, controlado con placebo, de grupos paralelos, multicéntrico realizado en adultos con pólipos nasales graves y al menos una cirugía endoscópica previa se observó mejoría de los síntomas y calidad de vida, disminución del tamaño de los pólipos nasales, así como reducción de la necesidad de GCO y de cirugía endoscópica. En este momento estaría indicado en pacientes en los cuales los GCS y/o la cirugía no proporcionan un adecuado control de la enfermedad.
En el SHE, un estudio pivotal163 de fase III, aleatorizado, doble ciego y controlado con placebo de 32 semanas de duración con una dosis de mepolizumab por vía sc 300mg cada 4 semanas realizado en pacientes adolescentes y adultos con SHE grave (definido como aquel que había presentado un mínimo de dos brotes en los últimos 12 meses y un recuento de Eos en sangre de ≥1.000cél/μl) observó una reducción del porcentaje de pacientes con exacerbaciones (empeoramiento de síntomas o incremento en el recuento de Eos, que requieren escalado de otros tratamientos) y disminución de las exacerbaciones anuales. El estudio de extensión abierto confirmó los resultados del estudio aleatorizado164.
ReslizumabEs un mAb bloqueador de la IL-5 circulante. Se une a la misma región por la que la IL-5 se une a su receptor. Los estudios han demostrado que es eficaz en pacientes con AG de fenotipo eosinofílico con ≥400Eos/μl. En un estudio aleatorizado controlado con placebo, que incluyó a 53 pacientes tratados con reslizumab, Castro et al.165 observaron que la disminución de Eos en sangre periférica se acompañaba de una mejoría del FEV1 y de la calidad de vida (ACQ-5), especialmente en el grupo de pacientes con poliposis nasal. El desarrollo de la fase clínica incluyó varios estudios166–168, que han demostrado disminución de las exacerbaciones, mejoría en la calidad de vida y una mayor mejoría en el FEV1 que otros mAbs, si bien debe tenerse en cuenta en la valoración de este último parámetro que las poblaciones de estudio en los diferentes trabajos no fueron exactamente superponibles. Un estudio abierto de dos años de seguimiento ha evidenciado la seguridad del fármaco169.
En un análisis post hoc de un estudio que incluyó a 480 pacientes con asma eosinofílica (>400Eos/μl) no controlada de moderada a grave que fueron tratados con reslizumab (3mg/kg/cada 4 semanas) durante 52 semanas, se evaluó la respuesta según la atopia (IgE específica basal positiva o no)170. Tanto en los pacientes atópicos como en los no atópicos, se observó reducción de exacerbaciones, y mejoría en el FEV1, el control del asma y la calidad de vida. Estos resultados no eran dependientes de la sensibilización alérgica170.
El reslizumab también ha sido evaluado como alternativa en un cambio de tratamiento tras otro mAb. Se evaluó la respuesta al tratamiento con reslizumab (4 infusiones por vía iv de 3 mg/kg/cada 4 semanas) en 10 pacientes corticodependientes (prednisona) que presentaban eosinofilia en esputo (>3%) y en sangre (>300cél/μl) a pesar de que previamente habían sido tratados con mepolizumab (100mg por vía sc/cada 4 semanas) durante un año29. El tratamiento con reslizumab con la pauta de este estudio disminuyó la inflamación eosinofílica de la vía aérea significativamente más que la dosis fija de mepolizumab por vía sc, lo que se asocia a una mejoría del control del asma en estos pacientes29. También se ha evaluado el cambio desde omalizumab en un estudio prospectivo multicéntrico de 24 semanas de seguimiento. Se evaluó la eficacia y seguridad del reslizumab por vía iv (3mg/kg) en 29 pacientes con asma eosinofílica (>400Eos/μl) sin respuesta adecuada a omalizumab171. Los resultados mostraron una mejoría significativa en el ACT en la semana 24 de tratamiento, el objetivo principal, con un 60% del total de pacientes con buen control y sin exacerbaciones. Por lo tanto, el tratamiento con reslizumab aparece como una opción efectiva y segura para este perfil de pacientes171.
Dos estudios en fase III, aleatorizados, a doble ciego, en pacientes con >300 Eos (solo el 30% podían tener <400Eos) fracasaron en el intento de demostrar que reslizumab es eficaz a una dosis fija de 110mg/mensual172. En un estudio multicéntrico abierto, reslizumab ha demostrado ser eficaz en pacientes alérgicos con eosinofilia con mala respuesta a omalizumab171.
Un estudio post hoc ha demostrado el efecto ahorrador de GCO173. Otro análisis post hoc que incluyó 6 estudios, que recoge 3 casos de anafilaxia controlada clínicamente demostró la seguridad del fármaco174.
BenralizumabEs un mAb humanizado dirigido contra la subunidad α del receptor de la IL-5 que induce la eliminación directa de Eos y basófilos a través de las células NK mediante la citotoxicidad mediada por anticuerpos175. Su uso está aprobado a partir de los 18 años. Se ha demostrado su eficacia en AGNC eosinofílica en términos de reducción de exacerbaciones graves frente a placebo hasta en un 55%, la mejora del control de los síntomas, y la reducción y suspensión del tratamiento con GCO, así como incremento de la función pulmonar (FEV1) desde la visita basal en un 25% (398ml). Estos resultados son independientes de los niveles basales de IgE (>30UI) o de la presencia de atopia176–178. Los resultados son coherentes también en el estudio ZONDA179, en el que se pudo reducir la dosis de GCO a asmáticos graves corticodependientes manteniendo el control en la mayoría (75% de reducción de dosis) e incluso interrumpir su uso (en el 52% de los pacientes). Los mayores beneficios se observaron en pacientes con recuento >300Eos/μl en sangre periférica y >150Eos/μl si se trataba de pacientes con GCO de mantenimiento. En los estudios de fase III se identificaron varios factores clínicos basales asociados con una mayor eficacia de benralizumab, que eran independientes de los valores de Eos. Estos comprendían el uso de GCO; el antecedente de poliposis nasal; la función pulmonar baja basada en la capacidad vital forzada <65% antes de broncodilatador; las exacerbaciones frecuentes, y que la enfermedad se iniciara en la edad adulta180–182. El perfil de seguridad y EA a 2 años es similar al observado en el primer año181.
El estudio BORA181 es un estudio de extensión, aleatorizado, doble ciego, de grupos paralelos y 56 semanas de duración que incluyó un total de 2.123 pacientes procedentes de los estudios en fase III SIROCO, CALIMA y ZONDA con edad comprendida entre 18-75 años con AGNC. Este estudio fue seguido del estudio abierto183. El tiempo medio de seguimiento de los pacientes que recibieron benralizumab cada 4 semanas fue de 3,9 (0,9) años y de 3,7 (0,9) para los que recibieron la dosis cada 8 semanas. Un 10,8% de los pacientes recibieron benralizumab durante 5 o más años y el 35,2% durante 4 o más años. El estudio MELTEMI certificó la seguridad del fármaco183.
El estudio PONENTE105 incluyó a 598 pacientes y evidenció una retirada de GCO en el 62,5% de los casos, disminución por debajo de 5mg/día o retirada de GCO en el 80,6% de los pacientes tratados. La reducción se produjo independientemente del valor de Eos basales y se consiguió una disminución de las exacerbaciones. Dos aspectos adicionales del estudio merecen especial mención: Por un lado, la propuesta de descenso de GCO y por otro la descripción del número de pacientes con insuficiencia suprarrenal cuando se llegaba a la dosis de 5mg/día de GCO. Un 60% de los pacientes presentaba un cierto grado de insuficiencia suprarrenal (33% parcial y 18,1% completa).
DupilumabEs un mAb totalmente humano que bloquea la subunidad α del receptor de la IL-4. Tiene efecto anti-IL-4 y anti IL-13. Disminuye la producción de IgE y la liberación de IL-5, por lo que inhibe el reclutamiento de Eos184,185. Wenzel et al.185 demostraron que, además, disminuye otros marcadores de la vía Th2. Además, observaron la eficacia del fármaco en pacientes con asma de moderada a grave con >300Eos/μl en sangre o más del 3% en esputo. Posteriormente, Wenzel et al.186 desarrollaron un estudio en fase IIb aleatorizado y a doble ciego en el que reclutaron 769 pacientes para 24 semanas de tratamiento con dosis de 200 y 300mg y 16 semanas de seguimiento. Observaron una disminución de las exacerbaciones y una mejora del FEV1 a la semana 12 que se mantuvo hasta la semana 24, independientemente del valor basal de Eos (categorizado ≥300 o <300cél/μl).
El estudio aleatorizado en fase III QUEST, a doble ciego y comparado con placebo, de Castro et al.27 compararon 2 dosis de dupilumab (200 y 300mg) y placebo cada 2 semanas a lo largo de las 52 semanas del estudio. Con este trabajo, realizado en 1.902 pacientes a partir de 12 años y asma moderada-grave no controlada, se concluyó que el tratamiento disminuía significativamente las exacerbaciones en comparación con placebo, mejoró la función pulmonar y el control del asma. Los beneficios fueron mayores en los pacientes con mayor eosinofilia (≥300cél/μl) pero el grupo con recuento entre 150 y 299Eos/ml también presentó mejorías significativas. Los beneficios fueron más evidentes en aquellos pacientes con marcadores T2 altos (≥150Eos/mm3 y FENO basal ≥25ppb).
Estudios post hoc del ensayo QUEST27,187 mostraron que dupilumab redujo las tasas de exacerbaciones graves, mejoró el FEV1 y el control del asma, así como suprimió los biomarcadores inflamatorios de tipo 2 en pacientes con AGNC con o sin evidencia de asma alérgica, e independientemente de la presencia o no de rinosinusitis crónica (con o sin poliposis nasal) como comorbilidad asociada.
VENTURE188 fue un ensayo aleatorizado y a doble ciego diseñado para demostrar que el uso de este mAb disminuía el consumo de GCO, y obtuvo un resultado positivo al alcanzar este objetivo primario con disminución de las exacerbaciones graves y mejora del FEV1 en pacientes dependientes de GCO. Mejoraron más aquellos pacientes que poseían valores más elevados de Eos y FENO. De hecho, el recuento basal de Eos y el resultado de FENO parecen ser los mejores marcadores de respuesta al fármaco189.
En cuanto a EA, cabe destacar que en VENTURE188, el 14% de los pacientes tratados con dupilumab presentaron eosinofilia (1% en grupo placebo). De estos, el recuento fue superior a 3.000cél/μl en un 13%, si bien no hubo repercusión clínica. En el estudio QUEST27, se registró eosinofilia en el 4,1% (54 pacientes) del grupo tratado frente al 0,6% (4 pacientes) en el grupo placebo. No obstante, únicamente 4 pacientes del grupo tratado con dupilumab presentaron sintomatología clínica27.
El estudio TRAVERSE190 fue un estudio de extensión, abierto que demostró la seguridad y eficacia a largo plazo del fármaco. Incluyó 2.282 pacientes procedentes de los estudios en fase IIa (EXPEDITION), fase IIb (DRI), fase III (QUEST) en los que los pacientes no eran corticodependientes y el estudio en fase III que solo incluyó pacientes corticodependientes (VENTURE). Se observó eosinofilia en un 1,4% de los 2.062 pacientes incluidos en QUEST y DRI. Estudios en vida real mostraron la eficacia obtenida en ensayos clínicos y que la hipereosinofilia transitoria no modificaba la respuesta al tratamiento191,192.
Finalmente, dupilumab puede ser eficaz en otras comorbilidades asociadas al AG como la dermatitis atópica y/o poliposis193–196.
La EMA ha aprobado el uso del dupilumab en adultos y adolescentes (≥12 años) como tratamiento de mantenimiento para AG tipo 2 que no sea controlada con altas dosis de GCI acompañados de otro fármaco controlador, y curse con un alto recuento de Eos y/o FENO y desde el uno de enero de 2022 está disponible en España para el tratamiento de pacientes de AGNC con esos requisitos.
La Dirección General de Cartera Común de Servicios del SNS y Farmacia ha emitido resolución de financiación para la indicación de dupilumab en adultos y adolescentes a partir de 12 años como tratamiento de mantenimiento adicional para el AG con inflamación de tipo 2 caracterizada por Eos elevados en sangre y/o elevada FeNO, que no están adecuadamente controlados con GCI en dosis altas en combinación con otro medicamento para el tratamiento de mantenimiento, restringiendo la financiación al tratamiento de pacientes con niveles de Eos (Eos) ≥300 o FeNO≥50, o pacientes con Eos≥150 y <300, pero con más de 2 exacerbaciones graves en el último año o más de una exacerbación grave que requiera hospitalización, o pacientes con uso crónico de GCO.
Cambio de anticuerpo monoclonal en pacientes poco o no respondedores a un anticuerpo determinado.La reciente introducción de tratamientos biológicos en el campo del asma en España (tabla 9) se remonta al año 2006 cuando se comercializó omalizumab y este fue el único anticuerpo disponible durante una década. Si bien esta situación ha favorecido notablemente el progreso en el conocimiento de la inmunología de la enfermedad también ha favorecido el uso compasivo de omalizumab (situaciones fuera de ficha técnica), al tiempo que ha limitado las decisiones terapéuticas de los clínicos. Sin embargo, en el último lustro han aparecido 4 anticuerpos más que se disputan su indicación en un espacio común: el AGNC que conocemos como T2 alto. En caso de no respuesta o respuesta insuficiente, aparecen también otras alternativas. La existencia de suficiente evidencia en la literatura29,159,171,197, así como experiencia clínica, permite plantear un cambio de biológico en determinadas situaciones entendiendo que, aunque la indicación inicial fuera acertada, la respuesta al tratamiento no es nunca completa. Es de esperar que aparezcan progresivamente nuevos estudios que amplíen los conocimientos sobre el cambio de tratamiento entre diferentes biológicos. Además, empieza a generarse evidencia del beneficio que en caso de fracaso secuencial de dos anticuerpos con efecto inmunológico distinto (anti-IgE y antieosinofílico), se debe plantear la combinación de dos mAb con efecto anti-IgE y antieosinofílico198.
Principales características de los biológicos disponibles para tratamiento del asma grave
| Mecanismoacción | Indicaciónprioritara | Evidencia efectos clínicos | Dosificación | Vía | Lugar | Seguridadlargo plazo | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓Exacerbaciones | ↓Síntomas | ↑Calidad vida | ↑FEV1 | Dosis | Frecuencia | ||||||
| Omalizumab | Anti-IgE | Asma alérgica | +++ | ++ | ++ | + | Variable(según IgE y peso): 75-600mg | Cada 2-4 semanas | Subcutánea | Unidad asma/domicilio | >10 años |
| Benralizumab | Antirreceptor IL-5 | Asma eosinofílica | +++ | ++ | ++ | + | Fija(30mg) | Cada 8 semanas (3 primeras cada mes) | Subcutánea | Unidad asma/domicilio | 4 años |
| Mepolizumab | Anti-IL-5 | Asma eosinofílica | +++ | ++ | ++ | + | Fija(100mg) | Cada 4 semanas | Subcutánea | Unidad asma/domicilio | 5 años |
| Reslizumab | Anti-IL-5 | Asma eosinofílica | +++ | ++ | ++ | + | Variable(3mg/kg) | Cada 4 semanas | Intravenosa | Hospital de día | 2 años |
| Dupilumab | Anti-IL-4/IL-13 | Asma T2 alto (alérgica o no alérgica) | +++ | ++ | ++ | ++ | Fija(400mg seguido de 200mg)a | Cada 2 semanas | Subcutánea | Unidad asma/domicilio | 2 años |
Ig: inmunoglobulina; IL: interleucina.
En pacientes en tratamiento crónico con GCO, poliposis nasal o dermatitis atópica: 600mg de carga, 300mg/cada 2 semanas.
Fuente: modificada de Otero y Garcia Polo199.
En caso de fracaso secuencial de dos anticuerpos con efecto inmunológico distinto (anti-IgE y antieosinofílico) se debe indicar en primer lugar dupilumab27. En caso de fracaso terapéutico, se debe plantear la combinación de 2 mAbs con efecto anti-IgE y antieosinofílico.
Las recomendaciones elaboradas en relación con el tratamiento del paciente con AG con monoclonales son:
- •
Se debe realizar una valoración objetiva del cumplimiento terapéutico antes de iniciar un tratamiento con mAb.
- •
Los resultados obtenidos con omalizumab, mepolizumab, reslizumab, benralizumab y dupilumab son similares para AGNC, si bien las poblaciones estudiadas no son exactamente superponibles.
- •
En los asmáticos graves no controlados sensibilizados a un alérgeno estacional (con clínica estacional o persistente), el omalizumab podría ser una alternativa (indicación: uso compasivo).
- •
En los pacientes que no responden adecuadamente a un primer mAb, se debe valorar el cambio a otro, considerando las evidencias en cuanto a efectividad y seguridad de cada uno en este contexto para cada paciente en concreto. En asmáticos graves no controlados alérgicos con recuentos de Eos con más de 300cél/μl en los que ha fracasado el omalizumab, tanto los anti-IL-5 como dupilumab son una alternativa válida.
- •
La decisión última de la elección de un monoclonal concreto para un paciente corresponde exclusivamente a los especialistas (neumólogos o alergólogos) responsables de este. Esto no es óbice para que existan comisiones en las que participen además otros profesionales que evalúen los tratamientos con criterios de eficiencia.
- •
En los pacientes con AGNC y fenotipo alérgico con un recuento de Eos<150cél/μl sin tratamiento con glucocorticoides de mantenimiento, omalizumab es la primera opción de tratamiento.
- •
En los pacientes con AGNC y fenotipo alérgico con un recuento de Eos≥150<300cél/μl sin tratamiento con glucocorticoides de mantenimiento, omalizumab, mepolizumab y dupilumab son alternativas válidas.
- •
En AGNC con fenotipo eosinofílico están indicados tanto los anti-IL5/anti eosinofílicos como dupilumab.
- •
En caso de respuesta incompleta tras el tratamiento secuencial con dos monoclonales con diferentes mecanismos de acción (anti-IgE y anti-IL5/antieosinófilo), se debe plantear como primera opción dupilumab.
- •
En los pacientes con AGNC y fenotipo eosinofílico en los que han fracasado los anti-IL-5 y dupilumab, si los niveles de IgE>30UI/μl, omalizumab en uso compasivo podría ser una alternativa.
- •
En determinados casos de AGNC, el valor de la FENO≥25ppb puede ser relevante para la elección del mAb.
- •
En pacientes con AGNC, el diagnóstico de RSCcPN condiciona la elección del mAb.
En la actualidad, tezepelumab es el mAb no comercializado en fase más avanzada de desarrollo. Tezepelumab bloquea la linfopoyetina del estroma tímico (TSLP-acrónimo inglés) y, por tanto, actúa a nivel de la inmunidad innata, regulando la actividad de las células innatas de tipo 2 (acrónimo en inglés ILC2), y a nivel de la inmunidad adaptativa, regulando las células presentadoras de antígeno200.
En el estudio PATHWAY201 ensayo de fase II, aleatorizado, doble ciego y controlado con placebo, se compararon 3 dosis distintas de tezepelumab por vía sc con placebo durante un período de tratamiento de 52 semanas. La variable principal de eficacia fue la tasa anualizada de exacerbaciones del asma (eventos por paciente/año) en la semana 52. La tasa de exacerbaciones disminuyó con las 3 dosis de tezepelumab, un mínimo del 62% en la población general del estudio y del 71% con la dosis de 210 mg sc cada 4 semanas (dosis estudiada en los ensayos fase 3 y objeto de comercialización). La mejoría ocurrió independientemente del nivel de Eos inicial. El FEV1 final también fue superior en los grupos tratados. También se produjo una disminución de los Eos, de la FENO y de la IgE.
En el estudio pivotal en fase III NAVIGATOR202, se realizó un ensayo, multicéntrico, aleatorizado, doble ciego y controlado con placebo que incluyó pacientes con una edad comprendida entre 12 y 80 años y que fueron asignados aleatoriamente a recibir tezepelumab (210mg) o placebo por vía sc cada 4 semanas durante 52 semanas. El objetivo principal fue la tasa anualizada de exacerbaciones del asma a las 52 semanas. La disminución de exacerbaciones fue del 56% y en los pacientes con <300Eos, fue del 41%. También mejoró la función respiratoria, la calidad de vida y el control del asma.
El estudio SOURCE203 es un estudio en fase III, multicéntrico, doble ciego aleatorizado controlado con placebo que evaluó el efecto ahorrador de GCO de tezepelumab administrado a dosis de 210mg/cada 4 semanas comparado con placebo. Los resultados fueron numéricamente favorables al grupo tratado con tezepelumab, pero no hubo diferencias estadísticamente significativas con el placebo. El estudio demostró un descenso de los marcadores T2 a pesar de la disminución de GCO.
El estudio CASCADE204 es un estudio en fase II que intentó demostrar la disminución de infiltrado inflamatorio en la mucosa bronquial después de 28 semanas de tratamiento con tezepelumab, comparado con placebo. Los resultados mostraron una disminución significativa únicamente en el infiltrado de Eos y no mostraron cambios en el grosor ni integridad de la membrana basal205.
Medidas preventivas en asmaMedidas de control ambientalJunto con el tratamiento farmacológico debemos tener en cuenta las estrategias de control ambiental para mejorar el control de los síntomas y/o reducir el riesgo futuro. Las medidas documentadas incluyen:
Evitar el tabaquismo activo y pasivoLos asmáticos fumadores presentan síntomas más graves, una peor respuesta a los glucocorticoides y una pérdida acelerada de la función pulmonar, por lo que a menudo es necesario incrementar su escalón terapéutico. Además, el consumo de tabaco se relaciona con el desarrollo de asma tanto en adultos como en adolescentes, siendo por tanto el primer objetivo del control ambiental conseguir que el paciente abandone el tabaquismo. Para ello, se le debe informar sobre los métodos adecuados para conseguir la deshabituación. Además, la exposición pasiva al humo de tabaco empeora el curso del asma y es un factor de riesgo para desarrollar esta enfermedad en la infancia, por lo que se recomienda al paciente, o a los cuidadores de niños con asma, que las zonas donde van a permanecer (habitaciones, coche, etc.) permanezcan libres de humo3,4. Con relación al uso de cigarrillos electrónicos u otros dispositivos de inhalación, no hay evidencia de que estos dispositivos sean más seguros que el tabaco a largo plazo, por lo que no se debe respaldar su uso como una ayuda para dejar de fumar206. De hecho, la evidencia sugiere que los aerosoles de los dispositivos electrónicos de inhalación contienen numerosos irritantes respiratorios y toxinas que pueden tener un efecto citotóxico sobre el tejido pulmonar207,208. Así, en los últimos años se ha descrito la EVALI, la lesión pulmonar asociada al uso de cigarrillos electrónicos o de vapeo, con mayor porcentaje de asmáticos que en la población general209, y que en algunos casos conduce a la muerte210. Además, el uso de cigarrillos electrónicos o de otros dispositivos de inhalación que liberan nicotina e incluso la exposición pasiva al humo de estos dispositivos podría desencadenar asma, empeorar su gravedad y/o aumentar las agudizaciones211–213. Por ello, desde la clínica se deben incluir el uso de estos dispositivos, incluida la exposición pasiva, en la entrevista clínica y en las medidas de evitación.
Las recomendaciones elaboradas con relación a esto son:
- •
Los pacientes con asma deben evitar el uso del cigarrillo electrónico y otros dispositivos de inhalación.
- •
Los pacientes con asma deben evitar la exposición pasiva al cigarrillo electrónico y otros dispositivos de inhalación.
- •
Se debe investigar sobre el uso de cigarrillos electrónicos, cachimbas, etc. o la exposición pasiva a ellos en la entrevista clínica.
- •
Se debe investigar de forma habitual la exposición a otras sustancias tóxicas inhaladas.
Se ha demostrado que el cambio climático, la polución y la mala calidad del aire, tanto en el interior de viviendas y edificios como en el exterior, contribuye a la aparición, agravamiento y agudizaciones del asma208,214. Aparte del humo del tabaco en los hogares en los que se consume, otros agentes contaminantes frecuentes en interiores son el dióxido de nitrógeno, el monóxido de carbono y compuestos orgánicos volátiles, humo por combustión de biomasa (p. ej., chimeneas)214. Se suman a esto los alérgenos procedentes de mascotas, mohos y ácaros, que pueden influir en la calidad del aire de los entornos cerrados. Además, la alergia al polen y la estación polínica en su inicio, duración e intensidad se ven alteradas por el cambio climático. Así, hay evidencia de que las plantas producen más polen como respuesta a los altos niveles atmosféricos de dióxido de carbono215. Incluso se ha demostrado que las tormentas eléctricas en épocas de polinización pueden favorecer las crisis asmáticas graves en pacientes sensibilizados216. Por otro lado, la proliferación de moho aumenta con las inundaciones y las tormentas, pudiendo repercutir en el control del asma215. Por todo ello, las medidas contra el cambio climático y para reducir las emisiones de gases de efecto invernadero pueden tener beneficios positivos para la salud. A nivel individual se puede reducir la exposición a algunos agentes, como las sustancias procedentes de combustión en entornos domésticos, residenciales, escolares y profesionales; y para la lucha contra el cambio climático se pueden establecer medidas sencillas que disminuyan la huella de carbono. Sin embargo, se requiere el apoyo de políticas medioambientales para combatir el cambio climático y disminuir la presencia de muchas de estas sustancias en el aire. Las recomendaciones elaboradas con relación a esto son:
- •
Es necesario tener en cuenta el impacto sobre la huella de carbono que pueden tener algunos sistemas de inhalación, como los MDI que utilizan hidrofluorocarbono.
- •
En casos en los que haya otra alternativa a los inhaladores con hidrofluorocarbono, debería modificarse su prescripción a sistemas con menos impacto sobre la huella de carbono siempre que se compruebe que el paciente puede realizarlo adecuadamente.
Estos fármacos no están contraindicados de forma generalizada en los asmáticos, pero antes de prescribirlos se debe preguntar al paciente por su uso y los efectos secundarios previos3. Sin embargo, los sujetos con EREA, caracterizada por intolerancia a la aspirina, asma y pólipos nasales, evitarán tratamientos analgésicos o antiinflamatorios con fármacos de la clase terapéutica AINE que inhiben la ciclooxigenasa-1 (COX-1), ya que muchas de estas reacciones son graves o incluso mortales. Estos pacientes pueden recibir paracetamol, pero se recomienda comprobar antes su tolerancia, pues podrían presentar también reacciones adversas. Si se precisa mayor poder analgésico, podrá utilizarse tramadol, opiáceos y AINE inhibidores selectivos de la COX-2 (celecoxib, etoricoxib), estos últimos siempre tras comprobar su tolerancia3.
AlérgenosEn el asma alérgica se deben considerar recomendaciones específicas, una vez que se hayan confirmado las sensibilizaciones a los distintos alérgenos en cada paciente. Las medidas más eficaces son aquellas que permiten disminuir drásticamente los niveles de exposición, como son las que se pueden aplicar en muchos casos de asma ocupacional (cambio de puesto de trabajo), asma por epitelios (retirar los animales del domicilio), por cucaracha (uso juicioso de plaguicidas) o por hongos aerógenos (reducir mohos en domicilio). Las medidas individuales aisladas, como por ejemplo el uso de fundas de colchón o el de acaricidas, no son efectivas, ni siquiera en la reducción de los niveles de exposición. Por otro lado, la aplicación de intervenciones específicas combinadas ha proporcionado una reducción significativa del grado de exposición alergénica y, en consecuencia, mayor eficacia clínica3.
Vacunación antigripalLa vacunación antigripal no ha demostrado la reducción del número o la gravedad de las agudizaciones en los asmáticos217. Sin embargo, debido a que es una estrategia coste-efectiva, al elevado riesgo de complicaciones en pacientes con procesos crónicos, y a un mayor riesgo de fracaso terapéutico en niños218, debería ser considerada en pacientes con asma moderada o grave, tanto adultos como niños3,4.
Vacunación antineumocócicaLos pacientes con asma, especialmente los niños y ancianos, tienen un mayor riesgo de padecer enfermedad neumocócica invasiva. Además, se debe tener en cuenta que los pacientes con asma pueden presentar menor respuesta humoral frente a la vacunación antineumocócica 23-valente219. Sin embargo, a pesar de que no existe suficiente evidencia, diversos documentos de consenso de expertos220 y el Sistema Nacional de Salud recomiendan la administración de la vacuna antineumocócica en pacientes con AG3.
- •
Se recomienda el abandono del tabaquismo (incluido el pasivo) en los pacientes asmáticos.
- •
Los pacientes con EREA evitarán el tratamiento con cualquiera de los fármacos de la clase terapéutica AINE y los inhibidores de la COX-1.
- •
Se debe informar sobre los beneficios potenciales de la vacunación antineumocócica a los pacientes con AG.
La actual evidencia disponible sugiere que el asma bronquial no puede considerarse un factor de riesgo independiente de COVID-19; sin embargo, los pacientes con AGNC tienen peores resultados en salud cuando se infectan por SARS-CoV-2221,222. Por otro lado, la relación entre los mAbs para AG y la infección por SARS-CoV-2 aún no está clara, aunque se ha postulado un papel protector del tratamiento biológico223.
En estos momentos se dispone de vacunas frente al SARS-CoV-2, seguras y eficaces (tabla 10). Según la Organización Mundial de la Salud, estas vacunas son seguras para la mayoría de las personas, incluidas aquellas con afecciones preexistentes de cualquier tipo como el AG224. Diferentes sociedades científicas, entre ellas la SEPAR, abogan por el uso concurrente del tratamiento biológico para el asma y la vacuna frente al SARS-CoV-2, con un intervalo de al menos 5-7 días225,226.
Características de las vacunas para SARS-CoV2 actualmente disponibles en España (a fecha 11 de septiembre de 2021)
| Vacuna | Tecnología | Laboratorio | N.° de participantes | Edad de administración | Dosis e intervalos | Ensayo clínico | Eficacia contra COVID-19 sintomática | Índice de COVID-19 grave | Efectos secundarios frecuentes | Efectos secundarios raros |
|---|---|---|---|---|---|---|---|---|---|---|
| BNT162b2 | mRNA | Pfizer/BioNTech | 45.000 | ≥5 años | 2 dosis separadas 21 días | NCT04368728 | 95% a los 7 días de la 2.ª dosis | Uno en el grupo de la vacuna (n≈18.000)9 en el grupo de placebo (n=18.000) | -Reacciones locales en el lugar de la inyección-Síntomas sistémicos (fiebre, escalofríos, fatiga, mialgias, dolor de cabeza) | -Anafilaxia (aproximadamente 5/millón)-Miocarditis/pericarditis (aproximadamente 16/millón entre las personas de 16 a 39 años) |
| mRNA-1273 | mRNA | Moderna | 30.000 | ≥12 años | 2 dosis separadas 28 días | COVE study NCT04470427 | 94% a los 14 días de la 2.ª dosis | 0 en el grupo de la vacuna (n≈14.000)30 en el grupo de placebo (n=14.000) | -Reacciones locales en el lugar de la inyección-Síntomas sistémicos (fiebre, escalofríos, fatiga, mialgias, dolor de cabeza) | -Anafilaxia (aproximadamente 2,8 /millón)-Miocarditis/pericarditis (aproximadamente 16 por millón entre las personas de 16 a 39 años) |
| Ad26.COV2.S | Vector viral no replicante | Janssen/Johnson & Johnson | 60.000 | ≥18 años | Una dosis | ENSEMBLENCT04505722 | 66% de eficacia frente a COVID-19 moderada-grave | 85% de eficacia frente a COVID-19 grave | -Reacciones locales en el lugar de la inyección-Síntomas sistémicos (fiebre, escalofríos, fatiga, mialgias, dolor de cabeza) | Complicaciones trombóticas asociadas con la trombocitopenia:-Para mujeres de 30 a 39 años: 12,4 casos/millón-Para mujeres de 40 a 49 años: 9,4 casos/millón-Para mujeres en otros rangos de edad y varones: 1,3 a 4,7 casos/millón-Síndrome de Guillain-Barré (aproximadamente 8 casos/millón) |
Fuente: adaptada de Bakhiet y Tarurín228.
Las recomendaciones SEPAR226 para los pacientes con AG en época de pandemia por SARS-CoV-2 son:
- •
Se recomienda continuar el tratamiento de mantenimiento habitual del asma y/o rinitis para no perder el control de la enfermedad.
- •
Se recomienda mantener los tratamientos biológicos indicados para el AG en pacientes no infectados por SARS-CoV-2 a ser posible en autoadministración para evitar riesgo de transmisión del virus.
- •
En caso de infección por SARS-CoV-2 se aconseja demorar la administración del biológico hasta la resolución clínica (aproximadamente 10 a 14 días), ya que se desconoce su efecto en la respuesta inmune al virus.
- •
En casos de infección por SARS-CoV-2 y asma agudizada, se debe individualizar la administración del biológico, ya que no se han observado reacciones adversas en los escasos casos administrados durante la infección.
- •
No se debe administrar la vacuna SARS-CoV-2 a pacientes con antecedentes de reacción anafiláctica a fármacos biológicos.
Se han publicado estudios en vida real de pacientes con AG en tratamiento con biológicos que se han vacunado frente a SARS-CoV-2 y dada la pequeña proporción de efectos secundarios observados y la ausencia de agudizaciones de asma, los autores animan a la vacunación de este tipo de pacientes227. En esta misma línea, SEPAR226 destaca el papel de los neumólogos dentro de la estrategia global de vacunación frente a la COVID-19 en España, ya que la promoción activa de la vacunación en sus pacientes favorecerá la prevención de esta infección y el control de la patología de base.
- •
Es recomendable retrasar la administración del tratamiento con monoclonales 5-7 días tras la administración de la vacuna del SARS-CoV-2.
- •
Es recomendable retrasar la administración de la vacuna del SARS-CoV-2 tras la administración del tratamiento con monoclonal un mínimo de 3 días.
Diversos trabajos han demostrado que las unidades asistenciales de asma son coste-eficientes13,229, por eso los pacientes con AG deberían poder ser evaluados y tratados en estas unidades. Una unidad asistencial de asma debe tener un organigrama estable de funcionamiento y un espacio físico habilitado para la realización de consultas y estudios complementarios, pero además debe estar dotada de sistemas informáticos con bases datos y, por supuesto, protocolos de actuación que incluyan un programa de educación. En las consultas de enfermería de la unidad, se deben desarrollar programas de educación en asma que incluyan medidas de evitación de neumoalérgenos y talleres de manejo de los inhaladores. La educación en asma debe formar parte de un programa estructurado, en el que se incluyan planes de autotratamiento por escrito. Es aconsejable, además, la posibilidad de atención urgente a pacientes agudizados, evitando la asistencia a puertas de urgencia del hospital o centros de atención continuada.
Recursos técnicosEspacio físico. La unidad dispondrá de un espacio físico específico constituido por salas de consultas, sala de exploraciones y técnicas, despacho de enfermería/educación, secretaria y sala de espera, que pueden ser compartidos con el resto de sección o servicio de neumología donde se halla inscrita. Sería deseable la existencia de sala de reuniones independiente para actividades docentes.
Material clínico y ofimático. El material será el necesario para llevar a cabo todas las actividades propias de la unidad. Las salas contarán con el material y mobiliario apropiado. El material disponible será el necesario para realización de espirometría inmediata, provocación bronquial inespecífica, pruebas epicutáneas de alergia (prick-test), FeNO, determinaciones inmunológicas en sangre y posibilidad de administración de fármacos biológicos. Si la unidad asistencial es de una complejidad mayor, puede tener disponibles otras técnicas como el recuento celular en esputo inducido, un cicloergómetro para la provocación de asma inducido por ejercicio, la broncoscopia con biopsia bronquial, la termoplastia bronquial o la provocación bronquial específica.
Recursos humanosLa unidad será atendida por un grupo multidisciplinar de profesionales sanitarios especializados en asma. Estos profesionales deben estar capacitados para el manejo, en el proceso asistencial, de los procedimientos diagnósticos y terapéuticos habituales en asma. El personal médico, auxiliar administrativo y de enfermería pueden compartirse con otras actividades de la sección o servicio.
Formación acreditada en asmaEs importante que los miembros de la unidad de las diferentes especialidades que trabajen en la misma (médicos y enfermería) hayan realizado una formación adecuada en el manejo del asma (cursos acreditados o másteres).
Actividad docenteEste tipo de unidades también debería llevar a cabo actividades docentes. Dichas actividades se realizarán en dos ámbitos: pregrado y posgrado. Es muy interesante que se desarrollen cursos formativos en la unidad y programas de formación dirigidos a residentes que roten por la misma.
Actividad investigadoraLa unidad debe estar preparada para asumir una adecuada actividad de investigación: ensayos clínicos, trabajos originales y comunicaciones científicas.
Las sociedades científicas (SEPAR y SEAIC) han impulsado la creación de unidades asistenciales de asma y han buscado métodos para acreditar su calidad230,231. En el caso de SEPAR existen 3 niveles de complejidad, en función de la actividad y los procedimientos que se realizan en cada una de ellas (unidad básica, unidad especializada y unidad especializada de alta complejidad). Para obtener la acreditación es indispensable que se solicite y se aporte la documentación necesaria que justifique la actividad asistencial, docente e investigadora de la unidad. Asimismo, se debe aportar un listado de los profesionales adscritos a la unidad con descripción de sus funciones, así como del porcentaje de tiempo laboral semanal que dedican cada uno a las tareas propias de la misma. La memoria de actividades debe ser remitida cada 5 años, pues se realiza una evaluación periódica del funcionamiento de las unidades acreditadas.
Unidades multidisciplinaresEs imprescindible la formación de equipos multidisciplinares y la continuidad asistencial en el manejo adecuado de los pacientes con asma232,233. Una consulta monográfica se convierte en una unidad asistencial de asma gracias a la incorporación de otras especialidades, siendo esencial el trabajo conjunto con enfermería especializada en asma. Los miembros fundamentales del equipo serían especialistas en respiratorio/alergia y enfermería con adecuada formación y experiencia en AG. Sobre esta base se requieren otros especialistas que trabajen de forma coordinada para descartar y tratar de forma adecuada todas las comorbilidades o factores agravantes del asma del paciente: otorrinolaringólogos, foniatras, pediatras (transición de niños con AG a unidades de adultos)234, psicólogos-psiquiatras, fisioterapeutas-rehabilitadores, digestólogos, dietistas, endocrinos y, por supuesto, también son importantes la farmacia tanto hospitalaria como comunitaria. No todas las unidades pueden disponer de todas las especialidades trabajando de forma conjunta, pero cuánto más miembros diversos sean capaces de adscribirse a la unidad, mejor será la calidad asistencial que pueda ofrecerse a los pacientes.
Criterios de derivaciónLas discrepancias que existen entre las diferentes guías GPC y documentos de estrategia en asma, para la derivación de pacientes al especialista, deben corregirse mediante documentos estratégicos de consenso que optimicen el proceso de derivación a centros de referencia, sobre todo en el AG, con la finalidad de reducir la morbimortalidad asociada a la enfermedad235.
La realidad, no obstante, demuestra que, más del 50% de los pacientes con asma, nunca han sido visitados por un especialista236, más del 50% de los pacientes que mueren por asma no estaban en seguimiento por un especialista y que, un 20% de estas muertes, podrían haberse evitado si el paciente hubiera sido visitado en un centro especializado237. Ni siquiera el 40% de los pacientes atendidos en un servicio de urgencias en nuestro medio, son derivados al alta al especialista238,239. Por tanto, son necesarias estrategias para determinar cuándo un paciente con asma debe ser remitido al especialista o viceversa240.
En España, se han elaborado documentos de consenso para la derivación de pacientes con asma a atención especializada, tanto desde atención primaria241,242 (tabla 11), como desde los servicios de urgencias243 (tabla 12), todavía en distintas fases de implementación a nivel local.
Criterios de derivación en asma al especialista
| 1. | Confirmar el diagnóstico de asma |
| 2. | Estudio de las enfermedades concomitantes cuando no pueda completarse en AP |
| 3. | Pacientes con asma grave y con asma no controlada |
| 4. | Situaciones especiales (estudio alergológico, asma relacionada con el trabajo, EREA, asma inducida por el ejercicio y asma en embarazo) |
| 5. | Estudio de otras enfermedades que planteen diagnóstico diferencial con el asma |
Criterios para la derivación al especialista desde un servicio de urgencias tras una atención por crisis de asma
| Derivación al especialista (aconsejable en <1 mes) | Derivación al especialista con prioridad (aconsejable en ≤2 semanas) |
| Paciente sin diagnóstico objetivo de asma | Crisis grave. |
| Pacientes que incumplen el tratamiento o no controlados con GCI/LABA | Antecedentes de ARV en el último año |
| Hiperfrecuentadores por exacerbación (≥3 veces/año) o que hayan requerido al menos una hospitalización en el año previo | Embarazadas |
| Tratados con SABA únicamente y que realicen un uso >2 ocasiones a la semana o >1 cartucho al mes | Uso diario de SABA a pesar de tratamiento adecuado |
| Pacientes que reciben GCS de forma mantenida o repetitiva (>2 tandas de prednisona o equivalente año) | Anafilaxia |
ARV: asma de riesgo vital; GCS: glucocorticoides sistémicos; GCI: glucocorticoides inhalados; LABA: agonistas β2 adrenérgicos de larga acción; SABA: agonistas β2 adrenérgicos de corta acción.
Fuente: adaptada Pinera-Salmeron et al.243.
Los pacientes que reciben altas dosis GCI/LABA de forma regular, con buena técnica inhalatoria y, especialmente, los que no alcanzan un buen control, deben ser derivados a un centro de referencia para confirmar diagnóstico de asma, investigar comorbilidad e identificar fenotipos de AG y, de esta manera, ofrecer un tratamiento personalizado. Este proceso puede ser iniciado por el médico de familia, en función de la disponibilidad de medios244.
No siempre se dispone de unidades de asma acreditadas en cada sector sanitario de cada ciudad o comunidad autónoma, lo que no excluye que haya especialistas capacitados (neumólogos/alergólogos), para realizar una evaluación sistemática de un paciente con asma, fenotipar el AG y ofrecer un tratamiento personalizado. No obstante, cuando esta evaluación de pacientes con AG se lleva a cabo en unidades o centros especializados en asma, mediante un abordaje multidisciplinar, se consigue un mejor control del asma, de la calidad de vida los pacientes y un menor consumo de recursos sanitarios13,229,245.
Precisamente, el carácter multidisciplinar y la condición de coordinación entre niveles asistenciales que ofrecen las unidades de asma, hacen que el AG, controlado o no controlado y especialmente con comorbilidad, deba ser abordado en estas unidades.
Indicadores de resultados en saludDentro de los modelos de atención basados en la enfermedad, es la práctica clínica basada en la evidencia científica con la implementación de GPC y el uso de los mejores recursos disponibles, los elementos más usados para el diagnóstico y tratamiento del AGNC, siendo la calidad asistencial un parámetro insuficientemente medido246.
Tanto la calidad como los indicadores de resultados son variables cuantitativas que permiten conocer el grado en que un aspecto relacionado con la atención sanitaria (diagnóstico, seguimiento y tratamiento) consiguen los resultados en salud esperados, tanto por los profesionales que realizan dicha actividad y por los pacientes que la reciben.
Para medir el impacto de las intervenciones que se realizan a un paciente con AGNC, es imprescindible emplear una serie de indicadores de resultados en salud3 relacionados con la enfermedad, por lo que se consigue una aproximación «más cercana» a todo el proceso asistencial. De esta manera se puede medir de una manera objetiva y previamente marcada, si se han conseguido los objetivos propuestos por los equipos de salud y valorar si se precisan cambios organizativos y/o asistenciales en caso de no alcanzarlos. Es por ello por lo que se plantean diferentes indicadores de resultados en las unidades de asma especializadas que puedan garantizar la excelencia desde el diagnóstico y seguimiento, tanto desde un punto de vista técnico y educacional.
Las recomendaciones formuladas en relación con la organización de las unidades asistenciales de AG son las siguientes:
- •
Es necesario implementar los consensos de derivación de pacientes con asma desde atención primaria y servicios de urgencias.
- •
La coordinación entre niveles asistenciales es clave para el correcto manejo del asma.
- •
Es necesario garantizar la continuidad asistencial en el manejo adecuado de los pacientes con asma.
- •
El abordaje multidisciplinar del AG en unidades especializadas mejora el control del asma, la calidad de vida del paciente y disminuye el consumo de recursos sanitarios
- •
Es imprescindible la existencia de equipos multidisciplinares para el manejo adecuado del AGNC.
- •
Se deben establecer indicadores de resultados en salud fácilmente medibles, de forma que se pueda realizar una evaluación sencilla y prolongada en el tiempo.
No se ha recibido financiación para su realización.
Conflicto de interesesFrancisco Javier Álvarez-Gutiérrez declara haber recibido honorarios por labores de asesoría, impartir conferencias o ayudas para asistir a congresos y reuniones científicas por parte de ALK-Abelló, AstraZeneca, Bial, Boheringer-Ingelheim, Chiesi, GlaxoSmithKline, Mundipharma, Novartis, Orion, Sanofi y Teva. Declara no haber recibido, directa o indirectamente, financiación de la industria tabacalera o de sus filiales.
Marina Blanco Aparicio declara haber recibido honorarios por conferencias, asesorías y asistencia a cursos/congresos por parte de AstraZeneca, Chiesi, GlaxoSmithKline, Novartis, Teva, Sanofi y Menarini. Declara no haber recibido, directa o indirectamente, financiación de la industria tabacalera o de sus filiales.
Francisco Casas Maldonado declara haber recibido honorarios por participar como orador en reuniones patrocinadas por AstraZeneca, Chiesi, GlaxoSmithKline, Novartis, Teva y Sanofi. Ha recibido honorarios por actuar como consultor de AstraZeneca, Chiesi y GlaxoSmithKline. Recibió ayudas económicas para la asistencia a congresos por parte de Menarini y Novartis. Declara no haber recibido, directa o indirectamente, financiación de la industria tabacalera o de sus filiales.
Vicente Plaza declara haber recibido honorarios por hablar en reuniones patrocinadas por AstraZeneca, Boehringer-Ingelheim, Chiesi, Gebro Pharma, GlaxoSmithKline Sanofi. Recibió ayudas para asistencia a reuniones científicas de AstraZeneca y Chiesi. Actuó como consultor de AstraZeneca y GlaxoSmithKline Sanofi. Y recibió financiación para proyectos de investigación de diferentes agencias gubernamentales y fundaciones sin ánimo de lucro, así como de AstraZeneca, Chiesi y Menarini.
Gonzalez-Barcala Francisco-Javier ha recibido honorarios como orador, honorarios de consultoría o becas de investigación de ALK-Abelló, AstraZeneca, Bial, Boehringer-Ingelheim, Chiesi, Gebro Pharma, GlaxoSmithKline, Laboratorios Esteve, Menarini, Mundipharma, Novartis, Rovi, Roxall, Sanofi, Stallergenes-Greer y Teva.
José Ángel Carretero Gracia declara ha recibido honorarios por impartir o recibir formación continuada y para proyectos científicos y de investigación procedentes de GlaxoSminthKline, Novartis, Chiesi, AstraZeneca, Sanofi y de la fundación Pneumaragon de la Sociedad Aragonesa de Aparato Respiratorio.
Manuel Castilla-Martínez declara haber recibido honorarios por labores de asesoría para AstraZeneca y subvenciones para proyectos de investigación provenientes de GlaxoSmithKline y Novartis. Declara haber recibido honorarios por impartir conferencias y/o ayudas para asistir a congresos y reuniones científicas por parte de Chiesi, GlaxoSmithKline, AstraZeneca, Novartis, Faes Farma y Sanofi.
Carolina Cisneros declara haber recibido ayudas por: asesorías científicas, estudios de investigación, charlas y cursos, material y ayudas para investigación y asistencia a congresos de AstraZeneca, Chiesi, Novartis, Sanofi, Mundipharma, GlaxoSmithKline, Menarini, Pfizer, Gebro Pharma y Teva.
David Diaz Pérez declara haber recibido el pago de honorarios por impartir ponencias o participación en proyectos formativos y de investigación por parte de GlaxoSmithKline, Teva, AstraZeneca y Chiesi.
Christian Domingo declara haber recibido ayudas por desplazamiento y honorarios de conferenciante en ALK-Abelló, Allergy Therapeutics, Almirall, AstraZeneca, Boehringer-Ingelheim, Chiesi, Esteve, Ferrer Pharma, GlaxoSmithKline, HAL Allergy, ImmunoTek, Menarini, Novartis, Pfizer, Sanofi-Aventis, Stallergenes-Greer, Takeda y Teva.
Eva Martínez Moragon ha recibido honorarios como ponente, asesor científico o participante de estudios clínicos de ALK, AstraZeneca, Bial, Boehringer-Ingelheim, Chiesi, Gebro Pharma, GlaxoSmithKline, Novartis, Sanofi y Teva.
Xavier Muñoz ha recibido honorarios como ponente, asesor científico o participante de estudios clínicos de: AstraZeneca, Boehringer-Ingelheim, Chiesi, Faes, Gebro Pharma, GlaxoSmithKline, Menarini, Mundipharma, Novartis, Sanofi y Teva.
Alicia Padilla-Galo declara haber recibido honorarios por labores de asesoría, impartir conferencias o ayudas para asistir a congresos y reuniones científicas por parte de ALK-Abelló, AstraZeneca, Chiesi, GlaxoSmithKline, Novartis, Orion Pharma, Teva y Sanofi.
Miguel Perpiñá declara no tener conflicto de intereses.
J. Gregorio Soto declara haber recibido honorarios por participar como orador en reuniones patrocinadas por AstraZeneca, Boehringer-Ingelheim, Novartis y GlaxoSmithKline y como consultor de AstraZeneca, Sanofi, GlaxoSmithKline, Chiesi, Novartis, Rovi y Bial. Recibió ayudas económicas para la asistencia a congresos por parte de Boehringer-Ingelheim, Bial, FAES, Boehringer-Ingelheim y Novartis, y recibió ayudas para proyectos de investigación provenientes de GlaxoSmithKline, Sanofi y Boehringer-Ingelheim.
Contribución de los autoresTodos los autores han contribuido en la elaboración y redacción del manuscrito.
Los autores quieren agradecer el soporte y colaboración de Medical Statistics Consulting (MSC) en el proceso de actualización de las recomendaciones, así como la colaboración de Blanca Piedrafita, PhD y de Antoni Torres-Collado, PhD (MSC) en la coordinación y edición del manuscrito actualizado.
Abel Pallarés Sanmartín, SOGAPAR
Agustín Sojo González, SEAR
Alberto Levy Naón, NEUMOSUR
Alfredo de Diego Damiá, SEPAR
Alicia Padilla Galo, SEPAR
Ana Gómez-Bastero, SEPAR
Ana Pueyo, SOCALPAR
Ana Fernández Tena, SEPAR
Ana Isabel Enríquez Rodríguez, ASTURPAR
Ana Isabel Sogo Sagardía, SEPAR
Andrea Trisán, SEPAR
Antolín López Viña, SEPAR
Antonio Pereira Vega, SEPAR
Astrid Crespo Lessmann, SOCAP
Aurelio Arnedillo Muñoz, NEUMOSUR
Auxiliadora Romero Falcón, SEPAR
Berta Román Bernal, NEUMOCAN
Borja Valencia Azcona, SEPAR
Carlos Almonacid Sánchez SEPAR
Carlos Bujalance Cabrera, SOCAMPAR
Carlos Martínez Rivera, SEPAR
Carlos Melero Moreno, SEPAR
Carlos Cabrera López, SEPAR
Carolina Cisneros Serrano, SEPAR
Carolina Puchaes Manchón, NEUMOSUR
Cesar Picado Valles, SEPAR
Cleofe Fernández Aracil, SVNEUMO
Concepción Cañete, SOCAP
David Díaz Pérez, SEPAR
Ebymar Arismendi, SOCAP
Elena Curto Sánchez, SEPAR
Elisabeth Vera Solsona, SADAR-PNEUMARAGON
Eva Martínez Moragón, SVNEUMO
Fernando Sánchez-Toril López, SEPAR
Francisco Casas Maldonado, SEPAR
Francisco de Borja García-Cosío Piqueras, AIRE
Francisco Pérez-Grimaldi Área Asma SEPAR
Francisco Javier Álvarez Gutiérrez, SEPAR
Francisco Javier Callejas González, SOCAMPAR
Gerardo Pérez Chica, SEPAR
Gregorio Soto Campos, SEPAR
Hemily Izaguirre Flores, NEUMOCAN
Irina Bobolea, SEPAR
Isabel Urrutia Landa, SEPAR
Jacinto Ramos Gonzalez, SOCALPAR
Javier González Barcala, SOGAPAR
Javier Michel de la Rosa, SVNPAR
Joan Serra Batlles, SEPAR
Jordi Giner Donaire, SEPAR
José Serrano Pariente, AIRE
José Ángel Carretero Gracia, SEPAR
José Antonio Castillo Vizuete, SEPAR
José Antonio Gullón Blanco, ASTURPAR
José Carlos Serrano Rebollo, SEPAR
Juan Francisco Medina Gallardo, SEPAR
Juan José Garrido Romero, SEPAR
Juan Luis García Rivero, SEPAR
Laura Tomás López, SVNPAR
Luis Hernández Blasco, SVNEUMO
Luis Pérez de Llano, SEPAR
Luis Manuel Entrenas Costa, NEUMOSUR
Manuel Castilla Martínez, SOMUPAR
Mar Mosteiro Añon, SEPAR
María José Linares Serrano, SEPAR
María Teresa Gómez Vizcaíno, SEAR
Marina Blanco Aparicio, SEPAR
Miguel Perpiñá Tordera, SEPAR
Paz Vaquero Lozano, SEPAR
Pedro Romero Palacios, SEPAR
Pilar Cebollero Rivas, SEPAR
Raúl Godoy Mayoral, SOCAMPAR
Rocío García García, SEPAR
Rubén Andújar Espinosa, SOMUPAR
Salvador Pons Vives, AIRE
Sylvia Sanchez Cuellar, NEUMOMADRID
Tamara Alonso Hermida, SEPAR
Vicente Plaza Moral, SEPAR
Xavier Muñoz Gall, SEPAR