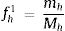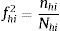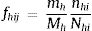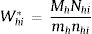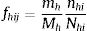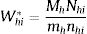El asma es una enfermedad con elevada prevalencia, que afecta a todos los grupos de edad y genera elevados costes sociosanitarios. Estudios realizados en diversas poblaciones muestran gran variabilidad en su prevalencia, incluso en poblaciones cercanas geográficamente, con datos que sugieren una influencia relevante de factores socioeconómicos. Actualmente en población adulta de España no disponemos de datos poblacionales fiables sobre la prevalencia de esta enfermedad. Los objetivos de este estudio son estimar la prevalencia de asma en población española de 18-79 años, describir la variabilidad entre comunidades autónomas, estimar la prevalencia de infra y sobrediagnóstico, prevalencia de asma no controlada, de asma córticodependiente, conocer el consumo de recursos sanitarios, identificar los fenotipos más frecuentes y establecer un punto de partida para evaluar la tendencia temporal con estudios posteriores.
Material y métodosSe realizará un estudio transversal, bietápico, incluyendo pacientes de 50 áreas sanitarias. El estudio se desarrollará en tres fases: 1) cribado y confirmación en historia clínica, en la cual se identificarán los pacientes con diagnóstico previo correctamente establecido de asma; 2) diagnóstico de asma, evaluando a los pacientes en los cuales no está claro el diagnóstico de asma con los datos disponibles en la historia clínica; 3) caracterización del asma, analizando las características de estos pacientes e identificando los fenotipos más frecuentes.
DiscusiónParece necesario y factible realizar un estudio epidemiológico del asma en España que permita identificar la prevalencia de asma, optimizar la planificación sanitaria, caracterizar los fenotipos más frecuentes de la enfermedad y evaluar los diagnósticos erróneos.
Asthma is a disease with high prevalence, which affects all age groups and generates high health and social care costs. Studies carried out in a number of populations show great variability in its prevalence, even in geographically close populations, with data suggesting a relevant influence of socio-economic factors. At present, we do not have reliable data on the prevalence of this disease in the adult population of Spain. The objectives of this study are to estimate the prevalence of asthma in the Spanish population for those aged 18-79, to describe the variability between autonomous communities, to estimate the prevalence of under and overdiagnosis, to analyse the prevalence of uncontrolled asthma and steroid-dependent asthma, to evaluate the health care cost, to identify the most frequent phenotypes and to establish a starting point to evaluate the temporal trend with subsequent studies.
MethodsA cross-sectional, two-stage study will be carried out, including patients from 50 catchment areas. The study will be carried out in 3 phases: 1) screening and confirmation in the clinical history, in which patients with a previously correctly established diagnosis of asthma will be identified; 2) diagnosis of asthma to evaluate patients without a confirmed or excluded diagnosis; 3) characterization of asthma, where the characteristics of the asthmatic patients will be analysed, identifying the most frequent phenotypes.
DiscussionIt seems necessary and feasible to carry out an epidemiological study of asthma in Spain to identify the prevalence of asthma, to optimize healthcare planning, to characterize the most frequent phenotypes of the disease, and to evaluate inaccurate diagnoses.
El asma es una enfermedad frecuente, que afecta tanto a niños como a adultos generando un elevado coste, que se incrementa significativamente con las exacerbaciones, especialmente en los casos de asma grave1–6.
Se estima que en el año 2019 afectaba a 262 millones de personas en el mundo y causó 461.000 muertes7. Aunque la mortalidad por asma se redujo 59% entre los años 1990 y 2015, en algunos grupos de población, como las mujeres mayores de 65 años, este descenso no es significativo8,9. Además, el hecho de tener asma aún supone un incremento de la mortalidad de 46%, especialmente en menores de 15 años10. Las estimaciones de prevalencia de asma muestran una enorme variabilidad entre diferentes zonas geográficas tanto en adultos (entre 0,2 y 21%) como en niños (entre 2,8 y 37,6%)11. Parte de estas diferencias puede atribuirse a la metodología utilizada en la investigación, pero estudios realizados de forma estandarizada, incluyendo grandes muestras procedentes de diferentes países, como la European Community Respiratory Health Survey (ECRHS) o el World Health Survey (WHS), que se llevaron a cabo en 70 países, mantienen la variabilidad entre zonas geográficas. Sirva como ejemplo este último trabajo en el cual la prevalencia global de asma diagnosticada por un médico fue de 4,3%, de 4,5% la de asma clínica o tratada y 8,6% la de sibilancias en el adulto, mientras que la relación de prevalencias entre las zonas con mayor y menor prevalencia llega a ser hasta de 2112. Algunas de estas estimaciones tienen la limitación de ser dependientes del nivel del sistema sanitario de la zona estudiada. Otro hallazgo de interés es que la prevalencia de asma mostró una relación en forma de «U» en relación con el nivel socioeconómico, observándose las mayores prevalencias en los países con niveles socioeconómicos bajos y altos. Esta variabilidad en la prevalencia entre zonas geográficas no solo se ha observado en adultos, sino también en niños (International Study of Asthma and Allergies in Childhood [ISAAC]) e incluso lactantes (Estudio Internacional de Sibilancias en Lactantes [EISL])12.
La información es más limitada en lo que se refiere a la evolución en el tiempo. Algunos estudios han revaluado a sus participantes luego de 20 años de seguimiento pudiendo disponer de datos longitudinales, (ECRHS, separados 20 años el primero del último), permiten disponer de información longitudinal. A nivel mundial, la iniciativa Global Burden of Disease (GBD) aporta datos de 195 países y territorios, estimando un aumento de 29,4% en el número de casos de asma entre 1990 y 2017. El aumento no es continuo, con una tasa de incidencia ajustada por edad en estos años con forma de «U», con un descenso desde el año 1990 hasta el año 2005 y a partir de ahí con un ascenso continuado. De nuevo, también la variabilidad entre regiones en la incidencia es alta, con unas tasas de incidencia estandarizadas por edad que oscilan entre 314,1/100.000 y 1.822,7/100.00013. Otros estudios recientes realizados en países occidentales, incluido España, muestran una tendencia similar respecto al aumento de prevalencia, aunque en algunos casos como Finlandia este incremento parece haberse estabilizado y alcanzado una fase de meseta14–19.
Es de destacar que esta variabilidad entre zonas geográficas se mantiene incluso cuando las zonas están cercanas y son similares desde el punto de vista socioeconómico. Es el caso de España, donde la ECRHS constató unas tasas de prevalencia de asma, en población de 20 a 44 años, de 4,7% en Albacete, 3,5% en Barcelona, 1,1% en Galdácano, 1% en Huelva y 1,7% en Oviedo20. O incluso zonas más cercanas como dentro de una misma comunidad autónoma (C. A.). En Galicia, en población infantil y adolescente, un estudio multicéntrico realizado en las siete áreas sanitarias de Galicia entre los años 2006 y 2007 detectó diferencias importantes en la prevalencia, incluso entre áreas relativamente cercanas, oscilando entre 8,5% en Santiago de Compostela y 17,4% en Lugo en los niños de seis a siete años o 11,4% en la población adolescente de Orense y 21,4% en la de Vigo21.
Existe la sospecha fundada de que los costes sanitarios del asma están aumentando en niños y en adultos y de que hay una amplia variabilidad en la tasa de diagnóstico de asma; siendo frecuente tanto el infradiagnóstico como el sobrediagnóstico y un manejo subóptimo. Algunos estudios actualmente en marcha, como la Global Asthma Network (GAN) están investigando estas hipótesis15.
Las diferencias en la prevalencia de asma entre los diferentes estudios pueden ser debidas a una gran variedad de causas, incluidas distintas exposiciones a factores de riesgo, diferentes criterios diagnósticos, variaciones étnicas, geográficas, socioeconómicas, climáticas o ambientales22–30.
La importancia de los factores ambientales parece ser la que está mejor justificada con los estudios disponibles, en particular aquellos que comparan poblaciones con origen étnico muy parecido expuestas a factores socioeconómicos muy diferentes como se observa al comparar Alemania del Este con Alemania del Oeste, sobre todo antes de la reunificación del país30, o poblaciones migrantes chinas que se trasladan a países con mayor prevalencia y que aumentan su prevalencia comparadas con las que se quedan en el país de origen, tanto más cuanto mayor es el tiempo que viven en el país de destino31. Esta influencia ambiental parece reforzada por los resultados de algunos estudios recientes, como el de Carelia, donde una misma variante genética se asocia con efectos opuestos en el riesgo de enfermedades alérgicas al comparar el impacto en la zona finlandesa con la zona rusa, probablemente relacionado con los cambios ambientales32.
De igual manera, en otro estudio realizado con población inmigrante en Italia, se observa que la prevalencia de sintomatología asmática es menor en inmigrantes que en italianos, pero en los inmigrantes se incrementa la sintomatología con el aumento del tiempo de residencia en Italia33.
Un aspecto importante a tener en cuenta en el estudio de la prevalencia de asma es la posibilidad de remisión de la enfermedad en algunos individuos. En pacientes con inicio de la enfermedad en la edad adulta seguidos durante cinco años, se observó que en 15,9% de ellos, el asma remitía34, situación que puede darse hasta en 2/3 de los pacientes con asma de inicio en la infancia35–37. Esto afecta a los criterios diagnósticos a utilizar en el estudio y a valorar la necesidad o no de confirmar antecedentes bien estudiados de asma.
En España, como hemos visto, disponemos de información limitada de prevalencia de asma en adultos. El último estudio disponible se realizó entre los años 1998 y 2001, incluyendo únicamente población de cinco zonas geográficas14. Dada la sospecha de cambios en el tiempo de la prevalencia y su variabilidad entre zonas geográficas, parece necesario conocer esta información para poder dimensionar correctamente el problema y establecer estrategias de salud, tanto asistenciales como docentes y de investigación que permitan optimizar los recursos disponibles.
Uno de los objetivos principales en el manejo del asma es lograr el control de la enfermedad, pero los datos disponibles hasta el momento procedentes de distintos países muestran un elevado porcentaje de pacientes con asma no controlada38–42.
La morbilidad asociada al asma genera, además, un impacto significativo en la actividad laboral, ya que más de 25% de los asmáticos tiene algún episodio de incapacidad laboral debido al asma a lo largo del año, y el GBD la sitúa entre las 11 causas más frecuentes de incapacidad43,44.
El asma tiene, por tanto, una importante repercusión clínica y económica, en particular el asma grave que revela unos costes casi seis veces superior al asma moderada45. La disponibilidad actual de fármacos biológicos muy eficaces para un subgrupo de pacientes con asma grave no controlada (AGNC) hace especialmente importante conocer su prevalencia para tener una estimación del número de pacientes que puede beneficiarse de esta opción terapéutica. La información disponible de la prevalencia de AGNC en nuestro país procede de un único estudio realizado en pacientes con asma atendidos en las unidades hospitalarias de asma de los servicios de neumología y alergia y que estiman en 3,9% el porcentaje de AGNC atendida en este ámbito concreto46. Recientemente, un estudio realizado en una base de datos de casi dos millones de pacientes que demandaron asistencia sanitaria por cualquier causa en nuestro país47 estimó que la prevalencia de asma era de 5,5% y del total de pacientes asmáticos, 4,9% presentarían asma grave no controlada, estimación similar a la citada anteriormente.
En resumen, el asma es un importante problema de salud en el que todos los aspectos indicados soportan el valor de disponer de información poblacional de calidad sobre esta condición como instrumento necesario para poder dar respuesta adecuada al problema del asma en España.
ObjetivosPrincipal1. Estimar la prevalencia de asma en la población española entre 18 y 79 años y por grupos de edad (décadas) y sexo. 2. Describir la variabilidad de la prevalencia de asma entre comunidades autónomas (CC. A.A.).
Secundarios1. Estimar la prevalencia de asma no diagnosticada (infradiagnóstico). 2. Estimar, entre los pacientes con diagnóstico previo de asma, la prevalencia de mal diagnóstico (sobrediagnóstico). 3. Estimar, entre los pacientes con diagnóstico previo de asma y tratados, la prevalencia de asma no controlada. 4. Estimar la prevalencia de asma en la población española entre 18 y 79 años de cada C. A. 5. Determinar los niveles de eosinofilia periférica y la prevalencia de atopia en los pacientes asmáticos. 6. Estimar la prevalencia de asma corticodependiente. 7. Conocer el consumo de recursos sanitarios (visitas a urgencias y hospitalizaciones) por asma. 8. Establecer una base para la realización de un estudio posterior de seguimiento de los nuevos diagnósticos de asma.
Material y métodosRealizaremos un estudio transversal en población general española entre 18 y 79 años con tarjeta sanitaria. La muestra se seleccionará mediante un procedimiento bietápico con estratificación tanto en la primera etapa como en la segunda. Las unidades de primera etapa (UPE) o conglomerados son los hospitales, y los estratos son las 17 CC. AA.; excluyendo las ciudades autónomas de Ceuta y Melilla. Las unidades de segunda etapa, y unidades de análisis, son los individuos entre 18 y 79 años del área de referencia de los hospitales seleccionados, y se estratificarán en función del sexo y el grupo de edad.
En la primera etapa se seleccionarán hospitales con población asignada y con servicios o unidades de neumología acreditadas por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) para garantizar la capacidad de realizar todas las pruebas necesarias en el estudio. En cada C. A., la selección de los hospitales será aleatoria, si es posible. En el caso de que alguna C. A. no disponga de suficientes centros acreditados, se identificarán centros alternativos que cumplan los mínimos necesarios y se les invitará a participar. En todo caso, la existencia de una unidad acreditada no debería estar relacionada con la prevalencia poblacional de asma por lo que, a efectos del diseño muestral, se asumirá que la selección es aleatoria para que la población muestreada corresponda a toda la población española de 18-79 años residente en las 17 CC. AA. En la segunda etapa del muestreo se seleccionará una muestra aleatoria estratificada de individuos de la población de referencia de cada hospital seleccionado.
Debido a las exploraciones y pruebas necesarias para diagnosticar asma, los hospitales que pueden entrar a formar parte de la muestra deben cumplir las siguientes condiciones:
- •
Públicos o concertados con población asignada.
- •
Con servicios o unidades de asma acreditadas por SEPAR (n = 73) o en los que exista la certeza acerca de la disponibilidad de las pruebas necesarias (tabla 1, material suplementario).
Solo dos CC. AA. (La Rioja y Principado de Asturias) no tienen una unidad acreditada actualmente; pero en ambas hay hospitales que cumplen los requisitos y podrían participar en el estudio. En otras CC. AA., con suficientes centros acreditados, estos se concentran en pocas ciudades. En estos casos, para mejorar la representación geográfica, se han seleccionado algunos hospitales no acreditados pero que disponen de los medios diagnósticos necesarios para realizar el estudio.
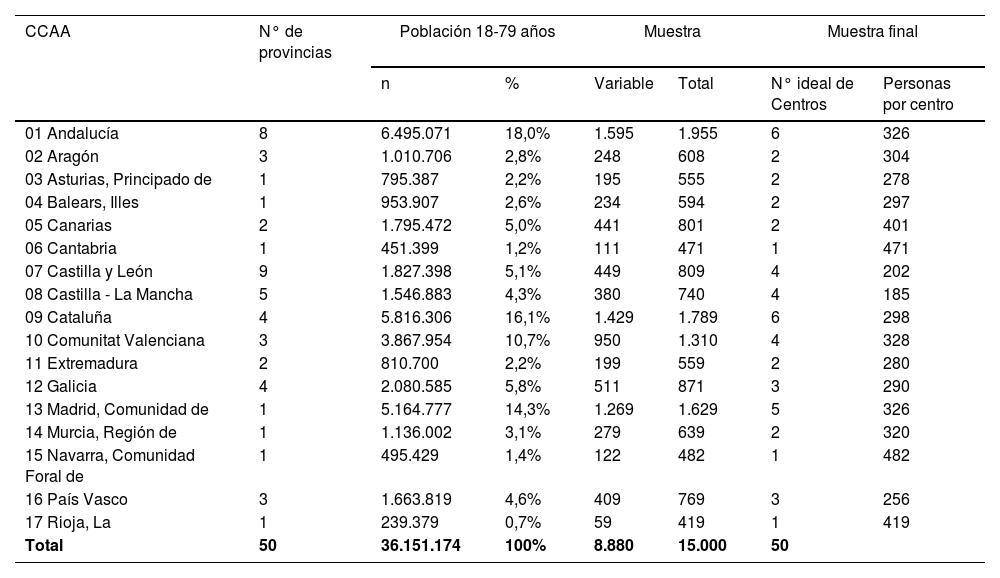
Se propone la selección de 50 hospitales con la distribución que se indica (tabla 1).
Población de 18-79 años residente en España a 1 de enero de 2021 por CA y reparto de la muestra por CA
| CCAA | N° de provincias | Población 18-79 años | Muestra | Muestra final | |||
|---|---|---|---|---|---|---|---|
| n | % | Variable | Total | N° ideal de Centros | Personas por centro | ||
| 01 Andalucía | 8 | 6.495.071 | 18,0% | 1.595 | 1.955 | 6 | 326 |
| 02 Aragón | 3 | 1.010.706 | 2,8% | 248 | 608 | 2 | 304 |
| 03 Asturias, Principado de | 1 | 795.387 | 2,2% | 195 | 555 | 2 | 278 |
| 04 Balears, Illes | 1 | 953.907 | 2,6% | 234 | 594 | 2 | 297 |
| 05 Canarias | 2 | 1.795.472 | 5,0% | 441 | 801 | 2 | 401 |
| 06 Cantabria | 1 | 451.399 | 1,2% | 111 | 471 | 1 | 471 |
| 07 Castilla y León | 9 | 1.827.398 | 5,1% | 449 | 809 | 4 | 202 |
| 08 Castilla - La Mancha | 5 | 1.546.883 | 4,3% | 380 | 740 | 4 | 185 |
| 09 Cataluña | 4 | 5.816.306 | 16,1% | 1.429 | 1.789 | 6 | 298 |
| 10 Comunitat Valenciana | 3 | 3.867.954 | 10,7% | 950 | 1.310 | 4 | 328 |
| 11 Extremadura | 2 | 810.700 | 2,2% | 199 | 559 | 2 | 280 |
| 12 Galicia | 4 | 2.080.585 | 5,8% | 511 | 871 | 3 | 290 |
| 13 Madrid, Comunidad de | 1 | 5.164.777 | 14,3% | 1.269 | 1.629 | 5 | 326 |
| 14 Murcia, Región de | 1 | 1.136.002 | 3,1% | 279 | 639 | 2 | 320 |
| 15 Navarra, Comunidad Foral de | 1 | 495.429 | 1,4% | 122 | 482 | 1 | 482 |
| 16 País Vasco | 3 | 1.663.819 | 4,6% | 409 | 769 | 3 | 256 |
| 17 Rioja, La | 1 | 239.379 | 0,7% | 59 | 419 | 1 | 419 |
| Total | 50 | 36.151.174 | 100% | 8.880 | 15.000 | 50 | |
CA: comunidad autónoma.
El principal condicionante del tamaño muestral en este estudio es disponer de un número de pacientes manejable desde el punto de vista logístico y de recursos que permita ofrecer estimaciones de prevalencia de asma para cada C. A. con una precisión aceptable.
Se parte de un tamaño total de muestra asumible de 15.000 personas. El reparto de esta muestra entre las CC. AA. se hizo en dos pasos, calculando un tamaño fijo para todas las CC. AA. y una parte variable. La parte fija del tamaño de muestra se calculó con criterios de precisión, para garantizar que la prevalencia de asma se puede estimar a nivel de CC. AA. con un margen de error razonable. Los datos asumidos para determinar este tamaño de muestra fueron:
- •
Prevalencia esperada de asma: 5%. Entre 2,6% (Aragón) y 7,4% (Cantabria) según la Encuesta Europea de Salud en España del año 202048.
- •
Precisión o error de muestreo: se analizaron valores entre 2 y 3%. Según las recomendaciones de la Office for National Statistics del Reino Unido (ONS) se consideran como aceptables, en términos de precisión, los coeficientes de variación (CV) inferiores a 20%49 y a 30% son considerados como puntos de corte aceptables en la práctica estándar del National Center for Health Statistics. Para una prevalencia de 5%, valores del CV entre 20 y 30% suponen errores de muestreo de entre 2 y 3%, lo que justifica la selección de estos valores para calcular el tamaño de muestra.
- •
Nivel de confianza: 95%.
- •
Tamaño de la población: se utilizaron las cifras de población residente 18-79 años por C. A. al 1 de enero de 2021, disponibles en la web del Instituto Nacional de Estadística (INE)50 (Anexo 1, material suplementario).
- •
Debido al diseño complejo de la muestra, y a que el tamaño de muestra se calcula con una fórmula que asume un muestreo aleatorio simple, que es más eficiente, el tamaño resultante debería multiplicarse por un efecto de diseño>1, para corregir la pérdida de precisión esperada. Sin embargo, no se aplicó esta corrección porque el tamaño se va a aumentar con la parte variable.
Con estos datos, se obtuvieron tamaños de muestra muy similares para todas las CC. AA., a pesar de las diferencias de población que van desde La Rioja con 239.379 habitantes de 18-79 años hasta la más poblada, Andalucía con 6.495.071 (tabla 2, material suplementario).
A fin de tener suficiente muestra para la parte variable, se consideró un tamaño de muestra mínimo en cada C. A. de 360 personas (error de muestreo de 2,25%), lo que supone una muestra total de 6.120 personas en las 17 CC. AA. La parte restante hasta 15.000 (8.880) se repartió proporcionalmente al tamaño poblacional de las CC. AA. para obtener la parte variable de cada CA (tabla 1).
Este método de reparto del tamaño de muestra garantiza, con la parte fija, que la prevalencia de asma se estima con una precisión adecuada en todas las CC. AA., pero el mismo tamaño de muestra en todas conduciría a probabilidades de selección muy diferentes entre ellas, debido a sus distintos tamaños poblacionales. La parte variable de la muestra trata de compensar un poco estas diferencias asignando más muestra a las CC. AA. más grandes.
El número de individuos a seleccionar en cada hospital se calcula dividiendo el tamaño total de muestra de cada CA entre el número de hospitales participantes de dicha C. A. (tabla 1, material suplementario). Las instrucciones para el muestreo en la segunda etapa (incluyendo la generación de secuencias aleatorias, en caso de que sea necesario) se realizarán centralizadamente y se distribuirán a los centros. Como no será posible disponer de los listados de población asignados a los centros participantes, la selección de las personas con las instrucciones indicadas se realizará por el responsable de la base de datos en cada caso o persona en quién delegue. El tamaño de muestra de cada hospital se repartirá por sexo y grupos de edad de forma proporcional a la distribución de la población que tenga el área hospitalaria.
En el anexo 2 (material suplementario) se recoge la selección de hospitales a incluir.
Para estimar las prevalencias ajustando por el diseño de la muestrazón:
Donde:
- -
h indica el estrato (C. A.), i el conglomerado (hospital) y j el individuo.
- -
Xhij es el valor de la característica que se estima (presencia de asma 0-1) en el individuo j del hospital i de la C. A. h.
- -
Whij es el factor de elevación o ponderación del individuo j del hospital i de la C. A. h.
El factor de elevación de cada individuo de la muestra es el número de personas de la población a las que representa dicho individuo. El cálculo de estos pesos se realiza en dos fases:
Los pesos del diseño se calculan como el inverso de la probabilidad de selección de cada individuo, que es el producto de las probabilidades de selección en cada etapa:
Primera etapa: en cada estrato (C. A.) se selecciona una muestra aleatoria simple de hospitales, o así se asume, con las siguientes probabilidades de selección:
donde Mh denota el número total de hospitales del estrato h y mh el número de hospitales seleccionados; como es habitual en el cálculo de las probabilidades de selección, mh será el número de hospitales que finalmente participen, lo que permite ajustar por la no respuesta (rechazo a participar).
En cada estrato o C. A. deben considerarse como seleccionables los hospitales de referencia que cubran a toda la población de la C. A.
Segunda etapa: para cada hospital de la muestra se selecciona una muestra aleatoria estratificada de individuos 18-79 años de su área, con las siguientes probabilidades:
donde Nhi es el número de individuos 18-79 años asignados al hospital i del estrato h y nhi es el número de individuos seleccionados e incluidos en la muestra. En cada hospital, todos los individuos tendrán la misma probabilidad de selección, aunque el muestreo se haga estratificado por sexo y grupos de edad, debido a que el reparto de la muestra será proporcional al tamaño de los estratos.
Entonces, la probabilidad de selección del individuo i del hospital j del estrato h es:
y la ponderación basada en el diseño para todos los individuos de la muestra del hospital i del estrato h es:
Con esta ponderación se cumple que la suma de los pesos de todos los individuos de una C. A. es una estimación del tamaño poblacional de dicha C. A. y, por tanto, la suma de todos los pesos de la muestra estima la población española de 18-79 años de las 17 CC. AA. Sin embargo, la distribución de la muestra ponderada por grupos de edad y sexo no se corresponde con la distribución poblacional, ya que el sexo y la edad no se tuvieron en cuenta en el diseño de la muestra.
La reponderación o calibrado es un procedimiento que permite ajustar los pesos del diseño para que la población estimada con la muestra coincida con la población objetivo respecto a determinadas características demográficas relacionadas con la enfermedad que se estima. En este estudio se va a reponderar la muestra por C. A., sexo y grupo de edad utilizando el procedimiento propuesto por Deville y Särndal51, con la instrucción calibrate del paquete estadístico Stata v14, Stata CORP, Texas-EE. UU. Para el calibrado se utilizarán las cifras de población residente por CC. AA., sexo y grupo de edad.
Entonces, la probabilidad de selección del individuo i del hospital j del estrato h es:
y la ponderación basada en el diseño para todos los individuos de la muestra del hospital i del estrato h es:
Para la selección de centros y participantes se hará una primera invitación a participar a los centros con base en el número de centros por C. A. recogido en la tabla 1 (y Anexo 2, material suplementario) y se les pedirá la distribución de su población asignada por edad y sexo. En caso de no participación de un centro, se sustituirá el centro seleccionado por otro de la misma C. A., siempre que sea posible.
Una asunción principal del diseño es que debido a los criterios y métodos utilizados para diagnosticar asma, la prevalencia que se estime no dependerá del mayor o menor interés de los investigadores locales por el asma (mayor o menor deseo en participar), sino de otros aspectos (localización geográfica, costa-interior, etc) que deberán estar adecuadamente considerados en la muestra. Debido a esta asunción, se utilizará el número de hospitales de la red pública de cada C. A. para asignar la probabilidad de selección (teórica) de la primera etapa.
Las variables estudiadas, que se presentan en el cuaderno de recogida de datos (anexos 3 a 7, material suplementario), incluirán: 1) información sobre la participación y causas de no participación, en las siguientes categorías: a) no ha sido posible participar (tras los intentos que se determinen en los procedimientos de contacto; b) no desea participar (y, eventualmente, las causas en grandes categorías) y c) participa. 2) Datos generales del hospital: localización, confirmación de cumplimiento de los criterios de inclusión, distribución por edad y sexo de la población asignada. 3) Datos de los individuos incluidos, que se desarrolla en tres fases: cribado y confirmación en historia clínica, diagnóstico de asma y caracterización del asma.
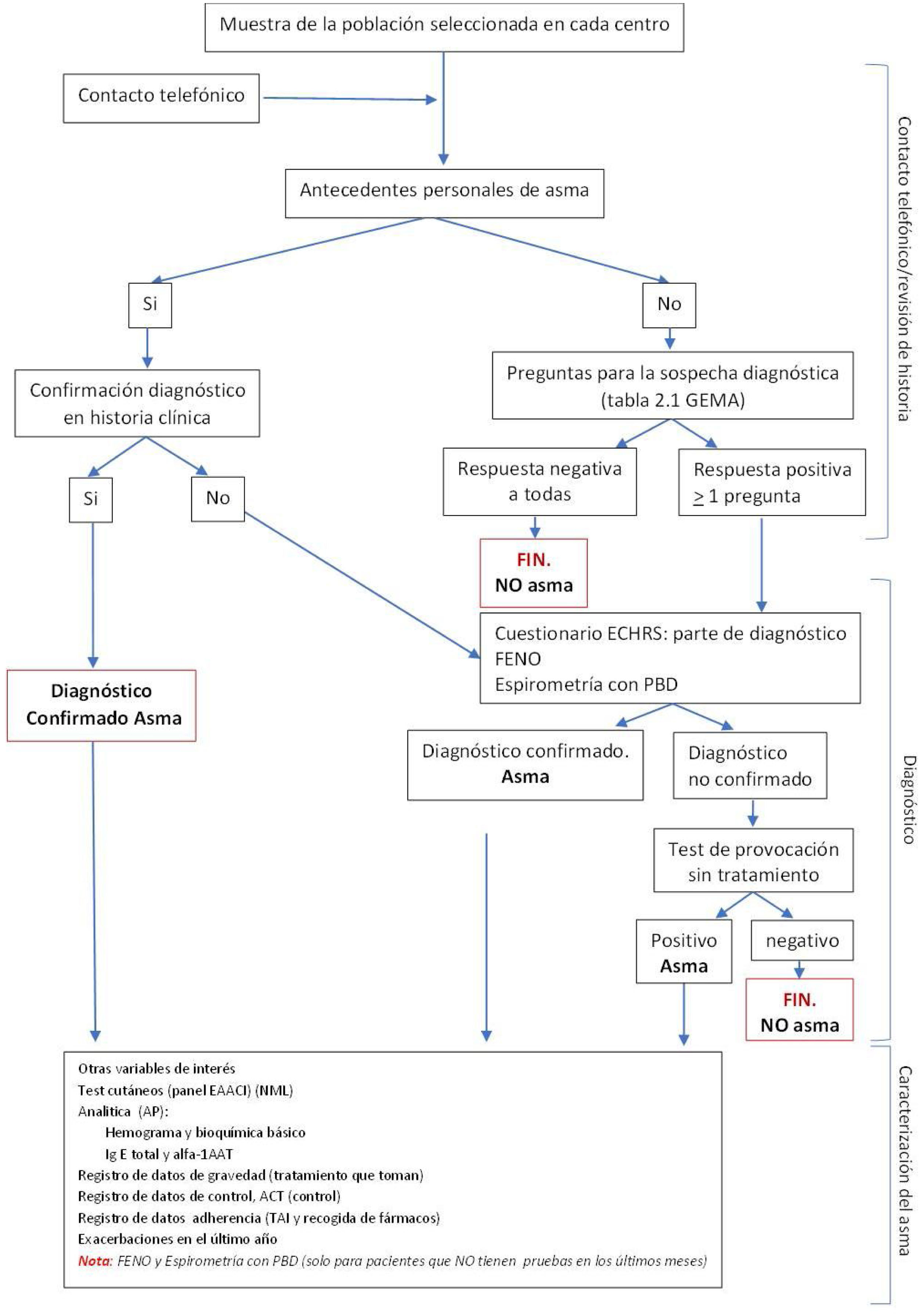
La fase de cribado y confirmación se realiza mediante la revisión de la información recogida en la historia clínica y llamada telefónica si es necesario (fig. 1), incluyendo:
Filiación y datos generales: lugar de residencia (código postal y tipo de hábitat, rural o urbano) y de nacimiento de los participantes, tiempo de residencia, sexo, fecha de nacimiento y de realización del estudio.
Antecedentes personales de diagnóstico de asma, edad del diagnóstico y confirmaciónFactores de riesgo de asma que incluirá, entre otros, información de profesión de riesgo (sí/no, con base en clasificación aceptada), tabaquismo, autopista/autovía a<200 m de vivienda, presencia de mascotas (perros o gatos) en el domicilio, diagnósticos previos de rinitis y/o atopia y antecedentes en familiares de primer grado (padres, hijos o hermanos) de diagnóstico de asma o alergia.
Preguntas específicas de sospecha de asma3 en los pacientes sin antecedentes de asma (anexo 3, material suplementario). Si responde «No» a todas las preguntas del cuestionario de despistaje de asma se clasifica al participante como «No asma» y finaliza su participación en el estudio. Si responde «Sí» a las preguntas del cuestionario, se revisará la historia clínica para confirmar el diagnóstico de forma objetiva y, en caso positivo, se cita directamente para la fase de caracterización del asma (fig. 1). Al resto de participantes se les citará para la fase de diagnóstico.
En la fase de diagnóstico, que aplica a los pacientes en los que no se ha descartado ni confirmado asma, se realizará en el hospital recogiendo información con un cuestionario específico desarrollado a partir del utilizado en la ECHRS (Anexo 4, material suplementario), examen del óxido nítrico exhalado (FeNO), espirometría con prueba de broncodilatación (PBD) y test de provocación bronquial si fuera necesario (fig. 1). Se considerará confirmado el diagnóstico de asma si se cumplen los criterios reflejados en la guía GEMA 5.2 para considerar una respuesta broncodilatadora positiva que pueden ser un aumento del FEV1 ≥ 12% y ≥ 200 mL respecto al valor basal tras administrar cuatro inhalaciones sucesivas de 100 μg de salbutamol o equivalente, o un aumento del flujo espiratorio máximo (PEF)>20%. La reversibilidad también puede ser identificada por una mejoría del FEV1 o del PEF tras dos semanas de tratamiento con glucocorticoides sistémicos (40 mg/día de prednisona o equivalente) o dos a ocho semanas de glucocorticoides inhalados (1.500-2.000 μg/día de propionato de fluticasona o equivalente)3,52,53.
La fase de caracterización del asma se realizará en el hospital, incluyendo unicamente los casos con diagnóstico de asma. Se recogerá información sobre otros antecedentes personales y familiares y hábitos de vida, test cutáneos de sensibilización alérgica utilizando el panel de la European Academy of Allergy and Clinical Immunology (EAACI), analítica que incluirá hemograma y bioquímica básica, IgE total y alfa-1 antitripsina. Se recogerán datos de gravedad del asma basándose en el escalón de tratamiento para el asma (anexo 5, material suplementario), incluyendo tratamiento inhalado (nombre/presentación/posología), corticoides orales de mantenimiento (fármaco y dosis), montelukast, azitromicina, fármacos biológicos y corticoides nasales. La información sobre adhesión o cumplimiento se evaluará mediante el cuestionario de adhesión a los inhaladores (TAI) y la recogida según la receta electrónica (confirmación de retirada de la farmacia de ≥ 80% de las recetas prescritas en los últimos seis meses, anotando el número de recetas prescritas y el número de recetas retiradas (Anexo 6, material suplementario)54. El control del asma se evaluará mediante el cuestionario ACT (Anexo 7, material suplementario) y según la escala de la guía GEMA3 basándose en síntomas diurnos, síntomas nocturnos, necesidad de medicación de rescate, limitaciones de la vida diaria o del ejercicio físico, exacerbaciones en el último año y función pulmonar. Si no hay datos disponibles en los últimos tres meses antes de la visita del estudio se realizará espirometría y FeNO para actualizar estos valores.
La realización del estudio estará centrada en el hospital. El contacto en la fase de cribado será telefónico, mientras que las fases de diagnóstico y caracterización del asma requerirán ser realizadas en el hospital.
En caso de nuevo diagnóstico de asma, las pruebas complementarias para caracterizar mejor el asma del paciente y administrar el tratamiento necesario se realizarán tanto en atención primaria como en el hospital. A partir de ahí, el paciente seguirá la vía clínica habitual en su área.
Debido al carácter poblacional del estudio, es clave la participación de las autoridades sanitarias, en particular en lo que se refiere a acceso a los participantes y actividades de divulgación en los medios de comunicación previas al inicio del estudio para mejorar la participación.
DefinicionesAsma. Se clasificarán como asma todos los participantes que presenten síntomas compatibles y tengan respuesta broncodilatadora positiva o FeNO ≥ 40 ppb y/o metacolina positiva.
Asma no controlada. Se clasificarán como asma no controlada todos los participantes diagnosticados previamente de asma que tengan puntuación ACT<20 y/o clasificación de control del asma según GEMA en las categorías «parcialmente controlada» o «no controlada».
Asma grave. Se clasificarán como asma grave todos los participantes diagnosticados previamente de asma que reciban tratamiento como mínimo con dosis altas de corticoides inhalados asociados con un beta agonista de larga duración.
Gestión de datosSe desarrollará una plataforma online para la entrada de datos desde los centros y que incluirá filtros (de valores y relaciones entre variables) y alarmas para mejorar la calidad de los datos.
Control de calidad y monitorización del estudioSe realizará a través de las siguientes vías: a) minimización de la ausencia de datos y datos erróneos mediante la plataforma online de entrada de datos; b) monitorización de progresos en cada centro. Se realizará centralizadamente desde la oficina del proyecto a través de plataforma online y contacto directo con los centros; c) se prepararán boletines periódicos de información de la evolución del estudio y se realizarán reuniones con los investigadores principales de los centros durante el desarrollo del mismo; d) generación y solución de dudas a través de plataforma de entrada de datos y desde oficina del proyecto; e) no se propone la realización de visitas a los centros por monitores.
Análisis de los datosIndicadores de frecuenciaSe estimará la prevalencia puntual y su intervalo de confianza del 95% (IC 95%) para todas las condiciones de interés. Cada participante se ponderará de manera inversa a la probabilidad de ser seleccionado, según se detalla en el aparado de muestreo. Se realizará análisis global ponderando a la distribución de la población española por edad y sexo y por grupos específicos de edad (décadas) y sexo. Se presentarán estimaciones de prevalencia crudas y ajustadas por edad para cada C. A. con su correspondiente IC 95%.
Coordinación y estandarización de métodosCada centro tendrá un investigador principal (IP) y se designará un coordinador autonómico entre los IPs de los hospitales de cada C. A.
Comité Científico estará constituido por miembros de SEPAR y por los expertos que esta considere. Aprobará el protocolo, el manual de procedimientos, los procedimientos de control de calidad y establecerá la política de publicaciones del grupo; además definirá las normas éticas a seguir durante el estudio. Podrá decidir y autorizar la realización de análisis estadísticos de los datos del estudio. Es el único comité que podrá realizar cambios en el protocolo. Elaborará una lista oficial de centros participantes e investigadores para su colocación a pie de portada o en anexo en las publicaciones conjuntas. Este comité se reunirá una vez al año y cuando el comité ejecutivo lo crea necesario.
Comité Ejecutivo: estará constituido por miembros de SEPAR y por los coordinadores autonómicos del estudio. Este comité se reunirá como mínimo dos veces al año. Será el responsable del seguimiento y desarrollo del proyecto. Designará los miembros y los cometidos del comité de control de calidad u otros que se organicen. Dará instrucciones al centro coordinador sobre los análisis de datos que debe realizar y velará para que se cumpla el protocolo, las normas éticas y la política de publicaciones que haya establecido el Comité Científico.
Centro Coordinador: Pendiente de selección
FuncionesAsistir al Comité Ejecutivo en las tareas de coordinación (carteos, difusión de la información, recordatorios de envío de informes e impresos, etc.).
Desarrollar el protocolo, manual de operaciones e impresos de recogida de datos del estudio.
Crear y mantener las bases de datos del estudio.
Crear y mantener el registro general del estudio.
Desarrollar y estudiar los indicadores de control de calidad del estudio. Ejecutar los procedimientos de control de calidad y monitorización que decida el Comité Directivo.
Producir los resultados oficiales del estudio respecto a los objetivos del proyecto.
Suministrar a los centros participantes los análisis de datos o copias de las bases de datos «oficiales» del grupo de estudio que autorice el Comité Ejecutivo o el Comité Directivo.
Entrenamiento para el trabajo de campoAntes de empezar el estudio se elaborarán materiales de entrenamiento y se realizarán reuniones virtuales con los investigadores que vayan a realizar el trabajo de campo para estandarizar criterios y procedimientos y solucionar dudas.
Política de publicacionesLos investigadores se comprometen a publicar conjuntamente los resultados globales del estudio.
Cada investigador es libre de publicar otros resultados individualmente o combinados con los de otros centros participantes siempre que no interfieran con la publicación conjunta. El investigador que impulse la realización de una publicación es responsable de informar al Comité Ejecutivo de sus intenciones, de su redacción, y de decidir el orden de los autores que figurarán en el encabezamiento. Si lo desea, el Centro Coordinador proporcionará los análisis estadísticos que precise con los datos utilizados para el proyecto.
Para utilizar el nombre del estudio en cualquier publicación, el manuscrito final deberá contar con la aprobación del Comité Ejecutivo (sin que por ello deba necesariamente aparecer ninguno de los miembros de dicho Comité entre los autores).
En las publicaciones oficiales del estudio aparecerá la lista de centros e investigadores participantes en el orden y forma que haya establecido el Comité Directivo.
Aspectos éticos y legalesEl acceso inicial a la población se realizará a partir de una selección aleatoria realizada en cada C. A., tomando como base la tarjeta sanitaria. Para ello será necesario contar con la aprobación del estudio al nivel más alto posible, se propone el Consejo Interterritorial de Sanidad. Los pacientes en los que mediante cuestionario telefónico se descarte asma no serán contactados de nuevo y la información correspondiente se guardará anonimizada. Los pacientes en los que no se pueda descartar asma en la encuesta telefónica serán invitados a participar en el estudio y se les solicitará en el momento de la primera visita su consentimiento informado, que incluirá la posibilidad de contactos en el futuro relacionados con su diagnóstico de asma (Anexo 8, material suplementario).
DiscusiónEl desarrollo de un proyecto de investigación debe identificar una pregunta clínica relevante e intentar responder a esta aplicando el método científico de forma sistemática, organizada y objetiva55,56. En nuestro caso la pregunta clínica parece claramente justificada dado que el asma es una enfermedad con elevada prevalencia que genera costes socioeconómicos relevantes1-6. Además, la prevalencia de la enfermedad presenta una amplia variabilidad entre las diferentes zonas geográficas donde se han realizado estudios11,13. Actualmente no se dispone de estudios poblacionales que permitan conocer la prevalencia de la enfermedad en España, aunque investigaciones realizadas en algunas zonas geográficas del país, tanto en niños como en adultos, parecen confirmar la variabilidad en la prevalencia observada en otros países14,20,21,22. Además, conocer la epidemiología de una enfermedad es un factor para establecer estrategias asistenciales, docentes e investigadoras57,58. Partiendo de esta evidencia, el objetivo principal de nuestro estudio es estimar la prevalencia de asma en población adulta de España realizando un estudio transversal bietápico. Aunque la selección de centros hospitalarios no será estrictamente aleatoria, dada la necesidad de disponer de los medios necesarios para alcanzar un correcto diagnóstico, consideramos que la población incluida será aceptablemente representativa de la población española, dado que las unidades de segunda etapa y unidades de análisis son todos los individuos del área sanitaria de ese hospital, y no solo los atendidos en las unidades de asma, ya que esto último podría condicionar un sesgo hacia los casos más graves de la enfermedad.
Muchos de los estudios poblacionales de prevalencia de asma se basan en cuestionarios, sin realizar estudios complementarios objetivos para demostrar atopia o hiperreactividad bronquial59-61. Con esta metodología se consiguen resultados válidos62, pero es bien conocido que el diagnóstico definitivo de asma requiere estudios complementarios, entre los cuales la espirometría y la prueba broncodilatadora son claves2,3. Es por esto que en nuestro estudio se realizarán las exploraciones necesarias en los hospitales de referencia de la población incluida, para alcanzar el diagnóstico de asma de acuerdo con lo indicado en las guías2,3. Esto nos permitirá, además, identificar y cuantificar la incidencia de sobre e infradiagnóstico en nuestra población. El infradiagnóstico puede deberse a que el paciente minimice la sintomatología y no comunique estos datos a sus médicos o a que el médico relacione estos síntomas con otro diagnóstico. En el caso del sobrediagnóstico, unos síntomas debidos a otra enfermedad son erróneamente atribuidos al asma11. Diversos estudios muestran que, en población adulta, la tasa de infradiagnóstico oscila entre 19 y 73%, mientras que el sobrediagnóstico parece ser un poco menos frecuente, entre 30 y 35% de los pacientes11. Las tasas de diagnósticos erróneos son especialmente relevantes en algunos pacientes como los obesos o los de edad avanzada63-66.
Otro aspecto relevante del asma es la heterogeneidad de la enfermedad, tanto en la presentación clínica, como en las comorbilidades asociadas o los mecanismos fisiopatológicos subyacentes, lo cual condiciona distintas respuestas al tratamiento en pacientes que pueden parecer inicialmente similares67-69. Para optimizar este aspecto, en lo que hemos denominado fase de caracterización del asma, se hará un estudio hospitalario, incluyendo únicamente los pacientes con diagnóstico de asma confirmado, para identificar los fenotipos de la enfermedad que presentan estos pacientes.
En conclusión, la necesidad de un estudio epidemiológico del asma en España parece bien sustentada y factible en las condiciones en qué se ha diseñado. Esto nos permitirá identificar la prevalencia de asma en España, optimizar la planificación sanitaria, caracterizar los fenotipos más frecuentes de la enfermedad y evaluar los diagnósticos erróneos.
Contribución de los autoresTodos los autores participaron igualmente en el diseño del estudio, redacción del artículo y aprobación de la versión final.
FinanciaciónEste trabajo ha sido financiado por el Foro Autonómico de Asma-SEPAR.
Conflicto de interesesGarcía-Río F ha recibido remuneración por ponencias de AstraZeneca, Boehringer Ingelheim, Chiesi, GlaxoSmithKline, Menarini, Novartis, Pfizer y Rovi, y financiación para investigación de Chiesi, Esteve, Gebro Pharma, GlaxoSmithKline, Menarini, Roche y Teva.
Gonzalez-Barcala FJ ha recibido recibido remuneración por ponencias o financiación para investigación de ALK, AstraZeneca, Bial, Boehringer-Ingelheim, Chiesi, Gebro Pharma, GlaxoSmithKline, Laboratorios Esteve, Menarini, Mundipharma, Novartis, Rovi, Roxall, Sanofi, Stallergenes Greer y Teva.
Muñoz X ha recibido recibido remuneración por ponencias o financiación para investigación de AstraZeneca, Boehringer Ingelheim, Chiesi, Faes, Gebro, GlaxoSmithKline, Menarini, Mundifarma, Novartis, Sanofi, Teva.
Plaza V ha recibido recibido remuneración por ponencias o financiación para investigación de Astrazeneca, Boehringer Ingelheim, Chiesi, Gebro, GSK, Luminova-Medwell, Novartis, Sanofi y Teva.
Soto JG declara haber recibido en los tres últimos años honorarios por participar como orador en reuniones patrocinadas por Sanofi, AstraZeneca, Novartis, GSK, Gebro y Teva y como consultor de AstraZeneca, GSK, Chiesi y Bial. Recibió ayudas económicas para la asistencia a congresos por parte de Bial, Menarini y Novartis ayudas para proyectos de investigación provenientes de AstraZeneca,GSK y Sanofi.
Almonacid C ha recibido recibido remuneración por ponencias o financiación para investigación de AstraZeneca, Chiesi, GSK, Novartis, Boehringer Ingelheim, Sanofi y MSD.
Los demás autores no declaran ningún conflicto de interés.