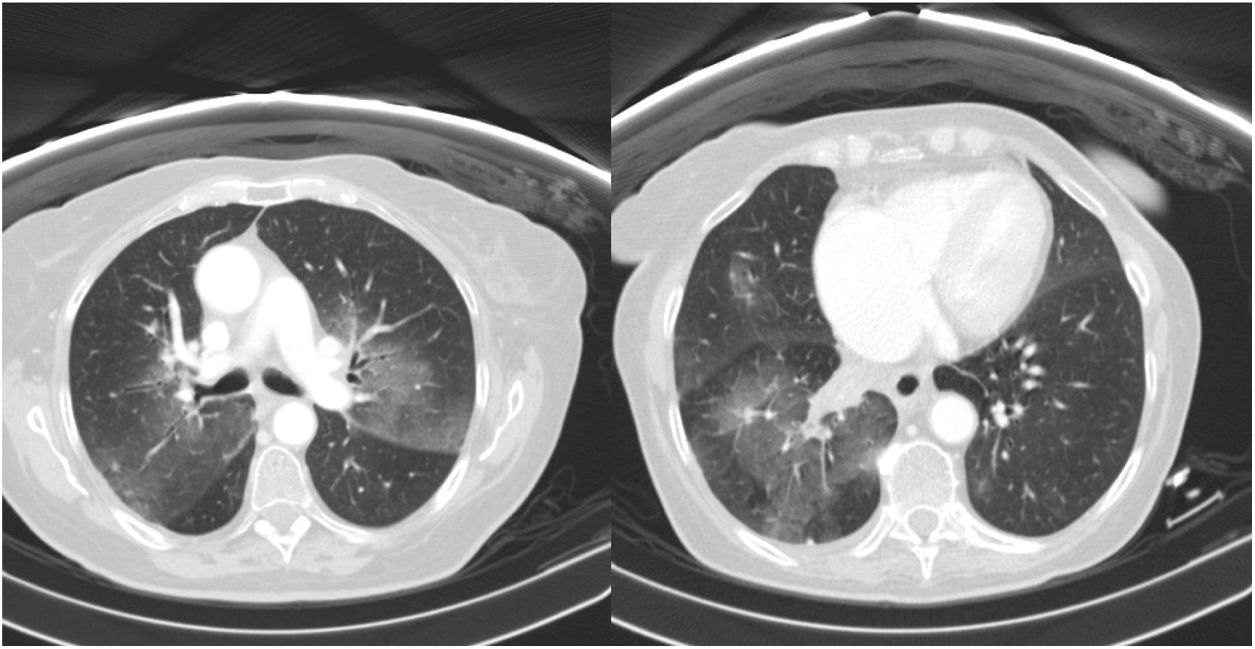
En los últimos años un mejor conocimiento de las bases moleculares del cáncer ha permitido la identificación de dianas moleculares y el desarrollo de fármacos altamente eficaces. En el caso del cáncer de pulmón no microcítico (CPNM), la identificación de la mutación de EGFR (receptor del factor de crecimiento epidérmico) supuso una revolución, con el desarrollo de fármacos específicos, que aumentaron la supervivencia de estos pacientes. Sin embargo, estas terapias no están exentas de toxicidad, la más conocida y fácil de manejar es la cutánea y digestiva. La toxicidad pulmonar está descrita, siendo muy infrecuente y difícil de diagnosticar, por lo que puede llegar a ser una complicación potencialmente mortal. En nuestra carta científica exponemos el caso de una paciente de 60 años, sin hábitos tóxicos conocidos, con antecedentes de estenosis aórtica grave. Durante una revisión, en la placa de tórax se objetivó una lesión pulmonar derivándose a Neumología para su estudio. El escáner toracoabdominopélvico (TAC) mostró una masa pulmonar de 40×35×50mm de diámetro con afectación mediastínica extensa y lesiones nodulares pulmonares múltiples. El estudio se completó con una tomografía por emisión de positrones (PET TAC) que confirmó los hallazgos anteriores y mostró afectación hepática extensa. Posteriormente, con la intención de obtener un diagnóstico anatomopatológico de la lesión, se realizó una fibrobroncoscopia con toma de biopsia concluyente para carcinoma de célula no pequeña con perfil inmunohistoquímico de adenocarcinoma (TTF1 positivo y p63 negativa). Ante la presencia de un adenocarcinoma en un paciente no fumador se solicitó un panel mutacional, identificándose una mutación de EGFR, concretamente una deleción del exón 19, por lo que se inició tratamiento dirigido con fármaco anti-EGFR (gefitinib) consiguiéndose un rápido control de la enfermedad a nivel clínico y radiológico. Sin embargo, a los 3 meses del inicio del tratamiento la paciente comenzó con sintomatología respiratoria no presente previamente en forma de disnea de mínimos esfuerzos y tos seca, documentándose una insuficiencia respiratoria aguda. Ante esta situación, se repitió la TAC documentándose imágenes sugestivas de enfermedad pulmonar intersticial de nueva aparición (EPI) (fig. 1). Con la sospecha clínica de una EPI por fármacos se realizó una fibrobroncoscopia cuyos resultados descartaron otras causas para el deterioro respiratorio. En esta situación, se decidió la suspensión del gefitinib, con una mejoría leve de los síntomas respiratorios a las 24h, e iniciar una pauta de corticoides junto con broncodilatadores para el control sintomático del cuadro. Con estas medidas, la clínica de la paciente fue remitiendo en cuestión de días. Sin embargo, ante la imposibilidad de reanudar el tratamiento dirigido por el desarrollo de una EPI secundaria a gefitinib, la enfermedad progresó rápidamente provocando el fallecimiento de la paciente unos meses más tarde.
En nuestra carta científica queremos resaltar dos puntos: por un lado, la importancia de un adecuado diagnóstico y tratamiento en los pacientes no fumadores y por otro, la existencia de toxicidades infrecuentes pero graves con los nuevos tratamientos disponibles. En la actualidad, es conocida la necesidad de buscar una diana molecular ante la presencia de un adenocarcinoma de pulmón diagnosticado en pacientes no fumadores1–3. La mutación de EGFR es la alteración más frecuente en este grupo de pacientes, con una frecuencia de aproximadamente un 10%, siendo asimismo la deleción del exón 19 la alteración más común, seguida por la inserción del exón 214. Su identificación permite el inicio de tratamiento dirigido con fármacos anti-tirosina quinasa, con resultados claramente superiores a la quimioterapia clásica y con menos toxicidad5–8. En nuestro caso se identificó una deleción del exón 19, permitiendo el inicio de tratamiento en una paciente cardiópata conocida, con pocas opciones terapéuticas con los esquemas clásicos de quimioterapia y con un control óptimo de la enfermedad. Sin embargo, un problema al que nos enfrentamos actualmente es a la aparición de nuevos patrones de toxicidad con los fármacos dirigidos, como ocurre en nuestro caso9. La existencia de EPI por fármacos oncológicos es bien conocida, existiendo múltiples casos descritos con fármacos citotóxicos tradicionales10. Su etiopatogenia no está del todo clara, barajándose hipótesis que hablan de una posible lesión oxidativa, daño vascular pulmonar, un mecanismo inmunológico o un efecto tóxico directo del fármaco11. En el caso de los fármacos anti-EGFR, los últimos estudios realizados plantean la presencia de polimorfismos que influirían tanto en la eficacia como en la toxicidad de forma general, necesitándose a día de hoy más estudios al respecto12. Otra línea de investigación reciente plantea que el bloqueo de la vía celular de EGFR se relacionaría con un aumento de TNF alfa y con un mayor riesgo de enfermedad inflamatoria pulmonar13. No obstante, en la actualidad el mecanismo por el cual se produce EPI es desconocido. Los diferentes estudios con gefitinib en población caucásica han reportado una tasa de EPI que oscila entre el 1-1,5%, existiendo por lo menos 3 casos con desenlace mortal6,14. Se caracteriza por la aparición de sintomatología respiratoria que puede ser aguda o subaguda, siendo los síntomas más frecuentes la tos seca, fiebre y disnea progresiva. Este cuadro se acompaña de la aparición de infiltrados pulmonares habitualmente múltiples visibles en la TAC. Las pruebas funcionales reflejan una restricción con disminución de la DLCO. Su diagnóstico es de exclusión: la fibrobroncoscopia puede ayudar al observarse en el lavado broncoalveolar una intensa linfocitosis, en ausencia de otras causas posibles15. Actualmente, no existe ningún factor que permita predecir qué pacientes pueden desarrollar esta toxicidad, aunque sí parece, por los datos de los diversos estudios, que puede ser más frecuente en pacientes cardiópatas, con diagnóstico reciente de cáncer de pulmón (<6 meses) y mal estado general9. En cuanto a su manejo clínico, se debe suspender inmediatamente el fármaco causante e iniciar tratamiento de soporte con corticoides si existe cuadro de broncoespasmo, con un seguimiento evolutivo para su ajuste. En conclusión, la EPI es una enfermedad infrecuente pero potencialmente mortal, que puede aparecer con las nuevas terapias para el CPNM y por lo tanto, debemos conocerla.