La tromboembolia de pulmón (TEP), la forma más grave de presentación de la enfermedad tromboembólica venosa (ETV), constituye actualmente un problema sanitario de primer orden, por su elevado impacto en términos de morbimortalidad, costes y consumo de recursos. La mortalidad temprana asociada a la TEP se debe fundamentalmente a inestabilización hemodinámica, agravamiento de enfermedades previas o complicaciones asociadas al tratamiento de la TEP. Más allá de la mortalidad, existen complicaciones relevantes relacionadas con la TEP, como los sangrados asociados a la anticoagulación, las recurrencias ETV y la persistencia de síntomas respiratorios residuales; esta última complicación relacionada con la TEP está caracterizada principalmente por dos entidades, la hipertensión pulmonar tromboembólica crónica y la enfermedad tromboembólica crónica pulmonar. Los relevantes avances científicos realizados en los últimos años han permitido mejorar el manejo tanto diagnóstico como terapéutico de la enfermedad, tal y como se expone en el presente documento mediante una serie de preguntas relevantes sobre la TEP que son respondidas con la mejor evidencia científica actualmente disponible.
Pulmonary embolism (PE), the most severe form of presentation of venous thromboembolic disease (VTE), currently represents a foremost healthcare issue due to its high impact in terms of morbidity, mortality, costs, and resource consumption. Early mortality associated with PE is primarily due to hemodynamic instability, exacerbation of pre-existing conditions, or major complications of antithrombotic therapies. Beyond the risk of death, there are relevant complications related to PE, such as bleedings, VTE recurrences, and persistence of residual respiratory symptoms; the latter complication related to PE is mainly characterized by two entities, chronic thromboembolic pulmonary hypertension and chronic thromboembolic disease. Significant scientific advances made in recent years have allowed for the improvement of both diagnostic and therapeutic management of the disease, as outlined in this document through a series of relevant issues about PE that are answered with the most up-to-date scientific evidence.
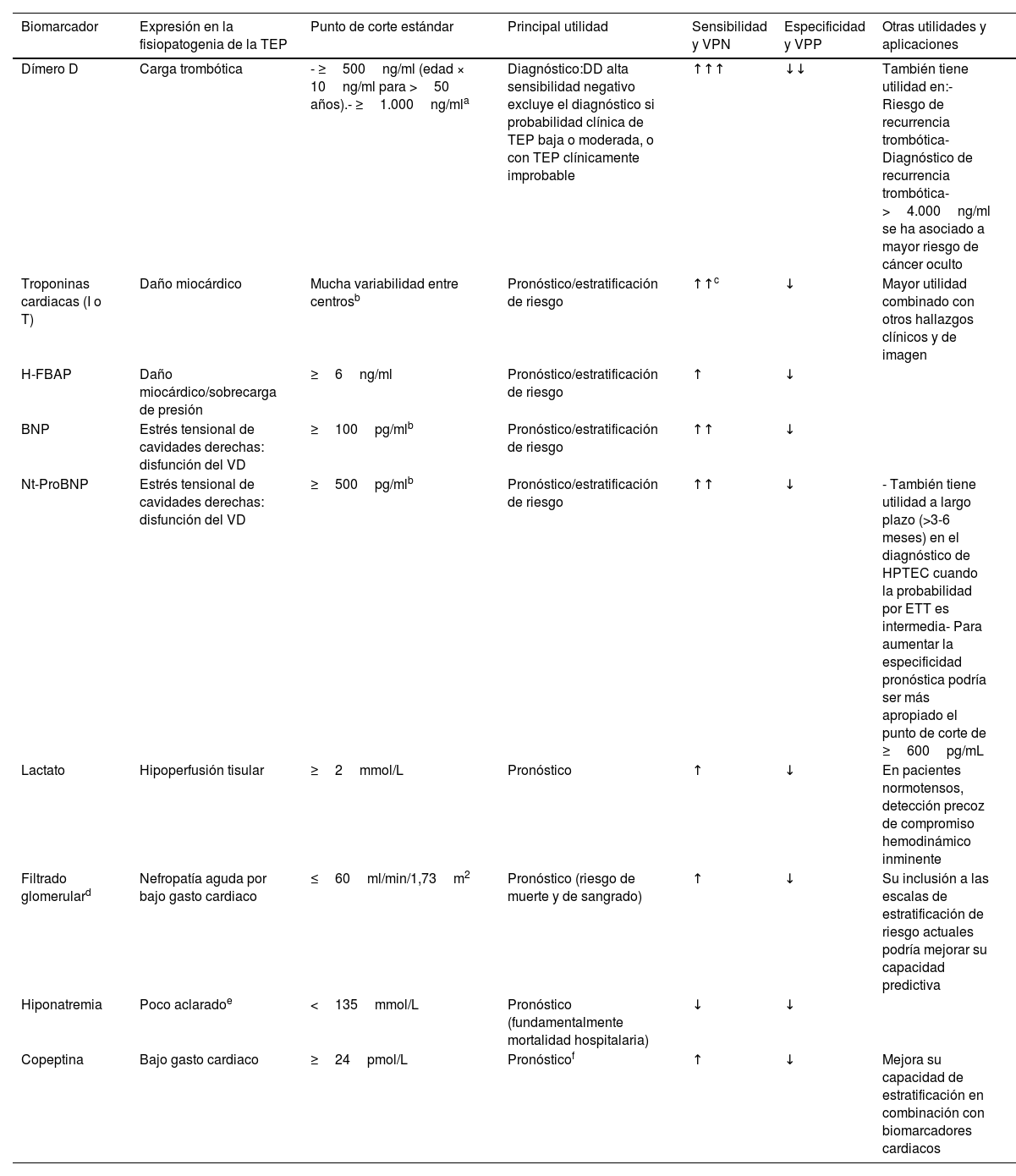
Determinados biomarcadores sanguíneos facilitan, de forma rápida y sencilla, la orientación diagnóstica, la valoración pronóstica y el consecuente manejo terapéutico de la tromboembolia pulmonar (TEP) (tabla 1).
Características de los principales biomarcadores sanguíneos en la valoración diagnóstica y pronóstica de la tromboembolia pulmonar
| Biomarcador | Expresión en la fisiopatogenia de la TEP | Punto de corte estándar | Principal utilidad | Sensibilidad y VPN | Especificidad y VPP | Otras utilidades y aplicaciones |
|---|---|---|---|---|---|---|
| Dímero D | Carga trombótica | - ≥500ng/ml (edad × 10ng/ml para >50 años).- ≥1.000ng/mla | Diagnóstico:DD alta sensibilidad negativo excluye el diagnóstico si probabilidad clínica de TEP baja o moderada, o con TEP clínicamente improbable | ↑↑↑ | ↓↓ | También tiene utilidad en:- Riesgo de recurrencia trombótica- Diagnóstico de recurrencia trombótica- >4.000ng/ml se ha asociado a mayor riesgo de cáncer oculto |
| Troponinas cardiacas (I o T) | Daño miocárdico | Mucha variabilidad entre centrosb | Pronóstico/estratificación de riesgo | ↑↑c | ↓ | Mayor utilidad combinado con otros hallazgos clínicos y de imagen |
| H-FBAP | Daño miocárdico/sobrecarga de presión | ≥6ng/ml | Pronóstico/estratificación de riesgo | ↑ | ↓ | |
| BNP | Estrés tensional de cavidades derechas: disfunción del VD | ≥100pg/mlb | Pronóstico/estratificación de riesgo | ↑↑ | ↓ | |
| Nt-ProBNP | Estrés tensional de cavidades derechas: disfunción del VD | ≥500pg/mlb | Pronóstico/estratificación de riesgo | ↑↑ | ↓ | - También tiene utilidad a largo plazo (>3-6 meses) en el diagnóstico de HPTEC cuando la probabilidad por ETT es intermedia- Para aumentar la especificidad pronóstica podría ser más apropiado el punto de corte de ≥600pg/mL |
| Lactato | Hipoperfusión tisular | ≥2mmol/L | Pronóstico | ↑ | ↓ | En pacientes normotensos, detección precoz de compromiso hemodinámico inminente |
| Filtrado glomerulard | Nefropatía aguda por bajo gasto cardiaco | ≤60ml/min/1,73m2 | Pronóstico (riesgo de muerte y de sangrado) | ↑ | ↓ | Su inclusión a las escalas de estratificación de riesgo actuales podría mejorar su capacidad predictiva |
| Hiponatremia | Poco aclaradoe | <135mmol/L | Pronóstico (fundamentalmente mortalidad hospitalaria) | ↓ | ↓ | |
| Copeptina | Bajo gasto cardiaco | ≥24pmol/L | Pronósticof | ↑ | ↓ | Mejora su capacidad de estratificación en combinación con biomarcadores cardiacos |
BNP: péptido natriurético tipo B; DD: dímero D; ETT: ecocardiografía transtorácica; H-FBAP: proteína ligadora de ácidos grasos cardiacos; HPTEC: hipertensión pulmonar tromboembólica crónica; Nt-proBNP: fragmento amino-terminal del proBNP; TEP: tromboembolia de pulmón; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
El dímero D, un producto de degradación de la fibrina, se eleva desde la primera hora tras la formación del trombo hasta 7 días después1. Su cuantificación mediante la técnica de ELISA es considerada la estándar, con una elevada sensibilidad diagnóstica pero una especificidad baja, ya que puede elevarse en otras situaciones clínicas distintas a la TEP, como en la insuficiencia cardiaca o la sepsis. Así, su interpretación adecuada vendrá definida por la probabilidad clínica pretest2. Por lo tanto, un dímero D normal permite excluir el diagnóstico de TEP en pacientes con probabilidad clínica baja o moderada de TEP, o con TEP clínicamente improbable3,4. El punto de corte clásico del dímero D (500ng/ml) puede ajustarse a la edad (edad×10ng/ml a partir de los 50 años), la clínica (estrategia YEARS, incluidas embarazadas) y la probabilidad clínica (escala de Wells)5. En el seguimiento, los niveles elevados de dímero D se han asociado a un mayor riesgo de recurrencia trombótica en caso de suspensión de la anticoagulación. Así, en pacientes con TEP no provocada, se considera el valor del dímero D a las 3-5 semanas de suspender la anticoagulación (normograma de Viena y escala DASH) o mientras el paciente está con el tratamiento anticoagulante (escala HERDOO2) para decidir la duración del tratamiento anticoagulante6.
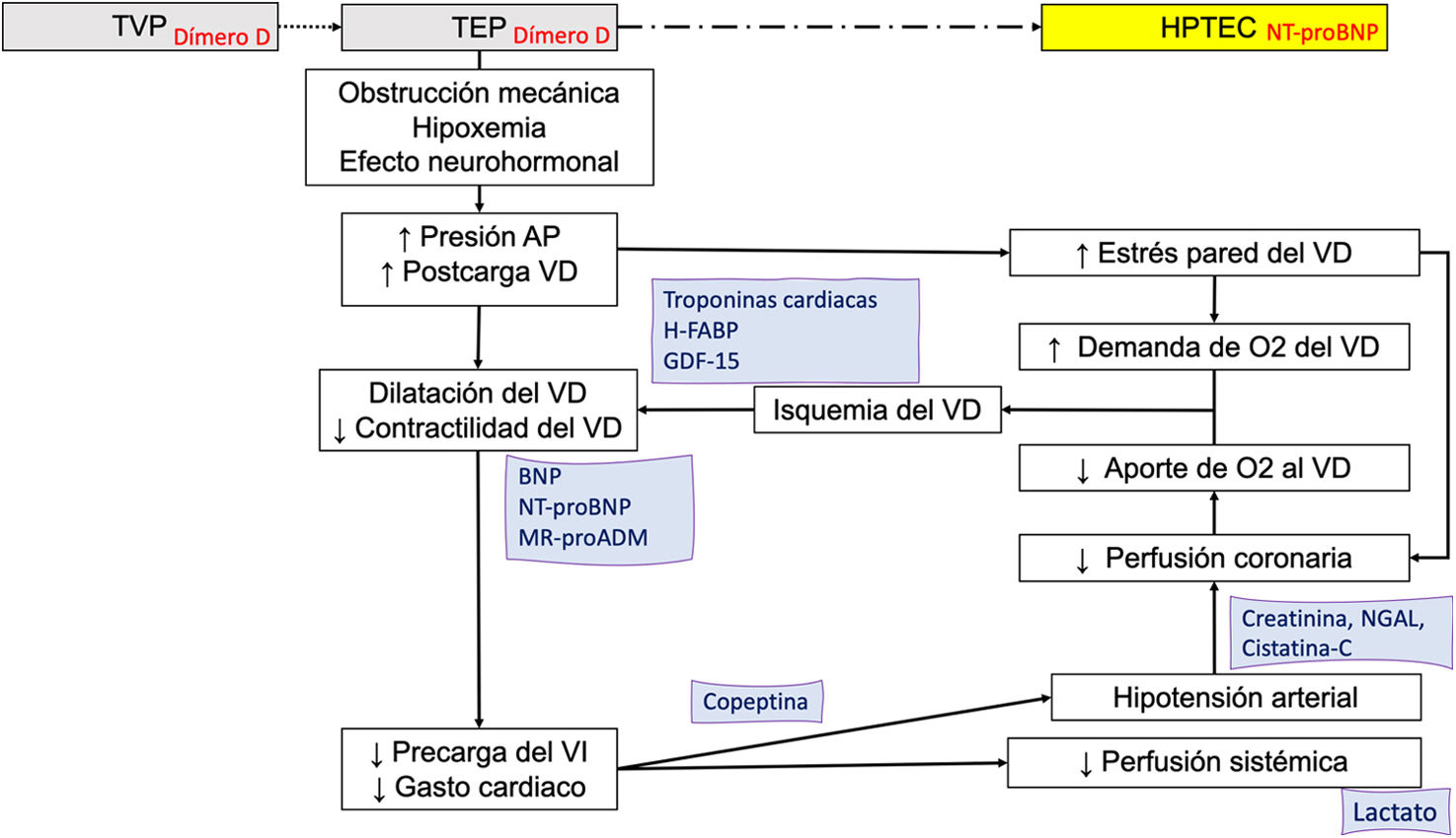
Valoración pronósticaDeterminados biomarcadores analíticos han demostrado utilidad pronóstica en la TEP, evaluándose integralmente con otros parámetros clínicos y de imagen para estratificar el riesgo (fig. 1).
Biomarcadores en la fisiopatogenia de la tromboembolia pulmonar aguda.
Los biomarcadores son posicionados en el esquema de acuerdo con el mecanismo fisiopatológico que expresan y según la utilidad diagnóstica (en roja) o pronóstica (en azul).
AP: arteria pulmonar; BNP: péptido natriurético tipo B; H-FABP: proteína ligadora de ácidos grasos cardiacos; GDF-15: factor de diferenciación de crecimiento 15; HPTEC: hipertensión pulmonar tromboembólica crónica; LMR: relación linfocito-monocito; MR-proADM: región media de la proadrenomedulina; NGAL: lipocalina asociada con la gelatinasa de neutrófilos; NLR: relación neutrófilo-linfocito; NT-proBNP: fragmento amino-terminal del proBNP; O2: oxígeno; PLR: relación plaqueta-linfocito; pO2: presión arterial de oxígeno; TEP: tromboembolia pulmonar; TVP: trombosis venosa profunda; VD: ventrículo derecho; VI: ventrículo izquierdo.
El aumento abrupto de la poscarga producido en la TEP puede producir efectos deletéreos sobre el miocardio del ventrículo derecho (VD), incluyendo daño miocárdico y disfunción del VD. Los principales marcadores de daño miocárdico son las troponinas cardiacas (troponinas I o T) y la proteína ligadora de ácidos grasos cardiacos (H-FABP), muy sensibles al daño celular del miocardio7. El aumento de tensión del miocardio produce la liberación del péptido natriurético tipo B (BNP) y su fragmento amino-terminal (NT)-proBNP, que expresan el grado de compromiso hemodinámico en la TEP aguda8. En pacientes con TEP aguda normotensos, valores elevados tanto de los marcadores de daño miocárdico como de BNP o NT-proBNP se asocian a una mayor mortalidad por la TEP, siendo particularmente útiles por su capacidad para excluir una evolución precoz desfavorable. El NT-proBNP también se eleva en los pacientes que desarrollan hipertensión pulmonar tromboembólica crónica (HPTEC). Valores elevados de copeptina, biomarcador subrogado de la vasopresina, y lactato determinan una situación de compromiso hemodinámico instaurado o inminente en la TEP aguda, optimizando la identificación de pacientes con TEP subsidiarios de una vigilancia más estrecha9,10. Otros biomarcadores como la creatinina, el sodio plasmático, la cistatina C y la lipocalina asociada con la gelatinasa de neutrófilos (NGAL) podrían ayudar a predecir mejor el pronóstico de la TEP aguda11.
Aún en fase de investigación, cada vez disponemos de más evidencia sobre la utilidad pronóstica de distintos marcadores inflamatorios en la TEP, como la interleucina 6, el factor de diferenciación de crecimiento 15 (GDF-15), la proteína C reactiva y, fundamentalmente, distintos índices celulares como el índice neutrófilo-linfocito (NLR) que aportan una información integral sobre el estado inflamatorio12.
¿Cuándo deberíamos considerar el tratamiento domiciliario en la TEP?La incidencia de la enfermedad tromboembólica venosa (ETEV), incluyendo la TEP, está aumentando de forma progresiva en los últimos años. La mayoría de los pacientes que sufren una TEP aguda en nuestro medio son hospitalizados. Aproximadamente el 85% de los gastos corresponden a la estancia hospitalaria13. Aunque esta estancia hospitalaria media se ha reducido, se ha observado que ingresos prolongados se asocian con un mayor riesgo de complicaciones. De acuerdo con las guías de práctica clínica vigentes, un porcentaje no desdeñable de pacientes podrían beneficiarse de un alta precoz (es decir, antes de 48h) o tratamiento domiciliario.
El tratamiento domiciliario o alta precoz de la TEP requiere una atención multidisciplinar, y para ello hay que tener en cuenta los siguientes aspectos: selección correcta de los pacientes, educación del paciente, necesidad de un seguimiento estrecho, y un correcto acceso al sistema sanitario13. Según la última guía European Society of Cardiology (ESC) 2019 para el diagnóstico y tratamiento de la TEP aguda, se puede considerar esta modalidad de tratamiento siempre que se cumplan los siguientes criterios14:
- -
El riesgo de muerte o complicaciones relacionadas con la TEP tiene que ser bajo.
- -
Ausencia de comorbilidades graves que requieran hospitalización.
- -
El paciente puede recibir un tratamiento y atención ambulatoria adecuados.
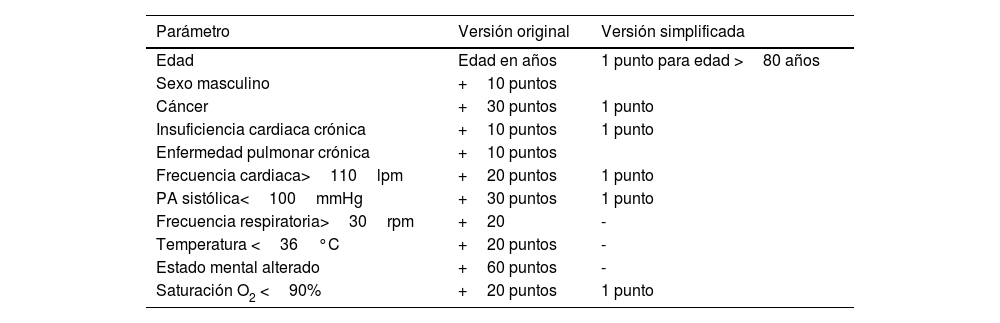
Múltiples estudios, metaanálisis y revisiones han demostrado que existe un subgrupo de pacientes, definidos como de riesgo bajo, que presentan tasas de mortalidad, recidivas y sangrados bajos a corto plazo. La última guía de la ESC14 recomienda el uso de los criterios de exclusión de Hestia (tabla 2) o las escalas Pulmonary Embolism Severity Index (PESI) y su forma simplificada (PESIs) validada (tabla 3) para identificar a los pacientes con un bajo riesgo de complicaciones a corto plazo. En consecuencia, los pacientes que se encuentren en clase I-II de la escala PESI, no cumplan ninguno de los criterios de la escala PESIs o que no presenten preguntas afirmativas de los criterios de Hestia son candidatos a valorar un manejo terapéutico domiciliario con un alta precoz, siempre y cuando sean bien seleccionados.
Criterios de Hestia
| ¿Inestabilidad hemodinámica? |
| ¿Es necesario tratamiento con trombólisis o embolectomía? |
| ¿Existe sangrado activo o riesgo de sangrado? |
| ¿Es necesario tratamiento con oxígeno para mantener saturaciones >90% durante más de 24h? |
| ¿La embolia de pulmón ha sido diagnosticada mientras ya recibía tratamiento anticoagulante? |
| ¿Precisa de tratamiento analgésico intravenoso >24h? |
| Motivo médico o social que precise de ingreso hospitalario >24h |
| Aclaramiento de creatinina <30ml/min |
| Presencia de enfermedad hepática severa |
| Embarazo |
| Antecedentes de trombocitopenia inducida por heparina |
Cuando la respuesta a una o más preguntas es afirmativa, el paciente no es candidato a alta precoz/tratamiento en domicilio.
Escala de gravedad de la embolia de pulmón PESI (versión original y simplificada)
| Parámetro | Versión original | Versión simplificada |
|---|---|---|
| Edad | Edad en años | 1 punto para edad >80 años |
| Sexo masculino | +10 puntos | |
| Cáncer | +30 puntos | 1 punto |
| Insuficiencia cardiaca crónica | +10 puntos | 1 punto |
| Enfermedad pulmonar crónica | +10 puntos | |
| Frecuencia cardiaca>110lpm | +20 puntos | 1 punto |
| PA sistólica<100mmHg | +30 puntos | 1 punto |
| Frecuencia respiratoria>30rpm | +20 | - |
| Temperatura <36°C | +20 puntos | - |
| Estado mental alterado | +60 puntos | - |
| Saturación O2 <90% | +20 puntos | 1 punto |
| Clasificación de riesgo | |
|---|---|
| Clase I: <65 puntos (riesgo muy bajo) | 0 puntos |
| Clase II: 66-85 puntos (riesgo bajo) | |
| Clase III: 86-105 puntos (riesgo moderado) | ≥1 punto |
| Clase IV: 106-125 puntos (riesgo alto) | |
| Clase V: >125 puntos (riesgo muy alto) |
PA: presión arterial.
El estudio HOME-PE evaluó la utilidad de los criterios de Hestia frente a la escala PESIs para seleccionar a pacientes candidatos a tratamiento domiciliario, no observándose diferencias en seguridad ni eficacia15.
En cualquier caso, esta clasificación de los pacientes en bajo riesgo por criterios clínicos podría optimizarse con criterios pronósticos adicionales. Revisiones sistemáticas y metaanálisis han demostrado la utilidad pronóstica de evaluar la presencia de disfunción del VD bien por tomografía computarizada (TC) o por ecocardiograma, y la valoración de la presencia de biomarcadores de daño miocárdico también en los pacientes con TEP de bajo riesgo16,17. En el momento actual se está desarrollando un estudio a nivel nacional para evaluar la seguridad del tratamiento ambulatorio de los pacientes con TEP de riesgo muy bajo: estudio TRAMTEP (https://www.clinicaltrials.gov, NCT05852119) que incluye el uso de una escala PESIs modificada (reduciendo el punto de corte de la frecuencia cardiaca a 100 lpm) y la valoración de disfunción del VD por TC.
Educación del pacienteEl paciente que va a recibir atención ambulatoria tiene que entender la relevancia del tratamiento y comprender de forma correcta el modo de administración y la posología de los fármacos que va a recibir. Además, debe ser capaz de identificar las posibles complicaciones relacionadas con la TEP o con el tratamiento anticoagulante.
Seguimiento – accesibilidad al sistema sanitarioAl alta se debe explicar al paciente quién realizará el seguimiento y los plazos recomendados para el mismo. Del mismo modo, se debe detallar qué hacer en caso de complicaciones. Es recomendable facilitar un acceso rápido al sistema sanitario, bien a través de los servicios de urgencias, o de las consultas encargadas de dicha patología en función del centro en el que se atienda.
¿Cuándo deberíamos considerar las terapias de reperfusión en el tratamiento de la TEP de riesgo intermedio-alto?En pacientes con TEP de riesgo intermedio-alto, la anticoagulación representa el tratamiento principal en la mayoría de los casos. Sin embargo, en aquellos pacientes que presentan deterioro hemodinámico se recomienda tratamiento de rescate con fibrinólisis a dosis completa, trombectomía quirúrgica o terapias dirigidas por catéter (TDC) (evidencia IIC)14,18,19. El estudio Pulmonary Embolism International THrOmbolysis (PEITHO) confirmó la eficacia clínica de la trombólisis a dosis completa en pacientes con riesgo intermedio-alto. Sin embargo, el 6,3% de los pacientes sometidos a trombólisis presentaron una hemorragia extracraneal (p<0,001)19. Por ello, se está llevando a cabo el ensayo clínico PEITHO-3 que evaluará la eficacia y seguridad de una dosis reducida de terapia trombolítica en pacientes con TEP de riesgo intermedio-alto20.
Las TDC, que incluyen la aspiración/fragmentación dirigida por catéter, trombectomía mecánica, trombólisis local y trombólisis asistida por ultrasonidos (USAT), han surgido como alternativas prometedoras, ofreciendo un potencial menor riesgo de hemorragia en comparación con la trombólisis sistémica. Sin embargo, la evidencia actual se limita a estudios observacionales y ensayos aleatorizados de pequeña escala. El ensayo ULTIMA que comparó heparina no fraccionada (HNF) con USAT, en 59 pacientes con TEP de riesgo intermedio, demostró una mejora significativa en la relación VD/ventrículo izquierdo (VI) a las 24h en el grupo USAT, con tasas de complicaciones hemorrágicas similares21. El ensayo OPTALYSE evaluó la seguridad de la TDC (USAT, EkoSonic), reduciendo dosis y tiempo de intervención en 101 pacientes con TEP de riesgo intermedio, mostrando una mejoría del 25% en la relación VD/VI y una tasa del 4,0% de hemorragias graves, incluyendo dos episodios de hemorragia intracraneal22. En el ensayo aleatorizado SUNSET-sPE con 81 pacientes, no se observaron diferencias significativas en la reducción del trombo entre la trombólisis asistida por ultrasonidos (USAT, EkoSonic) y el tratamiento estándar dirigido por catéter (p=0,76); sin embargo, el pequeño tamaño muestral del estudio supone una limitación para generalizar estas conclusiones23. El ensayo CANARY comparó la TDC más anticoagulación versus anticoagulación en monoterapia en 94 pacientes con TEP aguda de riesgo intermedio-alto, revelando una proporción menor de pacientes con relación VD/VI>0,9 a los 3 meses en el grupo de TDC (4,3% vs. 12,8%; odds ratio [OR] 0,31, IC 95% 0,06-1,69; p=0,24)24.
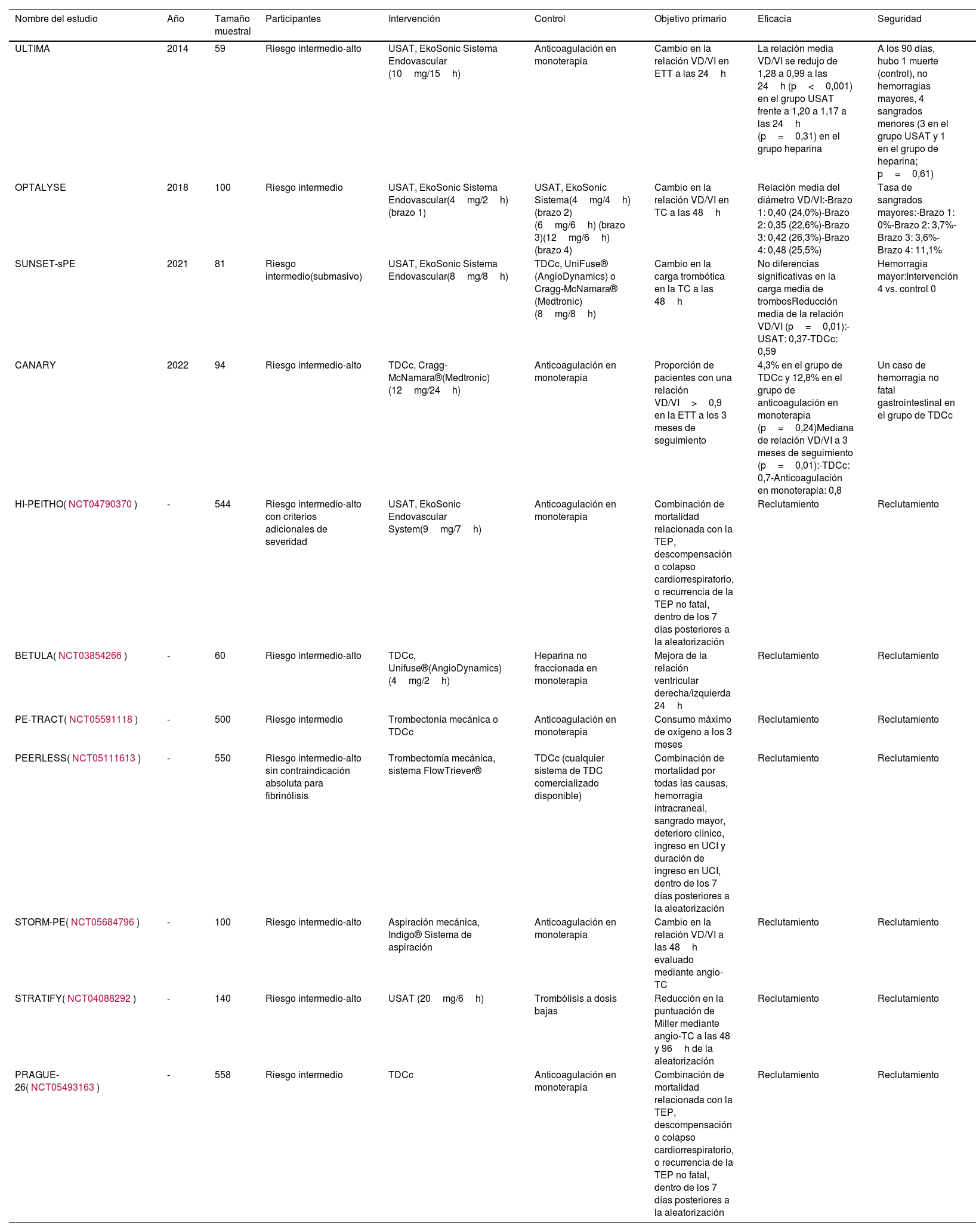
Varios ensayos clínicos en curso están evaluando el papel de la TDC en subgrupos de pacientes con TEP de riesgo intermedio-alto. El estudio Higher-Risk Pulmonary Embolism Thrombolysis (HI-PEITHO) compara TDC (EkoSonic) más anticoagulación versus anticoagulación en monoterapia en 406 pacientes con TEP de riesgo intermedio-alto con elevado riesgo de muerte temprana y/o colapso hemodinámico inminente25. En esa misma línea, el ensayo Pulmonary Embolism–Thrombus Removal With Catheter-Directed Therapy (PE-TRACT) evalúa TDC y anticoagulación versus anticoagulación en monoterapia en 500 pacientes con TEP aguda de riesgo intermedio-alto. Los resultados de estos ensayos clínicos aportarán más evidencia sobre el verdadero beneficio de las TDC en pacientes con TEP aguda de riesgo intermedio-alto, con implicaciones en su posicionamiento terapéutico (tabla 4).
Ensayos clínicos aleatorizados sobre la terapia dirigida por catéter en pacientes con tromboembolia pulmonar de riesgo intermedio-alto
| Nombre del estudio | Año | Tamaño muestral | Participantes | Intervención | Control | Objetivo primario | Eficacia | Seguridad |
|---|---|---|---|---|---|---|---|---|
| ULTIMA | 2014 | 59 | Riesgo intermedio-alto | USAT, EkoSonic Sistema Endovascular (10mg/15h) | Anticoagulación en monoterapia | Cambio en la relación VD/VI en ETT a las 24h | La relación media VD/VI se redujo de 1,28 a 0,99 a las 24h (p<0,001) en el grupo USAT frente a 1,20 a 1,17 a las 24h (p=0,31) en el grupo heparina | A los 90 días, hubo 1 muerte (control), no hemorragias mayores, 4 sangrados menores (3 en el grupo USAT y 1 en el grupo de heparina; p=0,61) |
| OPTALYSE | 2018 | 100 | Riesgo intermedio | USAT, EkoSonic Sistema Endovascular(4mg/2h) (brazo 1) | USAT, EkoSonic Sistema(4mg/4h) (brazo 2)(6mg/6h) (brazo 3)(12mg/6h) (brazo 4) | Cambio en la relación VD/VI en TC a las 48h | Relación media del diámetro VD/VI:-Brazo 1: 0,40 (24,0%)-Brazo 2: 0,35 (22,6%)-Brazo 3: 0,42 (26,3%)-Brazo 4: 0,48 (25,5%) | Tasa de sangrados mayores:-Brazo 1: 0%-Brazo 2: 3,7%-Brazo 3: 3,6%-Brazo 4: 11,1% |
| SUNSET-sPE | 2021 | 81 | Riesgo intermedio(submasivo) | USAT, EkoSonic Sistema Endovascular(8mg/8h) | TDCc, UniFuse® (AngioDynamics) o Cragg-McNamara® (Medtronic)(8mg/8h) | Cambio en la carga trombótica en la TC a las 48h | No diferencias significativas en la carga media de trombosReducción media de la relación VD/VI (p=0,01):-USAT: 0,37-TDCc: 0,59 | Hemorragia mayor:Intervención 4 vs. control 0 |
| CANARY | 2022 | 94 | Riesgo intermedio-alto | TDCc, Cragg-McNamara®(Medtronic) (12mg/24h) | Anticoagulación en monoterapia | Proporción de pacientes con una relación VD/VI>0,9 en la ETT a los 3 meses de seguimiento | 4,3% en el grupo de TDCc y 12,8% en el grupo de anticoagulación en monoterapia (p=0,24)Mediana de relación VD/VI a 3 meses de seguimiento (p=0,01):-TDCc: 0,7-Anticoagulación en monoterapia: 0,8 | Un caso de hemorragia no fatal gastrointestinal en el grupo de TDCc |
| HI-PEITHO(NCT04790370) | - | 544 | Riesgo intermedio-alto con criterios adicionales de severidad | USAT, EkoSonic Endovascular System(9mg/7h) | Anticoagulación en monoterapia | Combinación de mortalidad relacionada con la TEP, descompensación o colapso cardiorrespiratorio, o recurrencia de la TEP no fatal, dentro de los 7 días posteriores a la aleatorización | Reclutamiento | Reclutamiento |
| BETULA(NCT03854266) | - | 60 | Riesgo intermedio-alto | TDCc, Unifuse®(AngioDynamics) (4mg/2h) | Heparina no fraccionada en monoterapia | Mejora de la relación ventricular derecha/izquierda 24h | Reclutamiento | Reclutamiento |
| PE-TRACT(NCT05591118) | - | 500 | Riesgo intermedio | Trombectonía mecánica o TDCc | Anticoagulación en monoterapia | Consumo máximo de oxígeno a los 3 meses | Reclutamiento | Reclutamiento |
| PEERLESS(NCT05111613) | - | 550 | Riesgo intermedio-alto sin contraindicación absoluta para fibrinólisis | Trombectomía mecánica, sistema FlowTriever® | TDCc (cualquier sistema de TDC comercializado disponible) | Combinación de mortalidad por todas las causas, hemorragia intracraneal, sangrado mayor, deterioro clínico, ingreso en UCI y duración de ingreso en UCI, dentro de los 7 días posteriores a la aleatorización | Reclutamiento | Reclutamiento |
| STORM-PE(NCT05684796) | - | 100 | Riesgo intermedio-alto | Aspiración mecánica, Indigo® Sistema de aspiración | Anticoagulación en monoterapia | Cambio en la relación VD/VI a las 48h evaluado mediante angio-TC | Reclutamiento | Reclutamiento |
| STRATIFY(NCT04088292) | - | 140 | Riesgo intermedio-alto | USAT (20mg/6h) | Trombólisis a dosis bajas | Reducción en la puntuación de Miller mediante angio-TC a las 48 y 96h de la aleatorización | Reclutamiento | Reclutamiento |
| PRAGUE-26(NCT05493163) | - | 558 | Riesgo intermedio | TDCc | Anticoagulación en monoterapia | Combinación de mortalidad relacionada con la TEP, descompensación o colapso cardiorrespiratorio, o recurrencia de la TEP no fatal, dentro de los 7 días posteriores a la aleatorización | Reclutamiento | Reclutamiento |
Angio-TC: angiotomografía computarizada; ETT: ecografía transtorácica; TC: tomografía computarizada; TDCc: terapia dirigida por catéter convencional; USAT: trombólisis asistida por ultrasonidos; VD: ventrículo derecho; VI: ventrículo izquierdo.
Las escalas pronósticas en la TEP aguda permiten priorizar la mejor estrategia terapéutica de acuerdo con la gravedad de presentación, además de decidir la mejor ubicación del paciente para iniciar el tratamiento (unidad de cuidados intensivos, unidad de cuidados respiratorios intermedios, planta convencional, domicilio)14. Por ello, deben emplearse desde el momento que se confirma el diagnóstico, ya que su aplicación en las decisiones de manejo terapéutico mejora el pronóstico de los pacientes y reduce la estancia hospitalaria26.
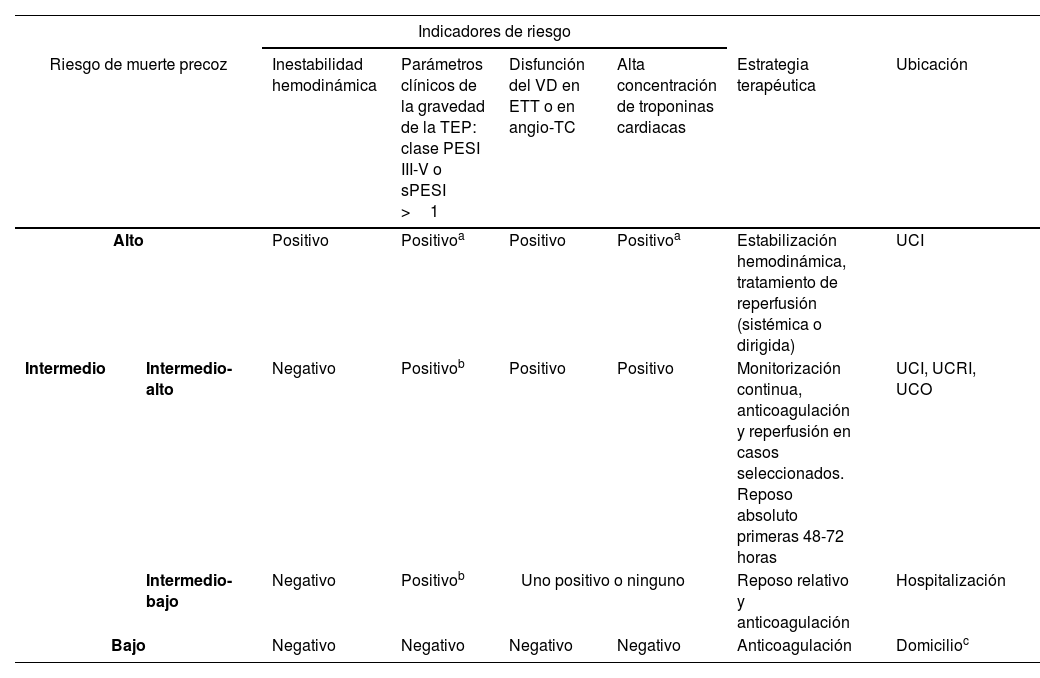
La clasificación pronóstica (tabla 5) propuesta en la última guía de la ESC es la más validada14. Los pacientes que se presentan con compromiso hemodinámico son los que presentan más riesgo de muerte precoz por la TEP (TEP de riesgo alto), siendo subsidiarios a terapias de reperfusión (i.e., fibrinólisis sistémica, TDC o embolectomía quirúrgica) asociadas al tratamiento anticoagulante. Entre los pacientes con estabilidad hemodinámica al diagnóstico, puede identificarse a un subgrupo de pacientes con mejor pronóstico según la escala PESI o PESIs y que no presentan disfunción del VD en las pruebas de imagen. Como ya se ha descrito en un apartado previo, estos pacientes con TEP de riesgo bajo pueden ser candidatos a tratamiento ambulatorio3. El resto de los pacientes, con TEP de riesgo intermedio, es un subgrupo de pacientes con un espectro de gravedad muy amplio, en el que es crítico identificar a los pacientes con elevación de marcadores de daño miocárdico y disfunción del VD (TEP de riesgo intermedio-alto), subsidiarios de una monitorización más estrecha.
Adaptación de la estratificación de riesgo de la Guía ESC 201914 con la mejor estrategia terapéutica y la ubicación para dicho tratamiento
| Indicadores de riesgo | |||||||
|---|---|---|---|---|---|---|---|
| Riesgo de muerte precoz | Inestabilidad hemodinámica | Parámetros clínicos de la gravedad de la TEP: clase PESI III-V o sPESI >1 | Disfunción del VD en ETT o en angio-TC | Alta concentración de troponinas cardiacas | Estrategia terapéutica | Ubicación | |
| Alto | Positivo | Positivoa | Positivo | Positivoa | Estabilización hemodinámica, tratamiento de reperfusión (sistémica o dirigida) | UCI | |
| Intermedio | Intermedio-alto | Negativo | Positivob | Positivo | Positivo | Monitorización continua, anticoagulación y reperfusión en casos seleccionados. Reposo absoluto primeras 48-72 horas | UCI, UCRI, UCO |
| Intermedio-bajo | Negativo | Positivob | Uno positivo o ninguno | Reposo relativo y anticoagulación | Hospitalización | ||
| Bajo | Negativo | Negativo | Negativo | Negativo | Anticoagulación | Domicilioc | |
ETT: ecocardiograma transtorácico; PESI: índice de severidad del embolismo pulmonar; sPESI: escala PESI simplificada; TEP: tromboembolia de pulmón; UCI: unidad de cuidados intensivos; UCO: unidad coronaria; UCRI: unidad de cuidados intermedios; VD: ventrículo derecho.
Aún con los beneficios que nos aportan, el uso de estas escalas presenta algunas limitaciones27:
- 1.
Marcadores pronósticos: se utilizan sólo 3 variables para determinar el pronóstico de los pacientes con TEP con estabilidad hemodinámica (PESI o PESIs, troponinas cardiacas y evaluación de la función y tamaño del VD)14. Sin embargo, otras variables clínicas28 o de laboratorio29 han demostrado su utilidad pronóstica (sección biomarcadores).
- 2.
Variables fijas: la valoración dicotómica de los parámetros pronósticos evaluados al diagnóstico supone una limitación en determinados marcadores pronósticos que son continuos y dinámicos (i.e., frecuencia cardiaca o tensión arterial)24, pudiendo precisar un cambio de estrategia terapéutica según el momento en que son valoradas.
- 3.
Terapias de reperfusión: la identificación de pacientes con un mayor riesgo de deterioro hemodinámico es crítica; estos pacientes son subsidiarios de una vigilancia más estrecha y podrían beneficiarse de un manejo intervencionista con terapias de reperfusión con mayor prontitud, es decir, sin precisar llegar al colapso hemodinámico25. Como se abordó previamente (sección terapias de reperfusión en la TEP de riesgo intermedio-alto), la evidencia que surja de los diversos ensayos en marcha permitirá afinar el paradigma de las escalas pronósticas y probablemente cambie el abordaje de las escalas pronósticas.
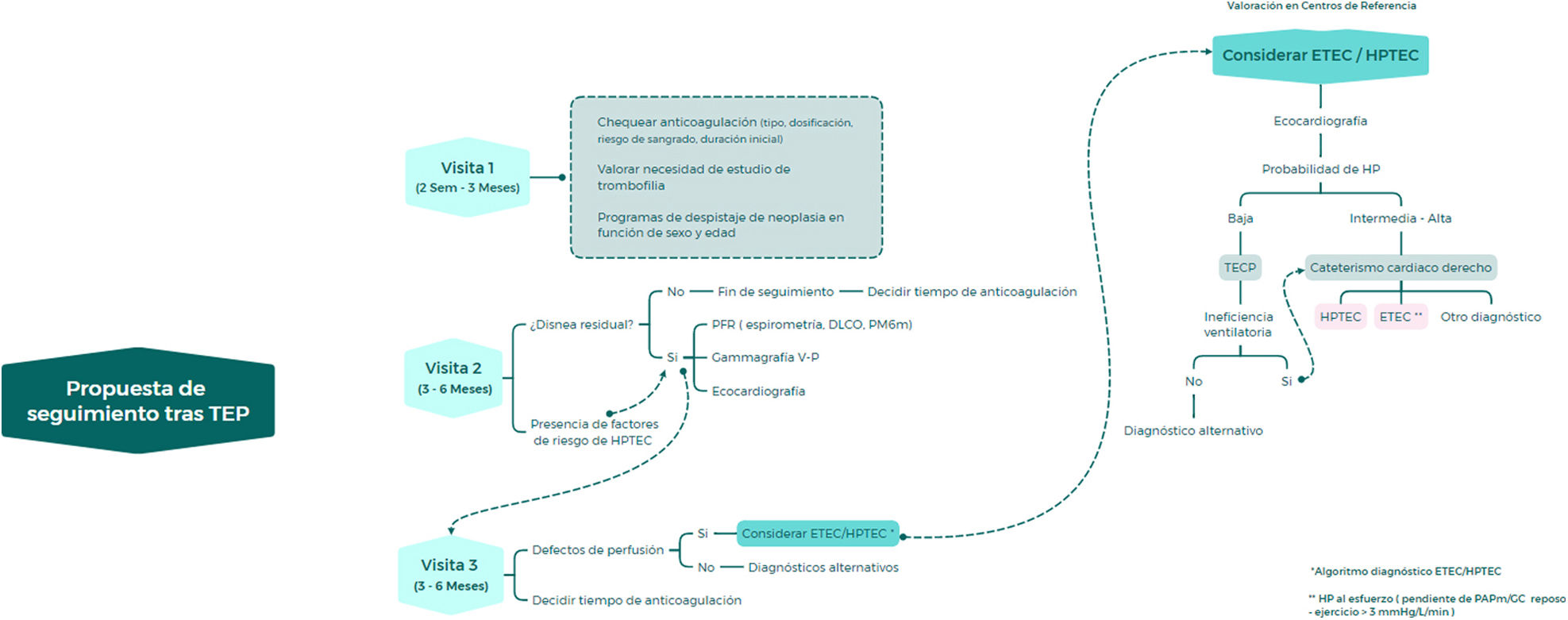
Las guías actuales proponen un algoritmo de seguimiento de los pacientes con TEP para diagnosticar secuelas a largo plazo, a los 3-6 meses del episodio agudo, principalmente dirigido a la valoración de la presencia de síntomas o signos clínicos de HPTEC14. Sin embargo, el abordaje de estos pacientes implica la cobertura de otros múltiples aspectos que deben tenerse en cuenta, fundamentalmente durante el primer año de seguimiento, como pueden ser el riesgo de recurrencia, la valoración del riesgo hemorrágico, la búsqueda de cáncer, el cribado de trombofilia hereditaria, la realización de ejercicio físico, los cambios en el estilo de vida y la detección y el manejo de los factores de riesgo cardiovascular30.
Propuesta de algoritmo de seguimiento tras una tromboembolia pulmonar14,30,36–38,40.
Primera visita: Comprobar que el tratamiento anticoagulante es correcto (dosis, tipo de fármaco, valorar riesgo de sangrado y la duración inicial prevista). Valorar si es preciso realizar estudio de trombofilia y remitir, en caso necesario, a los programas poblacionales de cribado de neoplasia.
Segunda visita: Decisiones sobre el tiempo de anticoagulación. Valorar eventuales secuelas. En aquellos pacientes que refieran disnea residual o empeoramiento de su capacidad funcional previa a la TEP y/o presenten algún factor de riesgo reconocido para el desarrollo de HPTEC, solicitar para la siguiente visita (más allá de los 3 meses): estudio funcional respiratorio, gammagrafía V-P y/o ecocardiografía. Con este estudio se buscará: a) evaluar la presencia de defectos de perfusión residuales, b) evaluar la presencia de hipertensión pulmonar y c) orientar el origen respiratorio y/o cardiaco de la disnea residual. Adicionalmente el Nt-proBNP pueden ser de ayuda diagnóstica en la sospecha de una HPTEC.
Tercera visita: Decisiones sobre el tiempo de anticoagulación. Interpretación de los resultados. Enfocar al diagnóstico de la ETEC/HPTEC si no hubiera diagnóstico alternativo en pacientes sintomáticos.
Considerar ETEC/HPTEC: Valorar el resultado de la ecocardiografía; si esta resulta de probabilidad alta o intermedia, realizar CCD e interpretación de los resultados correspondientes. Si existen síntomas respiratorios y defectos residuales pero la ecocardiografía en reposo es de baja probabilidad para HP, valorar completar estudio con TECP; si muestra ineficiencia ventilatoria, realizar CCD en reposo y al esfuerzo (este sólo si el primero es normal) para considerar ETEC/HPTEC o un diagnóstico alternativo.
* algoritmo diagnóstico ETEC/HPTEC.
** HP al esfuerzo (pendiente de PAPm/GC reposo - ejercicio>3mmHg/L/min).
CCD: cateterismo cardiaco derecho; DLCO: capacidad de difusión del monóxido de carbono; ETEC: enfermedad tromboembólica crónica; gammagrafía V-P: gammagrafía de ventilación-perfusión pulmonar; HP: hipertensión pulmonar; HPTEC: hipertensión pulmonar tromboembólica crónica; PAPm: presión arterial pulmonar media; PFR: pruebas funcionales respiratorias; PM6m: prueba de marcha de 6 minutos; RPT: resistencia pulmonar total; TECP: test de esfuerzo cardiopulmonar; TEP: tromboembolia pulmonar; Ud.W: Unidades Wood.
La anticoagulación extendida a largo plazo en la TEP tiene como objetivo evitar las recurrencias, que van a depender principalmente del factor de riesgo que lo ha provocado. El consenso nacional de expertos recomienda suspender la anticoagulación a los 3 meses del primer episodio de TEP provocada por un factor de riesgo transitorio mayor ya resuelto3. Se recomienda mantener la anticoagulación indefinida en los pacientes con evidencia de un factor de riesgo permanente mayor (i.e., cáncer activo, síndrome antifosfolípido, historia de dos o más episodios trombóticos idiopáticos); también en varones con una TEP idiopática, en quienes se ha observado un riesgo de recurrencia aumentado31. Los pacientes con TEP secundaria a factor de riesgo transitorio, menor y resuelto, mujeres con TEP idiopática, pacientes que desean suspender la anticoagulación, y pacientes con relación incierta riesgo/beneficio para el uso de anticoagulación indefinida, se podrían beneficiar de estudios adicionales que ayuden a valorar el riesgo de recurrencia (e.g., características clínicas, dímero D, escala HERDOO2 y estudios de trombofilia)6.
El riesgo hemorrágico se puede estimar valorando factores de riesgo hemorrágico conocidos según la evidencia disponible, como edad superior a 75 años, hemorragia previa o anemia, cáncer activo, ictus hemorrágico o isquémico previo, enfermedad renal o hepática crónica, tratamiento crónico con antiagregantes plaquetarios o antiinflamatorios no esteroideos, control inadecuado de la anticoagulación o la aplicación de escalas de predicción de riesgo hemorrágico que identifican pacientes de bajo riesgo de complicaciones hemorrágicas32.
No se recomienda la búsqueda activa de cáncer en pacientes con TEP provocada. Tampoco en los pacientes con TEP idiopática, puesto que no se ha demostrado que disminuya la mortalidad a los 12 meses del episodio trombótico, aunque haya un diagnóstico de cáncer más precoz33. Se recomienda un cribado limitado y acorde con la edad y sexo del paciente.
La realización de estudios de trombofilia no está recomendada para decidir la duración de la anticoagulación en los pacientes con TEP34. Sólo en aquellos pacientes jóvenes (<50 años) sin factor de riesgo mayor para ETV y con antecedentes familiares, podría ayudar a la decisión de mantener anticoagulación extendida. Se recomienda realizarlo más allá de las primeras 4-6 semanas del episodio trombótico agudo.
La disfunción del VD en pacientes con TEP de riesgo intermedio y de riesgo alto puede persistir durante días e incluso semanas, en los que se recomendaría la realización de un ecocardiograma de control a los 3 meses. Aunque en estos pacientes se debería aconsejar limitar los viajes en avión y el ejercicio físico extenuante durante las primeras semanas tras el episodio agudo, en general se recomienda un estilo de vida saludable incluyendo la práctica de ejercicio físico para evitar el desacondicionamiento físico tras la TEP35.
En aquellos pacientes que manifiesten disnea progresiva o de nueva aparición, intolerancia al ejercicio tras 3 meses de correcta anticoagulación no explicada por otras comorbilidades, habría que iniciar el estudio de HPTEC.
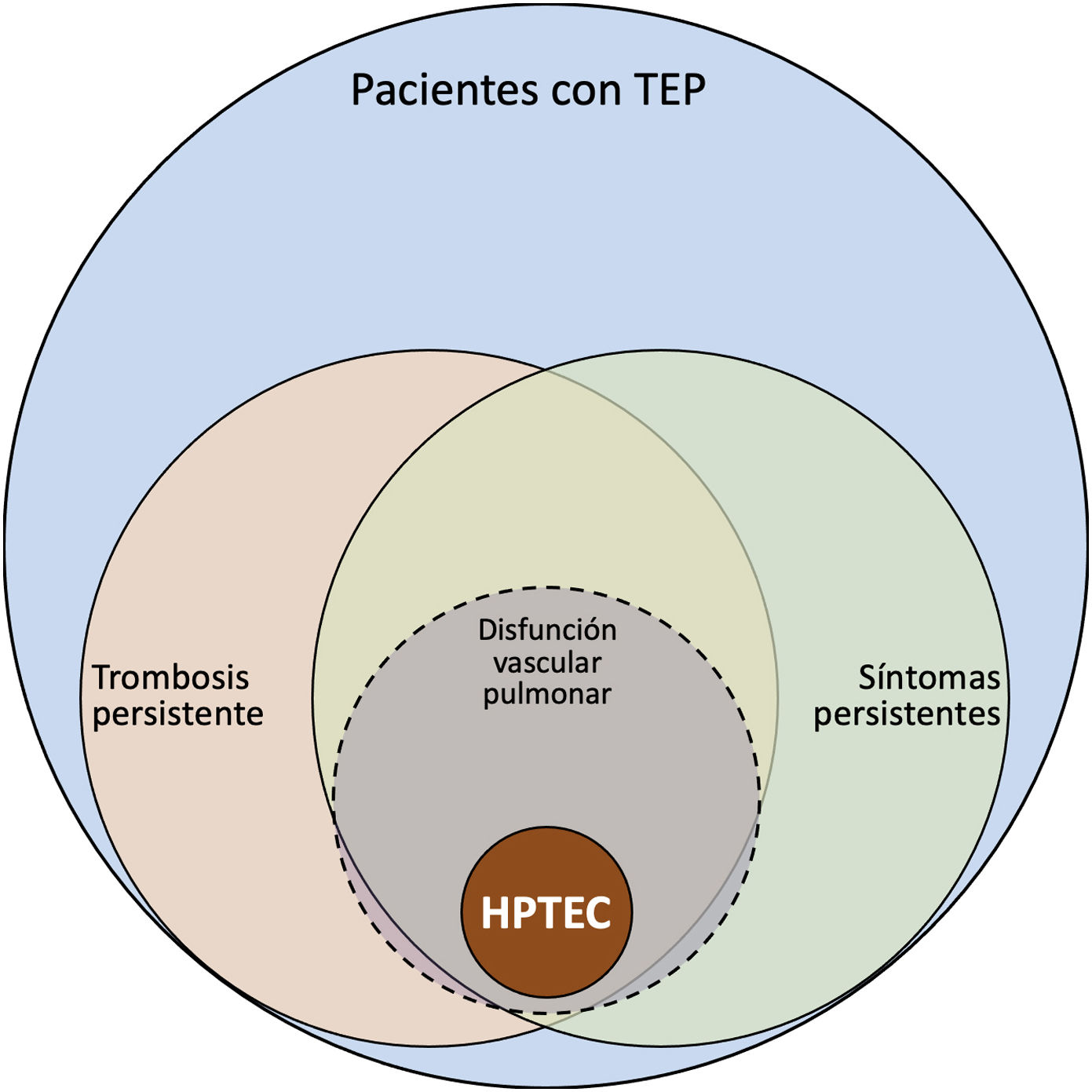
¿Cómo debemos identificar a los pacientes con enfermedad tromboembólica crónica (ETEC)?El espectro de secuelas tras una TEP va desde la persistencia asintomática de trombo fibrótico hasta la HPTEC (fig. 3). La HPTEC se produce como consecuencia de la organización del trombo fresco en trombo fibrótico que se adhiere a las paredes de las arterias pulmonares provocando obstrucción del flujo pulmonar junto con el daño de la microvasculatura pulmonar (zonas no trombosadas), produciendo remodelado del lecho vascular pulmonar, que incrementa la resistencia vascular pulmonar y en consecuencia el posterior fracaso del VD.
Espectro de complicaciones tras la tromboembolia de pulmón. HPTEC: hipertensión pulmonar tromboembólica crónica; TEP: tromboembolia de pulmón.
Fuente: con el permiso de Ramírez et al.37.
La ETEC supone una limitación al esfuerzo, con defectos de perfusión pero sin hipertensión pulmonar en reposo36. El abordaje diagnóstico se realiza durante el seguimiento en aquellos pacientes que refieren disnea al esfuerzo tras una TEP. Si bien no existe un algoritmo definido, se han publicado diferentes propuestas36–38 que difieren en la secuencia de las pruebas complementarias pero que coinciden en la necesidad de: 1. poner de manifiesto la presencia de trombo residual, para lo cual la gammagrafía ventilación-perfusión se ha posicionado como la herramienta más útil debido a su alto valor predictivo negativo. 2. demostrar que la causa de limitación al esfuerzo se debe a un origen cardiovascular; en este sentido el test de esfuerzo cardiopulmonar (TECP) nos permite discriminar el origen de la disnea36,37. De forma característica podremos encontrarnos con disminución del consumo pico de O2, umbral anaeróbico precoz; acompañado de signos de ineficiencia ventilatoria por la obliteración vascular (aumento de la pendiente VE/VCO2, y aumento del equivalente de CO2 y disminución de la PETCO2 en el umbral anaeróbico), descartando un patrón de limitación de origen ventilatorio37,38. La ecocardiografía sigue siendo una herramienta de elección en aquellos pacientes sintomáticos en los que se sospecha una HPTEC o una ETEC, sin embargo, varios trabajos cuestionan la eficacia de realizar ecocardiografía sistemática tras una TEP39. Es por ello que algunos autores proponen que aunque la ecocardiografía en reposo sea normal, en aquellos pacientes con patrón de disfunción vascular y trombo residual, debemos realizar un registro hemodinámico en reposo y al esfuerzo, sirviéndonos de las nuevas definiciones de hipertensión pulmonar e hipertensión pulmonar de esfuerzo (fig. 2)14,30,36–38,40. Aún se desconoce si la ETEC se trata de una forma precoz de HPTEC o una forma leve que no conllevaría una progresión del remodelado vascular. Desde el punto de vista terapéutico cada vez son más los Centros de Referencia que aplican el mismo algoritmo terapéutico a las ETEC y a la HPTEC considerando ambas entidades susceptibles de tratamiento intervencionista (i.e., angioplastia pulmonar con balón o tromboendarterectomía pulmonar), por lo que la valoración de manejo terapéutico debe realizarse de forma individualizada por parte de un Comité Experto en Centros de Referencia.
FinanciaciónEl presente trabajo no recibió ningún tipo de financiación.
Contribuciones de los autoresTodos los autores han colaborado en la preparación, redacción, diseño, revisión crítica y aprobación del documento final.
Conflictos de interésLos autores no declaran conflictos de interés.