El diagnóstico y el tratamiento precoces de la enfermedad pulmonar obstructiva crónica (EPOC) ayudan a enlentecer su progresión y disminuir sus complicaciones. El espirómetro portátil COPD-6 es una herramienta que puede ser útil para el screening de esta patología.
ObjetivoEvaluar la utilidad del espirómetro portátil COPD-6 para el screening de EPOC.
MétodosSe realizó una revisión sistemática de estudios que evalúan la capacidad diagnóstica del COPD-6 en el diagnóstico precoz de EPOC. Se revisaron varias bases de datos, y se valoró la calidad de los estudios incluidos con la herramienta QUADAS-2. Se realizó la curva ROC y una estimación ponderada de la OR diagnóstica con un análisis de efectos aleatorios bivariante. Las fuentes posibles de heterogeneidad se exploraron usando análisis de subgrupos y metarregresión bivariante.
ResultadosSe encontraron 14 estudios (3.986 pacientes). Hubo mucha heterogeneidad estadística en el cálculo de sensibilidad y especificidad, con estimaciones globales aceptables de sensibilidad (0,65 [IC 95% 0,63-0,68]) y especificidad (0,80 [IC 95% 0,78-0,81)]. El área bajo la curva ROC fue de 0,90. Se apreció efecto umbral. No hubo diferencias significativas en el análisis de subgrupos (estudios realizados en Europa vs. Asia, estudios de mejor vs. peor calidad, y estudios inicialmente dirigidos al diagnóstico de EPOC vs. los orientados al diagnóstico de patrón obstructivo). Los estudios que usaron un cut-off>0,75 tuvieron una aceptable capacidad para screening de EPOC (alta sensibilidad, menor especificidad).
ConclusiónEl COPD-6 es una prueba útil para el diagnóstico precoz de enfermos con EPOC.
Early diagnosis and treatment of chronic obstructive pulmonary disease (COPD) helps slow progression and reduce complications. The COPD-6 portable spirometer is a tool that may be useful for screening for this disease.
ObjectiveTo evaluate the usefulness of the COPD-6 portable spirometer for COPD screening.
MethodsWe performed a systematic review of studies evaluating the diagnostic capacity of COPD-6 in the early diagnosis of COPD. Several databases were reviewed, and the quality of the studies included was evaluated with the QUADAS-2 tool. The ROC curve and a weighted estimate of the diagnostic OR were conducted with a bivariate random effects analysis. Possible sources of heterogeneity were explored using subgroup analysis and bivariate meta-regression.
ResultsFourteen studies were retrieved (3,986 patients). Statistical heterogeneity in the calculation of sensitivity and specificity was high, with acceptable overall estimates of sensitivity (0.65 [95% CI 0.63-0.68]) and specificity (0.80 [95% CI 0.78-0.81]). The area under the ROC curve was 0.90 and a threshold effect was seen. There were no significant differences in the subgroup analysis (studies conducted in Europe vs Asia, better vs poorer quality studies, and studies initially aimed at diagnosing COPD vs. those aimed at diagnosing an obstructive pattern). The ability of studies using a cut-off>0.75 to screen for COPD (high sensitivity, lower specificity) was acceptable.
ConclusionCOPD-6 is a useful test for the early diagnosis of COPD patients.
La enfermedad pulmonar obstructiva crónica (EPOC) es una patología compleja, muy prevalente, infradiagnosticada y con una elevada morbimortalidad, donde los términos clásicos de enfisema (anatomopatológico) y bronquitis crónica (clínico) son insuficientes para abarcar a todos los enfermos, y que supone un problema de salud de gran magnitud1.
El diagnóstico de EPOC se basa en la combinación de datos clínicos y espirométricos, según los criterios aceptados por la iniciativa GOLD2. Sin embargo, la práctica de la espirometría convencional es poco frecuente, y el diagnóstico de estos enfermos sigue siendo escaso. El reciente estudio EPISCAN II muestra que aproximadamente el 11,8% de la población mayor de 40 años en España padece EPOC, con diferencias significativas en cuanto a sexo (14,6% hombres, 9,4% mujeres), y hay un infradiagnóstico referido por el paciente de un 74,7%3. Este hecho puede deberse a varias causas: desconocimiento de muchos aspectos de la enfermedad, falta de uso de las guías de manejo de la EPOC entre los profesionales sanitarios, realización insuficiente de espirometrías, etc.
Más de la mitad de los pacientes con EPOC incluidos en las bases de datos de Atención Primaria (AP) en la primera década del siglo XXI en España no tenían realizada una espirometría, lo que podría conllevar un sobrediagnóstico y un sobretratamiento4. Algunos datos pueden justificar este hallazgo: la mitad de los centros de salud de nuestro país disponen de espirómetro5 y el acceso a la espirometría convencional en hospitales y centros de especialidades en algunas zonas está restringido o conlleva un retraso en la realización. La situación era similar en 20126, con más del 15% de centros de salud sin espirómetro, y entre 2 y 8,9 espirometrías realizadas a la semana entre los que sí tienen espirómetro, cifras muy inferiores a los centros de especialidades. Todo ello, junto con la alta frecuencia de enfermos asintomáticos u oligosintomáticos en las primeras fases de la enfermedad, hace que las estrategias de búsqueda de casos sean recomendables. La más recomendada es identificar la población en riesgo, aquella en la que la presencia de varios ítems aumenta la probabilidad de diagnosticar EPOC (individuos de más de 40 años, con presencia de factores de riesgo —exposición a tabaco o tóxicos para el pulmón a nivel doméstico, laboral o ambiental, o alteraciones del desarrollo pulmonar con síntomas [tos, expectoración]— y/o infecciones respiratorias de repetición), e incluso en personas que consultan en AP por cualquier causa, y usar espirometría portátil y/o cuestionarios para cribar a los enfermos con mayor probabilidad de EPOC para derivarles a realizarse una espirometría convencional. Se necesita espirometría convencional para confirmar la presencia de EPOC2.
El diagnóstico precoz de la EPOC es relevante: la pérdida de la función pulmonar es más rápida en estadios iniciales7. Los pacientes en estadio GOLD II (50% de los pacientes en el momento del diagnóstico) tienen una pérdida absoluta del FEV1 más acusada que aquellos que sufren EPOC más grave8. Por tanto, el diagnóstico de EPOC en un estadio precoz puede suponer que el tratamiento se inicie antes, por lo que teóricamente se debería enlentecer su progresión, con menos complicaciones, menos ingresos hospitalarios, y posibles beneficios económicos a medio y largo plazo. Sin embargo, existe la posibilidad de que se sobrediagnostique, es decir, que se llegue a un diagnóstico correcto de EPOC, tan precoz que no vaya a tener repercusión positiva en el pronóstico del paciente, con el consiguiente sobretratamiento9. Este dilema probablemente se solucionará en los próximos años.
En los últimos 20 años han surgido los espirómetros portátiles, dispositivos pequeños, electrónicos de fácil manejo, que pueden ser útiles en el diagnóstico precoz de patologías respiratorias. Los trabajos iniciales hacen referencia a espirómetros de turbina o con efecto Venturi. En los años siguientes empiezan a fabricarse dispositivos diferentes: Air Smart, Spirobank, Easy One, Piko, etc.
El dispositivo COPD-610 es un aparato electrónico pequeño, pesa menos de 100g y de fácil uso. Al paciente se le pide colocarse sentado en posición neutra, realizar una inspiración máxima, colocar la boquilla en su boca bien sellada, y justo después realizar una espiración tan rápida como sea posible durante 6 segundos —hasta oír una alarma—. Deben introducirse varios datos del enfermo (edad, talla y sexo) antes de realizar la prueba; a diferencia de la espirometría convencional, no es necesario introducir el peso. No necesita calibración. El dispositivo da medidas absolutas (en litros) y relativas (en porcentaje de valor esperado para edad, peso, sexo y raza) del volumen espiratorio forzado en el primer segundo (FEV1) y en el sexto segundo (FEV6), su cociente (FEV1/FEV6) y una estimación de la edad pulmonar. La pantalla muestra el valor del porcentaje de FEV1 predicho (a la izquierda) en una escala de colores, y según los valores del FEV1 predicho y de la ratio FEV1/FEV6 el diagnóstico de EPOC (sí/no) y el estadio de EPOC. El valor de la ratio FEV1/FEV6 que establece el diagnóstico de EPOC (<0,7) y los puntos de corte del FEV1 predicho para delimitar los estadios de EPOC (<80, <50 y <30%) fueron los aceptados por la iniciativa GOLD2.
El COPD-6, de forma similar a otros microespirómetros, puede ser una herramienta de cribado para seleccionar pacientes con mayor probabilidad de padecer EPOC; posteriormente debería realizarse a esos enfermos seleccionados una espirometría convencional con prueba broncodilatadora, que sigue siendo el gold standard. Las evidencias cada vez más frecuentes de la utilidad de estos dispositivos en el cribado rápido y accesible de esta patología para pacientes y personal sanitario ameritan el desarrollo de una revisión sistemática y un metaanálisis sobre la utilidad de uno de los dispositivos más habituales en nuestro medio, CODP-6, en el diagnóstico precoz de la EPOC.
Material y métodosSe ha llevado a cabo una revisión sistemática de estudios de pruebas diagnósticas de acuerdo a las recomendaciones de las guías clínicas de la Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)11. Los datos recogidos en los estudios se analizaron de acuerdo a las guidelines promovidas por la European Association for Technology Assessment12.
Se realizó una búsqueda de artículos de valoración de pruebas diagnósticas dirigidos al uso del miniespirómetro COPD-6, de la casa farmacéutica Vitalograph, en el diagnóstico precoz de EPOC en adultos mayores de 18 años. No se realizó restricciones por idioma o por fecha de publicación. En los artículos relevantes hallados (estudios incluidos, revisiones sistemáticas) se buscó en la bibliografía la presencia de estudios útiles para nuestra revisión.
La prueba de referencia (gold standard) de diagnóstico de EPOC ha sido la espirometría convencional2. Se han excluido trabajos en los que para el diagnóstico definitivo de EPOC no se usó espirometría convencional (por ejemplo, con «elevada sospecha clínica», o con el uso de cuestionarios), ni estudios en los que se usó espirometría convencional en solo una parte de los enfermos. La población en la que se ha aplicado la prueba son enfermos con EPOC —en su totalidad, o en un porcentaje mayoritario de enfermos—. Se han incluido trabajos transversales y prospectivos; estudios con pacientes consecutivos, o aquellos en los que se incluyeron pacientes con alta sospecha de EPOC; y estudios realizados en AP y en medio hospitalario/centro de especialidades.
Se ha llevado a cabo una búsqueda para identificar artículos potencialmente relevantes en Medline, Embase, Web of Science (WOS), Elsevier (donde se incluyen Scopus y Science Direct), Cochrane Library plus, ClinicalTrials.gov, Trip Database, Lilacs y Teseo. La búsqueda se definió en PubMed con 2 argumentos: población («Pulmonary Disease, Chronic Obstructive»[Majr]) y herramienta diagnóstica («Spirometry»[Majr] o «mini-spirometry», «portable – spirometry» y «hand – held – spirometry», como texto libre). La búsqueda en las restantes bases de datos fue análoga. Los detalles de la búsqueda se describen en el anexo 1 del material adicional. También se han revisado las citas bibliográficas de los artículos que se consideraron interesantes. La fecha de la última revisión de la búsqueda fue el 14 de enero de 2019.
En los estudios considerados adecuados para nuestro metaanálisis se han extraído datos relativos a los verdaderos positivos (VP), falsos positivos (FP), falsos negativos (FN) y verdaderos negativos (VN) detectados con COPD-6. En ocasiones los artículos no han citado esta información; en ellos, se han buscado resultados de sensibilidad (S), especificidad (E), valor predictivo positivo y valor predictivo negativo para poder construir la tabla 2×2. Los trabajos en los que no se ha podido obtener esa tabla 2×2 se han descartado para nuestro estudio. Esos datos han sido extraídos por 2 investigadores (MAGG y MARA); las diferencias entre ellos se han resuelto con ayuda de un tercer investigador (MMBU). También se recogió el país donde se realizó el trabajo y el punto de corte (cut-off) de FEV1/FEV6 que definió el COPD-6 como positivo (con alta probabilidad de EPOC) o negativo.
Se ha evaluado la calidad metodológica de los estudios incluidos, es decir, la posibilidad de sesgo —por metodología deficiente del estudio— y la aplicabilidad externa —que el objetivo del estudio coincida con la pregunta de revisión—, con la herramienta Quality Assessment of Diagnostic Accuracy Studies 2 (QUADAS-2)13,14, con atención en varios aspectos: selección de pacientes, prueba a valorar y prueba de referencia, y flujo de pacientes/intervalo de tiempo de realización entre ambas pruebas diagnósticas.
Se ha valorado la heterogeneidad de la S y de la E de cada estudio gráficamente y con el test Q (ji cuadrado), y se ha explorado la relación entre la S y la tasa de FP gráficamente con la confección de una curva ROC global (SROC), y estadísticamente con el coeficiente de correlación de Spearman. En el análisis univariante, se ha representado S, E y odds ratio diagnóstica (DOR) de cada estudio en un forest plot. Finalmente se ha planteado un análisis de subgrupos, y se ha valorado realizar una metarregresión multivariante entre S y tasa de FP, siendo las covariables de la metarregresión las variables del análisis de subgrupos.
La heterogeneidad de los estudios puede explicarse también por el «efecto umbral» (los valores de S y E de los estudios pueden deberse en parte a los distintos puntos de corte de positividad de la prueba, y las representaciones de cada pareja de S y 1-E en el plano ROC mostrarían una nube de puntos a lo largo de la curva ROC). Este efecto umbral también se valora con el citado coeficiente de correlación de Spearman.
La parte de heterogeneidad que pudiera deberse a la presencia de algún factor conocido se evaluó con la realización de análisis de subgrupos. Se plantearon a priori varios análisis: estudios realizados en AP vs. realizados en el hospital; estudios de buena vs. mala calidad; y estudios desarrollados en Europa o Asia. De acuerdo con la valoración de la calidad metodológica (instrumento QUADAS-2), se ha considerado un estudio de baja calidad si algún dominio valorado suponía un riesgo alto de sesgo o si el documento obtenido era un abstract de congreso (con insuficiente descripción de aspectos metodológicos del trabajo). A posteriori, y tras valorar los estudios incluidos, se plantearon dos nuevos análisis de subgrupos: comparar estudios dirigidos al diagnóstico precoz de EPOC versus estudios con objetivo de diagnóstico de patología obstructiva; y los estudios con cut-off de VEF1/VEF6≤0,75 versus >0,75. La interacción entre estas variables y la exactitud diagnóstica se valoró con una metarregresión bivariante.
A la vista de esos resultados se describieron el nivel de evidencia (hasta qué punto podemos confiar en que los estimadores medidos son correctos) y el grado de recomendación (en qué medida podemos confiar en que poner en marcha la recomendación conllevará más beneficio que riesgo) de estos dispositivos según el GRADE Working Group15,16.
El análisis estadístico y las figuras se realizaron con los programas R (aplicación Mada), REVMAN v.5.3, STATA v. 14.0 y Meta-DiSc.
ResultadosLos apartados de realización de esta revisión sistemática y metaanálisis según la declaración PRISMA se incluyen en el anexo 2 del material adicional.
La búsqueda inicial de artículos ha obtenido 1.918 citas. Tras descartar duplicados (537), y valorando la utilidad del trabajo por la lectura del título y el abstract, han quedado 49 estudios para valorar su texto completo. Se descartan 34 estudios que no cumplen los criterios de nuestro trabajo, y 4 revisiones sistemáticas-metaanálisis, y se incluyen 3 estudios encontrados en la revisión de citas bibliográficas de los estudios incluidos. Finalmente, se incluyen en nuestro trabajo 14 estudios17–30, con N=3.986 pacientes (anexos 3 y 4 del material adicional).
Las características de los estudios incluidos se describen en la tabla 1. La mayoría18–23,25,29 de estos se han desarrollado en AP/medio extrahospitalario. Ocho estudios se han llevado a cabo en Europa19,21–23,25,26,29,30 (519,22,23,25,26 en España), y el resto en Asia. En 7 se ha realizado un diagnóstico precoz de EPOC17,20–23,26,30, y los 7 restantes18,19,24,25,27–29 se han dirigido al diagnóstico precoz de patrón obstructivo.
Tabla de estudios incluidos en el metaanálisis
| Autor, año, país | Diseño del estudioEdad, sexo, población | Objetivo del estudioDesarrollo en AP/hospital | Pruebas comparadas | Umbral de positividad | Otros |
|---|---|---|---|---|---|
| Banka et al.2015Mumbay (India) | N=765 pacientes consecutivos que llegan al hospitalChequeo anual de pacientes consecutivos que llegan a un hospital | Screening de EPOCHospital de tercer nivel | Enfermos sometidos a espirometría convencional se les realiza COPD-6. Gold standard, espirometría con FEV1/CVF<0,7 tras broncodilatador | Cut-off 0,8 recomendado por fabricante | Abstract de congreso |
| Ching et al.2014Malaysia | Cohortes transversalN=416. Pacientes consecutivosPacientes >40 años, fumadores >10 paquetes/año. Edad media 53 años, 99,8% varones | Diagnóstico de patrón obstructivo de vías aéreasÁrea suburbana de AP | Espirometría manual COPD-6 vs. combinado de espirometría y/o cuestionario clínico de Canadá. FEV1/CVF<0,75 para probable EPOC con espirometría convencional | FEV1/FEV6<0,7 recomendado | No se hace espirometría convencional en todos los pacientes porque no vuelven a consulta |
| Figueira et al.2017Tenerife (España) | N=223. Estudio observacional transversal según principios de práctica habitualEdad media 59 años, 60% varones. 25% fumadores activos, 36% exfumadores. Diagnósticos de asma (43%) y EPOC (30%) | Screening de patrón obstructivoPacientes remitidos al laboratorio de pruebas funcionales respiratorias durante 2 meses consecutivos. Medio hospitalario | En la misma visita se realizan medidas con espirómetro portátil y con espirómetro convencional en orden aleatorio | No cut-off fijado previo de FEV1/FEV6. El valor de cut-off encontrado es de 0,76 | Valoración de la utilidad del COPD-6 en relación con el peso-IMC: con IMC>30kg/m2 el AUC es menor |
| Kim et al.2016Seúl (Corea) | N=190. Cohorte prospectivaEdad media 60,3 años. Pacientes ≥40 años, fumadores >10 paquetes-año, enfermos de AP con síntomas respiratorios | Screening de EPOCVisitas a la consulta de AP con quejas respiratorias9 centros de AP | Uso de espirometría manual COPD-6, y posteriormente remitidos a un hospital terciario para llevar a cabo una espirometría convencional. No clara relación temporal entre ambas espirometrías | Cut-off óptimo diagnóstico encontrado de 0,77 | Valoración conjunta de espirometría convencional y cuestionario sobre EPOC en los enfermos cuando se remiten al hospital |
| Labor et al.2016Croacia | N=227 pacientes consecutivos. Cohorte prospectiva. Edad media 52,5 años. Pacientes que consultan con médico AP por cualquier motivo no pulmonar. 185 fumadores y 42 exfumadores; 37,8% varones | Screening de EPOCAP | COPD-6 en AP, se remite al hospital donde se repite COPD-6 seguida de espirometría con test broncodilatador para valorar gravedad de EPOC | Cut-off previo conocido de 0,7 | En población en riesgo de EPOC se encuentra un 19% de pacientes no diagnosticados. Puede usarse el COPD-6 con bastante seguridad a nivel de AP |
| Llordés et al.2017Terrassa (España) | N=407. Estudio multicéntrico transversalPacientes con ≥40 años, fumadores o exfumadores de al menos 1 paquete-año sin diagnóstico previo de EPOC y que fueron a los centros de AP por cualquier motivo; 65,2% varones, 57,4 años edad media | Screening de EPOC8 centros de AP del área de Terrassa | Realización primero de miniespirometría con el COPD-6, y posteriormente en todos los enfermos se realizó espirometría convencional. No reporta el tiempo entre una y otra | No cut-off fijado previo de FEV1/FEV6. El cut-off encontrado es de 0,78 | En la primera parte del estudio se valora la utilidad de screening de EPOC de un cuestionario |
| Miravitlles et al.2012Barcelona (España) | Casos (N=79) y controles (N=94)En ambos grupos 51,7/65,8 años, 62,4/86,1% varones. 94% fumadores | Screening de EPOCControles de consulta de AP por cualquier motivo vs. EPOC diagnosticado por espirometría/criterios GOLD10 centros AP Barcelona | Medida de FEV1/FEV6 con el dispositivo portátil COPD-6 antes de la administración de broncodilatador. Espirometría convencional | FEV1/FEV6<0,7 prefijado | Objetivo primario: validación de cuestionario de screening de EPOC |
| Nishimura et al.2011Japón | N=312. Estudio observacional de cohortesTrabajadores industriales sanos varones (100%) sometidos a chequeos anuales y espirometría. Edad mediana 55 años, sin datos sobre tabaquismo o comorbilidades | Screening de limitación al flujo aéreo (patrón obstructivo)Centro de Salud Ocupacional de Niigata | Espirometría con espirómetro electrónico de sobremesa, seguida de espirometría manual con dispositivo Hi-Checker | FEV1/FEV6<0,7 prefijado | Valorar la utilidad del COPD-6 (Hi-Checker (idéntico al COPD-6, comercializado en Japón con este nombre) en el screening de patrón obstructivo en medio de salud laboral |
| Represas et al.2010Vigo (España) | Prospectivo descriptivo transversal. N=16256 años de media, 59% varones | Diagnóstico de proceso obstructivo de vías aéreasPacientes que acuden a laboratorio de pruebas funcionales respiratorias a lo largo de 2 meses consecutivosMedio hospitalario. 18% diagnóstico de EPOC, 20% asma, 25% otras patologías respiratorias, 37% sin diagnóstico | Espirometría convencional y miniespirometría con dispositivo COPD-6 realizada sucesivamente | FEV1/FEV6<0,7 prefijado | Curva ROC para hallar el punto óptimo (cut-off) diagnóstico: 0,75-0,76, mejor suma de S y E para diagnosticar obstrucción. 0,79-0,80, cribado de patologías obstructivas |
| Represas et al.2016Vigo (España) | N=362. Estudio de cohortes prospectivasPacientes con factores de riesgo de EPOC: >40 años, tabaquismo activo o exfumadores >10 paquetes/ año, y síntomas respiratorios sugestivos de EPOC. 55,4 años de media, 61,9% varones | Screening de EPOCInstalaciones sanitarias no especializadas (medio extrahospitalario): AP, servicios de emergencia y farmacias comunitarias | Realización de COPD-6, seguida en las siguientes 24h de espirometría convencional (si valor de FEV1/CVF es <0,7, se repite esta última tras administración de broncodilatador inhalado) | Mejor cut-off global de las 3 cohortes de FEV1/FEV6 para COPD-6 es 0,8 | Aporta resultados desglosados para cada cohorte valorada: AP, servicios de emergencia y farmacias comunitarias |
| Thorat et al.2014India | N= 111. No aclara el tipo de estudio69 asmáticos, 18 EPOC, 24 sanos | Screening de patrón obstructivoNo describe si en AP u hospital | Uso de espirometría convencional y COPD-6 en todos los pacientes incluidos | Cut-off óptimo medio de 0,75 | Abstract de congreso |
| Thorat et al.2017India | N=189. Estudio observacional transversalPacientes consecutivos con síntomas respiratorios. 58,73% varones, media de 51 años | Screening de patrón obstructivo (EPOC y asma)Realizado en una Clinical Facility de la Chest Research Foundation | Valoración de los enfermos con cuestionario clínico, medida del flujo espiratorio pico y espirometría convencional y manual COPD-6 | No cut-off fijado previo. Encuentra un cut-off de 0,75, con área bajo la curva ROC del 87%, S 80% y E 86% | Los enfermos incluidos en el estudio se diagnosticaron de asma (115), EPOC (33) y otras patologías (41) |
| Thorn et al.2012Suecia | Cohortes. N=305Pacientes de 45-85 años (media 61,2) con historia de tabaquismo de ≥15 paquetes/año, potenciales EPOC. 43% varones. | Diagnóstico de EPOC21 centros de AP suecos | Espirometría realizada con aparato COPD-6, seguida de espirometría convencional realizada con espirómetro usado en la práctica diaria habitual | No aclara cut-off previo. Realiza cálculos para FEV1/FEV6 entre 0,7 y 0,8 | Cut-off diagnóstico que consigue la mejor curva ROC: 0,73. Estudio económico de coste-utilidad del COPD-6 para el diagnóstico de EPOC. También uso del CCQ (COPD Clinical Questionary) |
| Vandevoorde et al.2012Bélgica | N=147. No aclara el tipo de estudio realizadoNo se describe el tipo de enfermos incluidos | Detección de patrón obstructivoNo descrito si en AP u hospital | Enfermos sometidos a espirometría manual y convencional en orden aleatorio. La hacen estudiantes de último año de medicina (COPD-6) y profesionales altamente capacitados para evaluar la función pulmonar (espirometría convencional) | Cut-off óptimo diagnóstico de 0,73. Cut-off de screening, con alta sensibilidad, 0,8 | Abstract de congreso |
AP: Atención Primaria; AUC: área bajo la curva; cut-off: punto de corte, umbral óptimo de positividad de la prueba; CVF: capacidad vital forzada; E: especificidad; EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado en el primer segundo; FEV6: volumen espiratorio forzado en el sexto segundo IMC: índice de masa corporal; Iniciativa GOLD: Global Obstructive Lung Disease; N: tamaño muestral; S: sensibilidad.
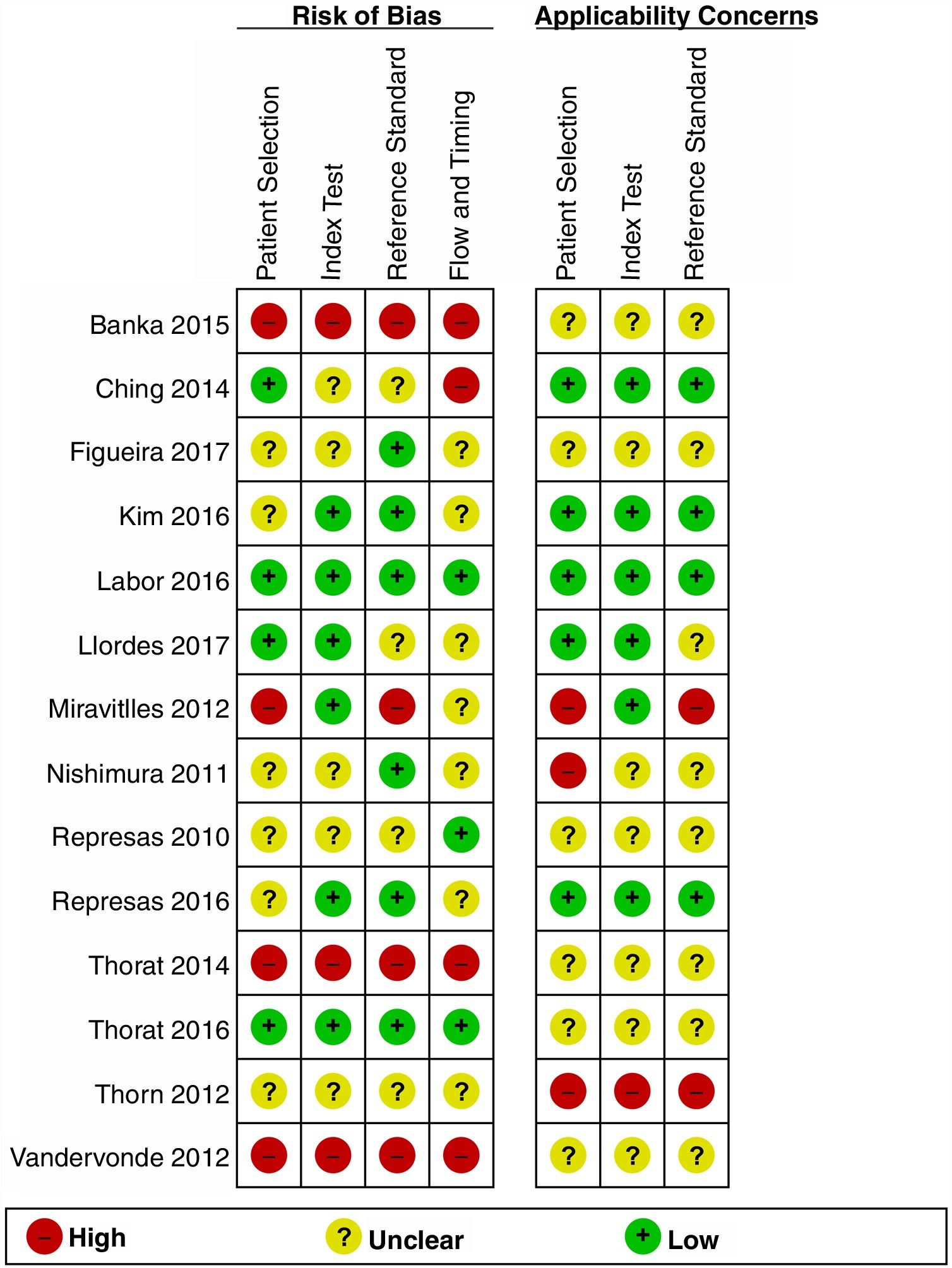
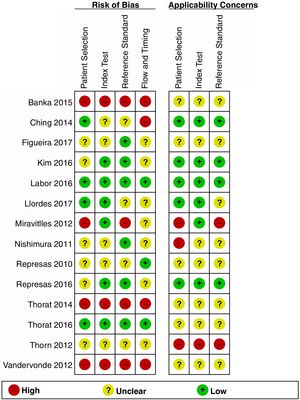
Las valoraciones de calidad y riesgo de sesgo con el instrumento QUADAS-2 se exponen en la figura 1 y en el anexo 5 del material adicional. Hasta 7 estudios17,18,23,24,27,29,30 tienen alto riesgo de sesgo, y solo 3 estudios21,25,28 tienen una valoración clara del intervalo temporal entre ambas pruebas diagnósticas. Tres trabajos incluidos17,27,30 son abstracts de congresos.
Valoración de la calidad metodológica de cada estudio incluido con la herramienta QUADAS-2. Valoración de la calidad metodológica de cada estudio incluido con la herramienta QUADAS-2. Risk of bias: riesgo de sesgo; high: alto; low: bajo; unclear: no aclarado; applicability concerns: dudas de aplicabilidad externa; patient selection: selección de pacientes; index test: prueba a valorar; reference standard: prueba de referencia; Flow & timing: flujo de pacientes e intervalo de tiempo entre la realización de la prueba a valorar y la prueba de referencia.
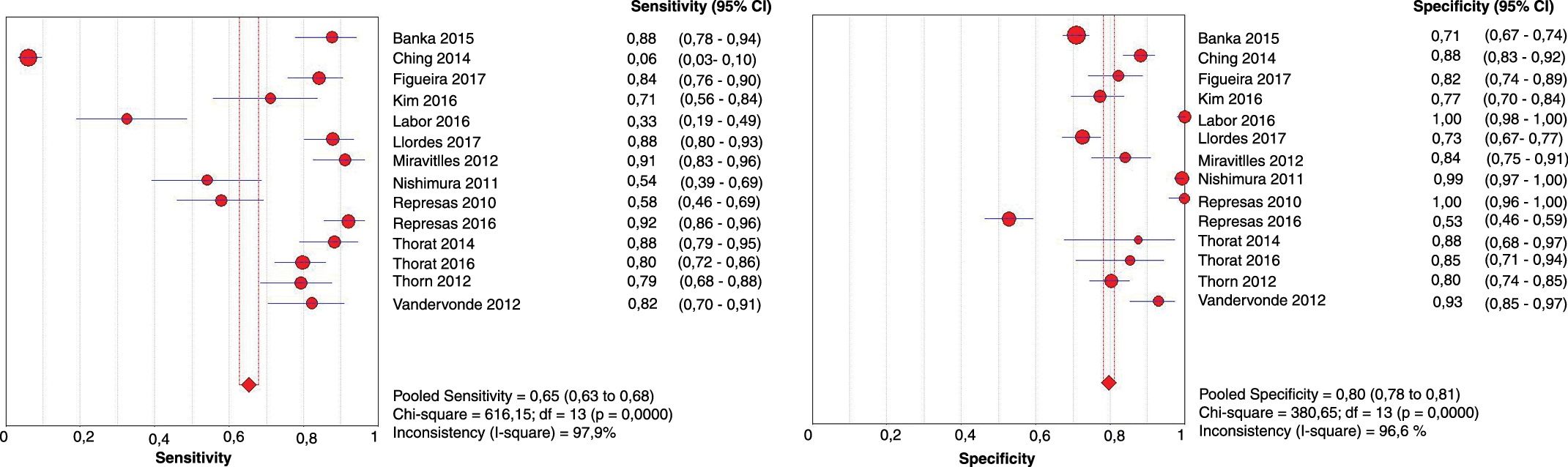
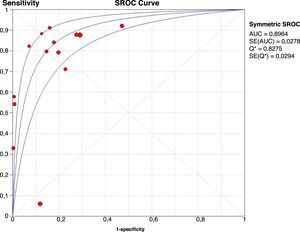
Los gráficos de árbol de descripción de S y E de los distintos trabajos se exponen en la figura 2. Las estimaciones globales de S y E son, respectivamente, 0,65 (IC 95% 0,63 a 0,68) y 0,80 (IC 95% 0,78 a 0,81). Se aprecia mucha heterogeneidad en las distribuciones, confirmada con el estimador Q tanto para S (616,15) como para E (380,65) —ambas p<0,0001—, con lo que puede no estar indicado obtener esas estimaciones globales. Los gráficos de descripción de los cocientes de probabilidad positivo y negativo son análogos (anexo 6 del material adicional). La estimación conjunta de la eficacia de la prueba diagnóstica, la DOR, es de 23 (IC 95% 10,26-51,55), también con elevada heterogeneidad estadística (anexo 7 del material adicional).
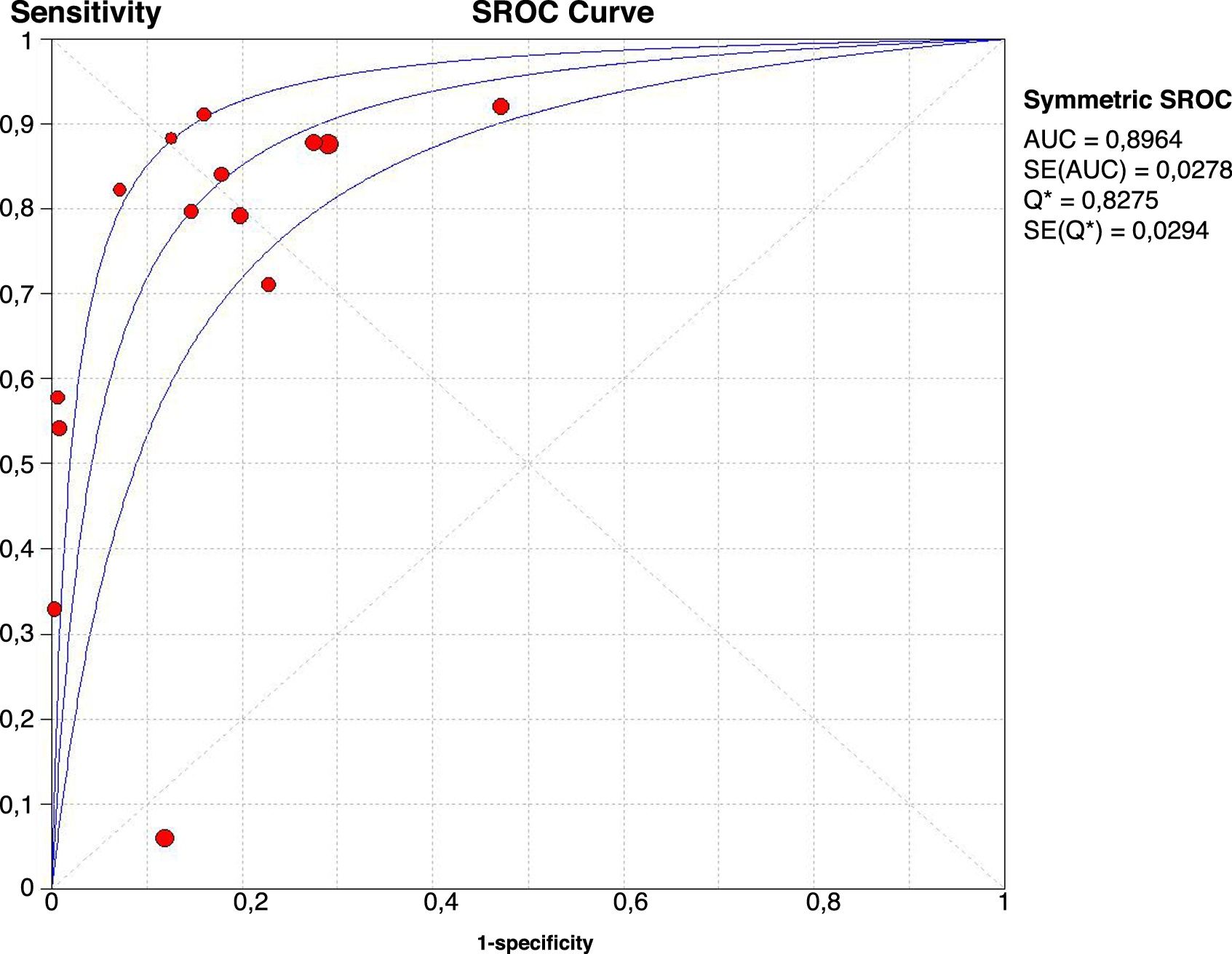
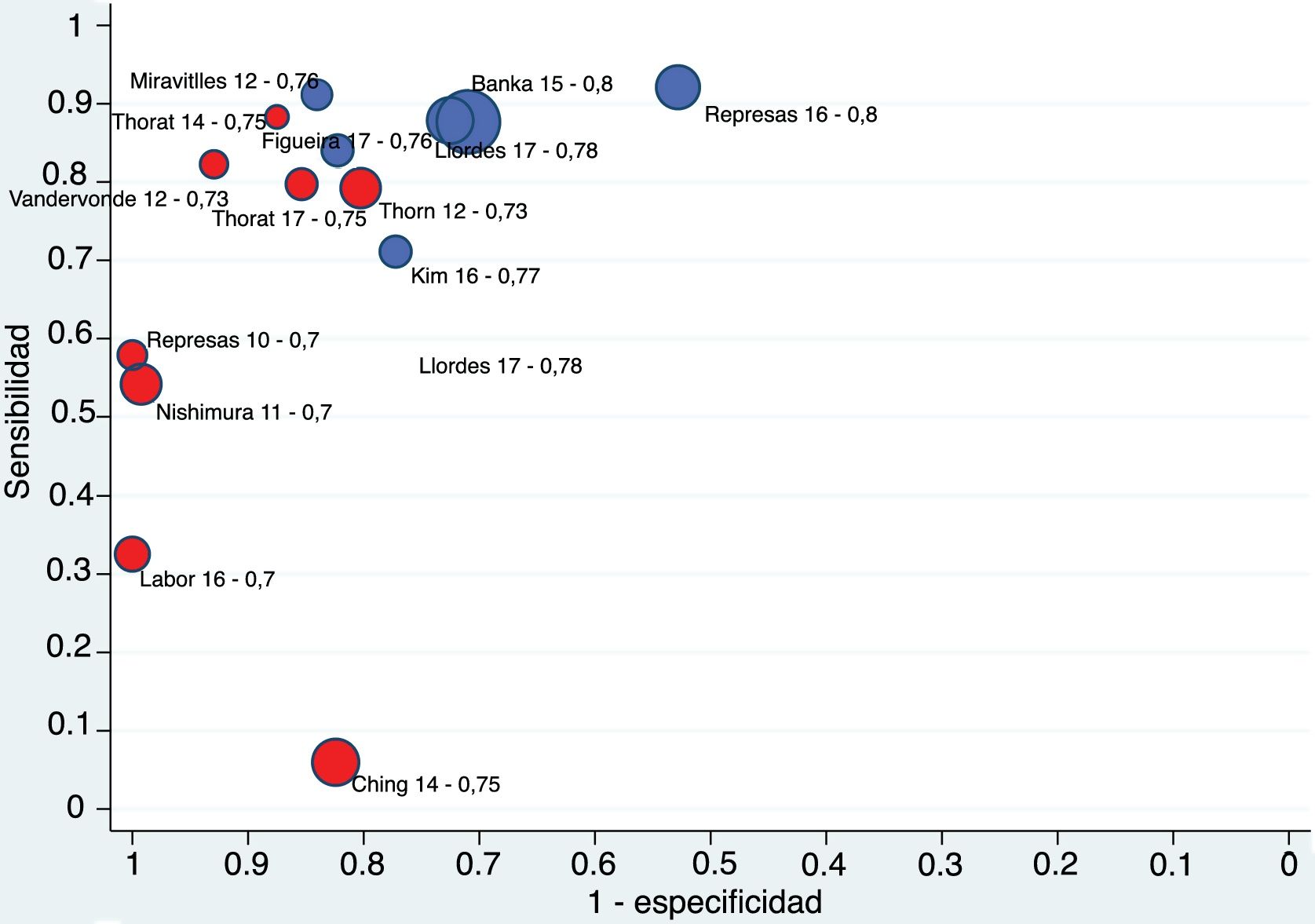
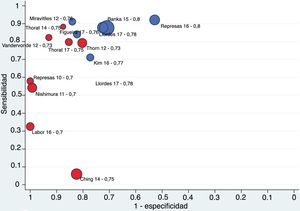
La figura 3 muestra que la mayoría de los estudios están distribuidos en el 4.o cuadrante del gráfico, con S y E superiores al 70%, con una distribución de las estimaciones de los estudios a lo largo de la teórica curva SROC que sugiere fuertemente la existencia de efecto umbral. La correlación hallada entre S y la tasa de FP fue casi significativa (rho 0,452, IC 95% de −0,103 a +0,793). El área bajo la curva es de 0,90 (IC 95% 0,91-0,891).
Al evaluar los estudios, se encontró que la mayoría estaban realizados en AP; otros pocos estaban realizados en el laboratorio del hospital de pruebas funcionales respiratorias, pero con enfermos remitidos desde AP; y en algunos trabajos no quedaba claro el origen de los enfermos. Con estas dudas, se decidió no realizar ese análisis de subgrupos.
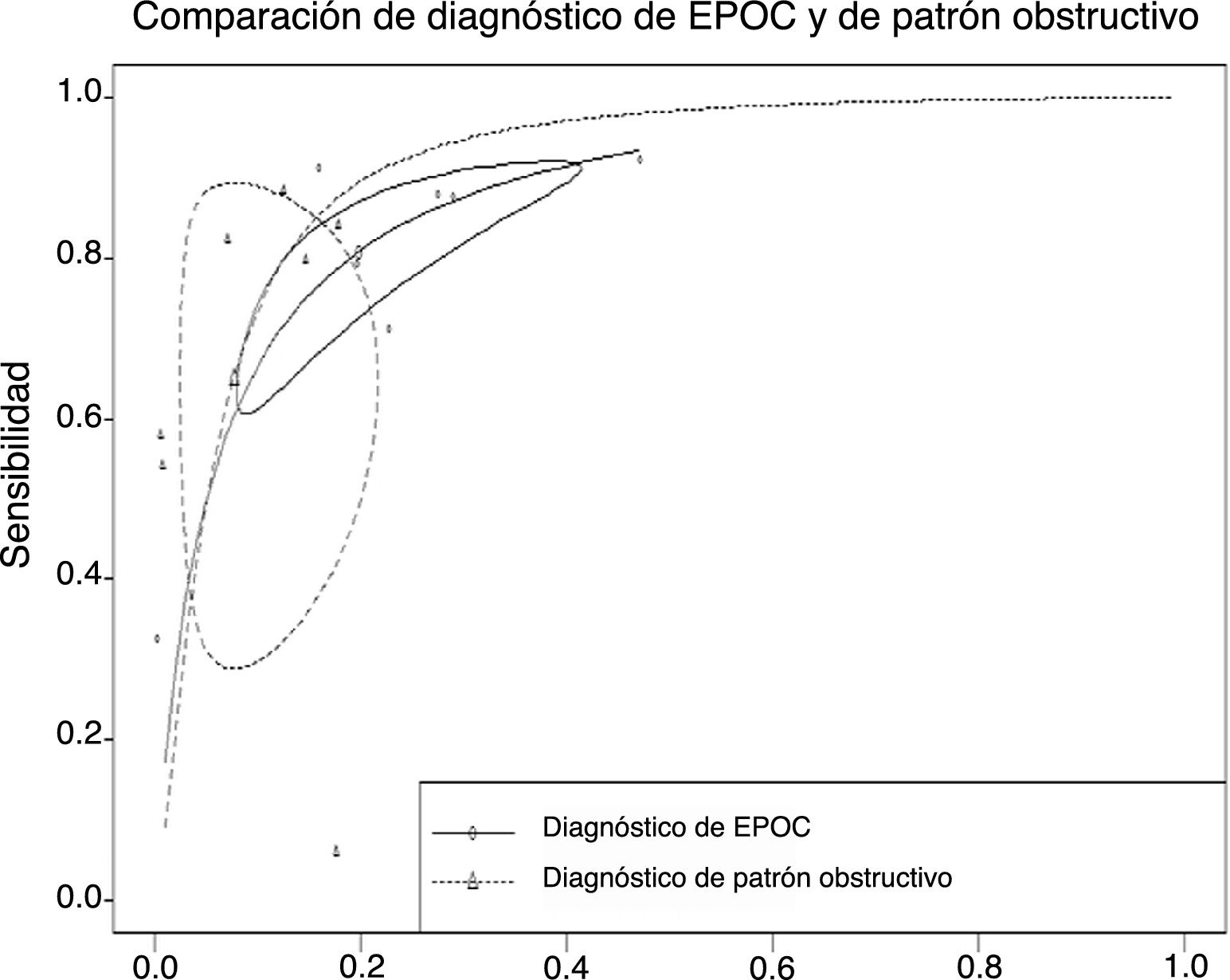
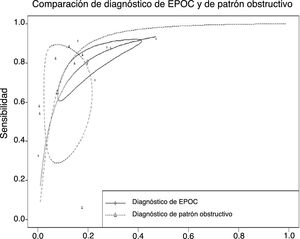
El análisis estratificado de estudios, comparando aquellos cuyo objetivo es el diagnóstico precoz de EPOC frente a los que tienen como objetivo el screening de patrón obstructivo, se valora en la figura 4. Las curvas SROC conjuntas y las nubes de puntos están superpuestas. La metarregresión bivariante muestra una asociación no significativa entre esa variable «objetivo de diagnóstico precoz del estudio» y la fiabilidad (S y E) del estudio; es decir, parte de la heterogeneidad observada no se debe al objetivo inicial de los estudios incluidos.
Comparación de las curvas SROC de los estudios dirigidos al diagnóstico precoz de EPOC y los dirigidos al diagnóstico de patrón obstructivo. tsens (transformed sensibility)=−0,848 (IC 95% −2,322 a +0,626), p=0,26; tfpr (transformed tasa de FP)=−1,077 (IC 95% −2,285 a +0,131), p=0,081.
La valoración de estudios de mala y buena calidad es análoga a la anterior, con nubes de puntos superpuestas, y el análisis de metarregresión bivariante arroja resultados no estadísticamente significativos.
La evaluación de estudios realizados en Europa vs. en Asia (anexo 8 del material adicional) tampoco encuentra diferencias, quizá con resultados algo mejores (curva y estimación ponderada más cercana al vértice superior izquierdo) en estudios desarrollados en Europa, pero con importante superposición de las 2 nubes de puntos. La metarregresión no consigue diferencias de significación estadística.
La figura 5 es una representación gráfica de las estimaciones de S y tasa de FP de cada estudio reflejando los puntos de corte elegidos en cada trabajo. Los estudios con punto de corte menor (FEV1/FEV6≤0,75) tienen E alta y S variable, aunque menor (parte vertical de la nube de puntos). Los estudios con punto de corte mayor (FEV1/FEV6>0,75) se distribuyen en la parte horizontal de la nube de puntos y tienen alta S. Las nubes de puntos no están superpuestas y la metarregresión sí arroja diferencias significativas en la tasa de FP (p<0,001), y diferencias casi significativas en la S (p=0,052) (anexo 9 del material adicional). La distribución de las nubes de puntos de los estudios dirigidos al diagnóstico de EPOC es análoga (anexo 10 del material adicional).
Concluimos a la vista de estos resultados que la calidad de la evidencia es baja (diseño de los estudios incluidos con probables sesgos, heterogeneidad de las características de los estudios y de los resultados hallados) y establecemos una recomendación débil (el beneficio de la realización de COPD-6 es mucho mayor que el coste del dispositivo y los riesgos nulos de su realización para el paciente) a favor del uso del dispositivo COPD-6 como herramienta de screening en población de riesgo de sufrir EPOC.
DiscusiónSe han publicado recientemente 2 trabajos análogos al nuestro. Haroon et al.31 realizan en 2015 una revisión sistemática y metaanálisis de distintos métodos de screening de EPOC. En total, 8 estudios valoran cuestionarios de diagnóstico de EPOC, y 4 trabajos un miniespirómetro: el de Thorn et al.29, que usa un dispositivo COPD-6, y otros 3 (Duong-Quy, Frith y Sichletidis, anexo 4 del material adicional) que usan otro dispositivo, para un total de 3.530 pacientes incluidos. Entre pacientes fumadores, los valores conjuntos de S (79,9%) y E (84,4%) son aceptables, y análogos a los encontrados en nuestro trabajo. La utilidad de los cuestionarios es menor (S 64,5 y E 65,2%). La conclusión fue que los espirómetros portátiles tenían mayor utilidad diagnóstica que los cuestionarios para detectar EPOC en el ámbito de AP. La ausencia de cegamiento adecuado supuso el principal sesgo de los trabajos.
Un trabajo similar se presentó como abstract en un Congreso de la European Respiratory Society de 201732. Se incluyeron 8 estudios desarrollados en el ámbito de AP y en centros de atención terciaria, con más de 4.000 pacientes en total y miniespirómetros de distintos tipos. Los resultados agregados de S y E son del 87% y 79%. La inclusión en el trabajo de enfermos fumadores, y un mayor valor de punto de corte de FEV1/FEV6, se asociaron a una mayor S, aunque no queda claro si ese punto de corte se define a priori, antes de llevar a cabo el estudio, o a posteriori tras su desarrollo.
Las bondades de nuestro trabajo son varias. Se ha intentado localizar el mayor número posible de trabajos. Es un dispositivo de reciente aparición, por lo que eso también puede condicionar la escasez de literatura. Los resultados de nuestro trabajo se basan en 14 estudios, de características y calidad muy heterogéneas, aunque muchos estudios se han llevado a cabo en áreas de AP, en países europeos, y con un perfil de enfermos y un nivel de vida y atención sanitaria que creemos debe ser superponible al de nuestro entorno; la aplicabilidad externa de los resultados de este trabajo parece buena.
También nuestro trabajo cuenta con limitaciones. La heterogeneidad de los estudios es importante (cohortes transversales, o casos y controles consecutivos; enfermos fumadores, o pacientes consecutivos que acuden a AP por cualquier motivo; cut-off definidos con anterioridad al desarrollo del trabajo, o a posteriori). La heterogeneidad de resultados no parece deberse a algunas circunstancias (país-continente donde se ha realizado el trabajo, calidad, objetivo inicial de detección de EPOC vs. patrón obstructivo), y sí al punto de corte para valorar la prueba como positiva o negativa.
La calidad de los estudios incluidos en nuestro trabajo no es en general buena. Hemos optado por catalogar a los estudios de mala calidad como aquellos en los que constatamos algún elemento que supone un alto riesgo de sesgo según la herramienta QUADAS-2, o tratarse de abstracts de congresos (3 estudios), y asumir que los restantes trabajos son de buena calidad. Además, los momentos de realización de la miniespirometría o la espirometría convencional son dudosos en la mayoría de los trabajos. Un planteamiento alternativo, considerar a los estudios de buena calidad como aquellos con planteamiento óptimo en todas las áreas de valoración del estudio, catalogaría solamente a un estudio como de buena calidad16.
Al llevar a cabo nuestro trabajo decidimos centrarnos en el uso de un miniespirómetro concreto. Los diferentes dispositivos (Piko, EasyOne, etc.) pueden tener distintas características y distintas capacidades diagnósticas. Parecía, por tanto, que incluir distintos modelos de dispositivo añadiría mucha heterogeneidad, y que a priori tuviera sentido realizar un metaanálisis sobre la utilidad de un tipo concreto de miniespirómetro en el diagnóstico precoz de EPOC.
Los datos de nuestro estudio son concluyentes. El espirómetro COPD-6 tiene utilidad diagnóstica (área bajo la curva ROC>0,85), con utilidad en el screening de EPOC si utilizamos un cut-off apropiado (>0,75). Se trata de una herramienta barata y fácil de usar, que puede incluso ser usada en zonas con pocos medios económicos. Probablemente el uso del COPD-6 aumente mucho la probabilidad preprueba del enfermo sometido a espirometría convencional, y reduzca los pacientes en los que está indicado realizarse una espirometría convencional, con lo que se reducirán las listas de espera para su realización.
ConclusionesEl espirómetro portátil COPD-6 es una herramienta útil para el diagnóstico del patrón espirométrico obstructivo en general, y del EPOC en particular. Con los estudios disponibles hasta la fecha, podemos decir que puede ser útil en el screening de la EPOC. En las próximas guías GOLD debería valorarse la recomendación sobre el uso de COPD-6 como herramienta de screening de EPOC.
Nota de bioéticaEl trabajo es una revisión sistemática y metaanálisis de prueba diagnóstica. Se ha recogido información con una búsqueda bibliográfica amplia y se han realizado cálculos matemáticos y análisis gráficos. El trabajo no supone tratar de forma activa o pasiva a ningún enfermo, por lo que la opción de solicitar la autorización de realizar dicho trabajo al Comité de Ensayos Clínicos no tiene sentido.
FinanciaciónEste trabajo se ha llevado a cabo sin ninguna ayuda económica de ningún tipo.
AutoríaMAGG y MARA realizaron la búsqueda de artículos relevantes en las bases de datos y en las referencias bibliográficas de los trabajos obtenidos. MAGG y AMC valoraron los datos relevantes de los trabajos (numéricos y de calidad), y en los aspectos sin acuerdo se alcanzó acuerdo gracias a la ayuda de MARA. El análisis estadístico fue realizado por MAGG y MARA. Las tareas de elaboración del manuscrito y la discusión del mismo fueron realizadas por todos los autores.
Conflicto de interesesTodos los autores afirman no tener conflicto de intereses, ni haber percibido ningún dinero de la casa farmacéutica Vitalograph® ni de otra casa farmacéutica fabricante de cualquier otro espirómetro portátil.
Los autores de este trabajo queremos agradecer especialmente su ayuda a:
- -
Arnau Ulsamer, representante farmacéutico de la casa Vitalograph, por el aporte de información al desarrollo del trabajo. Ninguna persona vinculada a esta casa farmacéutica, o a otra, ha participado ni ha influido en el desarrollo del trabajo.
- -
Isabel María Álvarez, ayudante técnico de información científica de GSK, por su ayuda en cuanto a conseguir varios artículos necesarios para desarrollar este trabajo.
- -
Jaime Latour, médico intensivista y gran conocedor de los estudios y metaanálisis de pruebas diagnósticas, y de la metodología de la investigación en general, por su ayuda en el planteamiento del trabajo.
- -
Álex Saller y Amparo Ruiz, por su ayuda en la traducción del trabajo de Muller (Anexo 4 del material adicional).
- -
Alberto García, por su inestimable ayuda en la edición de varias figuras del trabajo.