Recientemente, hemos descrito que el tabaquismo se asocia con infección por Mycobacterium tuberculosis(M.tuberculosis)en adultos1, un hallazgo confirmado en otros estudios2-6. En pocos estudios se ha investigado la asociación entre la exposición medioambiental al humo de los cigarrillos (tabaquismo pasivo) y la infección por esta bacteria.
En niños, el tabaquismo pasivo puede producir efectos especialmente lesivos, comparado con adultos, porque su sistema respiratorio e inmunitario no está desarrollado por completo7-10. Por otra parte, los niños pasan más tiempo en el domicilio y, por lo tanto, tienen mayores probabilidades de experimentar una exposición al tabaco más intensa y prolongada si fuma algún miembro adulto de la familia. El tabaquismo pasivo aumenta el riesgo del niño a contraer asma, bronquitis, neumonía, otitis media y presentar el síndrome de la muerte súbita del lactante, además del riesgo a someterse a procedimientos como timpanostomías, amigdalectomías y ade-noidectomías7,11-13. En la actualidad no se dispone de información suficiente para establecer la existencia de una asociación entre el tabaquismo pasivo y la infección por
M.tuberculosisen niños. Llevamos a cabo un sondeo comunitario transversal que nos permitió una evaluación de la asociación entre la infección por esta bacteria y el tabaquismo pasivo en niños. Formulamos la hipótesis de que en niños éste se asocia con dicha infección.
MÉTODOSÁrea del estudio y población del estudioEl presente estudio se efectuó en dos comunidades urbanas adyacentes caracterizadas por ingresos bajos a medios (Ravensmead y Uitsig) en Ciudad del Cabo, Sudáfrica, con una población de 36.334 habitantes en 200114. En 2002 la tasa de declaración obligatoria de la tuberculosis era de 341 por 100.000 para tuberculosis (TB) con nuevo frotis positivo y de 841 por 100.000 para la TB total en adultos14,15 (TB pulmonar y extrapulmonar).
Los casos de TB infantil comprenden aproximadamente el 18% de la carga de casos de TB total16. La prevalencia de infección por virus de la inmunodeficiencia humana (VIH) en mujeres embarazadas en el distrito en el que se localizan Ravensmead y Uitsig aumentó desde el 7,9% en 2001 hasta el 15,1% en 200417.
Obtención de los datosEl presente estudio formó parte de un sondeo exhaustivo, el Lung Health Survey, y se condujo entre el 1 de julio y el 15 de diciembre de 2002. Se obtuvo la aprobación ética de la Stellenbosch University y la University of Cape Town. El presente estudio se condujo de acuerdo con los estándares éticos de la declaración de Helsinki de la World Medical Association. Se seleccionaron aleatoriamente 837 direcciones residenciales (15%) a partir de un Geographical Information System que contenía la localización exacta de las 5.592 direcciones en el área del estudio. Si el cabeza de familia del domicilio no dio su consentimiento, se seleccionó la dirección adyacente, la primera a la derecha y después a la izquierda. Eran elegibles para la participación en el estudio todos los residentes que vivían en las direcciones seleccionadas. Se obtuvo el consentimiento informado por escrito de todos los participantes adultos (≥ 15 años de edad) y de los padres o tutores legales de los niños (< 15 años de edad). Todos los niños se sometieron a una prueba cutánea de la tuberculina intradérmica (PPD) recibiendo 2 UT (0,1 ml) de PPD RT 23 en la cara anterior del antebrazo izquierdo18. Enfermeras con experiencia midieron la induración después de 48 a 120 horas. Se consideró que una reacción de 10 mm o mayor representaba una infección por M. tuberculosis. Todos los miembros adultos de la familia completaron un cuestionario que incluía preguntas relacionadas con el tabaquismo, ingresos y tuberculosis previa.
Análisis estadísticoEl tabaquismo pasivo se definió como vivir en una familia con al menos un adulto fumador durante como mínimo un año. Los ingresos medios de los miembros adultos de la familia se calcularon como los ingresos totales de todos los miembros, divididos por el número de miembros adultos de la familia. Los niños que eran fumadores activos y aquellos para los que no estuvo disponible información sobre tabaquismo pasivo se excluyeron del análisis. Para modelar la infección por M. tuberculosis en el tabaquismo pasivo se utilizó una regresión logística de efectos aleatorios. Se tuvo en cuenta la agrupación a nivel de la familia mediante la inclusión de la familia como efecto aleatorio en el modelo. Se estimaron las odds ratios (OR) no ajustadas y ajustadas y los intervalos de confianza (IC) del 95%. Los factores de confusión que se tomaron en consideración fueron la edad del niño, ingresos medios de los miembros adultos de la familia, y presencia de un caso de TB en la familia. También utilizamos un modelo de regresión logística de efectos aleatorios para determinar la asociación entre la infección por M. tuberculosis en niños y el número de fumadores en la familia y el número medio de cigarrillos fumados al día en el hogar. Se llevaron a cabo análisis separados para los niños que vivían en familias donde, como mínimo, uno de los adultos había experimentado alguna vez TB y para niños que vivían en familias en las que ninguno de los adultos había experimentado TB. Las distribuciones del PPD de niños cuya induración se determinó después de 48-72 horas y aquellos en los que se determinó después de 96-120 horas se compararon con la prueba de Mann-Whitney.
Se obtuvo la aprobación ética de la Stellenbosch University y de la University de Cape Town. El presente estudio se efectuó de acuerdo con los estándares de ética de la Declaración de Helsinki de la World Medical Association.
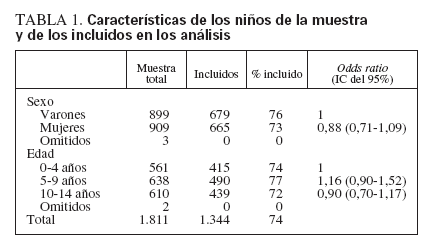
RESULTADOSFueron elegibles para el estudio un total de 1.811 niños. Para 1.593 (88%) niños, se obtuvo el consentimiento de los padres o tutores legales. Se excluyó a tres niños porque no se dispuso de datos sobre tabaquismo pasivo y a otros 220 porque no se efectuó el PPD o no se leyó en un plazo de 48 a 120 horas. No se identificó una diferencia en la distribución del tamaño del PPD entre aquellos con induraciones leídas a las 48-72 horas y aquellos cuyas induraciones se leyeron hasta 120 horas después de la administración (p = 0,4242). Por lo tanto, en los análisis se utilizaron todos los niños con PCT leídas entre 48 y 120 horas. Se excluyó de los análisis a 26 niños porque eran fumadores activos. Todos estos niños también eran fumadores pasivos. En los análisis se incluyó un total de 1.344 de 1.593 (84%) niños de 664 familias. La edad o el sexo de los niños incluidos en los análisis no difirieron de los de aquellos no incluidos en los análisis o de aquellos para los que no se obtuvo el consentimiento (tabla 1).
TABLA 1. Características de los niños de la muestra y de los incluidos en los análisis
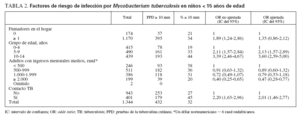
En 432 niños (32%) la induración del PPD fue de 10 mm o mayor. Entre niños más mayores se identificó infección con más frecuencia que entre los de menor edad (tabla 2). Un total de 1.170 (87%) niños eran fumadores pasivos en la familia y entre éstos se identificó con más frecuencia un PPD positivo (34%) que entre los que no eran fumadores pasivos (21%) (OR no ajustada: 1,89, IC del 95%: 1,24-2,86). No obstante, el significado de este hallazgo no se mantuvo después de un ajuste para la edad del niño, los ingresos medios de todos los adultos de la familia y la presencia de un caso de TB en la familia (OR 1,35, IC del 95%: 0,86-2,12) (tabla 2). Se identificó una relación significativa entre la infección por M. tuberculosis en niños y tanto el número de fumadores en la familia (OR para cada fumador adicional = 1,12, IC del 95%: 1,03-1,20) como el número de cigarrillos fumados al día en el hogar (OR para cada cigarrillo adicional: 1,009, IC del 95%: 1,003-1,014). No obstante, esto dejó de ser significativo después de un ajuste para las variables consideradas, la edad del niño, ingresos medios de los adultos de la familia y presencia de un paciente con TB en la familia (OR ajustada para cada fumador adicional = 1,03, IC del 95%: 0,94-1,13) y el número de cigarrillos fumados al día en el hogar (OR para cada cigarrillo adicional: 1,005, IC del 95%: 0,999-1,011).
TABLA 2. Factores de riesgo de infección por Mycobacterium tuberculosisen niños < 15 años de edad
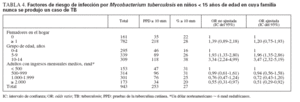
El tabaquismo pasivo se asoció significativamente con un PPD positivo en 172 familias con un paciente TB (OR ajustada: 4,60, IC del 95%: 1,29-16,45) pero no en las 492 sin un paciente TB (OR ajustada: 1,20, IC del 95%: 0,75-1,93) (tablas 3 y 4). La OR para el término de interacción de la presencia de un fumador y la presencia de un caso de TB en la familia fue de 4,09, con un IC del 95% de 0,95-17,54 (p = 0,058). En el análisis estratificado por paciente con TB en la familia no pudimos detectar un efecto cuantitativo del número de fumadores en la familia o el número medio de cigarrillos fumados al día en la familia.
TABLA 3. Factores de riesgo de infección por Mycobacterium tuberculosisen niños < 15 años de edad con un caso de TB en la familia
TABLA 4. Factores de riesgo de infección por Mycobacterium tuberculosisen niños < 15 años de edad en cuya familia nunca se produjo un caso de TB
DISCUSIÓNEn general, el tabaquismo pasivo no se asoció con infección por M. tuberculosis. No obstante, un análisis estratificado por familias con un caso de M. tuberculosis demostró una asociación significativa entre el tabaquismo pasivo y esta infección. El hallazgo del presente estudio sugiere que el tabaquismo pasivo aumenta el riesgo de adquirir esta infección, dada la exposición de la familia al caso adulto índice. La asociación es motivo de gran preocupación, porque en muchos países en desarrollo con una carga elevada de tuberculosis la prevalencia de tabaquismo está aumentando rápidamente, en particular entre mujeres19,20.
En 1995, el 58% de varones y el 59% de mujeres del grupo étnico que estudiamos eran fumadores21. En el presente estudio, el 87% de niños eran fumadores pasivos en el domicilio, porcentaje mayor que el documentado por Reddy et al, que describieron que el 67% refirió que fumaba como mínimo un miembro de la familia21. La diferencia puede explicarse por el hecho de que en el presente estudio incluimos tanto a los fumadores actuales como a los ex fumadores. Sin embargo, creemos que en esta comunidad pocos fumadores dejan el tabaco. La proporción elevada de mujeres que fuman es de particular preocupación porque exponen a sus hijos al humo de los cigarrillos.
El tabaquismo pasivo puede afectar al sistema inmunitario de los niños y, en consecuencia, aumentar el riesgo de contraer infecciones. La exposición al humo de los cigarrillos da lugar a alteraciones de la función epitelial, como una disminución de la actividad mucociliar, disminución del aclaramiento de las sustancias inhala das, y una permeabilidad vascular y epitelial anormal3,22-25. Además, el tabaquismo puede cambiar la cantidad, consistencia y permeabilidad del moco3,26,27. El número de macrófagos alveolares aumenta debido a la exposición al humo de los cigarrillos pero su capacidad para fagocitar y/o destruir bacterias disminuye28-30. Como consecuencia, se compromete la inmunidad natural del pulmón y es más fácil que los agentes infecciosos alcancen el tejido alveolar. Los linfocitos T son muy vulnerables al humo de los cigarrillos lo que podría deteriorar su capacidad citotóxica para combatir las infecciones26. Además, el tabaquismo se asocia con disminuciones de la concentración sérica de inmunoglobulinas, cociente linfocitos T colaboradores/supresores y actividad citotóxica de las células agresoras naturales31-33, lo que puede traducirse en una disminución de la respuesta inmune del organismo a la infección por M. tuberculosis.
Algunos otros estudios han examinado la asociación entre tabaquismo pasivo e infección por M. tuberculosis. Kuemmerer y Comstock34 documentaron que las reacciones a la tuberculina fueron mayores en niños cuyos padres eran fumadores. En un estudio efectuado en la India sus autores mencionaron un riesgo relativo de 2,68 (IC del 95%: 1,52-4,71) de infección por M. tuberculosis en niños menores de 5 años de edad que vivían con un paciente adulto portador de TB y que estaban expuestos al humo medioambiental de los cigarrillos comparado con niños no expuestos35. El análisis multivariado incluyó la positividad del esputo del caso índice y la desnutrición del niño pero no se efectuaron ajustes para la posición socioeconómica (PSE) lo que podría haber sesgado los resultados. En un estudio efectuado por Gerald et al36 el estado actual del tabaquismo del caso índice de TB fue un factor de riesgo univariado significativo de infección tuberculosa en los contactos adultos y pediátricos. Sin embargo, estos investigadores excluyeron el tabaquismo de su modelo final debido al reducido número de individuos incluidos.
El presente estudio adolece de algunas limitaciones. En el análisis de subgrupo de niños expuestos a un caso de TB en la familia, el número de niños sin un fumador en la familia fue muy reducido. Aunque la odds ratio fue alta, sugestiva de una asociación entre el tabaquismo pasivo y la infección por esta bacteria, el pequeño tamaño de la muestra se refleja en unos intervalos de confianza anchos y, por esta razón, deben interpretarse los hallazgos con precaución. El estado del tabaquismo se basó en la autoevaluación y podría haber estado influido por un sesgo de documentación. No determinamos marcadores biológicos, caso de la concentración urinaria de cotinina, para confirmar la exposición al humo del tabaco. Tratamos de controlar la PSE mediante un ajuste para los ingresos medios. El nivel de educación y el hacinamiento no se asociaron significativamente con la infección y, por lo tanto, no se incluyeron en los análisis. No pudimos ajustar el grado de nutrición. Efectuamos un control para la presencia de un caso de TB en la familia ya que es un importante factor de confusión puesto que los fumadores tienen más probabilidades de experimentar TB que los no fumadores37-39. En grandes fumadores la tos también puede dar lugar a un retraso en el diagnóstico de la enfermedad, lo que se traducirá en un período más prolongado de tiempo para su transmisión. Los pacientes TB fumadores también pueden ser más contagiosos porque tosen más. Así mismo, el PPD como parámetro de la infección tuberculosa adolece de limitaciones. Las induraciones pequeñas pueden deberse a la exposición a micobacterias medioambientales y/o a la reactividad cruzada debida a la BCG. Sin embargo, en el área del presente estudio consideramos que no son prevalentes las micobacterias medioambientales ya que identificamos una distribución unimodal de las respuestas al PPD con casi cualquier induración de pequeño tamaño. Además, después de la vacunación con BCG, la edad en el momento de la vacunación afecta principalmente a la reactividad a la tuberculina. Si la vacuna se administra en los primeros meses de vida, como ocurre en nuestras comunidades, las reacciones a la tuberculina se desvanecen rápidamente en todos los individuos40,41. Por lo tanto, consideramos que en los niños de esta población está justificado el punto de corte de 10 mm usado como indicación de la infección.
CONCLUSIÓNAunque, en general, el tabaquismo pasivo no se asoció con infección por M. tuberculosis, se asoció significativa-mente con la infección en el análisis estratificado por familias con un caso de TB. Se requiere un mayor número de estudios para confirmar esta observación, pero la posible asociación es causa de una preocupación sustancial considerando la elevada prevalencia del tabaquismo y la tuberculosis en la mayor parte de países en desarrollo.
AGRADECIMIENTOSLos autores desean expresar su agradecimiento al Dr. Ivan Toms, Director of Health of the City of Cape Town, por el permiso para realizar la investigación epidemiológica en las comunidades de Ravensmead y Uitsig. Los autores también dan las gracias a Katherine Lawrence por la organización de los datos.
Correspondencia: Saskia den Boon, MSc, KNCV Tuberculosis Foundation, PO Box 146, 2501 CC, La Haya, Holanda.
Correo electrónico: denboons@kncvtbc.nl