La exposición solar excesiva y crónica se ha descrito asociada a quemaduras solares, al envejecimiento cutáneo y al desarrollo de cáncer de piel principalmente1. Conociendo la relevancia del cáncer de piel en la planeación de políticas públicas en salud, dada su prevalencia creciente, los costos asociados con la atención médica y el impacto en la calidad de vida de los pacientes diagnosticados2–4; actualmente se recomienda a la población en general como estrategia de prevención primaria, minimizar la exposición a la radiación solar5.
Una de las alternativas para disminuir los efectos adversos de las radiaciones solares sobre la piel, es el uso de protectores solares. Y en la medida en que su uso se hace cotidiano, la máxima «primum non nocere» (lo primero es no hacer daño) nos recuerda el compromiso de garantizar en cualquier intervención, formulación o estrategia de prevención, la seguridad del paciente, reduciendo al máximo los riesgos innecesarios6, compromiso que debe incluir el impacto medioambiental de cualquier recomendación médica.
El objetivo de esta revisión narrativa es resumir la evidencia disponible acerca de las consecuencias nocivas para el ser humano y el medio ambiente del uso frecuente de los diferentes protectores solares, con el fin de brindar a los profesionales de la salud, especialmente al personal de atención primaria y a los dermatólogos, las herramientas para recomendar a la población en general el uso seguro de los protectores solares.
MetodologíaSe realizó una búsqueda de la literatura en la base de datos PubMed MEDLINE de los artículos publicados en los idiomas español e inglés, hasta el 20 de enero de 2022, utilizando los siguientes términos: «sunscreening agents», «sun protection factor», «chemical safety», «environment impact», «sunscreen», «photoprotection» y «patient safety». Adicionalmente se realizó una búsqueda en la base de datos de la Agencia Europea de Sustancias y Mezclas Químicas (ECHA, por sus siglas en inglés) de cada uno de los filtros y componentes más utilizados en los protectores solares (óxido de cinc, dióxido de titanio, metilbencilidenalcanfor, 2-etilhexil 4-metoxicinamato, benzofenona-3 (BP-3), ácido fenilbenzimidazol sulfónico, Neo heliopan® ap, tinosorb® A2B, Tinosorb® S, tinosorb® M, Uvinul® T 150, Uvinul® A plus, avobenzona, octocrileno (OC), dietilhexilbutamidotriazona, octilsalicilato).
Posteriormente se realizó una síntesis de la literatura encontrada en formato de texto. No se contactó a los autores.
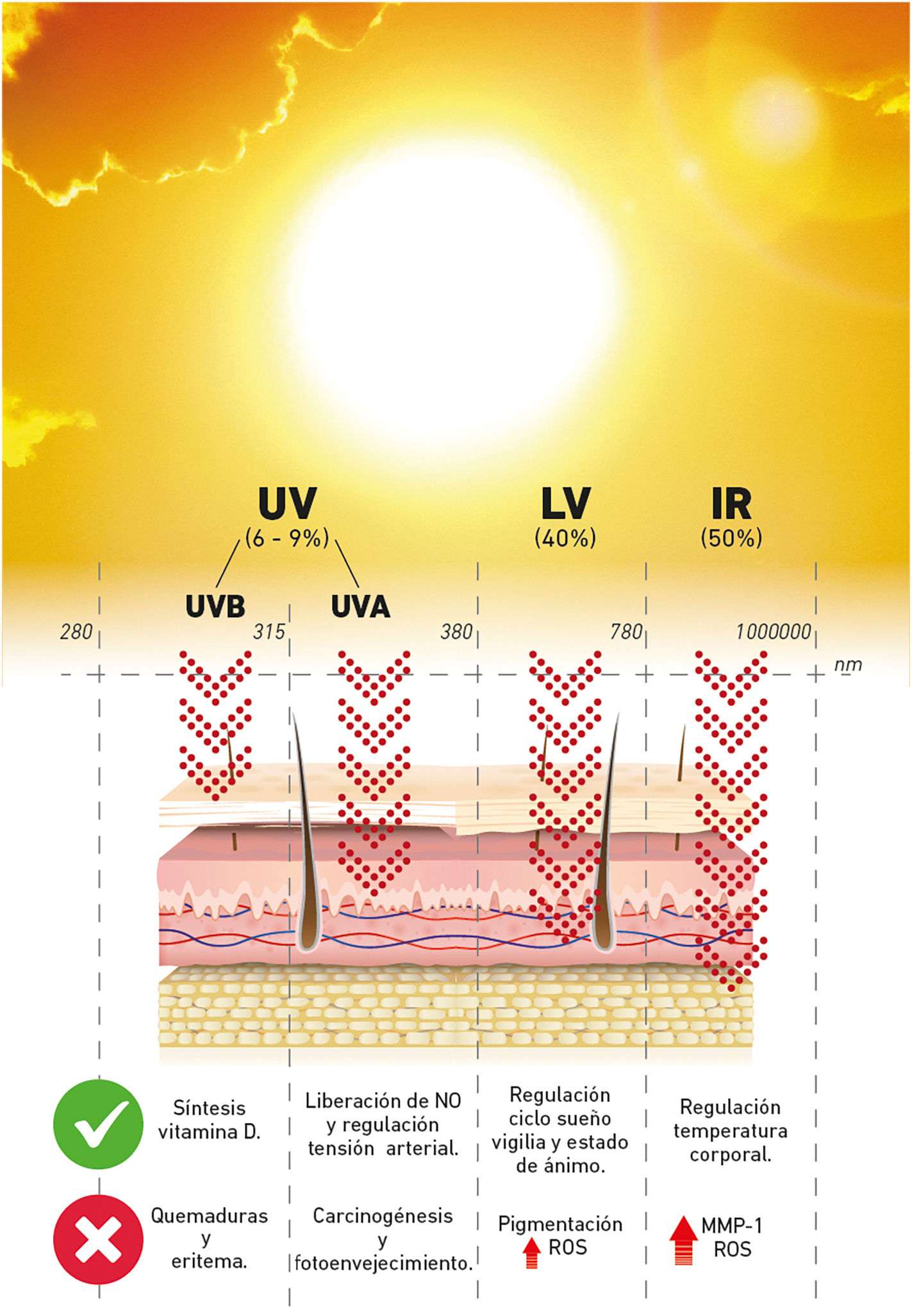
Interacción de la radiación solar con la piel humanaLa radiación solar tiene efectos tanto beneficiosos como nocivos para la salud humana7 (fig. 1). Dentro de sus efectos beneficiosos, la radiación ultravioleta (RUV) B juega un papel indispensable en la síntesis cutánea de la previtamina D38, y la RUV – A se ha relacionado con la modulación del estado de ánimo, el ciclo de sueño, vigilia, e incluso, con la regulación de la tensión arterial a través de la liberación de óxido nítrico, por su efecto relajante en el endotelio9.
Por otro lado, la exposición solar excesiva se ha asociado con varios efectos perjudiciales agudos y crónicos en la piel humana, que incluyen quemaduras solares, fotoenvejecimiento y cáncer de la piel, siendo la RUV el principal carcinógeno ambiental implicado y el factor de riesgo modificable más conocido1,10.
Dado el impacto del cáncer de piel a nivel mundial y el interés de los pacientes por prevenir el envejecimiento cutáneo prematuro, actualmente se recomienda a la población en general minimizar la exposición a la radiación solar5. Por lo tanto, la promesa de una protección adecuada, con un impacto seguro tanto para los seres humanos como para el medio ambiente, ha ocupado en los últimos años y de forma creciente el mercado de los protectores solares y productos dermocosméticos.
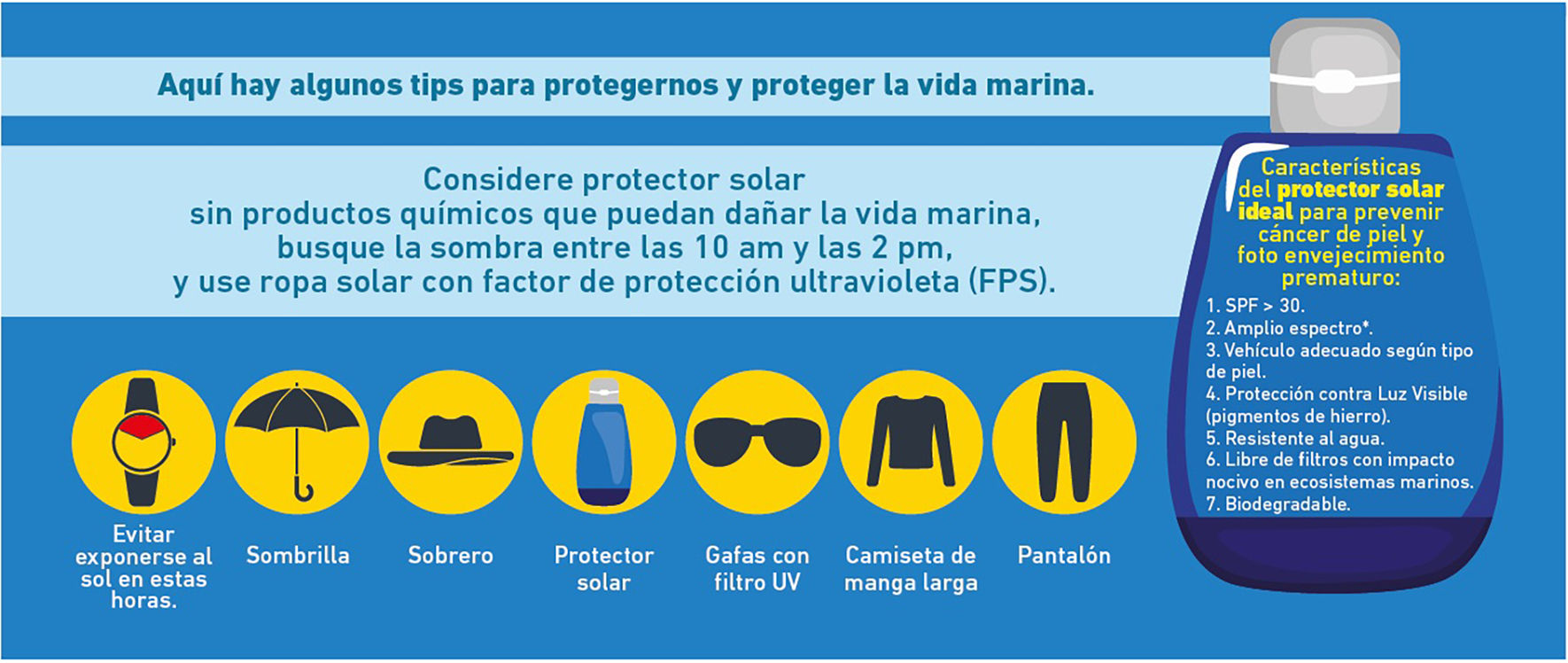
Foto protección y protectores solaresCon respecto a las estrategias para reducir la exposición a la radiación solar, la American Academy of Dermatology (AAD) recomienda: buscar la sombra de 10:00 am a 2:00 pm, proteger la piel del sol con ropa de manga larga, usar sombreros de ala ancha y gafas de sol con filtros ultravioleta adecuados; así como aplicar un protector solar de amplio espectro, con factor de protección solar (FPS) de 30 o más en las áreas de la piel no cubiertas por la ropa11.
Los protectores solares son preparaciones tópicas que contienen uno o varios componentes capaces de bloquear, reflejar o absorber la radiación emitida por el sol; los autores preferimos el término «fotoprotector cutáneo» debido a que estamos expuestos a otras fuentes de radiación además del sol. Sus ingredientes activos se clasifican en orgánicos e inorgánicos12,13. Los filtros orgánicos incluyen una variedad de compuestos aromáticos que absorben la RUV y la convierten en una cantidad insignificante de calor. Los filtros inorgánicos son compuestos minerales como el óxido de cinc (ZnO) y el dióxido de titanio (TiO2) que son capaces de reflejar y dispersar la RUV1,14,15.
El fotoprotector cutáneo ideal, debería bloquear todo el rango de la radiación electromagnética (REM) emitida por el sol (RUV, luz visible y radiación infrarroja) y las fuentes artificiales, y no solo una porción, con el fin de preservar lo que Stengel describe como la «homeostasis espectral», que se refiere al hecho de que el uso continuo de fotoprotectores que filtran solo una parte del rango de REM emitida por el sol, puede llegar a alterar la homeostasis cutánea7. Por lo tanto, con el fin de conseguir la homeostasis espectral, la industria farmacéutica ha desarrollado gran cantidad de alternativas cuyos ingredientes activos varían mucho a nivel mundial. Los autores proponemos algunas características del fotoprotector cutáneo ideal (fig. 2).
Debido a su fotosensibilidad, ciertos filtros UV orgánicos tienden a descomponerse por la exposición a la RUV, por lo que para alcanzar la fotoestabilidad se hace necesaria la mezcla de filtros, permitiendo que estas sustancias sean más lipofílicas y por lo tanto, más resistentes a la degradación abiótica y biótica16. Esta resistencia a la degradación genera preocupación a largo plazo por su impacto medioambiental.
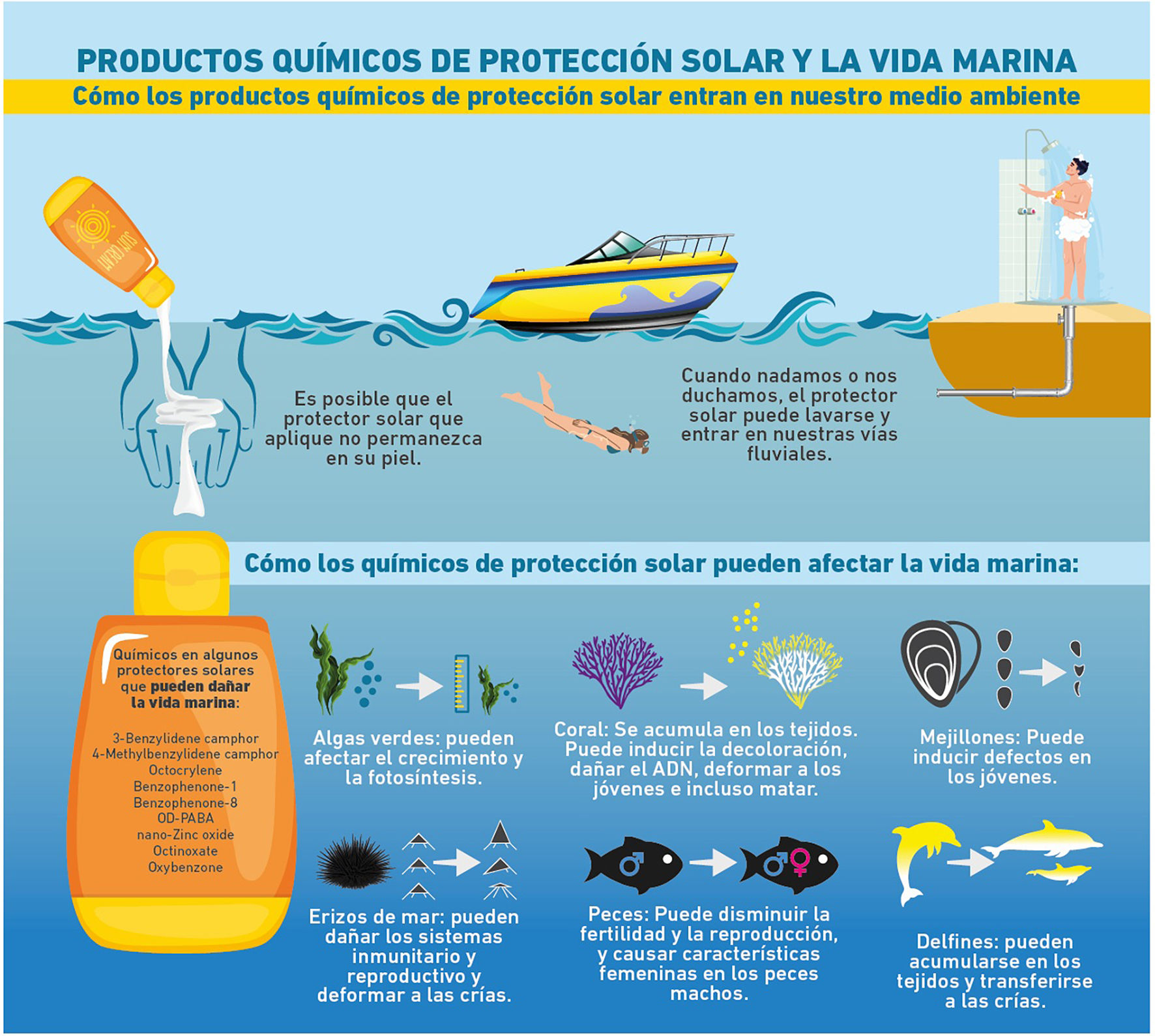
Impacto ambiental del uso frecuente de fotoprotectores cutáneosLos fotoprotectores aplicados no permanecen únicamente en nuestra piel. Durante el baño diario o al nadar, los principios activos pueden entrar en las vías fluviales y por tanto, en contacto con el medio ambiente marino (fig. 3). La Agencia de Protección Ambiental de Estados Unidos, considera a los protectores solares (como grupo) como contaminantes ambientales, porque se pueden medir en muchos ecosistemas acuáticos17. Una afirmación controversial que ha motivado varios estudios para determinar el verdadero impacto de cada uno de los componentes en el medio ambiente.
Productos químicos de protección solar y su posible impacto en la vida marina. Modificada de US Department of Commerce, National Ocean Service18.
Los arrecifes de coral son ecosistemas biodiversos compuestos por colonias de pequeños animales actualmente muy amenazados. Aunque los arrecifes de coral cubren solo el 0,1% del fondo del océano19, aproximadamente el 25% de todas las especies marinas conocidas dependen directa o indirectamente de ellos como hábitat o fuente de alimento20 y, por lo tanto, son de gran importancia para la economía y las fuentes de alimentación en las comunidades costeras.
Uno de los signos del estrés que sufren los corales es su «blanqueamiento», el cual se exacerba cuando la temperatura del océano aumenta, cuando los corales se ven expuestos al exceso de los RUV y en presencia de bacterias patógenas y contaminantes21. Así como también se exacerba cuando el coral está expuesto a ciertos químicos. Algunos autores han detectado filtros UV en la biota acuática22,23, incluso se plantea que puedan acumularse en la cadena alimentaria24,25, sin que se conozca con claridad aún su efecto fisiológico hasta la fecha.
Filtros orgánicosEn el agua de mar recolectada en las playas italianas, se documentó el 4-metoxicinamato de 2-etilhexilo (EHMC) y la BP-3 en concentraciones que oscilaron entre 25 y 83 ng/L y 33 -118 ng/L, respectivamente26. En estudios recientes, se han encontrado algunos filtros en las aguas marinas superficiales en Grecia, Noruega, España, Japón, China y EE. UU., incluso en la región ártica, pero su distribución estacional con picos de verano y las proporciones relativas entre compuestos variaron significativamente entre los puntos de muestreo27,28.
En general, BP-3, (OC), salicilato de 2-etilhexilo (EHS), 4-metilbencilideno alcanfor (4-MBC), homosalato (HMS) y butil-metoxidibenzoilmetano (B-MDM) se detectaron con mayor frecuencia con concentraciones que rara vez superan los 1.000 ng/L en el agua de mar, excepto en algunos estudios de muestreo en Hong Kong, Oslo y España que alcanzaron significativamente concentraciones más altas20,28.
El OC, el octilsalicilato (etilhexil salicilato), la BP-3 y el octilmetoxicinamato son considerados por la ECHA como sustancias muy tóxicas para la vida acuática29. Se sabe que las exposiciones agudas a OC de Daphnia magna, alteran su comportamiento fototáctico, encontrándose una mortalidad retardada hasta 7 días después de la exposición a 200 μg/L; mientras que la exposición crónica de 21 días a 7,5 μg/L de OC produjo una mortalidad completa30. Se ha demostrado también que los peces expuestos a niveles bioquímicos y moleculares indicaron toxicidad reproductiva y actividad estrogénica del OC31. En el caso del pez cebra, el OC altera el desarrollo del cerebro y el hígado14.
Filtros inorgánicosEn el caso de los filtros inorgánicos, es decir TiO2 y ZnO. El TiO2 no presenta registro de peligros para el medio ambiente acuático a la fecha, por lo que se considera una sustancia sin riesgo.
Por otra parte, el Comité Científico de Seguridad del Consumidor de la Unión Europea, considera seguro el uso de fosfato de cetilo, dióxido de manganeso y trietoxicaprililsilano como recubrimientos para el dióxido de titanio nano utilizado en productos de aplicación dérmica32. Sin embargo, esto no se aplica a las presentaciones que podrían provocar la inhalación pulmonar de las nanopartículas por el consumidor, como polvos o productos en spray, especialmente en concentraciones superiores al 25%, por considerarlo de potencial carcinogénico para las vías respiratorias, es decir carcinógeno categoría 2B33.
Con respecto al ZnO, la clasificación y etiquetado armonizados (CLH) aprobados por la Unión Europea, considera a esta sustancia muy tóxica para la vida acuática34.
La exposición de embriones de erizo de mar a filtros solares que contienen ZnO durante el desarrollo temprano tiene impactos negativos, como malformaciones que se correlacionan positivamente con la concentración de Zn en el entorno de los embriones. La toxicidad del Zn afecta a la capacidad de los embriones para sobrevivir al interferir con la formación del esqueleto y el movimiento axial35.
Las nanopartículas (NP) de ZnO tienen la tercera tasa más alta de producción de NP en todo el mundo debido a su amplio uso en cosméticos, fotoprotectores, pigmentos, electrónica y textiles36,37. Y se han clasificado como «extremadamente tóxicas» ([CL50] < 0,1 mg/l, concentración a la cual el 50% de los organismos expuestos muere) para los organismos acuáticos38.
Se ha demostrado que la toxicidad de las NP de ZnO se relaciona con frecuencia con los mecanismos tóxicos asociados con la disolución y liberación de zinc iónico39. También se ha demostrado que la generación de especies reactivas de oxígeno (ROS) por NP de ZnO induce daño en el ADN, según estudios con el pez cebra40,41.
El zinc disuelto dicta el comportamiento de absorción y la toxicidad de las partículas de ZnO en las comunidades acuáticas a través de la disolución rápida. Sin embargo, las concentraciones ambientales estimadas actuales para ZnO NP son demasiado bajas para provocar impactos adversos en los ecosistemas acuáticos, hacen falta más estudios al respecto.
Impacto en la salud humanaSi una persona sigue al pie de la letra las recomendaciones de fotoprotección, estaría expuesto a múltiples aplicaciones de protector solar en el transcurso de su vida, a partir de los 6 meses de edad42. Los fotoprotectores generalmente se aplican de forma tópica y repetida en grandes áreas de la piel. Por tanto, deben ser sustancias capaces de tener alta afinidad por el estrato córneo, con una mínima permeabilidad a la circulación sistémica43.
Dado que se ha documentado que el cuerpo humano puede absorber algunos filtros UV orgánicos contenidos en los fotoprotectores, en los últimos años se ha estudiado ampliamente su absorción y excreción percutánea42.
Algunos estudios han confirmado la detección de oxibenzona en la sangre y en la orina44, así como avobenzona, octocrileno y ecamsule en el plasma45, sin que se tenga claro su efecto clínico a corto ni largo plazo, lo cual no indica que se deba recomendar por el momento abstenerse de su uso. Hacen falta más estudios clínicos que permitan la actualización de los listados oficiales para así definir cuáles sustancias podrían seguir empleándose y cuáles definitivamente deben retirarse del mercado.
Regulación de la FDALos protectores solares son considerados medicamentos de venta libre, over the counter (OTC) en los Estados Unidos y actualmente existen 2 vías regulatorias para llevar un medicamento OTC al mercado según la Administración de Alimentos y Medicamentos de los Estados Unidos, Food and Drug Administration (FDA): el proceso de solicitud de nuevos medicamentos y el proceso de revisión de medicamentos de venta libre basado en las monografías de OTC46.
Las monografías de OTC establecen las condiciones en las cuales la FDA permite que ciertos medicamentos OTC sean comercializados sin necesidad del proceso de solicitud de nuevos medicamentos, por ser generalmente considerados como seguros y eficaces, es decir, generally recognized as safe and effective (GRASE)47.
La FDA emitió en febrero de 2019 una reglamentación (Registro Federal 84FR6204, 2019-03019) que actualiza los requisitos de control para la mayoría de los productos de protección solar OTC48 y el 24 de septiembre de 2021, se incluyeron revisiones y actualizaciones relacionadas con los valores del factor de protección solar (SPF), ingredientes activos, requisitos de amplio espectro y etiquetado de productos, entre otras disposiciones mencionadas en la reglamentación publicada en 201949.
En su revisión actualizada en 2021, encontraron suficientes datos de seguridad sobre el ZnO y el TiO2 (en concentraciones de hasta el 25%) para considerarlos GRASE (Categoría I)49, sin mención de estas sustancias en NP.
Por el contrario, concluyeron que los riesgos asociados con el uso de ácido aminobenzoico (PABA) y el salicilato de trolamina, superan sus beneficios y proponen que los protectores solares que contienen estos 2 ingredientes no son GRASE (Categoría II). En el caso del salicilato de trolamina, estos riesgos incluyen el sangrado causado por los efectos anticoagulantes del ácido salicílico y mayor riesgo de toxicidad por salicilato. Para PABA, los riesgos incluyen reacciones cutáneas alérgicas y fotoalérgicas, así como la sensibilización cruzada con compuestos estructuralmente similares49.
Debido a que el registro público no contiene datos suficientes para respaldar determinaciones positivas de GRASE para cinoxato, dioxibenzona, ensulizol, homosalato, meradimato, octinoxato, octisalato, octocrileno, padimato O, sulisobenzona, oxibenzona o avobenzona, proponen que estos ingredientes no sean GRASE y requieren más evaluación (Categoría III)49.
Consideraciones especiales en la seguridad humana y ambiental de los filtrosEn la actualidad no existen criterios definidos y/o oficiales que permitan establecer si las sustancias disponibles para la formulación de fotoprotectores cutáneos son del todo seguros tanto para los seres humanos como para el medio ambiente.
Las características de los filtros como el tamaño molecular, las propiedades fisicoquímicas, así como la solubilidad o el coeficiente de reparto, ligados a su propia naturaleza estructural, entre otros; son elementos que podrían explicar los fenómenos de absorción a través de la piel de aquellos cuya cuantificación plasmática ya ha sido, no solamente determinada, sino que superan el umbral de seguridad definido para ellos. Así como los fenómenos de distribución y permanencia de dichas sustancias en los distintos compartimentos del cuerpo humano.
El impacto ambiental de los filtros disponibles aún no se ha terminado de evaluar; en la actualidad existen investigaciones y estudios en curso, pero no existe un lineamiento gubernamental y/o oficial que establezca metodologías o criterios de rechazo o aceptación; características como la toxicidad acuática, el coeficiente de reparto, la bioacumulación, la biodegradabilidad, la toxicidad terrestre, entre otros; son elementos que correlacionados podrían estimar si la sustancia en cuestión puede ser o no, compatible con el medio ambiente.
Mientras las entidades oficiales y las autoridades gubernamentales que regulan la industria y los productos químicos y de uso humano, definan criterios y metodologías que permitan una clara conceptualización con relación a la seguridad humana y del medio ambiente, se debe realizar una búsqueda exhaustiva bibliográfica con miras a recopilar la mayor cantidad posible de información con relación a las sustancias usadas en productos cosméticos y específicamente en fotoprotectores cutáneos.
A partir de una búsqueda extensa en las diferentes bases de datos, incluyendo registros de las agencias regulatorias como FDA y ECHA, los autores proponemos una clasificación de las principales sustancias químicas utilizadas en los protectores solares según sus datos de seguridad tanto para la salud humana como para el equilibrio ambiental, como se muestra en la tabla 1. Los datos consignados estan sujetos a los resultados de futuras investigaciones.
Clasificación de activos solares teniendo en cuenta el perfil de seguridad humana y ambiental
| ¿Se sospecha algún riesgo de su uso en humanos? | |||
|---|---|---|---|
| No | Sí | ||
| ¿Es seguro su uso para el medio ambiente? | Sí | Tinosorb® M(Methylene Bis-Benzotriazolyl Tetramethylbutylphenol)BisoctrizolTinosorb® S(Bis-Ethylhexyloxyphenol Methoxyphenyl Triazine)BemotrizinolTinosorb® A2B(Tris-Biphenyl Triazine)Uvinul® A Plus(Diethylamino Hydroxybenzoyl Hexyl Benzoate)Uvinul® T-150(Ethylhexyl Triazone)Uvasorb® HEB(Diethylhexyl Butamido Triazone)IscotrizinolNeo Heliopan® AP(Disodium Phenyl Dibenzimidazole Tetrasulfonate)Bisdisulizole disodiumDióxido de titanio(Titanium Dioxide)Parsol® HS(Phenyl Benzimidazole Sulfonic Acid)Ensulizole | Parsol® 1789Butyl Methoxydiben-zoylmethaneAvobenzonaHomosalato(Homosalate) |
| No | Óxido de Zinc(Zinc Oxide) | Octocrileno(Octocrylene)Benzofenona(Benzophenone-3)Octilmetoxicinamato(Ethylhexyl Methoxycinnamate)OctinoxatoOctilsalicilato(Ethylhexyl Salicylate)Metilbencilidenalcanfor (4-Methylbenzylidene camphor)(Prohibido en EE. UU.-FDA) | |
Estamos obligados a garantizar un diseño racional y sustentable de este tipo de productos, así como brindar a la población en general recomendaciones de fotoprotección basadas en la evidencia.
Conflictos de interesesLos autores declaramos financiación para el acceso a las bases de datos y el diseño de las figuras de Laboratorios Megalabs Colombia.
FinanciaciónLaboratorios Megalabs.
- •
La radiación solar tiene efectos tanto beneficiosos como nocivos para la salud humana.
- •
Actualmente se recomienda a la población en general como estrategia de prevención primaria para el desarrollo de cáncer de la piel y el fotoenvejecimiento, minimizar la exposición a la radiación solar.
- •
El fotoprotector ideal debería bloquear todo el rango de la radiación electromagnética (REM) emitida por el sol (RUV, luz visible y radiación infrarroja) y las fuentes artificiales, y no solo una porción, con el fin de preservar la «homeostasis espectral», que se refiere al hecho de que el uso continuo de fotoprotectores que filtran solo una parte del rango de REM emitida por el sol, puede llegar a alterar la homeostasis cutánea.
- •
Los fotoprotectores aplicados no permanecen únicamente en nuestra piel; durante el baño diario o al nadar, los principios activos pueden entrar en las vías fluviales y por tanto en contacto con el medio ambiente marino.