Los tumores de células de Sertoli-Leydig son neoplasias ováricas infrecuentes; representan apenas el 0,5% de todos los tumores del ovario.
Aunque estos tumores secretan andrógenos, produciendo signos de virilización, sin embargo, no todos son funcionalmente activos. El tratamiento y pronóstico dependen de la edad, el estadio y el grado de diferenciación tumoral.
Presentamos 2 casos clinicopatológicos de mujeres de 13 y 47 años de edad, ambas con datos de androgenismo, hirsutismo e imagen de lesión sólida en el ovario. Fueron intervenidas quirúrgicamente con diagnóstico anatomopatológico de tumor de células de Sertoli-Leydig moderadamente diferenciado.
Sertoli-Leydig cell tumors are uncommon ovarian neoplasms, accounting for only about 0.5% of all ovarian tumors.
Although these tumors secrete androgen-producing signs of virilization, not all are functionally active. Treatment and prognosis depend on age and the stage and degree of tumor differentiation.
We present 2 cases in a 13-year-old girl and a 47-year-old woman, both with findings of androgenism, hirsutism and images of solid lesion in the right ovary. Both patients underwent surgery with a histopathological diagnosis of moderately differentiated Sertoli-Leydig cell tumor.
Los tumores ováricos se dividen en funcionantes y no funcionantes. Dentro del primer grupo tenemos los que presentan actividad endocrina y producen androgenización, como es el caso de los tumores de células de Sertoli-Leydig, denominados también androblastomas. Son neoplasias infrecuentes y corresponden a menos del 0,5% de todos los tumores del ovario. Pueden tener un comportamiento benigno o maligno, dependiendo del grado de diferenciación histológica, pero en general son tumores de bajo potencial maligno que se detectan en estadios iniciales (IA), lo que permite un tratamiento quirúrgico conservador, con un buen pronóstico y supervivencia.
Casos clínicosCaso 1Se trata de una mujer de 47 años de edad con aumento progresivo del vello facial en los últimos meses. Como antecedentes ginecoobstétricos refería menarquia a los 12 años, 2 gestaciones, 2 partos sin complicaciones y menopausia a los 42 años, sin terapia de sustitución hormonal. Presentaba también hipotiroidismo subclínico leve, sin necesidad de tratamiento desde hace 6 meses.
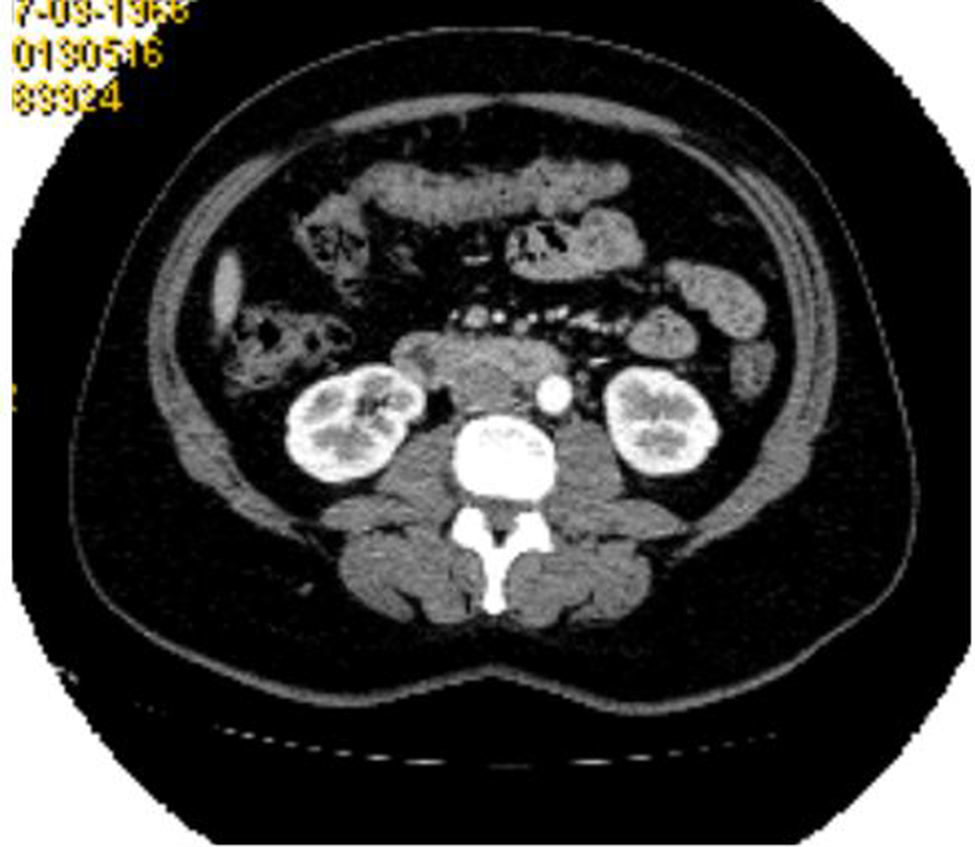
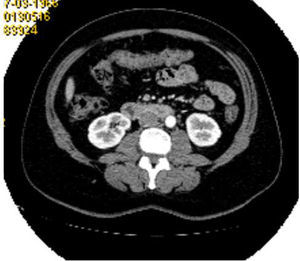
El estudio de determinaciones hormonales detectaba el aumento de la testosterona (5,6ng/ml; n: 0,084-0,481ng/ml) y de la TSH (5,55mcUI/ml; n: 0,27-4,2mcUI/m). Los niveles de LH, FSH, prolactina, estradiol y T4 libre fueron normales. La TC abdominopélvica mostraba las glándulas suprarrenales normales, el útero aumentado de tamaño, con una imagen en fondo uterino en relación con mioma submucoso de 3×2cm y una lesión sólida dependiente de anejo derecho de 4×3cm (fig. 1). La ecografía ginecológica reportaba una alteración en la vascularización del ovario derecho. Por todo lo anterior, y con el diagnóstico clínico de mioma uterino e hiperandrogenismo de probable causa ovárica, se realiza ooforectomía derecha y miomectomía para estudio anatomopatológico.
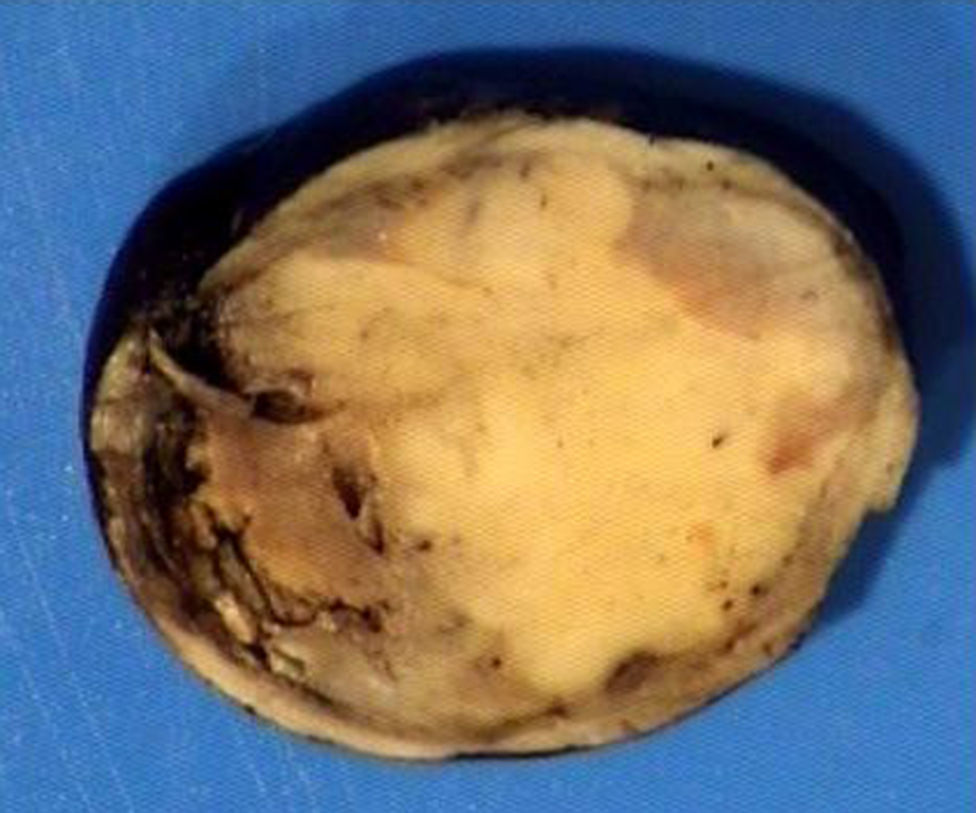
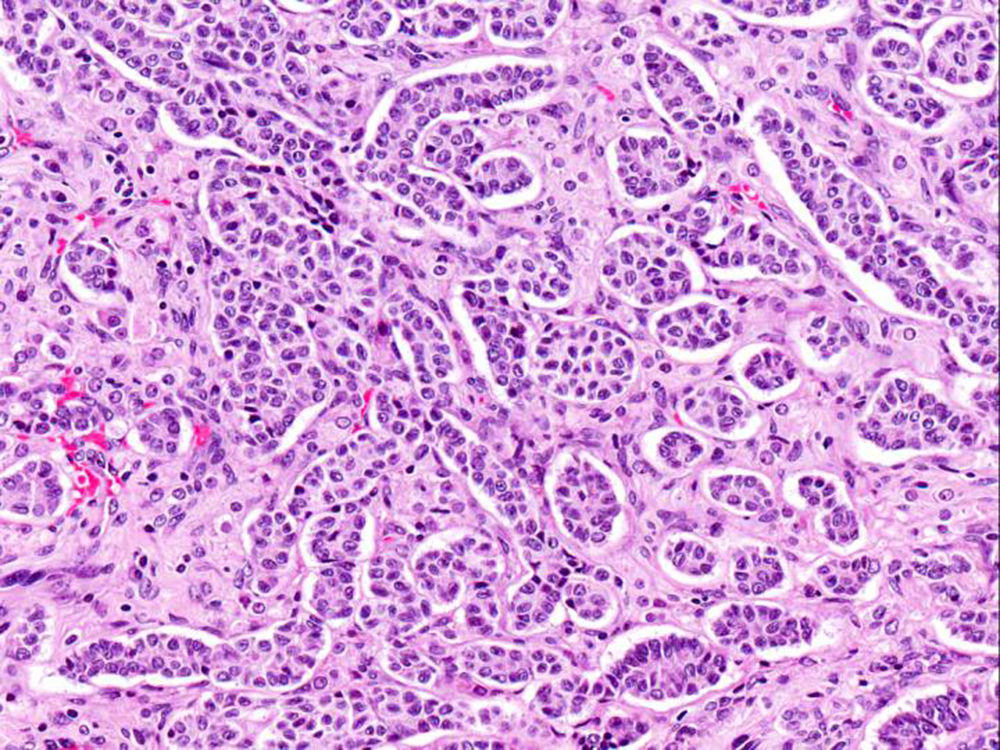
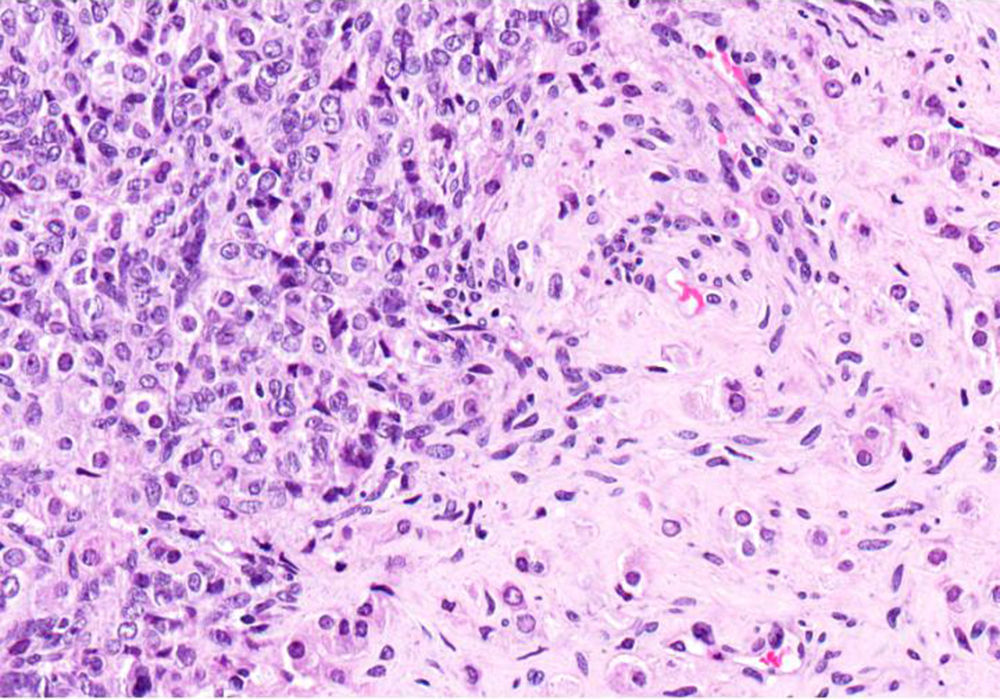
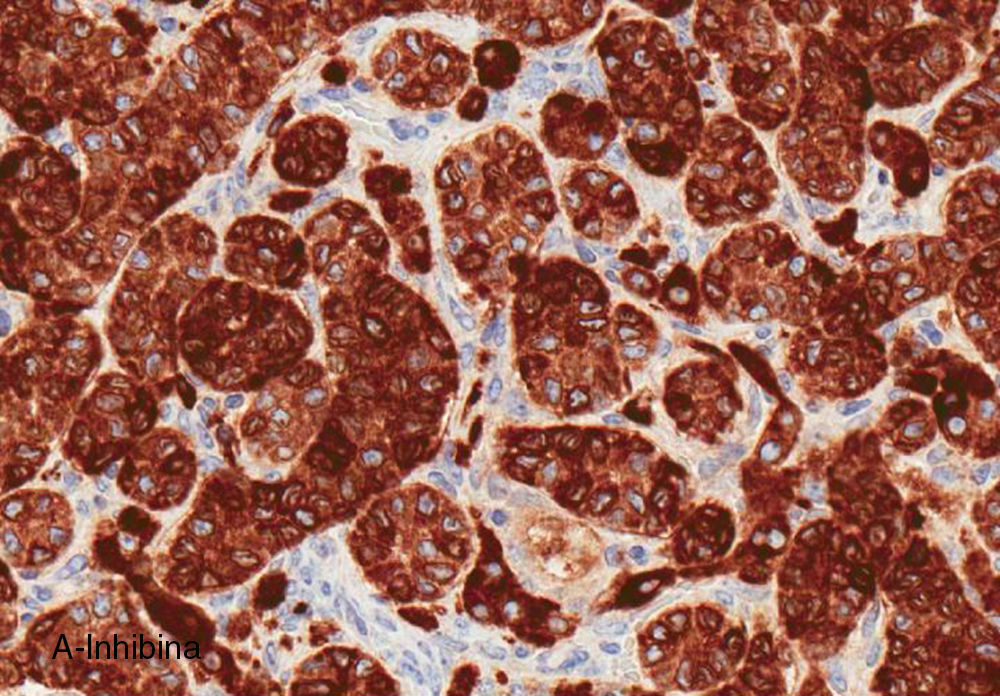
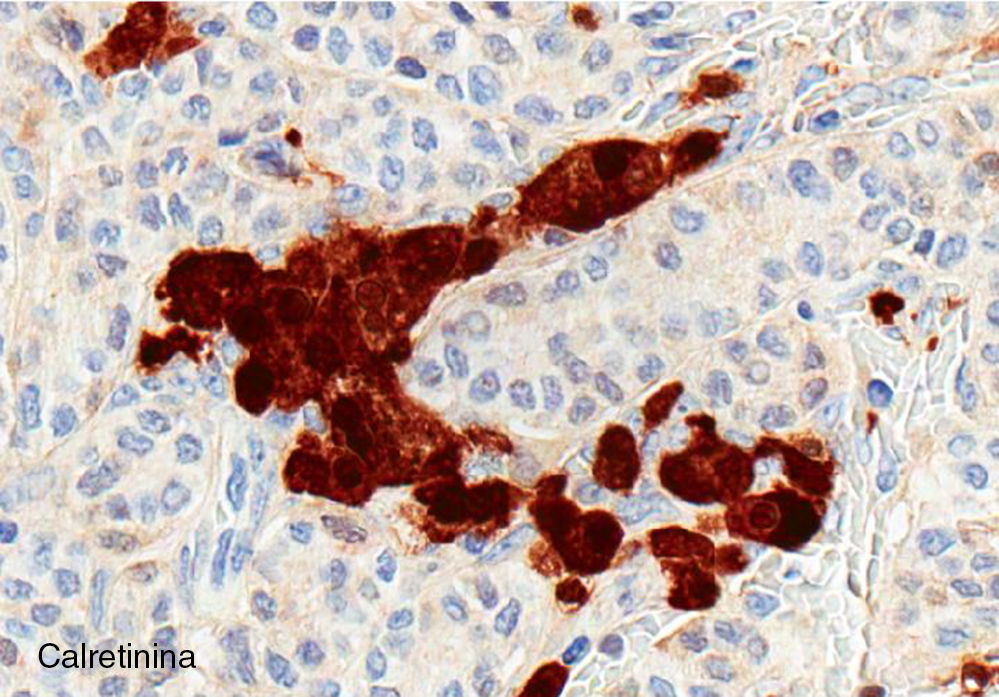
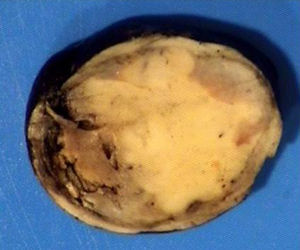
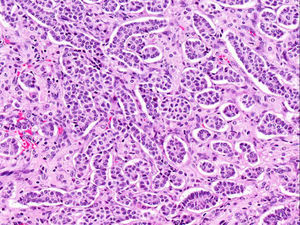
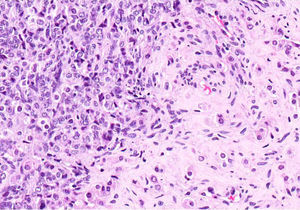
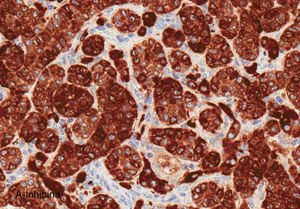
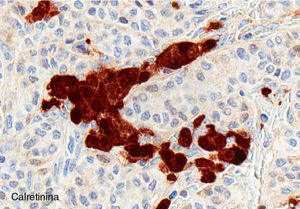
El ovario estaba ligeramente agrandado y medía 4×3×3cm (fig. 2). El nódulo miomatoso medía 3×2,2cm. En el estudio microscópico el parénquima ovárico estaba sustituido casi en su totalidad por una neoplasia densamente celular, de crecimiento aparentemente expansivo, con arquitectura muy heterogénea. Se identificaron áreas muy celulares de crecimiento en sábana constituidas por células de escaso citoplasma con núcleos elongados sin atipia significativa, y áreas nodulares de células con amplio citoplasma eosinófilo, granular, núcleos redondeados y con nucléolo prominente (fig. 3). En otras zonas existía una marcada arquitectura de cordones sólidos y túbulos con células de núcleos hendidos; entre los cordones sólidos destacaban unos pequeños agregados de células de amplio citoplasma eosinófilo (fig. 4). Se identificaron muy pocas mitosis (menos de una mitosis×10CGA) y no se observaron focos de necrosis. Con inmunohistoquímica los cordones sólidos fueron positivos con alfainhibina (fig. 5) y WT-1, mientras que las células entre los cordones fueron negativas para inhibina y positivas con calretinina(fig. 6). No se identificaron células germinales con PLAP.
El diagnóstico anatomopatológico del ovario fue de tumor de Sertoli-Leydig ovárico (cordones sexuales) de diferenciación intermedia, y el del nódulo uterino, de leiomioma.
Caso 2Niña de 13 años de edad con cuadro clínico de acné, hirsutismo y amenorrea secundaria de 8 meses de evolución, con test de embarazo negativo. Refería menarquia a los 9 años. El estudio de las determinaciones hormonales reveló un incremento de testosterona (3,7ng/ml; n: 0,084-0,481ng/ml) y estradiol (459,2pg/ml; n:<36pg/ml). El resto de los valores hormonales se encontraban dentro de los parámetros normales.
En el estudio radiológico, tanto la TC abdominopélvica como la ecografía ginecológica informaban de una tumoración sólida de ovario derecho de 67×64mm, no adherida. Las glándulas suprarrenales y el útero se encontraban sin alteraciones. Con la sospecha clínica de tumor del estroma gonadal productor de andrógenos, se le realizó anexectomía derecha.
La anatomía patológica destacaba ovario neoplásico de superficie lisa, grisácea, de 60g y de 6×5,5×3cm. Al corte mostraba una consistencia sólida y áreas blanquecinas-grisáceas con otras de aspecto hemorrágico. La cápsula se encontraba íntegra.
Histológicamente el ovario mostraba una proliferación neoplásica que formaba estructuras tubulares, cordones y áreas sólidas. Las células mostraban escaso citoplasma, núcleos redondeados u ovalados con pequeños nucléolos y escasas mitosis (una mitosis por 10CGA). Entre estos grupos se encontraban células de Leydig inmaduras con vacuolas citoplasmáticas.
El diagnóstico definitivo fue de tumor de células de Sertoli-Leydig de diferenciación intermedia.
DiscusiónEn las mujeres sanas, los ovarios y las glándulas suprarrenales producen alrededor del 40 al 50% de la testosterona corporal. Las causas de hiperandrogenismo de la mujer en edad fértil pueden ser de origen ovárico, adrenal y situaciones específicas del embarazo, entre otras1. Las causas adrenales incluyen la hiperplasia adrenal congénita de comienzo tardío, el síndrome de Cushing, los tumores adrenales secretores de andrógenos (adenoma y carcinoma) y la resistencia a los glucocorticoides. El hiperandrogenismo asociado al embarazo abarca los luteomas, la hiperreacción luteínica y el déficit de aromatasa en el feto. Entre otras causas de hiperandrogenismo se encuentran la hiperprolactinemia, el hipotiroidismo, la iatrogénica (fármacos) y la idiopática. Las causas de origen ovárico son: el síndrome del ovario poliquístico, la hipertecosis y los tumores del ovario secretores de andrógenos. Dentro de este último grupo encontramos el tumor de células de Sertoli-Leydig, el tumor de células de la granulosa, los tumores de células lipídicas o de células del hilio y el ginandroblastoma.
El tumor de células de Sertoli-Leydig es un tumor ovárico poco frecuente, representando menos del 0,5% de todos los tumores ováricos2; sin embargo, es el tumor funcionante androgenizante más frecuente3, y se caracteriza por estar orientado estructural y a menudo también funcionalmente en sentido masculino, aunque ocasionalmente puede producir estrógenos y en un 20% de los casos es inerte4. La testosterona es la hormona que con mayor frecuencia y en mayor cantidad secretan estos tumores, aunque también pueden sintetizar androstenediona y 17-OH progesterona, y algunos, incluso, gonadotropina coriónica o alfafetoproteína, sin llegar a alcanzar los niveles tan altos hallados en el tumor del seno endodérmico. El tumor de células de Sertoli-Leydig tiene una mayor incidencia en mujeres jóvenes entre los 20 y 30 años, pudiendo presentarse a cualquier edad. Clínicamente se manifiesta con signos de virilización progresiva, que se inician con acné, seguido de hirsutismo, calvicie de patrón masculino, voz ronca, clitoromegalia, aumento de peso, anormalidades menstruales y anovulación. La mayoría de los tumores ováricos virilizantes se presentan en la edad reproductiva y son casi siempre unilaterales, por lo tanto, deben sospecharse en mujeres jóvenes con irregularidad menstrual, hiperandrogenismo y signos de virilización.
Es imprescindible hacer una evaluación completa, con pruebas complementarias como la medición hormonal por cateterización selectiva de las venas ováricas, para obtener el gradiente venoso ovárico-periférico; todas estas pruebas irán dirigidas a identificar la fuente productora de andrógenos. La testosterona es la hormona que predominantemente se localiza en las células de Leydig5. Según Meldrum y Abraham6, debe descartarse un tumor productor de andrógenos cuando los niveles de testosterona periférica excedan los 2ng/dl, o los de testosterona de la vena ovárica, los 20ng/dl, en general acompañados de un tumor, y en particular si este es menor de 5cm de diámetro.
En 1930 Meyer les dio el nombre de arrenoblastoma. Y es desde 1958 que se conocen como tumor de células de Sertoli-Leydig7, una entidad poco frecuente incluida dentro de los tumores del ovario, de los cordones sexuales y del estroma gonadal específico, caracterizada por la presencia de células de Sertoli, células de Leydig y fibroblastos en proporciones variables dentro del mismo tumor. Macroscópicamente suelen ser unilaterales (98%), de componentes quísticos y sólidos, amarillentos y miden, en promedio, 13cm de diámetro mayor.
Histológicamente, dependiendo del grado de diferenciación se dividen en 3 grupos: bien diferenciados, moderadamente diferenciados y pobremente diferenciados2.
Los tumores bien diferenciados presentan un patrón típico tubular en cordones de células de Sertoli alternados con pequeños grupos de células de Leydig, sobre un estroma fibroso o hialino. Los tumores de diferenciación intermedia presentan una gran variedad de patrones histológicos intermedios. En los tumores poco diferenciados, el componente de células de Sertoli se presenta como grupos sólidos de células poco diferenciadas, fusocelulares, de aspecto sarcomatoide, con abundantes figuras mitóticas (10 o más mitosis en 10CGA). Cada uno de estos grupos presenta una significación pronóstica progresivamente más agresiva.
Tanto en los grupos de los tumores de diferenciación intermedia como en los poco diferenciados es posible encontrar 2 características histológicas que han sido señaladas como indicadores de peor pronóstico en cuanto a la recurrencia, que son:
- 1.
El componente heterólogo se ve con mayor frecuencia en los tumores de diferenciación intermedia, e incluye estructuras glandulares de tipo gástrico o intestinal. Otros componentes pueden ser de tipo carcinoide o elementos estromales.
- 2.
El patrón retiforme se caracteriza por presentar estructuras tubulares de células de Sertoli dispuestas en un estroma hialino en forma similar a la rete testis, que en ocasiones forman papilas o estructuras papilomatosas con un estroma denso o edematoso, dando el aspecto similar al tumor seroso borderline o invasivo.
El estudio inmunohistoquímico ayuda a confirmar el diagnóstico, ya que la alfainhibina es positiva tanto en las células de Sertoli como en las de Leydig7,8. Se han descrito casos de positividad de las células de Sertoli y de Leydig para los marcadores Melan A, CD99 y calretinina9. Las células de Sertoli son positivas también para queratinas y Sox-9 (pero no para EMA, PLAP, CEA, CA 19-9, CA-125, o S100), el componente estromal es muy positivo para alfainhibina, y WT1 es usualmente positiva en ambos componentes. Este perfil nos ayuda en el diagnóstico diferencial entre del tumor de célula de Sertoli-Leydig con elementos heterólogos y el carcinosarcoma10.
Como los casos que presentamos, la mayoría de los tumores de las células de Sertoli-Leydig se presentan en estadio IA, la mayoría con la cápsula íntegra, con una diferenciación intermedia y en mujeres en edad reproductiva. Por ende, es posible un manejo conservador, considerándose como cirugía de elección la ooforectomía unilateral, sobre todo en pacientes jóvenes que desean conservar su fertilidad.
Sin embargo, la rotura de la cápsula, una peor diferenciación o un estadio más avanzado ensombrecen el pronóstico. El uso de quimioterapia o radioterapia puede ser aconsejable en tumores que presentan un estadio superior a i, o en estadio i que son pobremente diferenciados, o que tienen componentes heterólogos mesenquimales, o se presentan con la cápsula rota11. En el caso de mujeres posmenopáusicas se recomienda la histerectomía más salpingooforectomía bilateral.
En los 2 casos presentados, los niveles hormonales se normalizaron inmediatamente tras la cirugía y el cuadro de hirsutismo mejoró progresivamente. En el momento actual, un año después del primer caso y 13 años después del segundo, las pacientes se encuentran sin evidencia de enfermedad recurrente. Se aconseja determinar las cifras de andrógenos periféricos, realizar ultrasonido transvaginal y TC abdominopélvica para descartar un tumor de células de Sertoli-Leydig ante un cuadro clínico de virilización femenina.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.