CALCIFICACION ABERRANTE
El calcio es un catión divalente vital para el desarrollo de numerosos procesos biológicos. En los seres humanos aproximadamente el 90% del calcio corporal total es relativamente insoluble y está presente en forma de moléculas cristalinas como la hidroxiapatita de los huesos y de los dientes. El 10% restante es soluble y se halla en el líquido extracelular y en el citoplasma de las células. El 50% de esta porción soluble es calcio ionizado, la forma biológicamente activa; el 40% se halla unido a la albúmina y otras proteínas; y el 10% se encuentra formando parte de complejos con aniones como bicarbonato, fosfato y citrato1.
El calcio es imprescindible para numerosos procesos fisiológicos como la contracción del músculo esquelético y del miocardio, la neurotransmisión, la coagulación sanguínea, la transmisión de información intercelular, la regulación del potencial eléctrico transmembrana, la exocitosis y la proliferación, diferenciación y adhesión intercelular de los queratinocitos epidérmicos1.
La concentración sérica de calcio está sometida a una regulación muy precisa por parte de la hormona paratiroidea y el 1,25-dihidroxicolecalciferol (1,25[OH]2 D3), la forma activa de la vitamina D. Ocasionalmente la piel y el tejido celular subcutáneo se calcifican u osifican a pesar de esta cuidadosa regulación. Calcificación es el depósito tisular de sales insolubles de calcio. La calcificación de los tejidos cutáneos se denomina calcinosis cutis. Virtualmente en todo proceso donde se produce calcificación se puede observar secundariamente osificación, es decir, metaplasia de tejido óseo sobre calcificación preexistente. La osificación primaria ectópica es excepcional.
Las calcificaciones cutáneas se pueden clasificar en las siguientes categorías: distrófica, metastásica, idiopática y yatrogénica.
La calcificación distrófica se produce como consecuencia de alguna anomalía del colágeno, la elastina o la grasa subcutánea. En estos casos los niveles de calcio y fósforo son normales. La calcificación metastásica es la precipitación de sales cálcicas en el tejido normal como resultado de un defecto subyacente en el metabolismo fosfocálcico. Se pueden observar calcificaciones metastásicas en las siguientes entidades: insuficiencia renal crónica, hipervitaminosis D, síndrome de leche y alcalinos, osteodistrofia hereditaria de Albright, neoplasias, sarcoidosis, pseudohiperparatiroidismo y pseudoxantoma elástico1.
CALCIFICACIONES METASTASICAS EN LA INSUFICIENCIA RENAL CRONICA
La mayoría de los casos de calcificación cutánea metastásica se producen en el seno de una insuficiencia renal crónica. En la insuficiencia renal crónica existe una disminución del aclaramiento renal de fosfato que da lugar a una hiperfosfatemia. Además, en el fracaso renal crónico, la síntesis de 1,25 (OH)2 D3 a partir de 25-colecalciferol (25[OH]D3) es deficiente, resultando como consecuencia una disminución en la absorción intestinal de calcio y, por consiguiente, una disminución de los niveles de calcio sérico. La hipocalcemia resultante determina un incremento en la producción de hormona paratiroidea e hiperparatiroidismo secundario compensatorio. El aumento de los niveles de parathormona circulante causa resorción ósea y movilización de calcio y fosfato a la sangre dando lugar a una normalización de la calcemia pero a expensas de provocar una marcada hiperfosfatemia2,3.
La calcificación metastásica en la insuficiencia renal se produce cuando el producto calcio-fósforo (Ca ´P) es superior a 70 mg/dl o 6,5 mmoles2/l2 4, en unidades de masa, o 5,6 en unidades del sistema internacional. En los pacientes urémicos las calcificaciones metastásicas afectan preferentemente a los vasos sanguíneos, riñones, pulmones, mucosa gástrica, córnea, conjuntiva ocular, miocardio, válvulas cardíacas y tejido subcutáneo.
La calcificación de los vasos y de la piel se produce a expensas de un depósito de cristales de hidroxiapatita cálcica que puede prevenirse o reducirse disminuyendo los niveles de fosfato sérico. Sin embargo, las calcificaciones metastásicas viscerales, por ejemplo, corazón, pulmón y músculo esquelético, están constituídas por un material cristalino o amorfo compuesto por calcio, fosfato y magnesio. Estos depósitos viscerales no se modifican con las variaciones de fosfato sérico. La afectación cardiopulmonar puede ser letal5.
Se describen 2 tipos de calcificación de los tejidos subcutáneos: la calcificación nodular benigna y la calcifilaxia6 .
La calcificación nodular benigna se caracteriza por el depósito de sales cálcicas sin necrosis tisular asociada en la piel y el tejido celular subcutáneo de áreas periarticulares. En estos casos las lesiones desaparecen con la normalización de los niveles de calcio y fósforo.
La calcifilaxia puede ser separada del amplio espectro de calcificaciones metastásicas benignas de los tejidos blandos en la insuficiencia renal crónica, tanto por sus características clínicas e histopatológicas como por su incidencia y evolución2.
LA CALCIFILAXIA
La calcifilaxia se caracteriza por una progresiva calcificación vascular con necrosis isquémica de los tejidos blandos y de la piel. Aunque la calcificación de la capa media de las grandes arterias en los pacientes urémicos de edad avanzada es relativamente frecuente, la calcificación de los vasos de pequeño calibre de la piel es excepcional7. También se ha descrito calcifilaxia extracutánea en el músculo subyacente a las lesiones cutáneas y en el tejido ocular. No obstante, se trata de una variante muy rara y difícil de distinguir de las calcinosis metastásicas convencionales o de la aterosclerosis. La proximidad de la piel a agentes externos tales como los cambios en la temperatura o la presión, la convierte en un órgano único y especialmente vulnerable al desarrollo de calcifilaxia8. Se ha estimado la incidencia en un 1% anual de los pacientes hemodializados9. Un estudio transversal cifró la prevalencia en un 4,1% de los pacientes hemodializados10.
La calcifilaxia ha sido descrita afectando mayoritariamente a pacientes urémicos con hiperparatiroidismo secundario o terciario11, hemodializados o trasplantados. Sin embargo se han descrito casos de calcifilaxia en pacientes sometidos a diálisis peritoneal ambulatoria o predializados12 y, más raramente, en pacientes sin insuficiencia renal previa. Se ha asociado raramente al hiperparatiroidismo primario13 y a otras causas de hipercalcemia como conectivopatías y neoplasias hematológicas (leucemia, linfoma, mieloma múltiple), y conocemos al menos 3 casos de calcifilaxia en el seno de un carcinoma metastásico de mama, 2 de éstos sin hipercalcemia14,15 y un tercero con hipercalcemia16.
Se han descrito algunos casos de calcifilaxia en ausencia de insuficiencia renal: en una paciente diagnosticada de cirrosis alcohólica17 y en otra con enfermedad de Crohn complicada con un síndrome del intestino corto18. En 1995, Hafner et al, en su revisión de la literatura, identificaron 2 pacientes con calcifilaxia sin antecedentes de insuficiencia renal; uno de estos pacientes estaba diagnosticado de diabetes mellitus no insulinodependiente y otro estaba diagnosticado de enfermedad arterial periférica aterosclerótica2. En 1997, Angelis et al realizaron un estudio de la prevalencia de la enfermedad y hallaron que los pacientes con calcifilaxia eran significativamente más jóvenes, habían recibido hemodiálisis durante más tiempo, y tenían unos niveles de calcio, fósforo, producto fosfocálcico, hormona paratiroidea (PTH) y fosfatasa alcalina ligeramente más altos que los de los pacientes hemodializados sin calcifilaxia10.
Levin et al, basándose en su experiencia con pacientes urémicos, desarrollaron una fórmula matemática para predecir la probabilidad de calcifilaxia en pacientes hemodializados. Aunque estaba basada en un pequeño número de casos (54 pacientes), la expresión matemática (2 ´ [CaPO4 - 5] ´fosfatasa alcalina ´razón de PTH) parecía distinguir a los pacientes hemodializados con alto riesgo de desarrollar calcifilaxia. En esta ecuación, la razón de PTH se calcula hallando el cociente entre la PTH del paciente y el límite superior del intervalo considerado normal para la PTH. Un resultado superior a 1.000 es considerado de alto riesgo19.
A pesar de que algunos autores aseguran que la incidencia del síndrome es similar en ambos sexos20, la mayoría sostiene que existe una mayor incidencia en el sexo femenino2, pese al predominio de la insuficiencia renal crónica en varones11. La relación mujer/hombre es variable según los autores entre un 2:111 y un 10:320. La edad de los pacientes afectados oscila entre 6 meses y 83 años, con una media de 48 ± 162. El tiempo transcurrido entre el inicio de la diálisis y el desarrollo de las lesiones cutáneas varía entre 1 semana y 3 años8.
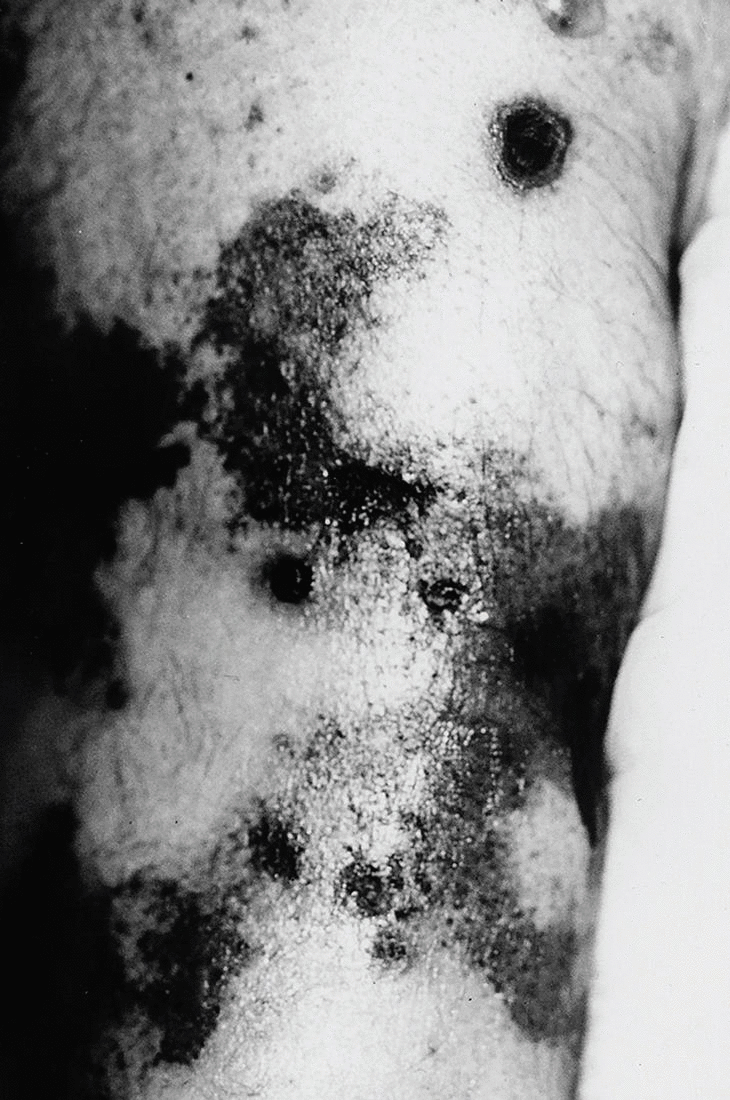
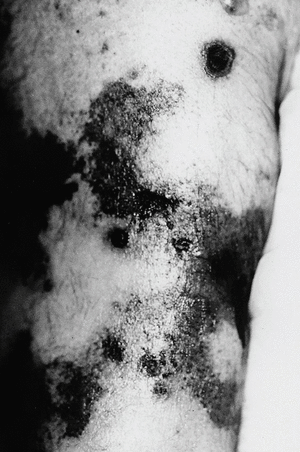
Clínicamente, las lesiones cutáneas de calcifilaxia se presentan como una serie de nódulos subcutáneos y placas violáceas, purpúricas o equimóticas extremadamente dolorosas, sobre una base de eritema moteado o reticular semejante a la livedo reticularis. Estas lesiones progresan en pocos días a la formación de úlceras necróticas recubiertas de escaras negruzcas (figs. 1 y 2).
Fig. 1.Lesiones ulceronecróticas que asientan sobre placas equimóticas con un patrón livedoide en la pierna.
Fig. 2. Placas eritematopurpúricas centradas por lesiones necróticas afectando a los miembros inferiores.
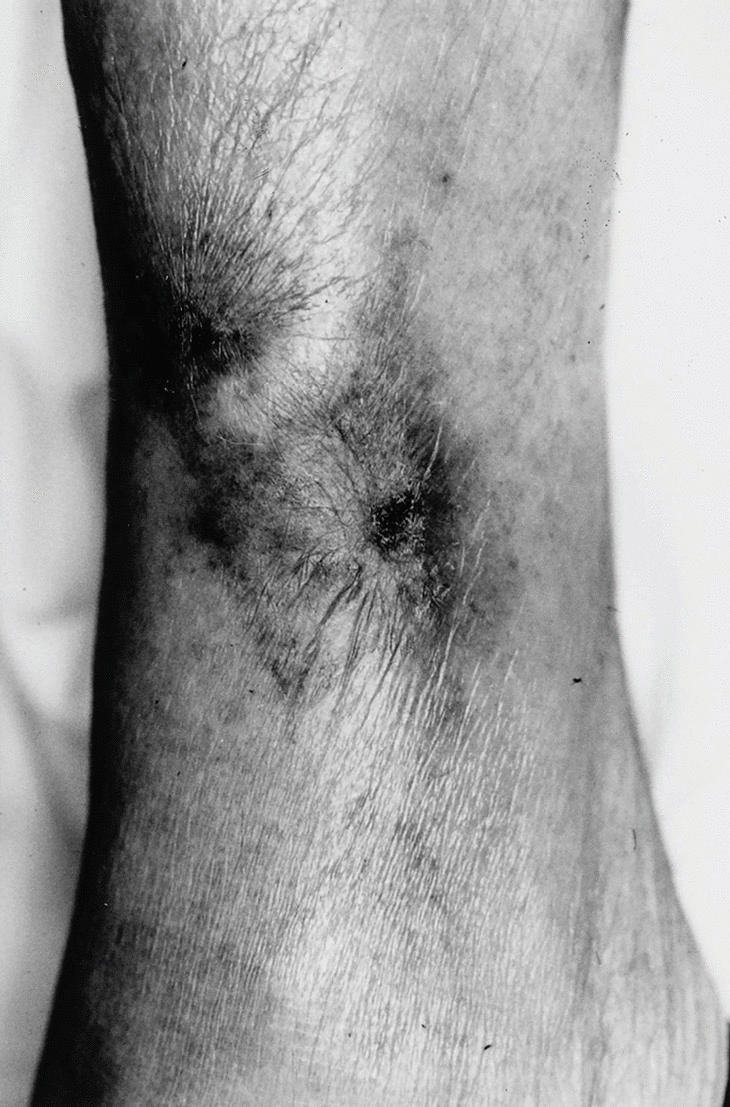
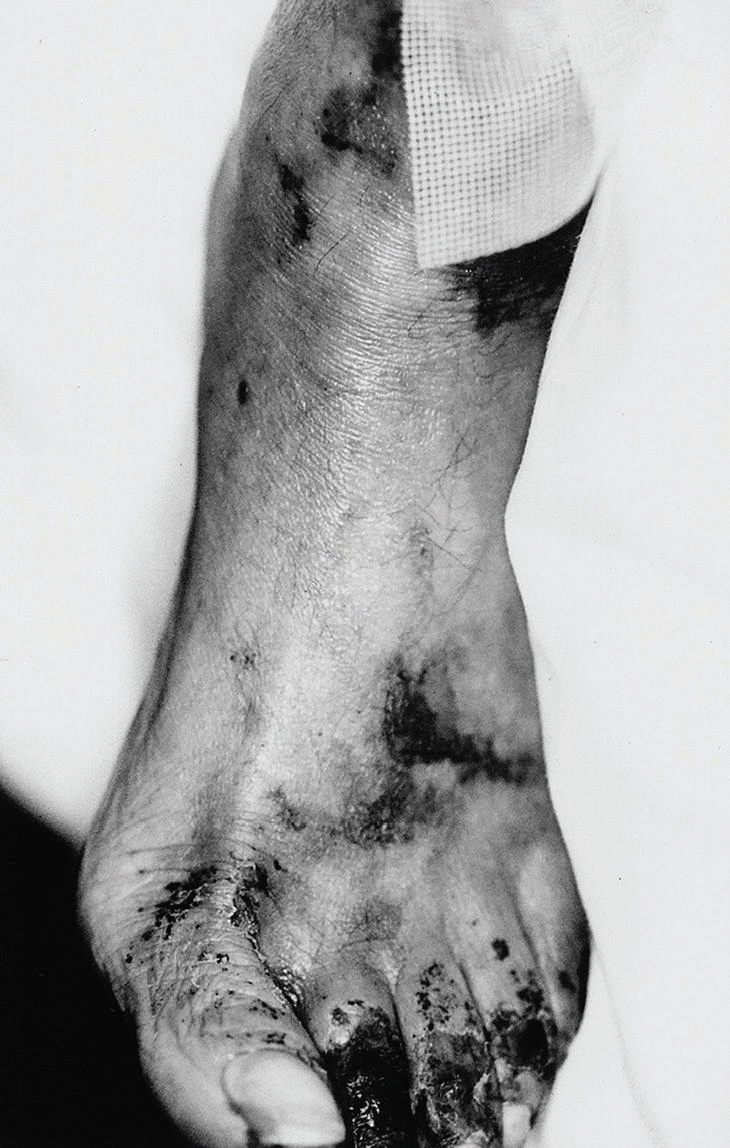
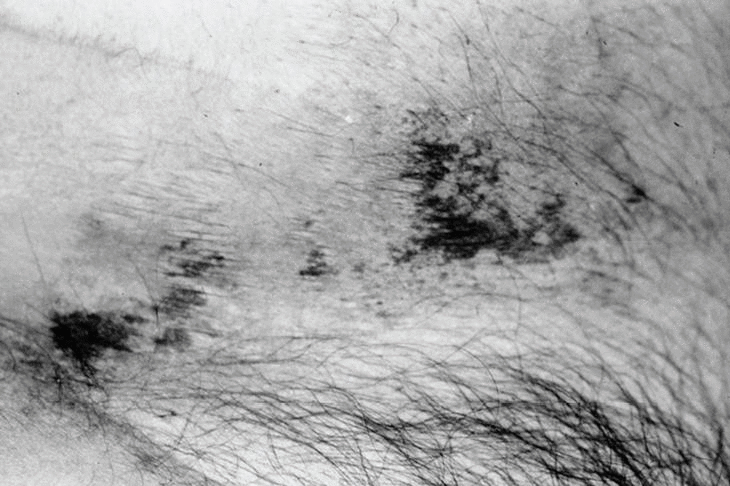
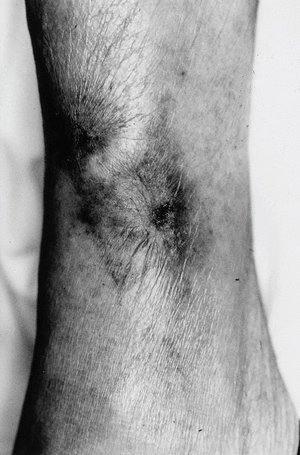
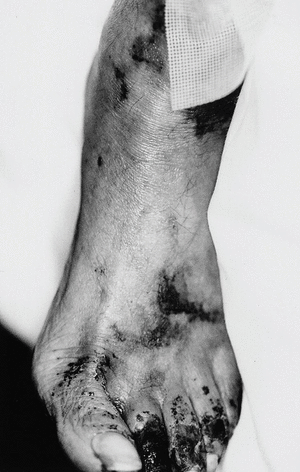
Las lesiones se distribuyen preferentemente por las extremidades. Se distingue un tipo distal de calcifilaxia, con afectación de piernas, pies y dedos (fig. 3), y un tipo proximal, menos frecuente y de peor pronóstico, con compromiso de muslos, nalgas y abdomen2 (fig. 4). La afectación de los muslos suele ser medial y simétrica en una disposición especular, denominada kissing distribution en la literatura inglesa21,22. En algún caso se ha descrito la aparición de ampollas flácidas4,8,20. Las lesiones son característicamente bilaterales, simétricas y superficiales. Los pulsos arteriales distales permanecen palpables de forma constante23. Excepcionalmente se ha descrito afectación del pene en forma de necrosis isquémica circunferencial de la porción proximal del glande o gangrena del prepucio24-26. Se han publicado al menos tres casos de mastopatía necrotizante con histología de calcifilaxia en pacientes con insuficiencia renal2,27,28. Se han observado lesiones cutáneas de calcifilaxia en otras localizaciones más raras como el cuello, el pecho, la lengua y la vulva29.
Fig. 3. Gangrena digital. Eritema purpúrico en dorso del pie que adopta una disposición reticular recordando a las lesiones características de la livedo reticularis.
Fig. 4. Lesiones incipientes de calcifilaxia consistentes en placas equimóticas sobre una piel con aspecto livedoide en el abdomen.
Las lesiones, en general, son de aparición súbita, evolucionan muy rápidamente y el pronóstico es infausto. La calcifilaxia suele complicarse con una septicemia habitualmente mortal. Otras complicaciones que también se han descrito son: fiebre, hipotensión, demencia, miopatía isquémica9 e infartos de miocardio, intestinales30,31o del sistema nervioso central4, polineuropatía sensitivomotora32 y pancreatitis33. Se ha descrito un caso de calcificación fulminante de la válvula aórtica y la aorta ascendente de curso paralelo al desarrollo de la calcifilaxia34, y publicado otro de infarto en el territorio de la arteria cerebral media como consecuencia de un émbolo calcificado de origen cardíaco en una paciente de 26 años de edad con calcifilaxia35.
Histopatológicamente, la calcifilaxia se caracteriza por afectación de las arteriolas de pequeño y mediano calibre de la dermis y la hipodermis (30-600 μm; 100 μm de media)23 en forma de depósitos circunferenciales de calcio en la capa media (figs. 5 y 6); proliferación fibroblástica y edematización de la capa íntima (fig. 7); y, ocasionalmente, trombosis de la luz. El proceso puede evolucionar a una extensa necrosis isquémica de la epidermis y los anejos cutáneos, así como a una llamativa degeneración de los haces de colágeno de la dermis. Se han descrito hallazgos de pseudoxantoma elástico consistentes en cúmulos basófilos e irregulares de fibras elásticas fragmentadas y calcificadas en la dermis media y profunda (fig. 8)36. La calcificación de las arteriolas subcutáneas se denomina «lesión primaria» de la calcifilaxia y el infarto de la piel y el tejido celular subcutáneo constituye la «lesión secundaria»37.
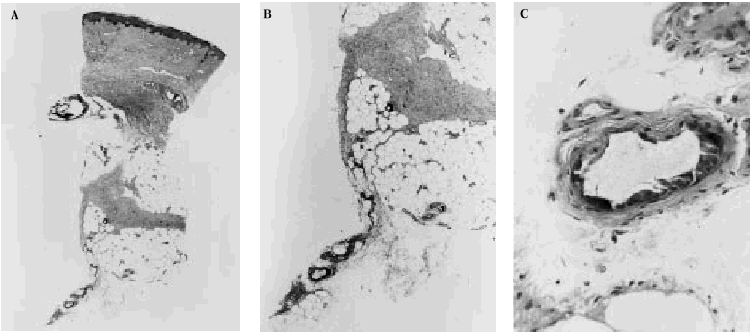
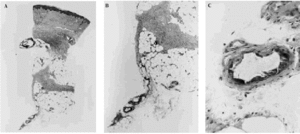
Fig. 5. Hallazgos histopatológicos de una lesión cutánea de calcifilaxia. A. Visión panorámica. Las anomalías están presentes en el vaso del borde profundo de la biopsia. B. Calcificación en las paredes de los vasos sanguíneos cortados transversalmente. C. Detalle de la anterior donde se observa calcificación de la íntima.
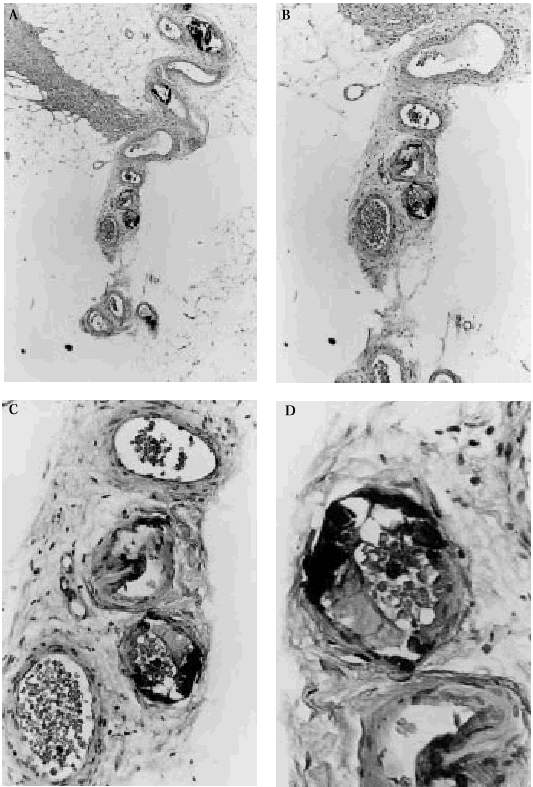
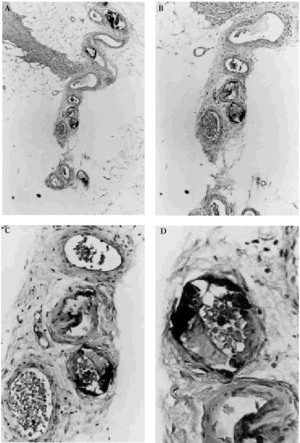
Fig. 6. Hallazgos histopatológicos de calcifilaxia en el tejido celular subcutáneo. A. Visión panorámica mostrando lóbulos de hipodermis sin alteraciones y septos con vasos calcificados. B. Sección de la arteriola de un septo del panículo adiposo donde se observa calcificación de la capa media con tendencia a ocluir la luz. C. Detalle de la calcificación de las paredes de los vasos. D. A gran aumento se observa la pared calcificada y hematíes en la luz vascular.
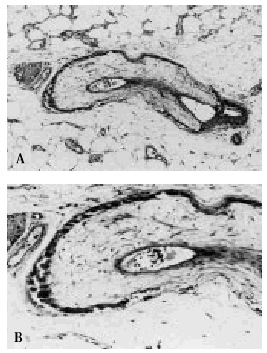
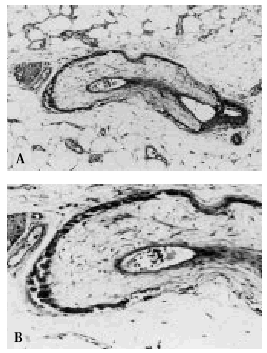
Fig. 7. A. Arteriola localizada en un septo del panículo adiposo con calcificación de la capa media. B. A mayor aumento se observa proliferación fibroblástica y edematización de la capa íntima.
Fig. 8. A. Calcificación de fibras elásticas de la dermis. B. Cúmulos basófilos e irregulares de fibras elásticas fragmentadas y calcificadas en la dermis profunda. C. A mayor aumento, los hallazgos histopatológicos recuerdan a los del pseudoxantoma elástico.
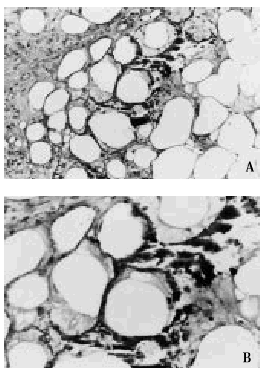
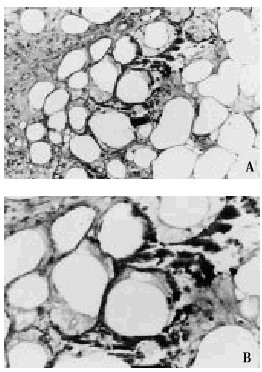
También se observa una paniculitis de predominio lobulillar consistente en necrosis grasa acompañada de focos de calcificación que tienden a distribuirse en la periferia de los adipocitos (fig. 9). El infiltrado inflamatorio, de intensidad leve o moderada, es de tipo mixto y está constituído por linfocitos, neutrófilos y macrófagos23. Fariña et al, de la Fundación Jiménez Díaz, publicaron un caso de calcifilaxia en el que además de los hallazgos histopatológicos habituales se observaba calcificación perineural38.
Fig. 9. A. Calcificación de adipocitos en el lobulillo hipodérmico. B. A mayor aumento se observa que los focos de calcificación asientan en la periferia de los adipocitos.
No se observa necrosis fibrinoide ni granulomas ni depósitos de inmunoglobulinas u otros datos de vasculitis21. Un estudio ha demostrado que existe una correlación directa entre la distribución y la intensidad de la afectación de las arteriolas en el estudio histopatológico y los hallazgos clínicos39. Sin embargo, otros autores no pudieron comprobar relación aparente entre la densidad y el tamaño de los depósitos cálcicos y el grado de afectación clínica33. Chan et al no pudieron demostrar calcificación ni fibrosis en los vasos subcutáneos en la piel aparentemente sana de los pacientes urémicos sin calcifilaxia39.
Se debe realizar una biopsia de tipo incisional profunda ya que los hallazgos histopatológicos pueden estar ausentes en las muestras obtenidas mediante punch-biopsia en vista de que la densidad de las lesiones primarias no es uniforme37. La realización de cortes seriados es obligatoria porque el proceso puede afectar a un pequeño número de capilares4. En general, no es preciso realizar tinciones especiales, como la tinción de von Kossa33.
En 1962, Hans Selye, basándose en sus experimentos con ratas de laboratorio y otros animales mamíferos, describió la calcifilaxia como un estado de hipersensibilidad sistémica inducida análogo a la anafilaxia, en la cual los tejidos responden a una serie de agentes con calcinosis masiva, inflamación y esclerosis en prácticamente todos los órganos, incluida la piel40.
Selye propuso que se precisaban 2 pasos sucesivos para inducir la formación de calcificaciones ectópicas sistémicas en su modelo animal. En primer lugar, se requeriría un período de «sensibilización» inducida por numerosos agentes hipercalcemiantes, tales como la hormona paratiroidea bovina, dihidrotaquisterol, ergocalciferol (vitamina D2), colecalciferol (vitamina D3), o una dieta rica en calcio y fósforo. Otras circunstancias sensibilizantes eran la nefrectomía bilateral, los medios de contraste radiopaco y el daño ureteral.
En segundo lugar, después de un intervalo de tiempo conocido como «período crítico» (aproximadamente 24 horas), la inyección subcutánea, intraperitoneal o intravenosa de diversos agentes, que denominó «precipitantes», provocaría el depósito de hidroxiapatita cálcica asociada a inflamación y esclerosis, tanto a nivel sistémico como en los sitios de inyección subcutánea, al cabo de unos 2 ó 3 días. Entre los agentes precipitantes, Selye incluyó los siguientes: sales de hierro y otros metales, albúmina de huevo, polimixina, 5-hidroxitriptamina, degranuladores de los mastocitos, glucocorticoides, traumatismos locales como extracción de pelo o punción de la piel. Otros autores han propuesto otros agentes alternativos como «precipitantes», entre otros: corticoides, infusiones de albúmina, tobramicina, complejo hierro-dextrano, heparinato cálcico, inmunosupresores, vitamina D, sobrecarga de hierro secundaria a transfusiones de sangre y el traumatismo debido al catéter de diálisis peritoneal22. La luz ultravioleta ha actuado como precipitante de un caso de calcifilaxia en un paciente con insuficiencia renal crónica secundaria a lupus eritematoso sistémico41.
Algunos años más tarde se describió un síndrome caracterizado por necrosis tisular isquémica periférica, calcificaciones vasculares y úlceras cutáneas en pacientes urémicos42 que, debido a su semejanza con el modelo experimental de Selye, se designó con el mismo término de calcifilaxia. Sin embargo posteriormente se ha podido comprobar que este término tiene algunas implicaciones patogénicas no extensibles a los seres humanos11. Por tanto, la analogía entre ambos fenómenos, aunque útil, no es del todo exacta. Las diferencias son significativas8,31: en primer lugar, en el modelo animal diversas maniobras invasivas desencadenan calcificaciones metastásicas, inflamación y esclerosis en el tejido conectivo de diversos órganos sin que puedan observarse calcificaciones vasculares, con la posible excepción de los vasos de la glándula paratiroidea8, ni necrosis2,8. En el ser humano sí se producen calcificaciones vasculares de forma característica, generalmente en el contexto de una insuficiencia renal crónica asociada a hiperparatiroidismo, hipercalcemia o hiperfosfatemia. Además, los hallazgos histológicos habitualmente descritos en todos los casos publicados de calcifilaxia en seres humanos (calcificaciones de la capa media de las arteriolas dermohipodérmicas, paniculitis y necrosis cutánea) están ausentes en el modelo animal43.
De acuerdo con estas diferencias, se han propuesto, entre otros, términos alternativos más exactos9 como los de: síndrome de gangrena urémica44, arteriolopatía urémica calcificada31, enfermedad urémica de las arterias de pequeño tamaño con calcificación de la media e hiperplasia intimal2, síndrome de calcificación vascular-necrosis cutánea45, paniculitis calcificante aguda20, calcinosis metastásica fulminante con necrosis cutánea5 y livedo reticularis necrotizante extensa46. Sin embargo, a pesar de su inexactitud, el término de calcifilaxia estaba demasiado enraizado en la literatura como para ser desplazado.
La etiopatogenia de la calcifilaxia es aún un enigma sin resolver. Probablemente se trate de un proceso multifactorial. La calcifilaxia en humanos se ha asociado tradicionalmente al hiperparatiroidismo secundario al fallo renal crónico. Sin embargo, en las publicaciones más recientes son constantes los argumentos en contra del hiperparatiroidismo como único mecanismo patogénico implicado.
En primer lugar, no se han podido demostrar anomalías del metabolismo fosfocálcico o de la PTH en muchos de los pacientes con uremia y calcifilaxia7,8. En 1996, Budisavijevic et al mostraron, en su revisión de la literatura, que el 68% de los casos de calcifilaxia presentaban niveles de fosfato superiores a 5 mg/dl, el 20% tenían niveles de calcio superiores a 10,5 mg/dl y en sólo el 33% de los casos el producto fosfocálcico era superior a 70 mg/dl47. En 1999, Oh et al revisaron la literatura y presentaron 5 nuevos casos de calcifilaxia. Estos autores no hallaron una relación temporal entre las anomalías del producto fosfocálcico y la PTH, por un lado, y los hallazgos clínicos de calcifilaxia, por otro lado8. Janigan et al se plantean incluso si la calcifilaxia constituye un tipo de calcificación distrófica y no metastásica como ha sido considerada clásicamente37.
En segundo lugar, a pesar de que el hiperparatiroidismo secundario era hace algunos años una complicación habitual de la insuficiencia renal terminal, la calcifilaxia, sin embargo, era extremadamente rara43.
En tercer lugar, a pesar de que el tratamiento del hiperparatiroidismo secundario se ha ido perfeccionando, la incidencia de la calcifilaxia se ha incrementado de forma significativa en los últimos 15 años43.
Por último, los resultados de la paratiroidectomía son a menudo insatisfactorios43. Por tanto, debe haber otros factores implicados en el desarrollo de la calcifilaxia en el ser humano. Los otros factores que se han propuesto como mecanismos patogénicos son: el aporte excesivo de vitamina D, la hipertensión arterial, la alcalosis sistémica tras hemodiálisis y la inmunosupresión postrasplante2.
En algunos pacientes con calcifilaxia se ha detectado un déficit cuantitativo o funcional de la proteína C, un potente anticoagulante de síntesis hepática4. El estado de hipercoagulabilidad que resultaría de este déficit podría contribuir a la necrosis cutánea observada en algunos pacientes con calcifilaxia1,48. Se ha demostrado un déficit cuantitativo de la proteína S debido probablemente a la diálisis peritoneal en un caso de calcifilaxia49. Actualmente se discute el papel que la anticoagulación oral pueda desempeñar como factor de riesgo de calcifilaxia50. Goyal et al han presentado un caso de calcifilaxia en una paciente con antecedentes de cirugía y quimioterapia de carcinoma de mama con función renal y niveles de PTH normales. Se ha propuesto una posible deficiencia funcional de la proteína S y de su cofactor, la proteína C, probablemente inducida por la quimioterapia en el origen de la calcifilaxia en esta paciente15.
La toxicidad directa de la PTH o del calcio sobre el endotelio también se ha propuesto como otro posible mecanismo. Es probable que el aumento de la incidencia de calcifilaxia en los últimos años sea debido al mayor uso de compuestos de calcio como quelantes del fósforo en sustitución de los clásicos compuestos de aluminio. La concentración de calcio medida en la piel de pacientes dializados es superior a la de la población general. Además, un dializado con un alto contenido en calcio tiende a agravar la situación de los pacientes con calcifilaxia51.
La obesidad ha demostrado ser un importante factor de riesgo para el desarrollo de calcifilaxia de localización proximal, especialmente en mujeres de raza blanca con bajas concentraciones séricas de albúmina y PTH. Bleyer et al establecieron que mientras el 57% de los pacientes con calcifilaxia tenía un índice de masa corporal (IMC) superior a 35 kg/m2, solamente el 5% de los pacientes hemodializados tenía este mismo índice. A pesar de la obesidad, la mayoría de los pacientes tenían un pobre estado nutricional y se hallaban encamados o confinados a una silla de ruedas. Posiblemente el daño de los pequeños vasos es más probable en las regiones con abundante panículo adiposo. El pronóstico de los pacientes obesos con calcifilaxia proximal es peor que el de aquéllos con calcifilaxia distal22. Los septos de tejido conectivo del panículo adiposo están firmemente anclados a la dermis por un lado y a la fascia por otro. En la obesidad los septos se expanden como consecuencia del aumento del volumen del tejido adiposo. En este contexto, las arteriolas contenidas en los septos estarían sometidas a unas fuerzas tensionales superiores a lo normal. No todos los pacientes urémicos son obesos, pero muchos son hipoalbuminémicos y en los septos edematizados las arteriolas septales se hallarían igualmente distendidas37.
Por el contrario, en una serie de 16 pacientes se describió pérdida de más del 10% del peso corporal en los 6 meses previos al desarrollo de las lesiones cutáneas de calcifilaxia. Es probable que esta pérdida de peso sea fundamentalmente debida a una corrección drástica de los edemas que pudiera desencadenar una depleción relativa del volumen intravascular y una reducción de la perfusión tisular. La isquemia se produce como consecuencia de la rigidez de los vasos calcificados incapaces de responder con una dilatación adecuada. El encamamiento predispone a la isquemia al favorecer la presión directa sobre la piel31.
Algunos autores han descrito una asociación significativa entre diabetes mellitus insulinodependiente y la aparición de calcifilaxia21,51. Sin embargo la obesidad podría comportarse en estos estudios como un factor de confusión en la mencionada asociación. Actualmente se considera a la diabetes como un factor de riesgo exclusivamente de la calcifilaxia de localización distal y el desarrollo de gangrena en partes acras. No se ha podido demostrar relación directa entre la diabetes y la aparición de calcifilaxia proximal50. Se han publicado casos de pacientes diabéticos con lesiones de calcifilaxia en los sitios de inyección de la insulina52.
Otros autores han sugerido que las inyecciones subcutáneas representaban un traumatismo local que podría precipitar el proceso. Así, se han descrito casos de calcifilaxia en los lugares de inyección subcutánea de insulina, heparina y hierro dextrano.
La hiperfosfatemia prolongada sigue considerándose un importante factor predisponente, fundamentalmente en los pacientes paratiroidectomizados con enfermedad ósea adinámica.
Se ha propuesto también una etiopatogenia infecciosa para la calcifilaxia dado que se ha observado la capacidad de determinados microorganismos para inducir depósitos de sales de calcio en cultivos celulares8.
Esta entidad también se ha descrito en pacientes con infección por el virus de la inmunodeficiencia humana (VIH) y fracaso renal53.
El diagnóstico diferencial debe efectuarse con las siguientes entidades: vasculitis y enfermedades del tejido conectivo (panarteritis nodosa microscópica, granulomatosis de Wegener8, púrpura de Schönlein Henoch, lupus eritematoso sistémico18, enfermedad mixta del tejido conectivo, esclerodermia, dermatomiositis9, lipodermatosclerosis33); calcinosis sistémica; paniculitis (paniculitis pancreática, ...); alteraciones de la coagulación (coagulación intravascular diseminada, déficit homocigoto de la proteína C o proteína S, déficit adquirido de la proteína S, necrosis por cumarínicos2, síndrome antifosfolípido54); endocarditis bacteriana subaguda18; crioglobulinemia esencial18; criofibrinogenemia55; enfermedad vascular periférica aterosclerótica18; enfermedad de Monckeberg15; émbolos de colesterol18; émbolos sépticos33; trombosis venosa profunda18; celulitis12; micosis profundas; fascitis necrotizante8; pioderma gangrenoso33; linfoma angiotropo13; y oxalosis18. En la hiperoxaluria primaria tipo 1, clínicamente indistinguible de la calcifilaxia, el estudio histopatológico revela un depósito de cristales rectangulares de oxalato cálcico en los vasos sanguíneos, que muestran una birrefringencia amarilla o azul con luz polarizada56.
En los últimos años se ha documentado un incremento en la prevalencia de calcifilaxia en probable relación con el aumento de la población en hemodiálisis, el mayor índice de sospecha clínica, el menor uso de quelantes de fosfato de aluminio en favor del carbonato cálcico y el tratamiento con calcitriol31.
El protocolo de actuación en la calcifilaxia incluye la determinación de niveles de creatinina, nitrógeno ureico sanguíneo, fosfato, calcio, PTH, anticuerpos antinucleares y anticuerpos anticitoplasma de neutrófilos, crioglobulinas, criofibrinógeno, amilasa y lipasa que descarten una paniculitis pancreática, estudios radiográficos de las extremidades, biopsia cutánea incisional profunda (que debe procesarse para tinción con hematoxilina-eosina, cultivo, estudios de sensibilidad y de inmunofluorescencia directa) y evaluación de los pulsos periféricos para excluir enfermedad aterosclerótica mediante oscilografía, que registra el movimiento de los vasos sanguíneos con cada contracción cardíaca, la presión transcutánea de oxígeno, la ultrasonografía doppler, y finalmente una angiografía29. El límite máximo de detección de una calcificación en las radiografías es de 0,1 mm. Así, pueden pasar inadvertidas muchas calcificaciones más pequeñas. El procedimiento radiográfico más sensible para detectarlas es la mamografía; sin embargo, esta técnica no se realiza de forma sistemática29.
El tratamiento de la calcifilaxia es a menudo desalentador. El pronóstico es muy pobre en estos pacientes dado que la mayoría de ellos mueren como consecuencia de una sepsis originada a partir de la infección de las lesiones cutáneas fundamentalmente en el contexto de un paciente trasplantado e inmunosuprimido8. La tasa de mortalidad se aproxima al 60%-75%39. Haffner et al publicaron que la edad y el tratamiento con diálisis o trasplante no influyen en el pronóstico de la enfermedad2. La localización de las lesiones sí tiene implicaciones pronósticas. Así, la calcifilaxia de localización proximal tiende a ser más grave que la distal2, probablemente debido a la dificultad de debridar el tejido necrótico en esta región21. La escasa incidencia de la calcifilaxia que impide programar análisis prospectivos, así como las dudas en torno a su patogenia dificultan extraordinariamente determinar cuál es el tratamiento más efectivo.
Se recomienda retirar los agentes considerados como «sensibilizantes» según la hipótesis de Selye. La normalización del producto fosfocálcico es prioritaria. Debe lograrse un estricto control de la hiperfosfatemia en pacientes hemodializados. Éste se basa en la reducción de la ingesta de fósforo, así como el uso de quelantes intestinales del fósforo que no contengan calcio en su composición, como el RenaGel29. También es importante utilizar bajas concentraciones de calcio en la hemodiálisis (menos de 2,5 meq/l)20,43,57 y suspender el uso de compuestos de vitamina D.
Hay que evitar las inyecciones locales, especialmente en regiones adiposas y otros potenciales «precipitantes», tales como los corticoides, los inmunosupresores y los derivados sanguíneos. Aunque se ha descrito un caso que evolucionó favorablemente tras la administración sucesiva de prednisona y cimetidina orales20, en general la mayoría de los autores aconsejan evitar el uso de corticoides en estos pacientes43.
Son prioritarias las curas agresivas de las úlceras: se precisan amplios desbridamientos del tejido necrótico y antibioterapia sistémica profiláctica43.
En algunos casos es preciso realizar la amputación de algún miembro. Los casos de afectación peneana se han tratado con resultados variables con circuncisión, penectomía parcial y en un caso además, con cistostomía suprapúbica24-26. En casos de mastopatía necrotizante puede requerirse la realización de mastectomía2.
A pesar de que inicialmente se observaron respuestas espectaculares a la paratiroidectomía, en la actualidad se cree que debe seleccionarse cuidadosamente a los pacientes candidatos a la intervención. En 1976, Gipstein et al publicaron una serie de 11 pacientes diagnosticados de calcifilaxia, la mayoría de ellos con úlceras digitales e hiperparatiroidismo muy grave, de los cuales el 68% experimentó una total resolución de sus lesiones tras la realización de una paratiroidectomía42. Sin embargo, otros estudios más recientes parecen menos optimistas. Chan et al revisaron, en 1983, 47 casos de calcifilaxia, demostrando que la tasa de supervivencia en los pacientes paratiroidectomizados era similar a la de los no intervenidos39. Budisavijevic et al presentaron 31 pacientes con calcifilaxia que fueron sometidos a paratiroidectomía. El 50% de estos pacientes falleció en el transcurso de los 9 meses siguientes a la cirugía47. Como conclusión, el resultado de la intervención es generalmente imprevisible y actualmente no está indicada la paratiroidectomía en los pacientes con bajos niveles de PTH. Kang et al sostienen que la paratiroidectomía parece añadir algunos meses a la esperanza de vida del paciente con calcifilaxia aunque la tasa de mortalidad permanece alta a pesar de la cirugía. Además la paratiroidectomía ha demostrado reducir el dolor58.
Por otro lado, en la mayoría de los casos asociados a un hiperparatiroidismo primario, la resección quirúrgica de un adenoma paratiroideo solitario se sigue de una normalización del metabolismo cálcico y resolución de las lesiones cutáneas.
Finalmente59 Vassa et al presentaron un caso de calcifilaxia refractario a la paratiroidectomía que fue tratado satisfactoriamente con 38 sesiones de oxígeno hiperbárico.
Aunque se ha propuesto la simpatectomía cervicodorsal como una medida para mejorar el flujo sanguíneo, esta técnica no ha demostrado ser claramente eficaz en el tratamiento de la calcifilaxia21.
AGRADECIMIENTOS
A mis compañeros del Servicio de Dermatología de la Fundación Jiménez Díaz, especialmente al doctor Luis Requena quien aportó las fotografías clínicas e histopatológicas que se muestran en este artículo.
NOTICIAS
LA FUNDACIÓN HISPANA DE Y ENFERMEDADES METABÓLICAS ÓSEAS (FHOEMO)
Convoca el VI BECAS FHOEMO PARA JÓVENES INVESTIGADORES 2002 de acuerdo con las siguientes
BASES
1. La Beca permitirá la realización de un período de aprendizaje y formación, sobre aspectos experimentales y/o clínicos en el campo de la Osteoporosis y Enfermedades Metabólicas Óseas, en un centro clínico especializado de ámbito nacional.
2. Las Becas estarán dotadas con 400.000 pesetas.
3. Los candidatos serán posgraduados, menores de 40 años, interesados en el estudio de estas enfermedades.
4. La fecha límite de recepción será el 1 de junio de 2002.
5. La Beca será concedida por un Jurado que estará compuesto por cuatro miembros del Comité Científico de la FHOEMO, actuando como secretaria del Jurado, con voz pero sin voto, la Secretaria de la Fundación.
6.La propuesta consistirá en una concisa explicación sobre el proyecto, el Curriculum Vitae del solicitante y la aceptación del jefe de Servicico donde vaya a desarrollar su labor.
7.La documentación se remitirá a la Secretaría de la FHOEMO (Gil de Santivañes, 6, 2.º D. 28001 Madrid. Tel/Fax: 91 578 35 10).
8. La decisión del Jurado será inapelable y las Becas podrán ser declaradas desiertas si, a juicio del jurado, se estimase que los proyectos presentados no reúnen los méritos suficientes.
9. Los aspirantes aceptarán las presentes bases por el mero hecho de concurrir a esta convocatoria.