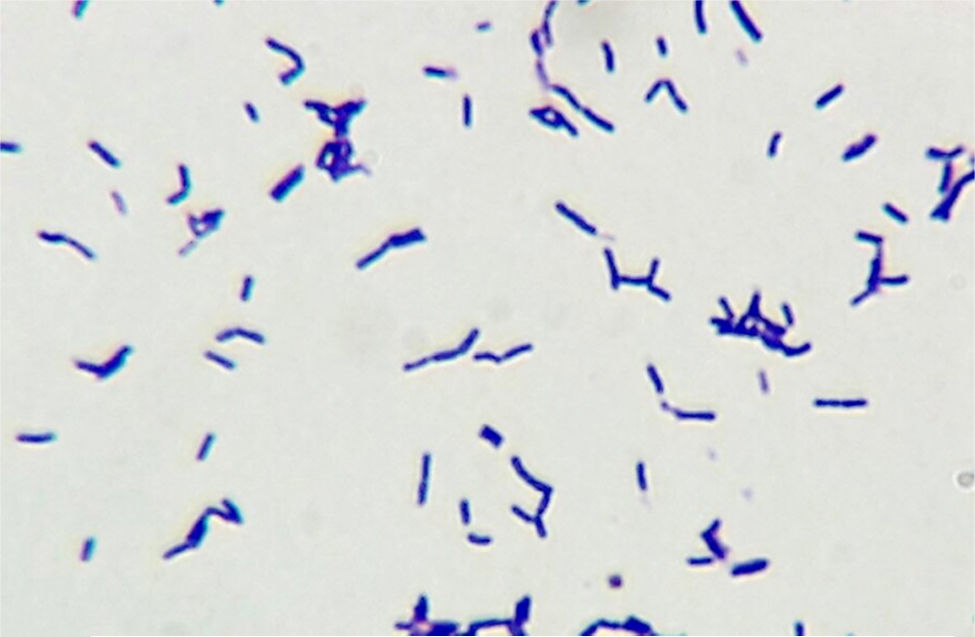
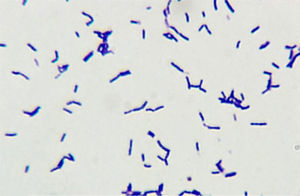
La especie Bifidobacterium scardovii está constituida por bacilos gram positivos anaerobios facultativos, cuyo desarrollo es estimulado por el CO2 y la anaerobiosis. Excepcionalmente se la ha asociado a infecciones humanas. Se presenta el caso de un paciente añoso con infección urinaria por B. scardovii y Enterococcus faecalis, ambos microorganismos aislados en 2 urocultivos consecutivos. El bacilo no desarrolló en los medios de cultivo habituales, pero sí en agar chocolate en CO2 y en agar Brucella suplementado, incubados durante 72h a 35°C. La coloración de Gram alertó acerca de su presencia al observarse abundantes bacilos gram positivos irregulares con extremos bifurcados en forma de Y, y escasos cocos gram positivos. Es importante la coloración de Gram en orinas con piuria y la siembra en medios enriquecidos por tiempos prolongados. En este caso, sin el resultado del Gram y con el desarrollo de E. faecalis, no hubiésemos advertido la presencia del agente mayoritario.
Bifidobacterium scardovii species consists of facultative anaerobic gram-positive rods whose growth is stimulated by CO2 and anaerobiosis. Exceptionally it has been associated with infections in humans. An elderly male patient with a urinary tract infection due to B. scardovii and Enterococcus faecalis is presented here; both microorganisms were isolated from two consecutive urine samples. The bacillus did not grow on standard media, but on chocolate agar incubated in CO2 and on supplemented Brucella agar in an anaerobic atmosphere, incubated for 72h at 35°C. Gram staining with abundant irregular gram-positive rods with Y-shaped ends and some gram-positive cocci alerted to its presence. The importance of the Gram stain test in urine samples with pyuria and the growth on enriched media for long periods is highlighted here. In this case, if we had not had the Gram stain test results, and had considered only the E. faecalis growth, we would have lost the major etiologic agent.
El género Bifidobacterium está constituido por más de 50 especies. Figura en la familia Bifidobacteriaceae, clase Actinobacteria del phylum Actinobacteria.
La mayoría de las especies constituyen parte de la microbiota residente gastrointestinal y de la cavidad oral en el hombre8. Las bifidobacterias se han aislado del intestino de insectos y animales, de aguas contaminadas, de leches fermentadas y otros alimentos, y algunas son utilizadas como probióticos, con beneficios para la salud humana7,8. Durante mucho tiempo, no se identificó a ninguna de las especies del género como agentes etiológicos de infecciones en humanos. En 1978 se comunicó una infección pulmonar fatal por Bifidobacterium eriksonii a partir de una infección odontogénica5. En 1996, 3 especies se encontraron en caries dentales4. En 1999 se describió el primer caso de sepsis por Bifidobacterium longum, asociado a la práctica de acupuntura, y también dicho microorganismo fue aislado como agente etiológico de una peritonitis purulenta secundaria a una perforación intestinal6,12.
En 2002 Hoyles et al.7 describieron una nueva especie, Bifidobacterium scardovii, a partir del estudio de 5 cepas (provenientes de una muestra de sangre, de 3 orinas y de una cadera), todas de significación clínica incierta. En 2012 se comunicó el primer caso de infección urinaria recurrente en una paciente de 80 años con múltiples factores de riesgo2, y en 2014 se aisló Bifidobacterium sp. y Candida glabrata en una mujer que presentaba hematuria e infecciones urinarias a repetición10.
Se presenta el siguiente caso clínico para aportar información adicional sobre B. scardovii, un microorganismo infrecuente en infecciones humanas.
Un varón de 94 años con antecedentes de hipertensión arterial, enfermedad coronaria y dislipidemia, ex enolista y ex tabaquista, institucionalizado con estenosis aórtica grave, fue internado en Clínica Médica en 2 oportunidades. Ingresó por una caída desde su propia altura, que le generó la fractura de la cadera izquierda. Se realizó un urocultivo, el sedimento mostró 8-10 leucocitos por campo (aumento 400×) y desarrollo de B. scardovii y Enterococcus faecalis, con conteos bacterianos>105UFC/ml y 104UFC/ml, respectivamente. A los 10 días el paciente recibió el alta con pautas de alarma. A las 48h reingresó por presentar deterioro del sensorio y fiebre. Se realizó un hemocultivo seriado constituido por 2 muestras que se colocaron en un frasco Standard aerobic y en un frasco Lytic anaerobic (BACTEC, Becton Dickinson Diagnostic Instrument Systems, EE. UU.), respectivamente, y se tomó una nueva muestra de orina. El sedimento urinario evidenció 15-20 leucocitos por campo y el cultivo mostró el desarrollo de ambos gérmenes nuevamente, por lo que se inició tratamiento con ampicilina-sulbactama 1,5 g cada 12h por vía intravenosa. El paciente presentó insuficiencia respiratoria aguda, que se interpretó como edema agudo de pulmón y pasó a terapia intensiva, donde permaneció durante 24h. Con los hemocultivos negativos, a las 2 semanas recibió el alta con la indicación de continuar con amoxicilina-sulbactama 1 g cada 12 h hasta completar 20 días de tratamiento, por la infección urinaria. Finalizado el tratamiento, se realizó un urocultivo control, que resultó negativo.
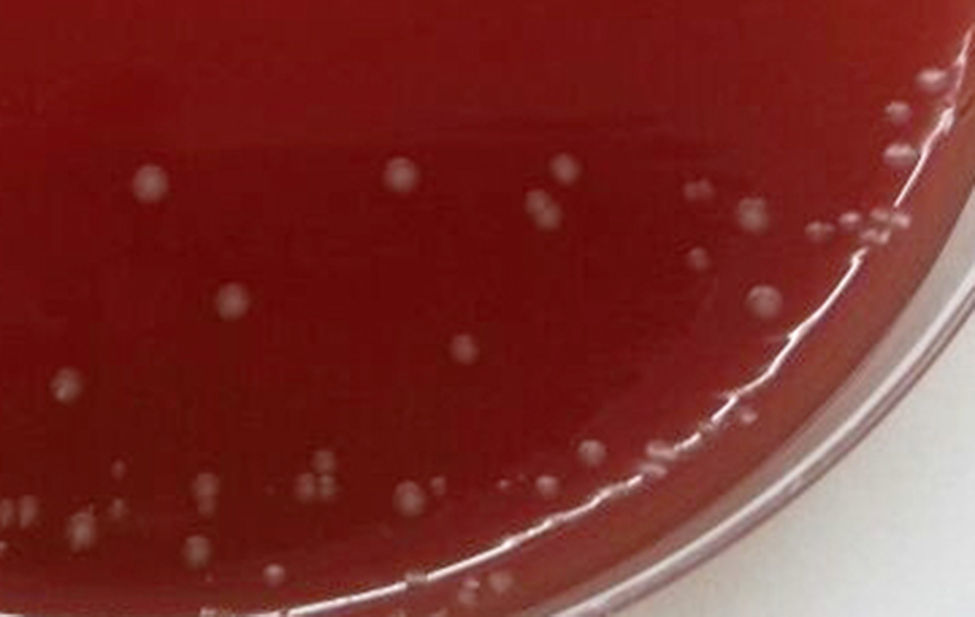
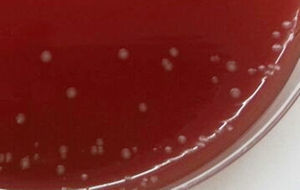
En el Departamento de Microbiología se estudiaron las 3 muestras de orina; las 2 primeras tomadas con un intervalo de 13 días, ambas con sedimento patológico. En la coloración de Gram se observaron abundantes bacilos gram positivos irregulares, algunos ramificados, curvados y con extremos bifurcados en forma de Y —que permitieron sospechar la presencia de alguna de las especies de Bifidobacterium— y escasos cocos gram positivos dispuestos en cadenas, identificados luego como B. scardovii y E. faecalis, respectivamente. La figura 1 muestra la morfología de los bacilos en caldo tioglicolato. Estos no desarrollaron en el medio CLDE, pero crecieron luego de 72h de incubación a 35°C en agar sangre ovina al 5% y en agar chocolate incubados en atmósfera enriquecida con CO2, también en agar Brucella suplementado con vitamina K1 (1μg/ml) y hemina (5μg/ml) incubado en anaerobiosis durante 72h. Las colonias eran transparentes y γ-hemolíticas; en CO2 de ≈ 0,5mm de diámetro y en anaerobiosis de hasta 2mm (fig. 2). Las características bioquímicas preliminares de los bacilos fueron las siguientes: metabolismo fermentador e inmóviles; catalasa, prueba de CAMP e hidrólisis de urea, negativas; sensible a vancomicina (30μg) y resistente al disco de polianetol sulfonato de sodio (SPS, Oxoid, Basingstoke, Hampshire, Reino Unido), con desarrollo discreto en el caldo Man, Rogosa & Sharp (Oxoid, Basingstoke, Hampshire, Reino Unido).
Para completar la identificación fenotípica se realizaron las siguientes pruebas, que resultaron positivas: hidrólisis de esculina, actividad de α-glucosidasa, β-glucosidasa, β-galactosidasa, β-N-acetilglucosaminidasa, β-glucuronidasa y α-fucosidasa; acidez de arabinosa, lactosa, manosa, rafinosa, maltosa, sacarosa y trehalosa. Fueron negativas las siguientes pruebas: hidrólisis de hipurato y arginina, acidez de sorbitol y manitol, reducción de nitratos, producción de indol, fosfatasa alcalina y prolina arilamidasa (ProAA). Para las pruebas enzimáticas se utilizaron las tabletas Rosco (A/S Rosco, Taastrup, Dinamarca) y el resto de las pruebas se hicieron mediante los métodos de identificación fenotípicos convencionales incubados en anaerobiosis11.
La identificación del aislado fue confirmada por espectrometría de masas (matrix-asisted laser desorption/ionization time-of-flight mass spectrometry [MALDI-TOF MS], Bruker Daltonics®, Bremen, Alemania), con un score de 2,3751.
Las pruebas de sensibilidad se realizaron con las tiras con gradientes de concentración de los antibióticos (Etest de bioMèrieux, Solna, Suecia) en agar Brucella suplementado con 5% de sangre lisada de caballo en anaerobiosis (Anaerogen compact, Oxoid). Se utilizó un inóculo equivalente al N.° 1 de la escala de McFarland y se obtuvieron los siguientes resultados (μg/ml): penicilina 0,032; ciprofloxacina 1,5 y trimetoprima-sulfametoxazol 0,25.
Las especies de Bifidobacterium no están incluidas en el Clinical Laboratory Standards Institute (CLSI), por lo que no existen puntos de corte para definir sensibilidad a los antimicrobianos.
Las especies de Bifidobacterium son difíciles de detectar por su lento crecimiento y sus requerimientos nutricionales. Además, estas dificultades también se observan en la identificación por los métodos fenotípicos convencionales, razón por la cual la identificación polifásica es la más confiable. Deben diferenciarse de otros géneros morfológicamente y bioquímicamente relacionados catalasa negativos e inmóviles, con mejor desarrollo en anaerobiosis o en atmósfera enriquecida con CO2, como Actinomyces spp., Lactobacillus spp., Alloscardovia omnicolens, Gardnerella vaginalis, Actinobaculum massiliense, Actinotignum schaalii y Actinotignum urinale, muchos de los cuales también pueden causar infecciones urinarias2,8.
La observación minuciosa de la coloración de Gram del sedimento urinario en orinas con piuria en ausencia de desarrollo en los medios de siembra habituales a las 24-48h de incubación es fundamental para evitar el subdiagnóstico de este tipo de microorganismos. Además, una vez aislados, es importante su reconocimiento para no subestimarlos ni descartarlos como contaminantes o parte de la microbiota residente de la mucosa uretral.
La observación de bacilos gram positivos irregulares, ligeramente ramificados, algunos curvados y con disposición en Y, alerta sobre la presencia de alguna de las especies de Bifidobacterium. Pruebas simples como el cultivo en el caldo MRS permiten descartar a los géneros Actinomyces, Actinobaculum, Actinotignum y G. vaginalis, que no desarrollan en dicho medio, en tanto las bifidobacterias y A. omnicolens exhiben un desarrollo discreto, como en el caso de nuestro aislado, y las especies de Lactobacillus muestran un desarrollo abundante. La prueba de resistencia a la vancomicina también aleja de la sospecha diagnóstica a los lactobacilos resistentes, y la sensibilidad al disco de SPS a G. vaginalis, la cual, además, presenta β-hemólisis en agar sangre humana2,8. Los resultados correspondientes a la actividad positiva de α-fucosidasa y negativa de ProAA, junto con el resto de las pruebas descritas, permitieron descartar a A. omnicolens e identificar fenotípicamente a B. scardovii.
Métodos comerciales como el API Coryne, el RapID ANA II y el API Rapid ID 32A han presentado problemas en la identificación de Bifidobacterium spp. y de A. omnicolens. Cepas previamente identificadas como B. scardovii por secuenciación dieron un perfil no identificable con el panel RapID ANA II, mientras que con el API Coryne se obtuvo un perfil erróneo compatible en un 96,6% con Arcanobacterium haemolyticum8.
En los últimos años, la espectrometría de masas se ha establecido como un método rápido y una herramienta diagnóstica confiable para la mayoría de los bacilos gram positivos. Según Barberis et al.1, la técnica de MALDI-TOF MS mostró mayor eficiencia que los métodos fenotípicos convencionales en la identificación de Actinomyces y los géneros relacionados, mientras que para Corynebacterium spp. la eficiencia de ambos métodos fue similar. El mismo trabajo demuestra también que puede utilizarse un score más bajo (≥ 1,7) para la identificación de los bacilos gram positivos a nivel de género y especie1.
Todas las especies de Bifidobacterium son sensibles a penicilina, ampicilina, piperacilina, imipenem, macrólidos, clindamicina, vancomicina y teicoplanina. La sensibilidad a cefalotina es variable y presentan resistencia intrínseca a los aminoglucósidos9. Nuestro aislado mostró amplia sensibilidad a la penicilina y a la trimetoprima-sulfametoxazol, y sensibilidad disminuida o intermedia a la ciprofloxacina, si asimilamos estos valores a los correspondientes para las especies de Corynebacterium según el CLSI 20163. La prueba de sensibilidad se realizó a modo de screening, de la que se infirió un probable éxito terapéutico cuando las CIM son bajas y superadas por las concentraciones que los antibióticos útiles alcanzan en la orina.
Las especies de Bifidobacterium no son fáciles de identificar e incluso pueden no ser recuperadas de muestras clínicas si no se realiza su búsqueda activa. Por esta razón, resaltamos la importancia de no descartar muestras de orina con sedimento patológico y cultivo negativo a las 24h en pacientes con factores de riesgo o en los extremos de la vida. Se debe pensar en la presencia de gérmenes no habituales, realizar la coloración de Gram y la siembra en medios enriquecidos con incubación prolongada, de hasta 7 días2. En este caso, si no hubiéramos contado con el resultado del Gram y hubiésemos considerado solamente el desarrollo de E. faecalis, no hubiésemos advertido que faltaba el aislamiento del agente mayoritario.
Estos microorganismos pueden presentarse como patógenos únicos o como agentes coinfectantes. Deben ser evaluados en el contexto clínico del paciente para su correcta jerarquización y evitar fallas terapéuticas. En nuestro caso, el aislado se jerarquizó clínica y microbiológicamente, dado que se confirmó la presencia de B. scardovii y E. faecalis en una segunda muestra de orina 13 días más tarde, sin tratamiento previo, en un paciente con sintomatología acompañante y sin otro foco infeccioso.
Con respecto a la identificación fenotípica, los métodos convencionales son confiables pero insumen más tiempo del deseable para el cumplimiento de los requerimientos asistenciales. Además, no siempre permiten llegar a la identificación completa de género y especie. Por otro lado, los sistemas comerciales API Coryne, RapID ANA II y API Rapid ID 32A son prometedores, pero aún presentan inconvenientes para la identificación de este tipo de microorganismos2,8. La espectrometría de masas es un método confiable que permite obtener la identificación rápida de estos microorganismos infrecuentes —siempre y cuando las bases de datos estén actualizadas—, aunque aún no está disponible en la mayoría de los laboratorios de microbiología hospitalarios. La secuenciación del gen ARNr 16S es el método de referencia para diferenciar ciertas especies de bifidobacterias de Actinomyces spp.8.
En conclusión, la identificación fenotípica de este tipo de microorganismos representa un desafío para los laboratorios de microbiología clínica. Se deberá aplicar el buen criterio microbiológico dado que si al microorganismo no se lo busca activamente, no se lo reconoce y se descarta el aislado, ni el MALDI-TOF MS ni la secuenciación génica lograrán el diagnóstico etiológico. Luego, se indica realizar las pruebas preliminares y las confirmatorias planteadas para poder identificar fenotípicamente a estos bacilos —por lo menos, hasta el nivel de género—, hacer la prueba de sensibilidad a los antibióticos potencialmente útiles y completar la identificación polifásica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.