Los bovinos son el principal reservorio de Escherichia coli productor de toxina Shiga (STEC); las estrategias para evitar su transmisión se concentran en la planta de faena. El objetivo de este trabajo fue evaluar la calidad higiénico-sanitaria y la frecuencia de detección de STEC en medias reses bovinas de frigoríficos de tránsito provincial. Se procesaron 274 esponjados de media res; en 9 (3,3%) el recuento de E. coli genérico fue marginal, en 4 (1,4%) se aisló E. coli O157, de los cuales 2 fueron caracterizados como stx2c(vh-a)/eae/ehxA, y los otros 2 como no toxigénicos. A partir de una (0,4%) muestra se aisló E. coli no-O157 ONT:H49, stx2a/ehxA/saa. En este trabajo la calidad del producto analizado indica que en la provincia de Tucumán se cumplen las buenas prácticas de manufactura en la faena de bovinos.
Cattle are the main reservoir of Shiga toxin-producing Escherichia coli (STEC), and the strategies to prevent the transmission of these microorganisms are concentrated in the slaughtering plant. The aim of this study was to evaluate the hygienic-sanitary quality and the frequency of detection of STEC in beef carcasses in abattoirs from Tucuman province. Two hundred and seventy four beef carcass sponges were processed; the count of generic E. coli was marginal in 9 (3,3%) of them. Escherichia coli O157 was isolated in 4 (1,4%) samples; 2 of which were characterized as stx2c(vh-a)/eae/ehxA whereas the other 2 were non-toxigenic strains. Non-O157 E. coli ONT:H49, stx2a/ehxA/saa was isolated from 1 sample (0,4%). In this work the quality of the analyzed product indicates that the good practices of manufacture are fulfilled in slaughtering facilities in Tucumán province.
Escherichia coli productor de toxina Shiga (STEC) es un patógeno emergente asociado a enfermedades transmitidas por alimentos. El serotipo O157:H7 es el prototipo de un grupo más amplio de cepas STEC, entre los que se incluyen las cepas O26:H11, O103:H2, O111:NM, O113:H21 y O145:NM, reconocidas por la Organización Mundial de la Salud por su potencial patogénico. La infección por STEC puede causar casos esporádicos o brotes de diarrea, colitis hemorrágica y síndrome urémico hemolítico1.
Los rumiantes, en particular los bovinos, son considerados como el principal reservorio de STEC, y la contaminación de las carcasas bovinas con el contenido intestinal durante el proceso de faena está relacionada con los procedimientos de remoción del cuero y las vísceras. Los recuentos elevados de E. coli genérico, microorganismo indicador de contaminación fecal, se relacionan con la carencia de buenas prácticas de higiene en el frigorífico9.
Estudios de STEC en frigoríficos de Argentina mostraron una prevalencia del serotipo O157 del 4,1% en heces de bovinos y del 2,6% en carcasas4, y de STEC no-O157, del 22,3 y el 9%, respectivamente5. En la provincia de Tucumán, Jure et al.2 reportaron un porcentaje de aislamiento de STEC O157 inferior al 1%; no existen estudios previos sobre detección de STEC no-O157 en media res.
En Argentina, los frigoríficos habilitados se clasifican como A (productos de exportación y mercado interno), B, C y rurales (tránsito provincial). Esta habilitación se basa en una estimación del régimen «animal-hora» y «producción-hora» en relación con la capacidad útil de las instalaciones del establecimiento (Reglamento SENASA Decreto 4238/68 actualizado http://www.senasa.gov.ar/Archivos/File/File753-Capitulos.pdf)
El objetivo de este trabajo fue evaluar la calidad higiénico-sanitaria en el proceso de faena y determinar la frecuencia de detección y aislamiento de STEC en medias reses bovinas en frigoríficos de tránsito provincial.
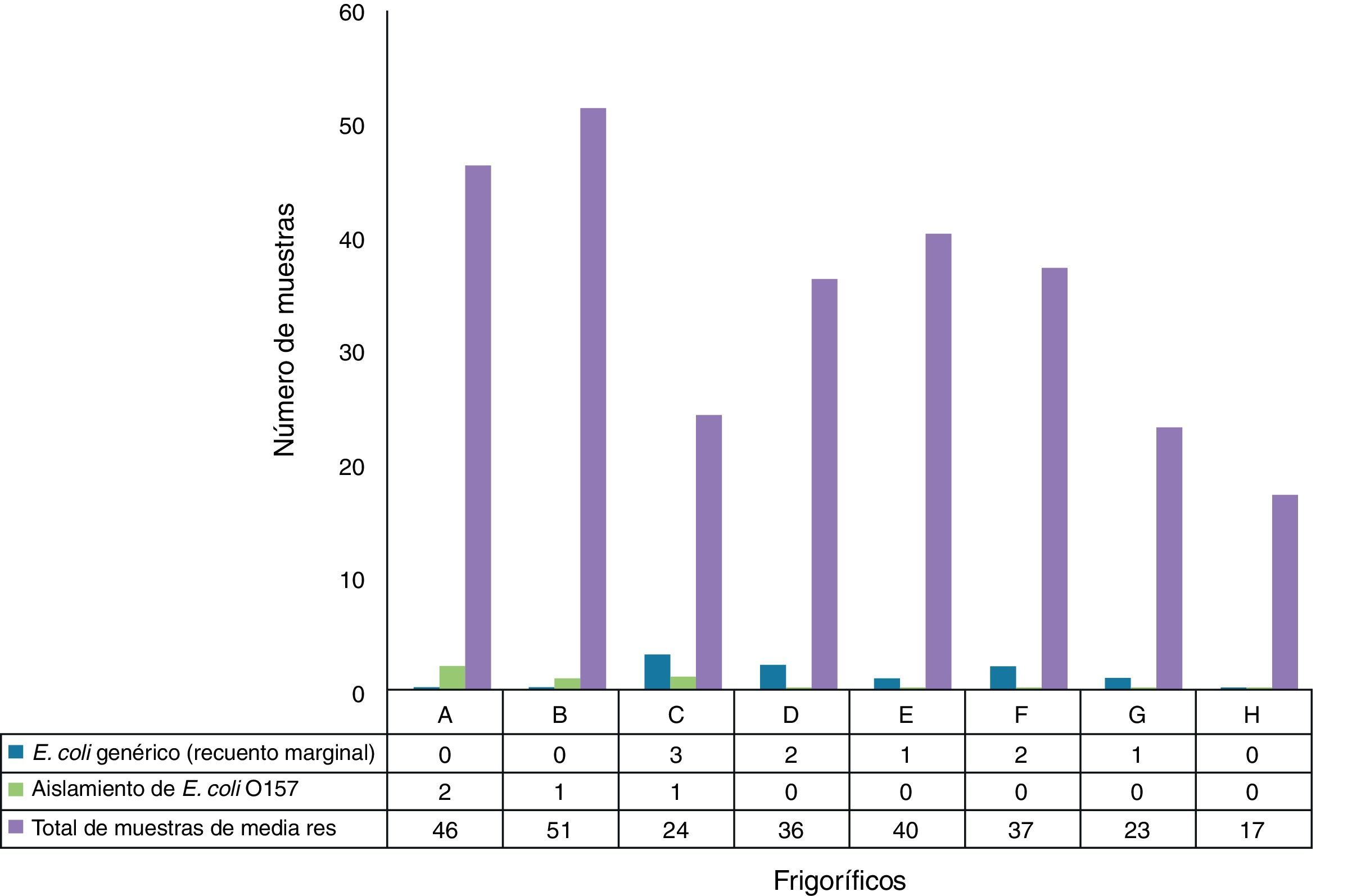
Recolección de muestras: en el período febrero del 2011-diciembre del 2015, se tomaron 274 muestras de medias reses en 8 establecimientos de faena de diferentes localidades de la provincia de Tucumán: Capital (n=51), Bella Vista (n=46), Santa Bárbara (n=23), Lules (n=17), La Reducción (n=24), Famaillá (n=37), Aguilares (n=36) y Monteros (n=40).
La toma de muestra se llevó a cabo en el momento de la faena, en la cámara de oreo, según normativas del SENASA (Circular 3192/96-Anexo II). Para el recuento de E. coli genérico, cada media res fue hisopada en 4 áreas diferentes de 100cm2 cada una: cuadril, vacío, pecho y cogote. Los hisopos se colocaron en bolsas con agua peptona bufferada (Britania S.A., CABA, Argentina). Para la detección de E. coli O157 y STEC, se utilizaron esponjas 3M® con caldo tripticasa de soya modificado con 8μg de novobiocina y casaminoácidos (TSBm, Neogen, Michigan, EE.UU.). Las muestras se trasladaron refrigeradas al laboratorio para su posterior análisis.
Control higiénico-sanitario: se realizó el recuento de E. coli en placas Petrifilm 3M® (PETRIFILM® AOAC Official Method 991.14 o 998.08). Según normativas del SENASA, se consideró como valor «aceptable» un conteo menor de 5UFC/cm2, como «marginal» uno de 5 a 100UFC/cm2 y como «inaceptable» aquel mayor de 100UFC/cm2.
Detección, aislamiento y caracterización de E. coli O157:H7: se siguió la normativa USDA MLG 5.05 (United States Department of Agriculture-Food Safety Inspection Services13). Las etapas metodológicas fueron las siguientes:
- 1.
Enriquecimiento en medio selectivo: a cada bolsa que contenía un esponjado de media res se le agregaron 40ml de TSBm, este material se incubó a 37°C durante 24h.
- 2.
Tamizaje a partir del caldo de enriquecimiento: se utilizaron tiras inmunocromatográficas RapidCheck®E. coli O157 Test Kit (Strategic Diagnostic Inc., Newark, EE. UU.), de acuerdo con las instrucciones del fabricante.
- 3.
Separación inmunomagnética: se utilizaron perlas inmunomagnéticas (Dynabeads® Dynal Brown Deer, EE. UU. y Beijing, China, pertenecientes a Dynal Biotech). El producto inmunoconcentrado (100μl) se separó en 2 alícuotas de 50μl, una de estas alícuotas se sembró en agar MacConkey sorbitol (Becton Dickinson, EE. UU.) adicionado con cefixima-telurito (bioMérieux, Marcy-l’Étoile, Francia) (CT-SMAC), la otra se sembró en CHROMagar (París, Francia). Las placas fueron incubadas a 37°C durante 24h. De cada placa se seleccionaron colonias presuntivas para su identificación bioquímica.
- 4.
Caracterización fenotípica y serotipificación: la identificación bioquímica se realizó mediante las pruebas de fermentación de celobiosa, crecimiento en cianuro de potasio, producción de pigmento y lisina descarboxilasa (Britania). La detección de movilidad se realizó en medio de Craigie11 y la determinación del biotipo mediante la fermentación de sorbitol, dulcitol, rafinosa y ramnosa (ICN Biomedicals, Aurora, Ohio, EE. UU.). La serotipificación se realizó con antisuero somático O157 (Oxoid, Ltd., Hampshire, Reino Unido) y flagelar H7 (Instituto Nacional de Producción de Biológicos-ANLIS «Dr. Carlos G. Malbrán»).
- 5.
Determinación del perfil de sensibilidad a los antimicrobianos: se realizó por el método de difusión en agar con discos siguiendo las normas del Clinical and Laboratory Standards Institute (CLSI), documento M100-S24 (http://clsi.org/blog/2014/01/27/m100-s24_em100_2014), y se utilizó como cepa control E. coli ATCC 25922. Se evaluaron los siguientes antimicrobianos: ácido nalidíxico (30μg), amicacina (30μg), ampicilina (10μg), ciprofloxacina (5μg), colistina (10μg), estreptomicina (10μg), gentamicina (10μg), nitrofurantoína (300μg), tetraciclina (30μg) y trimetoprima/sulfametoxazol (1,25/23,75μg).
- 6.
Caracterización molecular: se realizó por PCR múltiple para los genes stx1, stx2, rfbO157. La caracterización de los marcadores de virulencia accesorios eae, ehxA y fliCH7 se realizó por PCR simple mediante protocolos previamente estandarizados11.
- 7.
Subtipificación de toxina Shiga: se efectuó mediante el estudio de polimorfismo utilizando PCR-RFLP12.
Detección y aislamiento de STEC no-O157: las muestras de esponjados de media res se incubaron en agua peptona bufferada a 37°C durante 24h. Se utilizó como control positivo la cepa E. coli EDL 933, como control negativo, la cepa E. coli ATCC 25922, y como control de sistema, caldo de enriquecimiento sin muestra. A partir del caldo enriquecido de cada una de las muestras se tomó una alícuota de 1ml y se realizó la extracción de ADN total. Simultáneamente, se conservó 1ml de este caldo con 30% de glicerol a –20°C para continuar con su procesamiento, en caso de que la muestra resultara positiva al tamizaje para los genes stx por PCR-MK11.
Los caldos de las muestras positivas se reactivaron en medio EC y se sembraron en placas agar MacConkey y EMB-Levine. De las placas con medio MacConkey, se realizó el análisis por PCR-MK de los extractos de ADN obtenidos de la zona de confluencia. De las placas de Levine, se seleccionaron 50 colonias que se repicaron en una placa grillada de agar MacConkey y a partir de estas se realizaron pools de 5 colonias cada uno, de los que se extrajo el ADN total para utilizarlo como templado en una segunda PCR-MK. En los pools stx positivos se realizó una tercera PCR-MK a cada una de las 5 colonias que los conformaban, para individualizarlas.
Caracterización fenotípica y genotípica: se realizaron pruebas bioquímicas y serotipificación con antígenos somáticos y flagelares11. Todas las colonias se ensayaron con el antisuero anti-O siguiendo la técnica de aglutinación en lámina y la detección del antígeno H se realizó según la técnica de aglutinación en tubo con antisuero anti-H6. Para la determinación del serogrupo se utilizaron antisueros producidos por el Instituto Nacional de Producción de Biológicos ANLIS «Dr. Carlos G. Malbrán». Para la determinación del antígeno flagelar se utilizaron diferentes antisueros (Denka Seiken, Japón). La caracterización molecular de las colonias stx positivas se realizó mediante PCR múltiple para los genes stx1, stx2, rfbO157, los marcadores de virulencia accesorios eae, ehxA y saa (adhesina autoaglutinante) se detectaron también por PCR mediante protocolos previamente estandarizados11.
Para determinar la asociación entre recuentos de E. coli genérico marginal y aislamientos de E. coli O157 y no-O157 en las 4 estaciones del año, se realizaron tablas de contingencia basadas en el test de chi al cuadrado de Pearson con el software InfoStat versión 2014 (Grupo InfoStat, Facultad de Ciencias Agrarias, Universidad Nacional de Córdoba, Córdoba, Argentina).
Recuento de E. coli genérico: de los 274 hisopados de media res recolectados, en el 96,7% (n=265) se obtuvo un recuento aceptable (<5UFC/cm2) y en el 3,3% (n=9) un recuento marginal (5-100UFC/cm2).
Detección, aislamiento y caracterización de E. coli O157: el 11% (n=29) de las 274 muestras analizadas fue positivo presuntivo para la detección de E. coli O157.
Se identificaron 4 aislamientos de E. coli O157; 2 de ellos fueron caracterizados como STEC O157:H7 stx2c(vh-a)/eae/ehxA. Dos aislamientos no toxigénicos fueron O157: NM/eae(-)/ehxA(-). Ningún aislamiento presentó resistencia a los antimicrobianos ensayados.
Detección, aislamiento y caracterización de E. coli no-O157: el 3,3% (n=9) de las 274 muestras analizadas fueron positivas al primer tamizaje por PCR-MK. El segundo tamizaje (zona de confluencia de placas de MacConkey agar) fue positivo en el 2,2% (n=6) de las muestras. Solo de una de ellas, que no presentó recuento marginal de E. coli genérico, se aisló E. coli no-O157, caracterizado como ONT:H49, stx2/ehxA/saa.
En un período de muestreo de 5 años, E. coli O157 se aisló en otoño en 1/69 muestras de media res, en invierno en 2/76 y en primavera en 1/89. En verano se aisló STEC no-O157 en 1/40 muestras. No se detectaron variaciones en la frecuencia de aislamiento de E. coli O157 y no-O157 al comparar las estaciones del año.
Los 4 aislamientos de E. coli O157 obtenidos correspondieron a 3 de los 8 frigoríficos estudiados. En el frigorífico A se obtuvieron 2 aislamientos de E. coli O157 de 46 muestras procesadas (4,65%) y en el frigorífico B se obtuvo un aislamiento de 51 muestras procesadas (1,96%); esos aislamientos no se correlacionaron con un recuento de E. coli genérico marginal. En el frigorífico C se obtuvo un aislamiento de 24 muestras procesadas (4,17%), que se correlacionó con un recuento de E. coli genérico marginal (fig. 1).
En este estudio el recuento de E. coli genérico presentó valores marginales en el 3,3% de las muestras (9/274), los que difieren de los reportados por Martínez-Chávez et al.3, que informan un 12% (16/138) de muestras con recuento marginal.
El porcentaje de aislamiento de STEC O157 en carcasas es variable, ya que influyen factores como el tipo de animal, la edad, los regímenes de alimentación, la cantidad de muestra procesada y las metodologías de detección8.
En el presente estudio la frecuencia de aislamiento de STEC O157 fue inferior al 1%, lo que difiere del dato aportado por Varela Hernández et al.14, del 2,7%.
Las cepas STEC O157 fueron caracterizadas como stx2c(vh-a2)/eae/ehxA/fliCH7. Esta variante de toxina Shiga es detectada en casos de enfermedad humana en baja frecuencia en Argentina, la variante prevalente es la stx2a/stx2c10.
Reyes Rodríguez et al.7 detectaron aislamientos de STEC O157 resistentes a cefalotina, carbenicilina y amicacina. Estos resultados difieren de los obtenidos en esta investigación, pues los aislamientos fueron sensibles a todos los antimicrobianos ensayados.
En el estudio realizado por Masana et al.5, el 9% de las carcasas presentaron contaminación con STEC no-O157. Los principales serotipos identificados fueron O178:H9, O8:H19, O130:H11 y O113:H21, descriptos como productores de SUH en Argentina. En nuestro estudio, la frecuencia de detección de genes stx en media res fue del 3,3%, pero E. coli no-O157 solo se aisló en una de las muestras (1,9%) y fue caracterizada como ONT:H49.
Si bien en Argentina las normas vigentes para el control de la calidad microbiológica (tanto para muestras ambientales como de carcasas) y el control higiénico-sanitario en las plantas de faena están implementadas en los establecimientos clasificados como exportadores (categoría A) y no rigen en las plantas de faena de tránsito provincial (categorías B o C), la carencia de datos referidos a la cadena de producción-comercialización de carne bovina en Tucumán hace necesario profundizar los estudios en las distintas etapas de este proceso, para poder detectar los puntos críticos de contaminación.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo fue financiado por la Secretaría de Ciencia y Técnica de la Universidad Nacional de Tucumán. Programa CIUNT D 543/3; y por Agencia Nacional de Promoción Científica – PICTO OTNA N°79. Préstamo BID.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a la Lic. Elena Bru, Profesional Principal CERELA-CONICET por su asesoramiento en el análisis estadístico de los datos.