El objetivo de este trabajo fue estudiar la fermentación láctica como bioestrategia para potenciar la actividad antioxidante de la avena. Se evaluó la capacidad de 31 cepas de bacterias lácticas (BL) para adaptarse a un sistema de avena/agua (SAA) mediante la determinación del crecimiento, la acidificación y la actividad fermentativa (método impedimétrico; tiempo de detección [DT], velocidad máxima de cambio de conductabilidad [VMCC] y porcentaje de cambio de conductabilidad [PCC]). Además, se determinó el contenido de compuestos fenólicos (CF) mediante el método de Folin-Ciocalteu (equivalentes de ácido gálico [EAG]), así como de péptidos, de aminoácidos libres y de actividad antirradicalaria (métodos DPPH• y ABTS•+) de los extractos metanólicos y acuosos obtenidos a partir de los SAA fermentados (SAAf). Seis cepas mostraron la mejor adaptabilidad al SAA y produjeron altos valores de VMCC (0,34-0,47 μS/min) y PCC (53,6-66,6%), con bajos valores de DT (≤ 3 h). Estos cambios fueron acompañados por modificaciones en la concentración de CF, péptidos y aminoácidos libres, los cuales fueron dependientes de la cepa. Se evidenció un incremento de la concentración de CF en los SAAf de las seis cepas (29,1-39,85 μg EAG/ml) con respecto al SAA control (17,1 μg EAG/ml). Además, hubo un incremento (9-25,5%) en la actividad antioxidante de los extractos metanólicos de SAAf medida por ambos métodos. Respecto del contenido en péptidos/aminoácidos libres de los SAAf y de su actividad antioxidante, se encontraron modificaciones de menor magnitud. Los resultados muestran que las BL son capaces de adaptarse a la avena como sustrato de fermentación e incrementar su contenido de compuestos antioxidantes.
The objective of this work was to study lactic fermentation as a biostrategy to enhance the antioxidant activity of oats. The adaptability of 31 strains of lactic bacteria (LB) in an oats/water system (OWS/SAA) was evaluated, measuring growth, acidification and fermentation activity (impedimetric method; detection time [DT], maximum rate of conductance change [MRCC/VMCC] and percentage of conductance change [PCC]). Moreover, the content of phenolic compounds (PC) was determined using the Folin-Ciocalteu method (gallic acid equivalents [GAE]), free peptides and amino acids and free radical scavenging activity (DPPH• and ABTS•+ methods) of methanolic and aqueous extracts obtained from fermented OWS/SAAs (fOWS/SAAf) were determined. Six strains have shown the best adaptability to SAA, with high values of VMCC (0.34-0.47 μS/min) and PCC (53.6-66.6%), and low values of DT (≤ 3 h). In these f/OWS/SAAf the chemical composition was also modified (PC concentration, peptides and free amino acids) with strain-dependent behavior. The PC content in f/OWS/SAAf using these six strains (29.1-36.9 μg GAE/ml) was higher than the control content in OWS/SAA control (17.1 ± 1.9 μg GAE/ml). An increase (9-25.5%) in antioxidant activity in f/OWS/SAAf methanolic extracts was detected using both methods. Minor modifications were observed in the peptide and free amino acid content of SAA and their antioxidant activity. Our results show LB ability to adapt to oat as fermentation substrate and increase the content of its antioxidant compounds.
La harina de avena coloidal es una preparación a base de harina de avena (1/25 p/v) que se utiliza como un agente calmante para aliviar los síntomas asociados a la dermatitis13,21. La actividad antiirritante de la harina de avena coloidal ha sido ampliamente estudiada, tanto en ensayos in vitro como en estudios clínicos en pacientes con diferentes tipos de dermatitis34,47. Numerosos artículos indican que los compuestos fenólicos (CF) presentes en la avena son los responsables de su actividad antioxidante y antiinflamatoria14,43,47. Asimismo, Reynertson et al.34 evidenciaron que extractos acuosos de avena que contienen proteínas y péptidos poseen actividad antiinflamatoria.
El contenido total de CF en la avena (Avena sativa L.) es de aproximadamente 380 μg/g de materia seca; solo el 1,5% de ellos está en su forma libre y activa17,18. Estos CF están, en su mayoría, unidos a cadenas de arabinoxilano a través de enlaces éster o a la lignina a través de enlaces éter, lo que los hace menos activos. Las bacterias lácticas (BL) presentan un inmenso potencial biotecnológico por poseer un amplio espectro de enzimas49, tales como proteasas, peptidasas, descarboxilasas, reductasas, esterasas, glucosidasas, etc., que podrían producir modificaciones químicas en los compuestos presentes en la avena (CF, proteínas, péptidos) y potenciar sus propiedades biológicas, entre ellas, la antioxidante.
Existe limitada bibliografía respecto de la acción de la fermentación láctica sobre la bioaccesibilidad de los CF de la avena. La adaptabilidad de algunos lactobacilos probióticos a bebidas a base de avena o de avena germinada y malteada fue reportada en algunos trabajos2,15,16,22,25,31,37,50. Hole et al.18 demostraron que BL probióticas (Lactobacillusacidophilus, Lactobacillusjohnsonii, Lactobacillusreuteri) son capaces de liberar CF y modificar el perfil de fenólicos de la avena. Luana et al.23 reportaron que la fermentación láctica de una bebida tipo yogur a base de avena aumentó la disponibilidad de CF y la actividad antioxidante en un 25-70%.
La avena también posee proteínas que pueden ser hidrolizadas durante la fermentación. Se reportó que la fermentación de harina de avena con Lactobacillusplantarum TK9 y Bifidobacterium animalis V9 incrementó el contenido de péptidos con pesos moleculares ≤ 6.000 Da50. Coda et al.9 demostraron la capacidad de las BL de fermentar una masa de harina de avena y liberar péptidos con actividad antioxidante, sin embargo, esos péptidos no fueron identificados.
El objetivo de este trabajo fue estudiar la fermentación láctica como bioestrategia para mejorar la actividad antioxidante de la harina de avena coloidal.
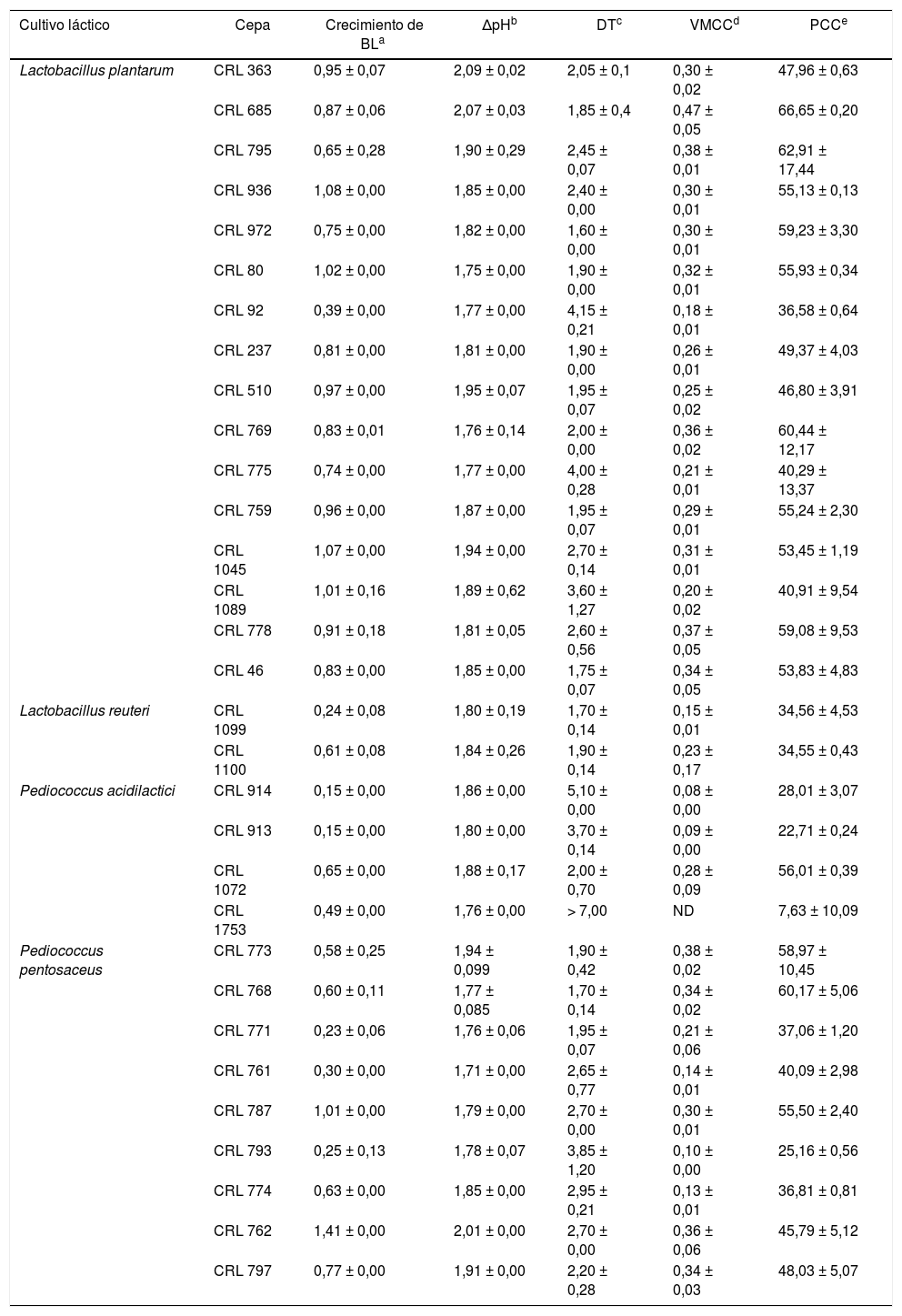
Materiales y métodosMicroorganismos y condiciones de cultivoEn este trabajo se utilizaron 31 cepas de BL aisladas de material vegetal, pertenecientes a la Colección de Cultivos del Centro de Referencia para Lactobacilos (CERELA-CONICET), Tucumán, Argentina. Estas cepas fueron seleccionadas en trabajos previos por su capacidad acidificante, antifúngica, proteolítica y amilolítica12. El listado de las cepas estudiadas se muestra en la tabla 1.
Valores de crecimiento, acidificación y actividad fermentativa de cultivos de BL en sistema avena/agua (SAA)
| Cultivo láctico | Cepa | Crecimiento de BLa | ΔpHb | DTc | VMCCd | PCCe |
|---|---|---|---|---|---|---|
| Lactobacillus plantarum | CRL 363 | 0,95 ± 0,07 | 2,09 ± 0,02 | 2,05 ± 0,1 | 0,30 ± 0,02 | 47,96 ± 0,63 |
| CRL 685 | 0,87 ± 0,06 | 2,07 ± 0,03 | 1,85 ± 0,4 | 0,47 ± 0,05 | 66,65 ± 0,20 | |
| CRL 795 | 0,65 ± 0,28 | 1,90 ± 0,29 | 2,45 ± 0,07 | 0,38 ± 0,01 | 62,91 ± 17,44 | |
| CRL 936 | 1,08 ± 0,00 | 1,85 ± 0,00 | 2,40 ± 0,00 | 0,30 ± 0,01 | 55,13 ± 0,13 | |
| CRL 972 | 0,75 ± 0,00 | 1,82 ± 0,00 | 1,60 ± 0,00 | 0,30 ± 0,01 | 59,23 ± 3,30 | |
| CRL 80 | 1,02 ± 0,00 | 1,75 ± 0,00 | 1,90 ± 0,00 | 0,32 ± 0,01 | 55,93 ± 0,34 | |
| CRL 92 | 0,39 ± 0,00 | 1,77 ± 0,00 | 4,15 ± 0,21 | 0,18 ± 0,01 | 36,58 ± 0,64 | |
| CRL 237 | 0,81 ± 0,00 | 1,81 ± 0,00 | 1,90 ± 0,00 | 0,26 ± 0,01 | 49,37 ± 4,03 | |
| CRL 510 | 0,97 ± 0,00 | 1,95 ± 0,07 | 1,95 ± 0,07 | 0,25 ± 0,02 | 46,80 ± 3,91 | |
| CRL 769 | 0,83 ± 0,01 | 1,76 ± 0,14 | 2,00 ± 0,00 | 0,36 ± 0,02 | 60,44 ± 12,17 | |
| CRL 775 | 0,74 ± 0,00 | 1,77 ± 0,00 | 4,00 ± 0,28 | 0,21 ± 0,01 | 40,29 ± 13,37 | |
| CRL 759 | 0,96 ± 0,00 | 1,87 ± 0,00 | 1,95 ± 0,07 | 0,29 ± 0,01 | 55,24 ± 2,30 | |
| CRL 1045 | 1,07 ± 0,00 | 1,94 ± 0,00 | 2,70 ± 0,14 | 0,31 ± 0,01 | 53,45 ± 1,19 | |
| CRL 1089 | 1,01 ± 0,16 | 1,89 ± 0,62 | 3,60 ± 1,27 | 0,20 ± 0,02 | 40,91 ± 9,54 | |
| CRL 778 | 0,91 ± 0,18 | 1,81 ± 0,05 | 2,60 ± 0,56 | 0,37 ± 0,05 | 59,08 ± 9,53 | |
| CRL 46 | 0,83 ± 0,00 | 1,85 ± 0,00 | 1,75 ± 0,07 | 0,34 ± 0,05 | 53,83 ± 4,83 | |
| Lactobacillus reuteri | CRL 1099 | 0,24 ± 0,08 | 1,80 ± 0,19 | 1,70 ± 0,14 | 0,15 ± 0,01 | 34,56 ± 4,53 |
| CRL 1100 | 0,61 ± 0,08 | 1,84 ± 0,26 | 1,90 ± 0,14 | 0,23 ± 0,17 | 34,55 ± 0,43 | |
| Pediococcus acidilactici | CRL 914 | 0,15 ± 0,00 | 1,86 ± 0,00 | 5,10 ± 0,00 | 0,08 ± 0,00 | 28,01 ± 3,07 |
| CRL 913 | 0,15 ± 0,00 | 1,80 ± 0,00 | 3,70 ± 0,14 | 0,09 ± 0,00 | 22,71 ± 0,24 | |
| CRL 1072 | 0,65 ± 0,00 | 1,88 ± 0,17 | 2,00 ± 0,70 | 0,28 ± 0,09 | 56,01 ± 0,39 | |
| CRL 1753 | 0,49 ± 0,00 | 1,76 ± 0,00 | > 7,00 | ND | 7,63 ± 10,09 | |
| Pediococcus pentosaceus | CRL 773 | 0,58 ± 0,25 | 1,94 ± 0,099 | 1,90 ± 0,42 | 0,38 ± 0,02 | 58,97 ± 10,45 |
| CRL 768 | 0,60 ± 0,11 | 1,77 ± 0,085 | 1,70 ± 0,14 | 0,34 ± 0,02 | 60,17 ± 5,06 | |
| CRL 771 | 0,23 ± 0,06 | 1,76 ± 0,06 | 1,95 ± 0,07 | 0,21 ± 0,06 | 37,06 ± 1,20 | |
| CRL 761 | 0,30 ± 0,00 | 1,71 ± 0,00 | 2,65 ± 0,77 | 0,14 ± 0,01 | 40,09 ± 2,98 | |
| CRL 787 | 1,01 ± 0,00 | 1,79 ± 0,00 | 2,70 ± 0,00 | 0,30 ± 0,01 | 55,50 ± 2,40 | |
| CRL 793 | 0,25 ± 0,13 | 1,78 ± 0,07 | 3,85 ± 1,20 | 0,10 ± 0,00 | 25,16 ± 0,56 | |
| CRL 774 | 0,63 ± 0,00 | 1,85 ± 0,00 | 2,95 ± 0,21 | 0,13 ± 0,01 | 36,81 ± 0,81 | |
| CRL 762 | 1,41 ± 0,00 | 2,01 ± 0,00 | 2,70 ± 0,00 | 0,36 ± 0,06 | 45,79 ± 5,12 | |
| CRL 797 | 0,77 ± 0,00 | 1,91 ± 0,00 | 2,20 ± 0,28 | 0,34 ± 0,03 | 48,03 ± 5,07 |
DT: tiempo (horas) requerido para alcanzar el límite de detección que provoque un cambio detectable de conductabilidad previamente establecido por el operador.
Se evaluó la capacidad de esas cepas de BL de fermentar un sistema a base de harina de avena (Quaker®, Argentina)/agua (relación 1/25 p/v, SAA, su preparación fue estandarizada según la Farmacopea de Estados Unidos), adicionado con glucosa (0,5%) y esterilizado a 121°C y 1 atm de presión durante 20 min. Las cepas lácticas se inocularon (1%) en el SAA y se incubaron a 37°C durante 24 h. Como indicadores de crecimiento se evaluaron la biomasa celular (método de dilución en placa) y la acidificación (pH). La actividad fermentativa de las cepas se determinó por métodos impedimétricos (Bactometer®, Biomerieux 69289 Marcy-ĺEtoile Inc., Francia) estandarizados en trabajos previos24. Los cambios de conductabilidad se registraron cada seis minutos y se graficaron en forma automática usando el programa BPS RP3-133. También de forma automatizada se generaron tres parámetros: el tiempo (en horas) requerido para alcanzar el límite de detección que provoca un cambio detectable de la conductabilidad (previamente establecido por el operador), también llamado tiempo de detección o DT; la velocidad máxima de cambio de conductabilidad (VMCC), que corresponde a la pendiente de la curva de conductabilidad y que fue expresada en microsiemens por minuto (μS/min); y el máximo cambio de conductabilidad (PCC), expresado en porcentaje.
Cuantificación de los compuestos bioactivos en SAA fermentados por BLLos SAA fermentados por los cultivos lácticos (SAAf) fueron deshidratados por liofilización y a partir de esas fracciones se obtuvieron extractos en agua destilada (compuestos de naturaleza proteica) y metanol (compuestos fenólicos), según la metodología descripta por Reynertson et al.34. Como control se usaron extractos de SAA acidificados (SAAa) a pH 4,0 (pH final de fermentación) con una mezcla de ácido láctico/acético (relación molar 4:1, ácidos producidos por fermentación láctica). El uso de este control permitió evidenciar modificaciones en las propiedades funcionales por simple acidificación. Para obtener los extractos metanólicos se suspendieron alícuotas de 0,25 g del SAAf o SAAa liofilizado en 4 ml de metanol (70%); estas mezclas se mantuvieron a 4°C durante 1 h y cada 15 min se agitaron en un agitador tipo vórtex. Finalmente se centrifugó a 14.000 rpm durante 20 min.
Para obtener los extractos acuosos, se mezcló 0,1 g del SAAf o SAAa con 1 ml de agua bidestilada y se agitó en un agitador vórtex. Las muestras se incubaron con 3,3 ml de ácido tricloroacético (TCA) 0,75 M a 4°C durante 30 min y luego se centrifugaron 10 min a 2.500 rpm. Los extractos así obtenidos, que contenían péptidos y aminoácidos libres, fueron conservados a −20°C.
La cuantificación de los compuestos de naturaleza proteica (péptidos y aminoácidos libres [AA]) presentes en los extractos acuosos se realizó mediante el método de orto- ftalaldehído (OPA)8, usando una curva estándar de leucina (0,2 a 5 μmol/ml). Una alícuota de 10 μl del sobrenadante del extracto acuoso se mezcló con 200 μl del reactivo OPA previamente preparado y se realizó la lectura a 340 nm. Como control se usaron las fracciones obtenidas del SAAa.
El contenido de CF total se determinó en los extractos orgánicos por el método de Folin-Ciocalteu, con una modificación39. Se empleó 200 μl de extracto, 800 μl de agua bidestilada, 100 μl de reactivo de Folin-Ciocalteu y se incubó por 5 min. La mezcla se neutralizó con 400 μl de NaCO3 al 15,9% y luego de 30 min de reacción en oscuridad, se midió la absorbancia a 750 nm con un espectrofotómetro. Como compuesto patrón se empleó ácido gálico (3,3-30 μg/ml); los resultados se expresaron como μg de equivalentes de ácido gálico por ml de la muestra (μg EAG/ml). Como blanco se utilizó una mezcla de 200 μl de metanol al 70% y 800 μl de agua destilada.
Evaluación de las propiedades antioxidantes del SAA fermentado por BLPara evaluar la actividad antirradicalaria de los extractos metanólicos y acuosos se emplearon dos metodologías ampliamente utilizadas, cuyo fundamento es la depuración de dos radicales libres: DPPH• y ABTS•+. El ensayo espectrofotométrico de reducción del DPPH• se basa en el método descripto por Wu et al.46. El radical DPPH• fue disuelto en etanol hasta obtener una solución de absorbancia igual a 1.0 a 517 nm. Alícuotas de 100 μl de cada uno de los extractos (SAAf o SAAa) fueron mezcladas con 100 μl de la solución de DPPH•. La disminución de la absorbancia fue determinada espectrofotométricamente en un lector de microplaca (VarianCary® 50 UV-Vis Spectrophotometer) haciendo lecturas a intervalos de 1 min durante 10 min. El porcentaje de inhibición del radical DPPH• fue calculado mediante la ecuación descripta por Burda y Oleszek5:
El porcentaje de decoloración se calculó como:
Donde actividad antirradicalaria (AAR) (%) es la capacidad depuradora expresada en porcentaje; C es la absorbancia del control y M es la absorbancia de la muestra.
El ensayo espectrofotométrico de reducción del ABTS•+ se basó en la técnica descripta por Rice-Evans et al.35. Para generar el radical ABTS•+, una solución acuosa de ABTS•+ 7 mM con persulfato de potasio (2,45 mM) se incubó a temperatura ambiente en oscuridad por 16 h (solución madre). La solución de trabajo se preparó diluyendo la solución madre en el medio correspondiente (metanol, buffer Tris-HCl o agua) ajustando la absorbancia a uno. Se tomaron alícuotas de 50, 10 y 100 μl, de los extractos en metanol, buffer Tris-HCl y acuosos, respectivamente, y se completó a un volumen final de 100 μl con el solvente o buffer correspondiente. Posteriormente, se adicionaron 200 μl de la solución de trabajo y el ensayo se siguió espectrofotométricamente a 734 nm durante 10 min, con lecturas cada minuto en un lector de microplaca (VarianCary® 50 UV-Vis Spectrophotometer). La capacidad depuradora de radicales libres (porcentaje de actividad antirradicalaria) se calculó usando la misma ecuación que la empleada en el ensayo de DPPH•.
Análisis estadísticoLos datos obtenidos en este trabajo corresponden al menos a tres ensayos independientes y se informan como valores medios, con sus respectivas desviaciones estándar. Los análisis ANOVA y Tukey se realizaron utilizando el software Minitab 7®. Las diferencias se consideraron significativas con p < 0,05.
ResultadosSelección de BL con capacidad de fermentar avenaEn la tabla 1 se muestran los valores obtenidos para cada cultivo láctico en el SAA. En la mayoría de los casos se observó crecimiento bacteriano (0,58-1,41 Δlog UFC/ml), excepto en los cultivos de CRL 92, CRL 1099, CRL 914, CRL 913, CRL 1753, CRL 771, CRL 761 y CRL 793, en los cuales el crecimiento fue inferior a 0,50 Δlog UFC/ml. El valor inicial del pH en el SAA fue de 7,0 ± 0,5; en el SAAf por cultivos lácticos, se registraron valores de pH entre 4,0 ± 0,5 y 5,0 ± 0,5 luego de 24 h.
La actividad fermentativa de las BL se basa en el principio de que éstas pueden crecer y metabolizar los compuestos químicos no cargados o débilmente cargados y transformarlos en productos finales cargados. La acumulación de estos productos conduce a aumentos en la conductabilidad del medio y en la capacitancia en la interfase electrodo-medio26. Aplicando esta metodología al SAA, se podría evidenciar la acidificación, la proteólisis y las posibles modificaciones químicas de compuestos fenólicos y/o flavonoides por efecto de las enzimas lácticas.
El valor de DT es la variación máxima de la conductabilidad registrada en un período de tiempo. Este valor puede interpretarse como la capacidad máxima de cada cepa para modificar la conductabilidad en el SAA y, por lo tanto, depende, principalmente, de su capacidad para acumular iones durante el crecimiento. En este trabajo, los valores mínimo y máximo de DT se obtuvieron con los cultivos de L. plantarum CRL 972 (DT = 1,6 h) y Pediococcus acidilactici CRL 1753 (DT = > 7 h), respectivamente. Por otro lado, las cepas con valores altos de DT mostraron menores valores de VMCC; tal es el caso de P. acidilactici CRL 914. Los valores de PCC fueron variables y dependientes de la cepa. En los cultivos de L. plantarum CRL 685, se detectó el máximo valor de PCC (66,6%) luego de 7 h de incubación.
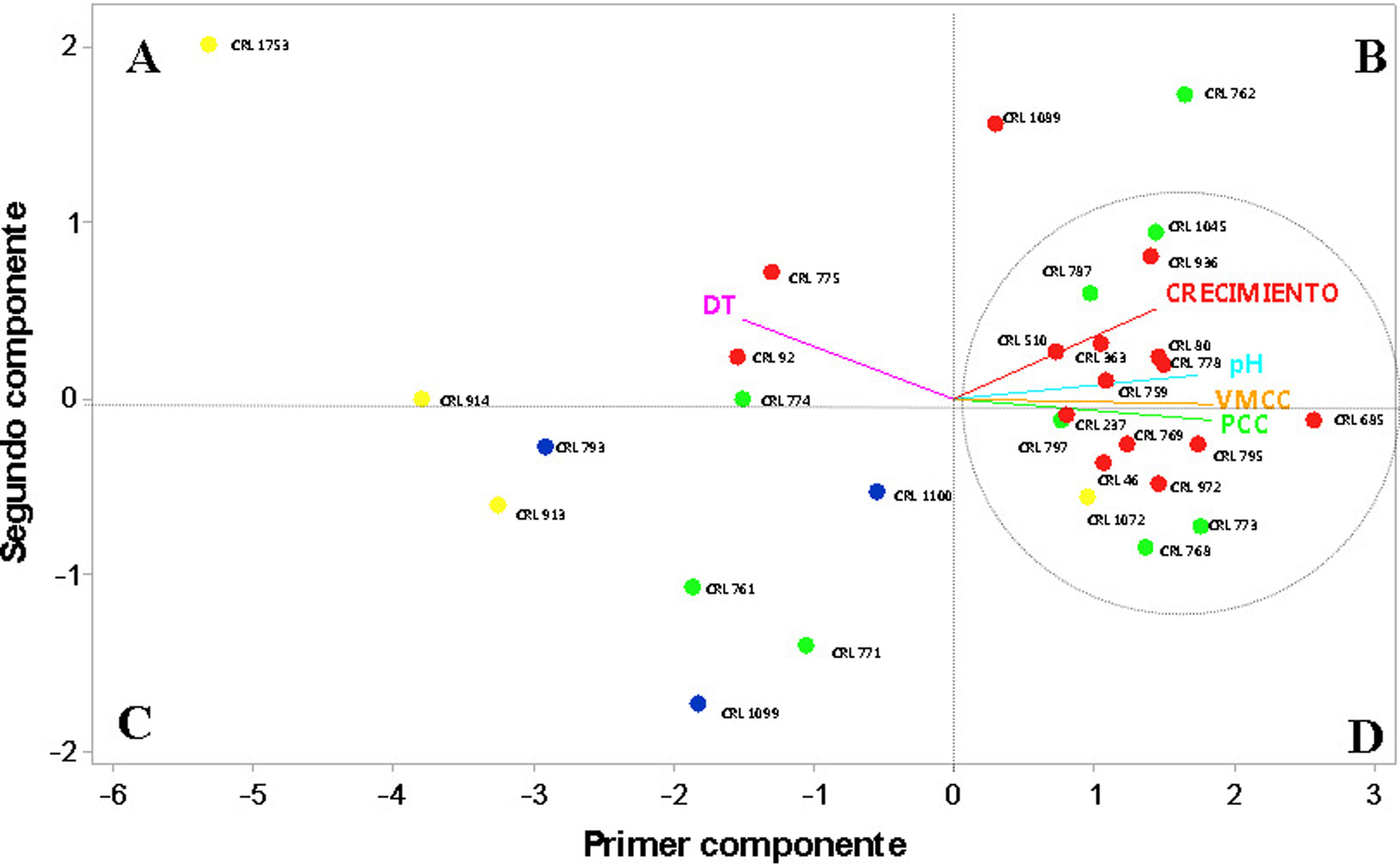
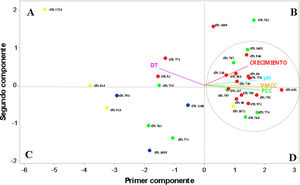
Para realizar un estudio descriptivo de los diferentes parámetros evaluados en los SAAf, se eligió el análisis de componentes principales (PCA). Del total de la varianza, los dos primeros componentes principales obtenidos de la base de datos describieron el 75,4% y el 14,1% de la variación, respectivamente, para una varianza total explicada por los dos primeros componentes del 89,5% (tabla de valores en material suplementario). Cada valor propio representa la proporción de información que recoge el componente principal, mientras que el vector propio indica la ponderación que debe aplicarse a cada una de las variables para obtener el componente principal. Las variables que más correlación presentaron (> 0,381) con el primer componente fueron la acidificación, la VMCC y el PCC. Para el segundo componente, las variables que más correlación presentaron fueron el crecimiento (0,722) y el tiempo de detección (0,641).
En la figura 1, generada a partir del análisis de componentes principales, las cepas de BL (puntos en el plano) están dispersas en diferentes cuadrantes (A, B, C y D) de acuerdo con las características de sus cultivos en el SAA. Las distancias entre los puntos (cepas) representan una medida de las diferencias observadas. Las variables evaluadas (crecimiento, acidificación, DT, VMCC y PCC) se representan en vectores, cuya dirección y longitud indican su relación con los componentes principales 1 y 2 (eje X e Y).
Representación gráfica del análisis de componentes principales obtenida de la evaluación de los cultivos de BL en los sistemas de avena/agua (SAA). Las diferentes especies de BL que se evaluaron fueron: L. plantarum (puntos rosas), L. reuteri (puntos celestes), P. pentosaceus (puntos verdes), P. acidilactici (puntos amarillos).
La cepa P. acidilactici CRL 1753 se ubicó en el extremo derecho superior del cuadrante A, con mayores valores de DT y menor crecimiento, acidificación, VMCC y PCC. En contraposición, L. plantarum CRL 685 mostró el menor valor de DT (cuadrante D) y mayor crecimiento, acidificación, VMCC y PCC. Entre las cepas de P. acidilactici evaluadas se destacó la cepa CRL 1072, la cual mostró menor DT (2,00 ± 0,70) y mayor crecimiento, acidificación, VMCC y PCC, y se ubicó en el cuadrante D. En el cuadrante C se encontraron las cepas de L. reuteri, caracterizadas por un menor valor de DT, así como también de crecimiento, acidificación, VMCC y PCC.
La mayoría de las cepas estudiadas se ubicaron entre el cuadrante B y D. Para continuar con los estudios, se seleccionaron las cepas que presentaron mayores valores de VMCC y PCC dentro de estos cuadrantes. Las cepas seleccionadas fueron CRL 685, 795, 773, 778, 769 y 768, cuyos valores de VMCC se encontraron entre 0,34 y 0,47 μS/min y de PCC entre 53,6 y 66,6%.
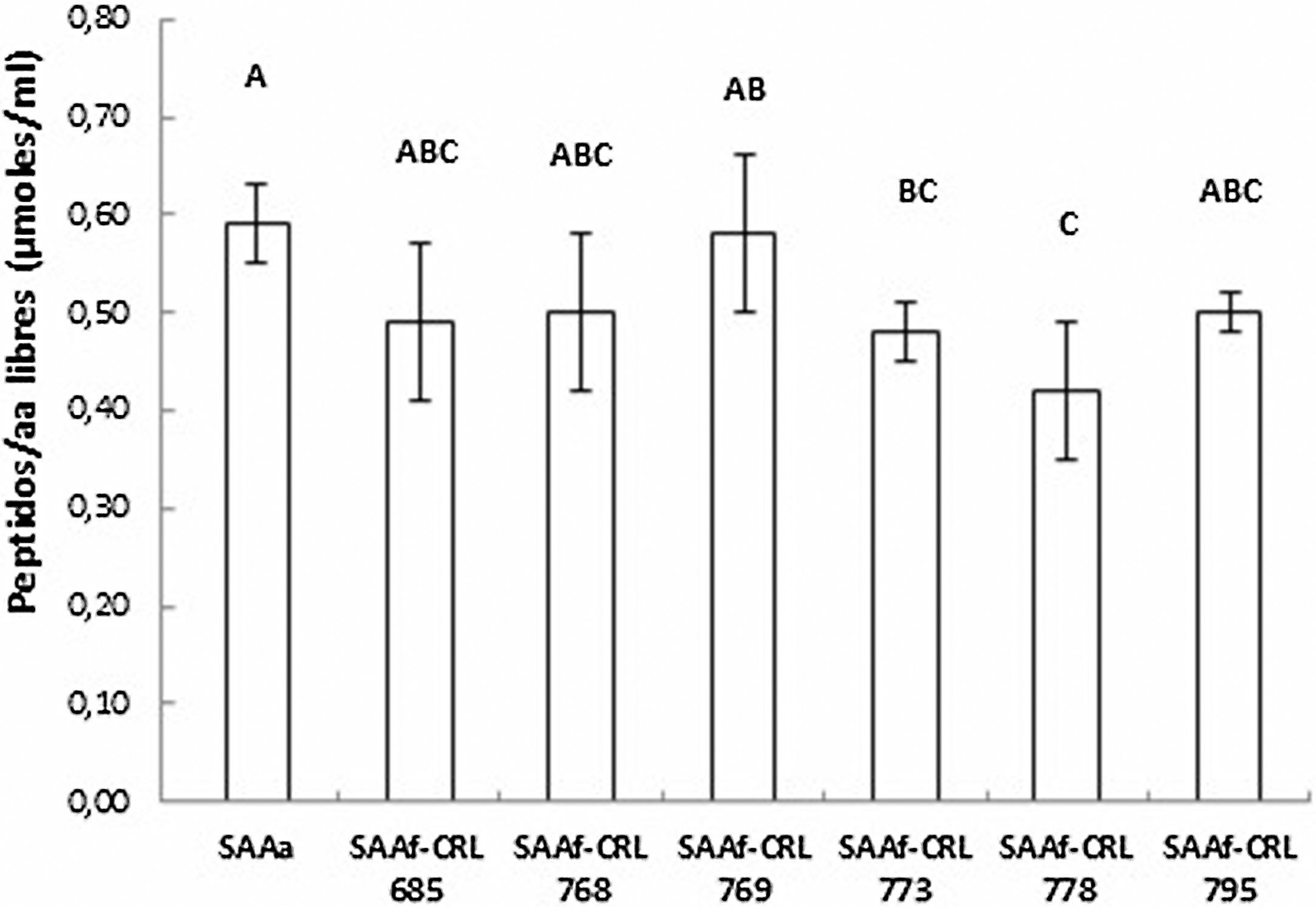
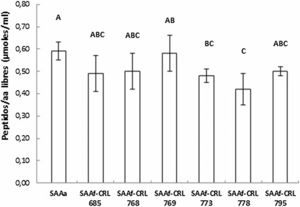
Cuantificación y actividad antioxidante de péptidos/aminoácidos en los SAA fermentados por BLEl contenido de péptidos y AA libres de los extractos acuosos se muestra en la figura 2. No se observaron diferencias significativas entre los SAAf-CRL 685, CRL 768, CRL 769 y CRL 795 con respecto al control SAAa. Por otro lado, el contenido más bajo correspondió al SAAf-CRL 778 (0,42 ± 0,07 μmol/ml).
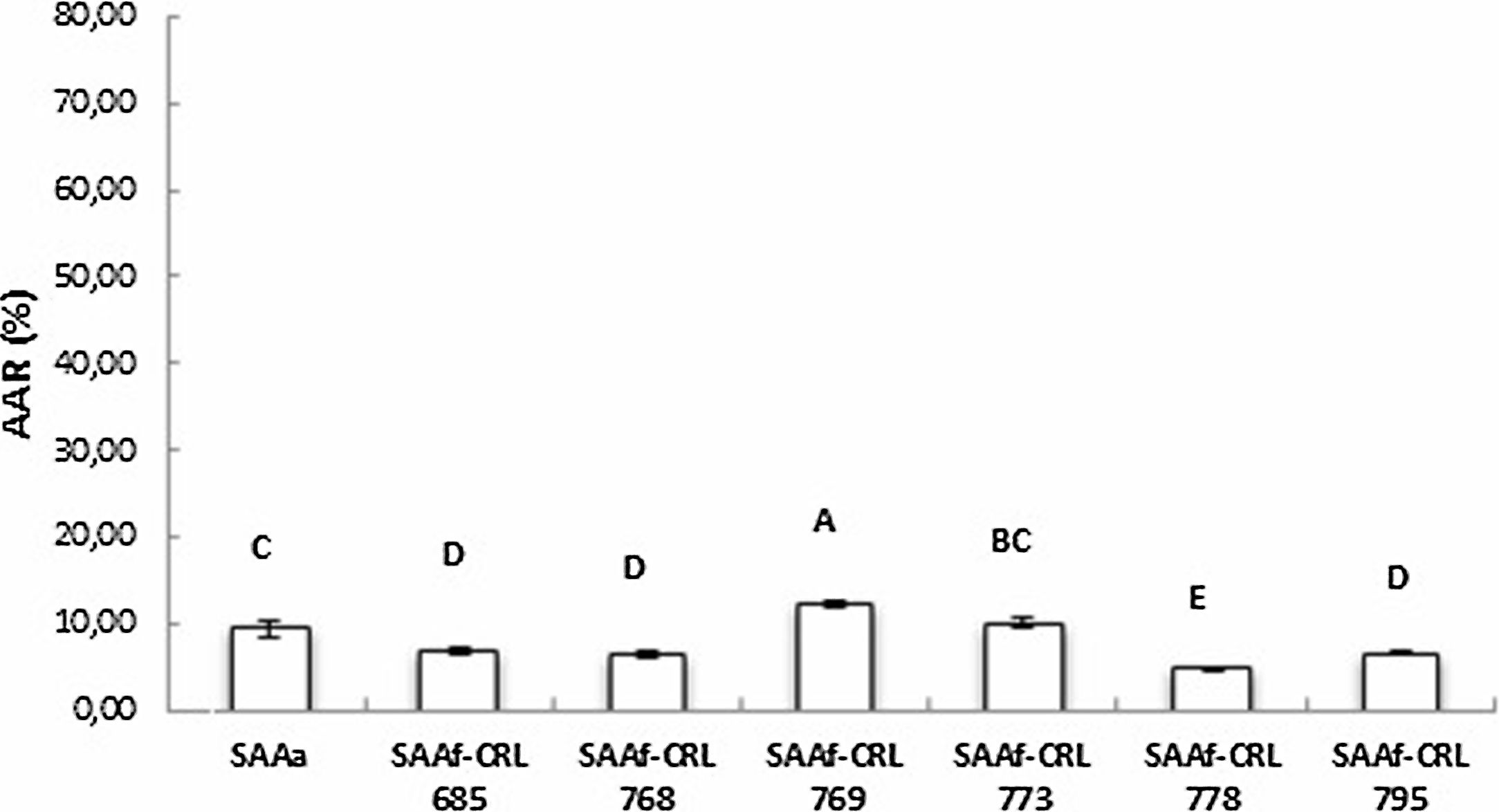
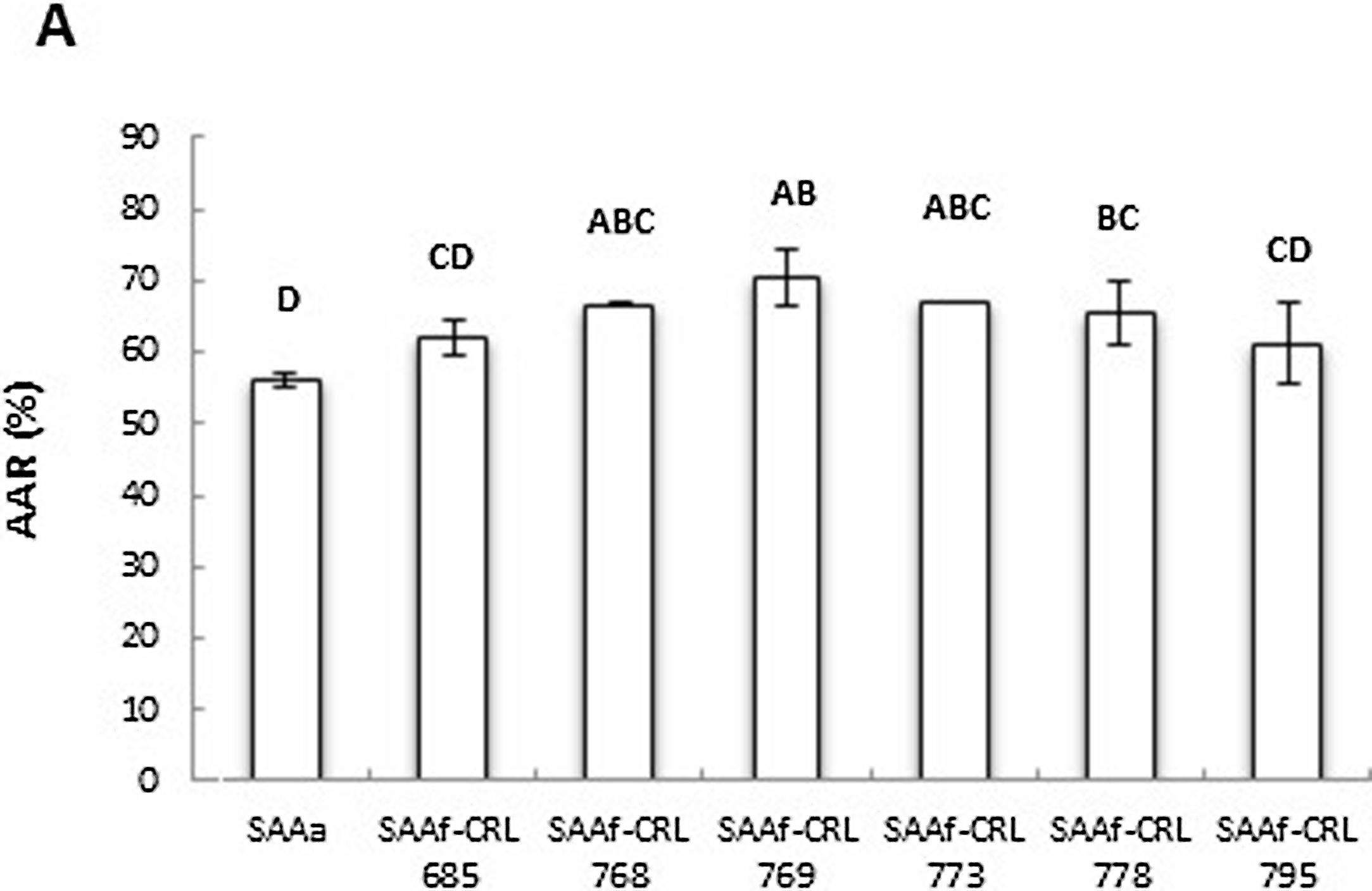
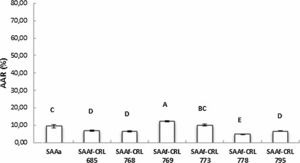
La figura 3 muestra la AAR determinada por la técnica de ABTS•+ de los extractos en agua bidestilada (péptidos/AA libres). El SAAf-CRL 769 mostró un incremento significativo (p < 0,05) de la AAR respecto del control SAAa y de los SAAf restantes, con una AAR de 12,32 ± 0,49%. Sin embargo, en la mayor parte de los extractos obtenidos de los SAAf se observó una disminución de la AAR con respecto al control.
No se detectó actividad en ninguno de los extractos acuosos analizados con la técnica de DPPH•.
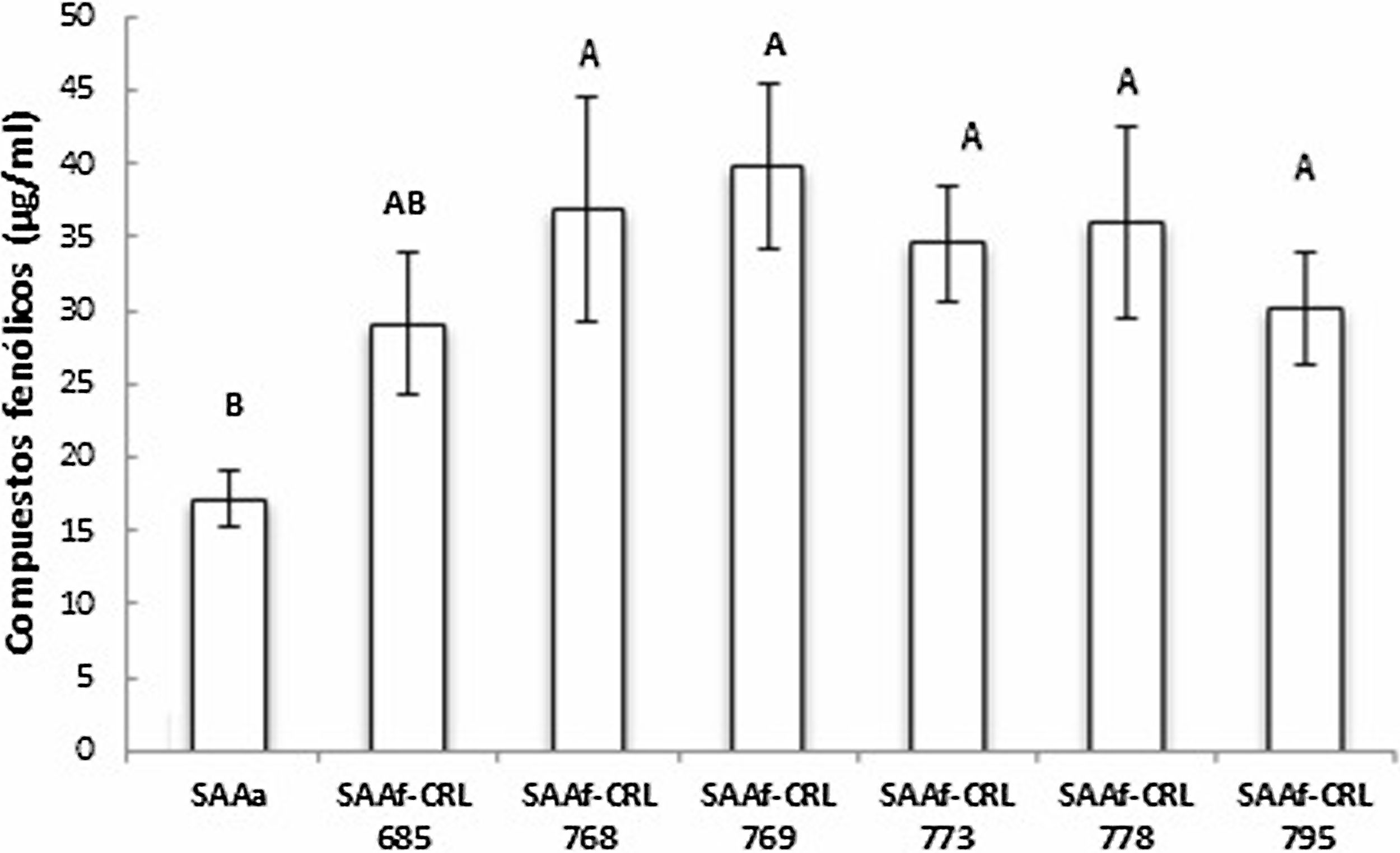
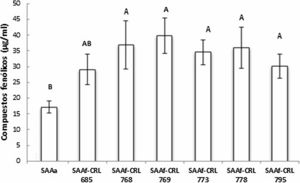
Cuantificación y actividad antioxidante de compuestos fenólicos en SAA fermentados por BLLa figura 4 muestra la concentración de compuestos fenólicos totales (CFT) de los extractos metanólicos de los SAAf de las seis cepas seleccionadas. En todas las muestras, la fermentación con las BL permitió aumentar el contenido de CFT con respecto al control SAAa (17,1 ± 1,9 μg EAG/ml). El valor de CFT en los SAAf se encontró entre 29,1-36,9 μg EAG/ml, sin observarse diferencias significativas (p > 0,05) entre las distintas muestras.
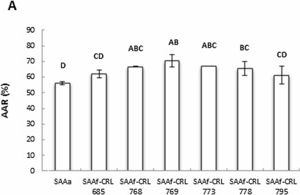
La figura 5 muestra la AAR determinada en los extractos orgánicos de los distintos SAAf y del sistema control SAAa, empleando la técnica de ABTS•+ (A) y DPPH• (B). Se observó un aumento significativo de la AAR de los sistemas fermentados con respecto al SAAa, excepto en los SAAf-CRL 685 y CRL 795 (fig. 5A).
Los SAAf-CRL 768, CRL 769, CRL 778 y CRL 795 no evidenciaron un aumento significativo de la AAR con respecto al SAAa mediante la técnica DPPH•. Con esta técnica, se detectó un aumento (35,82 ± 3,55%) de la AAR solo en el SAAf-CRL 685.
La AAR de los extractos metanólicos fue menor mediante la técnica de DPPH• (14,95-35,82%) que con la técnica de ABTS•+ (56,07-74,49%) (figs. 5A y 5B).
DiscusiónEl uso de harina de avena coloidal como un agente calmante para aliviar el picor y la irritación en diversas dermatitis es una alternativa natural. En la bibliografía, no se reporta el uso de harina de avena coloidal modificada tecnológicamente, aun cuando es sabido que los componentes relacionados con la actividad antiinflamatoria se encuentran en baja concentración en su forma activa. En este trabajo se estudió la fermentación láctica como una bioestrategia para potenciar los compuestos bioactivos de esta preparación dermatológica.
En general, el crecimiento de las cepas de BL en el SAA fue variable y dependiente de la cepa. Resultados similares se encontraron en estudios sobre la adaptabilidad de cepas de Lactobacillus spp. a bebidas a base de avena y de avena germinada y malteada2,15,16,22,25,31,37,50. La variabilidad en el crecimiento y la acidificación observada en nuestro estudio puede deberse a diversas causas. Un factor determinante en el crecimiento de BL es el contenido de aminoácidos en el sustrato. Mientras que algunas especies de BL requieren hasta 15 AA libres, otras, como Lactobacillus plantarum, requieren solo cuatro40. Esto podría explicar el mayor crecimiento de las cepas pertenecientes a L. plantarum. Además, la capacidad de las BL para crecer en vegetales puede depender también de su actividad amilolítica48, a pesar de que esta actividad es bastante limitada en este grupo de bacterias32.
El crecimiento bacteriano observado en los SAAf fue acompañado por un descenso de los valores de pH (hasta aproximadamente 4,0). También otros autores informaron descensos de pH en bebidas a base de avena, utilizando como inóculo cepas de L. plantarum. Angelov et al.1 lograron una rápida fermentación a las 6-8 h y documentaron un pH de 4,0-4,5, al inocular L. plantarum en una bebida formulada con harina de avena (5,5% p/v) y sacarosa (1,5% p/v). Luana et al.23 desarrollaron una bebida de avena probiótica utilizando L. plantarum e informaron un pH de 4,20 ± 0,03 luego de 12 h de fermentación a 30°C.
En este trabajo, las cepas de L. plantarum mostraron una buena adaptabilidad al SAA, con valores de DT bajos y de VMCC y PCC altos. L. plantarum es una especie que se caracteriza por su tolerancia a la acidez7 y por su gran habilidad para utilizar diferentes sustratos27, lo que le otorga una ventaja competitiva frente a otros microorganismos autóctonos presentes en cereales30,38.
En cereales con bajo contenido de proteínas, como la avena, el nitrógeno es un factor limitante para el crecimiento de las BL. El desarrollo de las BL dependerá de su capacidad para degradar las proteínas y obtener los aminoácidos necesarios. La cantidad de péptidos/AA libres determinada al final de la fermentación corresponde al balance entre lo consumido y lo liberado por las BL. En el SAAf-CRL 778 se encontró la menor concentración de péptidos/AA libres (0,42 ± 0,07 μmol/ml). Esto puede explicarse por el hecho de que fue ésta una de las cepas con mayor crecimiento (0,91 ± 0,18 Δlog UFC/ml) luego de 24 h de fermentación, por lo que es probable que haya consumido rápidamente los aminoácidos biodisponibles en el SAA. Contrariamente, la cepa CRL 773 tuvo un crecimiento menor en comparación con las demás cepas seleccionadas, lo cual podría deberse a sus mayores exigencias nutricionales. Pescuma et al.29 reportaron que las cepas de Lactobacillus tienen un requerimiento nutricional complejo, por lo que la baja concentración de aminoácidos libres en la avena puede afectar su desarrollo/crecimiento en este sustrato.
En ninguno de los SAAf estudiados en este trabajo se observó un incremento significativo del contenido de peptidos/AA libres. Contrariamente, otros autores reportaron que la fermentación de harina integral de avena con L. plantarum TK9 y Bifidobacterium animalis V9 incrementó el contenido de péptidos con pesos moleculares ≤ 6.000 Da50. Por otro lado, Coda et al.9 determinaron un aumento de la concentración de péptidos/AA libres en harina de avena fermentada por un pool de diez cepas de BL.
En este trabajo, se evidenció un aumento de la AAR en los extractos acuosos de SAAf-CRL 769 con respecto al control SAAa. Este resultado podría relacionarse con la liberación de péptidos activos. Cavazos et al.6 realizaron una predicción de los péptidos bioactivos que podrían ser obtenidos por hidrólisis de las proteínas de avena y otros cereales y encontraron que tanto globulinas como aveninas contienen secuencias de péptidos antioxidantes previamente reportados. Además, Reynertson et al.34 evidenciaron efectos antiinflamatorios de extractos acuosos obtenidos de avena coloidal en una línea celular de queratinocitos humanos.
Con respecto a la concentración de CF, se observó un incremento (70-133%) en los SAAf-CRL 685, CRL 768, CRL 769, CRL 773, CRL 778 y CRL 795 con respecto al SAAa. Si bien existen pocos estudios que detallen el efecto de BL sobre los CF de la avena, se ha reportado que estas bacterias son capaces de modificar los CF presentes en diversas matrices vegetales10,20. Por otra parte, los resultados obtenidos en el presente trabajo coinciden con lo descripto por Hole et al.18, quienes demostraron que la avena sometida al proceso de fermentación microbiana por diversas BL probióticas (L. acidophilus, L. johnsonii, L. reuteri) modifica su perfil de CF y mejora la biodisponibilidad de estos compuestos. En ese caso, los autores atribuyeron este efecto a la liberación de ácidos fenólicos a consecuencia de la alta actividad de feruloil esterasas bacterianas, las cuales contribuirían a aumentar (en un 20%) su concentración en la avena. Por otra parte, Luana et al.23 reportaron que la fermentación láctica en un yogurt probiótico de avena utilizando L. plantarum aumentó la biodisponibilidad de polifenoles en un 25% e incrementó notablemente su capacidad antioxidante (70%). A diferencia de Hole et al.18, Luana et al.23 atribuyen el aumento de la concentración de CF a la acción combinada de diversas enzimas endógenas (xilanasas, endoglucanasas, esterasas del ácido ferúlico, β-glucanasas y amilasa), las cuales promueven una disminución del pH, lo que aumentaría la concentración de las fracciones libres de CF.
Numerosos trabajos señalan una relación directa entre CFT y AAR. En este estudio no se observó una relación directa. Todos los extractos metanólicos de SAAf mostraron similares concentraciones de CFT, pero diferentes AAR. Se han propuesto varios argumentos para justificar la relación poco clara entre la actividad antioxidante y el CFT28: 1) el contenido fenólico total determinado por el método Folin-Ciocalteu no incluye todos los antioxidantes, como tocoferoles presentes en la avena; 2) la contribución de los CF a la AAR depende del tipo de compuesto y su concentración en la muestra19,28; 3) en una muestra dada, existe una sinergia entre antioxidantes por interacciones entre ellos11,44. Por esta razón, muestras con concentraciones similares de CFT pueden variar notablemente en su actividad antioxidante.
Por otro lado, se observaron diferencias entre los resultados de los ensayos DPPH• y ABTS•+. Mediante el ensayo ABTS•+ se obtuvieron porcentajes de AAR más altos que por medio del ensayo DPPH•. Este resultado puede ser explicado por la baja selectividad del ABTS•+, que reacciona con cualquier compuesto aromático hidroxilado, independientemente de su potencial antioxidante real36. Contrariamente, la reacción del DPPH• con los antioxidantes está directamente relacionada con su conformación estructural, es decir, un antioxidante pequeño con mayor acceso al radical mostrará mejor actividad antioxidante, teniendo presente que el DPPH• está impedido estéricamente3. Además, el DPPH• no reacciona con los flavonoides carentes de grupos hidroxilo en el anillo B, ni con ácidos aromáticos que contengan un solo grupo hidroxilo4,36. Por lo tanto, se debe tener en cuenta que el DPPH• es más selectivo que el ABTS•+. Estas diferencias entre los dos ensayos de depuración de radicales libres podrían explicarse también sabiendo que el ABTS•+ puede ser disuelto en un medio orgánico u acuoso, y en ambos puede medirse su actividad antioxidante según la naturaleza hidrofílica o lipofílica de los compuestos presentes en la muestra45. Sin embargo, el DPPH• solo puede medirse en un medio orgánico, lo cual limita la determinación de la capacidad antioxidante de los compuestos hidrofílicos41,42. Esto explicaría que la actividad AAR de los extractos acuosos solo pudo cuantificarse en el ensayo de ABTS•+.
ConclusionesEn este trabajo se evaluó la capacidad de 31 cepas de BL para adaptarse a SAA; los géneros Lactobacillus plantarum y Pediococcus pentosaceus fueron los que mostraron mejores resultados. La fermentación por estas cepas modificó la composición química del SAA, principalmente generó cambios en el contenido de compuestos fenólicos totales y, en menor medida, el de péptidos y AA libres. Estas modificaciones dependieron de la cepa de BL. El contenido de CF en los extractos metanólicos de los SAAf por las seis cepas seleccionadas fue mayor que en los SAAa. Este aumento del contenido de CF podría explicar la mayor actividad antioxidante encontrada en los extractos empleando los métodos de DPPH• y ABTS•+. También se observaron modificaciones de menor magnitud en el contenido de péptidos y AA en los SAA luego de la fermentación, así como también en su actividad antioxidante. De todos modos, es necesario complementar estos estudios con otras técnicas para confirmar la actividad antioxidante de los extractos obtenidos y optimizar los parámetros de fermentación para obtener mejores resultados.
Autoría y colaboraciónJ.A.C.T. y Y.L. tuvieron una misma contribución para la elaboración de este trabajo.
FinanciamientoEl presente trabajo ha sido financiado por el Consejo Nacional de Investigaciones Científicas y Técnicas (proyecto PIP N° 384 - CONICET) y por la Agencia Nacional de Promoción Científica y Tecnológica (proyecto PICT 2017 N° 786 - ANPCyT).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.