El empiema necessitatis (EN) constituye una muy rara complicación de un empiema pleural en el cual la infección se extiende a los tejidos blandos adyacentes. La etiología por anaerobios es muy infrecuente y se da en el curso de infecciones crónicas. Se presenta el primer caso de empiema necessitatis por Campylobacter rectus. La identificación de este agente se efectuó por espectrometría de masas (MALDI-TOF MS) y su sensibilidad antimicrobiana se determinó por el método epsilométrico.
Empyema necessitatis (EN) is a very rare complication of a pleural empyema, in which the infection extends to adjacent soft tissues. Anaerobic bacteria are very rare etiologic agents of EN, which occurs in the course of chronic infections. We present the first case of empyema necessitatis caused by Campylobacter rectus. Bacterial identification was carried out by mass spectrometry (MALDI-TOF MS) and antimicrobial susceptibility was determined by the epsilometer method.
El empiema necessitatis (EN) es una rara entidad en nuestros días en la que la infección de la cavidad pleural se extiende a los tejidos blandos contiguos de la cavidad torácica, usualmente en el marco de una infección respiratoria. A menudo es un proceso de evolución crónica y se produce, con mayor frecuencia, a través de la zona menos resistente que se encuentra entre el segundo y el sexto espacio intercostal, y entre la línea medioclavicular y la línea axilar anterior7. Por ser un empiema inespecífico, se requiere diagnóstico diferencial de las enfermedades con capacidad de fistulizar la pared torácica, como la tuberculosis, la actinomicosis, las infecciones micóticas y las neoplasias16. Puede cursar asintomático, pero también puede presentarse como dolor torácico de tipo pleurítico asociado a tos no productiva. Más comúnmente, se evidencia como una masa en la pared torácica, que puede ser dolorosa y fluctuante11. El diagnóstico requiere la demostración de continuidad entre el proceso pleuropulmonar y la masa de la pared torácica, lo cual se logra mediante las imágenes obtenidas por tomografía axial computarizada (TAC)11.
Campylobacter rectus es un bacilo gram negativo corto de formas curvas que requiere condiciones anaeróbicas para su aislamiento primario y su crecimiento9. Se ha descripto en pocas oportunidades como agente etiológico de abscesos orales e infecciones invasivas extraorales, principalmente en pacientes con pobre higiene oral13,14,16.
Presentamos el primer reporte de un caso de empiema necessitatis por Campylobacter rectus.
Caso clínicoPaciente varón de 48años que consultó por lesiones eritematosas y dolorosas en la cara anterior del hemitórax derecho, de 15días de evolución. El paciente refirió disnea, astenia y un descenso de peso de 6kg en los últimos 3meses. Al examen físico, presentaba 3lesiones eritematosas, fluctuantes y dolorosas, con enfisema subcutáneo, compatibles con abscesos. Como antecedente se destacaba el consumo excesivo de alcohol. En la exploración de la cavidad oral se observó ausencia de numerosas piezas dentarias. El paciente brindó su consentimiento informado en este estudio. Todos los procedimientos llevados a cabo en este trabajo cumplen los estándares éticos del Hospital de Clínicas José de San Martín.
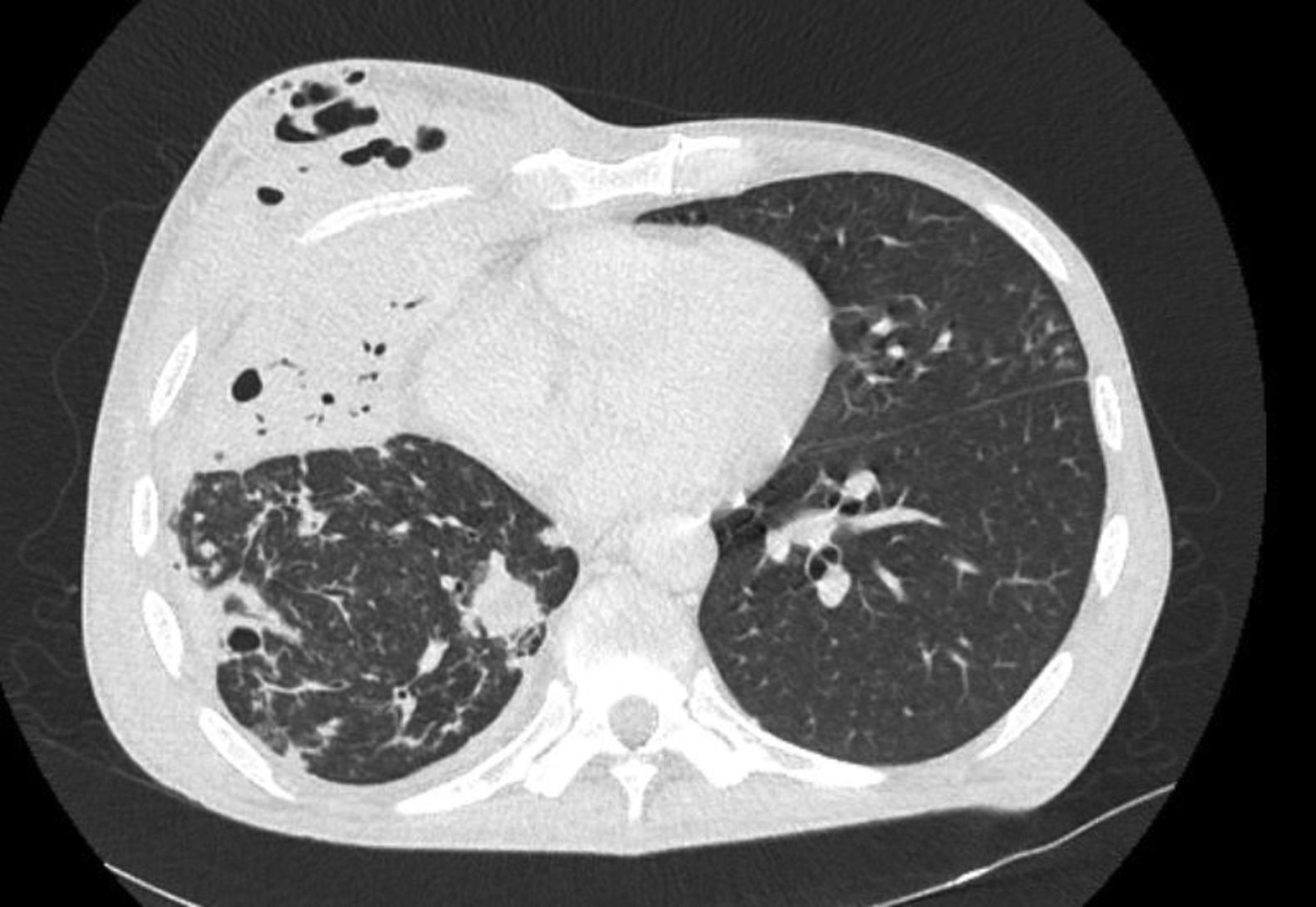
Se realizó TAC de tórax con contraste endovenoso. En el lóbulo medio del pulmón se observó consolidación con broncograma aéreo que aparentó retraer el parénquima adyacente, en el que se observaron múltiples imágenes cavitadas con paredes engrosadas, y un derrame pleural de escaso volumen. En la región pectoral derecha se observó una imagen heterogénea de densidad mixta y bordes irregulares, con burbujas aéreas en su interior, compatible con absceso en comunicación directa con la pleura subyacente y la condensación, configurando un cuadro imagenológico de EN (fig. 1).
Ante estos hallazgos, se tomaron dos muestras de la colección pectoral derecha y dos hemocultivos en botellas aerobia y anaerobia (BD BACTEC™ 9000, Becton Dickinson) y se enviaron al laboratorio de microbiología. El paciente inició tratamiento empírico con piperacilina-tazobactam y vancomicina.
En el laboratorio, la muestra de colección pectoral fue sembrada en agar sangre y agar chocolate en atmósfera con 5% de CO2 a 37°C para la búsqueda de bacterias aerobias y en agar sangre Brucella y agar sangre Brucella con agregado de antibióticos (amikacina y vancomicina), en atmósfera anaerobia, para la búsqueda de bacterias anaerobias. La coloración de Gram del material purulento (utilizando fucsina como contracolor) mostró abundante cantidad de polimorfonucleares y de bacilos gram negativos fusiformes, así como de cocobacilos cortos curvos. Para la investigación de micobacterias se utilizó el método convencional en medios sólidos (Lowenstein Jensen y Stonebrink, con y sin descontaminación) y en medio líquido MGIT (BD BACTEC™ MGIT™ 960, Becton Dickinson). Las coloraciones de Kinyoun y de Ziehl-Neelsen no mostraron bacilos ácido-resistentes ni ácido-alcohol-resistentes, respectivamente.
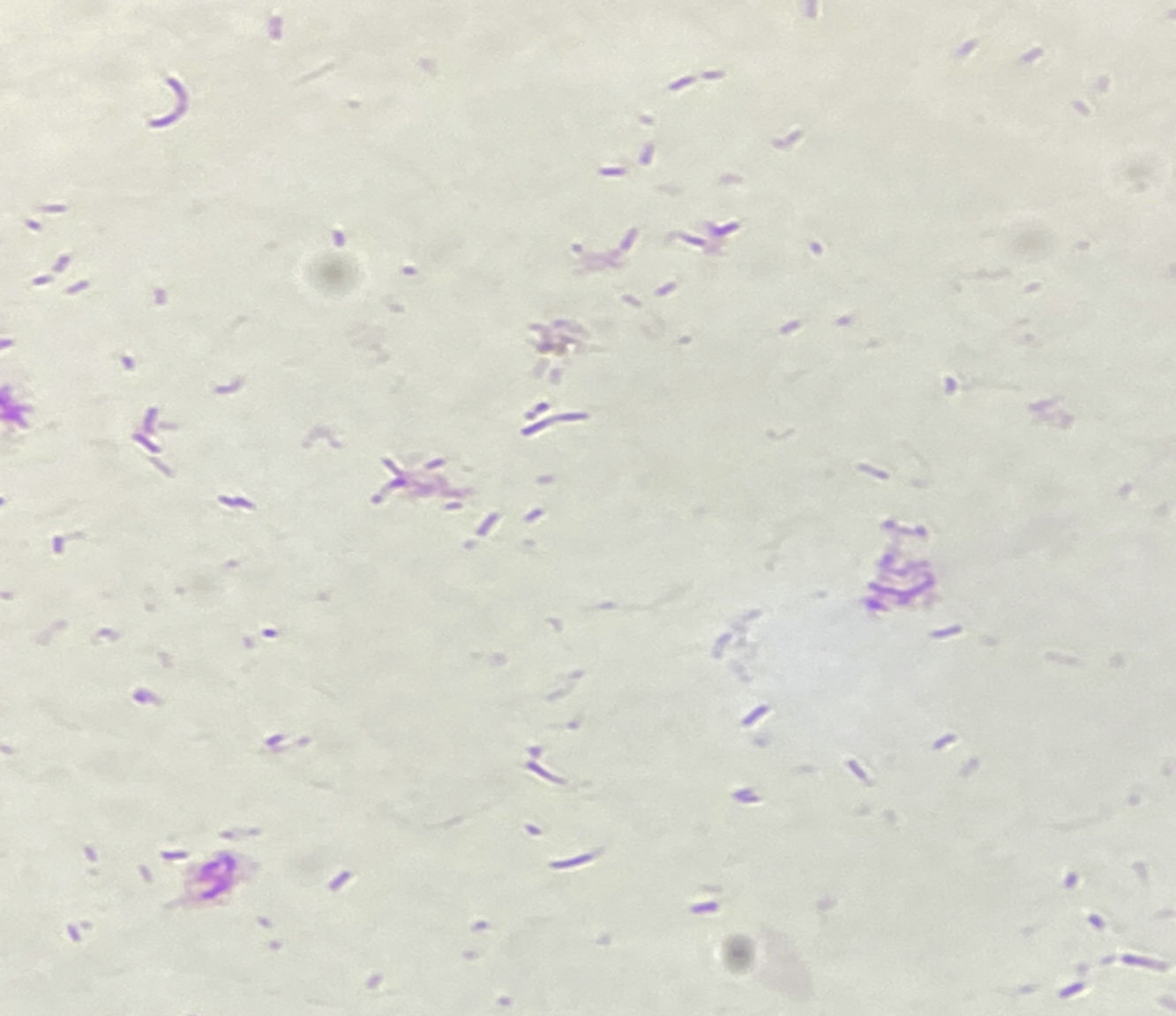
A las 48-72horas de incubación no se obtuvo desarrollo en los medios sólidos en aerobiosis; sin embargo, en los medios incubados en anaerobiosis se observaron dos tipos de colonias: unas pequeñas, brillantes, no hemolíticas (coloración de Gram: cocobacilos negativos curvos) (fig. 2) y otras blanquecinas, de mayor tamaño (coloración de Gram: bacilos gram negativos fusiformes). En el primer caso, la identificación realizada por espectrometría de masas MALDI-TOF MS (BD Bruker MALDI Biotyper™) correspondió a Campylobacter rectus en ambas muestras (score>2,0: identificación confiable a nivel de especie). En el segundo caso, las colonias más blanquecinas fueron identificadas como una dupla Fusobacteriumvarium/nucleatum (score>2,0), dado que ambas especies poseen espectros de masas con patrones muy similares y, por lo tanto, no es posible distinguirlas. El cultivo de la colección pectoral mostró un desarrollo predominante de la especie de Campylobacter, acompañado por Fusobacterium spp.
Se rotó el esquema antibiótico a imipenem 500mg cada 6horas endovenoso durante 20días. El cultivo de Nocardia y micobacterias, convencional y MGIT, resultó negativo a los 60 y los 42días de incubación, respectivamente. Asimismo, los hemocultivos resultaron negativos a los 5días de incubación.
Las pruebas de sensibilidad antibiótica se realizaron utilizando el método epsilométrico ETEST® (bioMérieux, Marcy-l’Etoile, Francia) en condiciones de anaerobiosis15. Los valores de CIM (μg/ml) para Campylobacter rectus fueron los siguientes: amoxicilina-clavulánico: 0,004; ceftriaxona: 0,16; imipenem: 0,002; ciprofloxacino: 0,002, y metronidazol: 0,16. Para el aislamiento de F.varium/nucleatum los valores de CIM (μg/ml) fueron los siguientes: amoxicilina-clavulánico: 0,016; metronidazol: 0,125. No se detectó producción de beta lactamasa por la técnica de nitrocefín en ninguno de los aislamientos.
El paciente permaneció internado por 4semanas, con evolución favorable del cuadro clínico y de su estado general. La herida fue tratada mediante sistema VAC (terapia de cierre asistido por vacío). El tratamiento antibiótico endovenoso se rotó a amoxicilina-clavulánico y metronidazol hasta completar 7días, con buena evolución clínica.
En relación con el diagnóstico diferencial, si bien la mayoría de los casos de EN reportados corresponden a Mycobacterium tuberculosis7, en nuestro caso tanto la coloración de Ziehl-Neelsen como los cultivos negativos descartaron este agente etiológico. En los procesos crónicos también se incluye la etiología por especies de Nocardia spp. y Actinomyces spp.18. Sin embargo, ambos fueron excluidos porque no se observaron bacilos gram positivos en la coloración de Gram y la coloración de Kinyoun fue negativa, sumado a la ausencia de desarrollo en el cultivo luego de una incubación prolongada. La observación de bacilos gram negativos finos y cortos curvos en la coloración de Gram de la colección permitió sospechar la etiología por bacterias anaerobias. Campylobacter spp. no se tiñe bien con contracolorantes como la safranina y la tinción de Gram es, sin duda, el primer paso en la identificación.
Campylobacter es un género de bacterias perteneciente a la familia Campylobacteraceae. Las especies de este género pueden clasificarse en dos grupos, de acuerdo al hospedero: especies zoonóticas y especies humanas orales. Las especies zoonóticas más importantes, como Campylobacter jejuni y Campylobacter coli, residen en el intestino de aves, ganado vacuno, ovino, porcino y de mascotas domésticas y pueden ser transmitidas a los seres humanos a través del consumo de alimentos contaminados; esto causa, principalmente, gastroenteritis. Otras especies, como Campylobacter fetus, están relacionadas con infecciones graves, como sepsis9. Campylobacter concisus, Campylobacter showae, Campylobactergracilis, Campylobacter ureolyticus, Campylobacter curvus y Campylobacter rectus son reconocidas como especies de reservorio humano que habitan la cavidad oral, con potencial para producir enfermedad periodontal12. Recientemente estas especies de Campylobacter orales se han relacionado en enfermedad entérica, pero se desconoce el mecanismo patogénico9.
En nuestro caso, el paciente presentaba dos factores de riesgo: la ausencia de piezas dentales, que hace suponer una mala higiene dental previa, y el consumo de alcohol en exceso. Las infecciones periodontales pueden tener un rol importante en la diseminación sistémica de estos microorganismos8. Otros factores predisponentes de la infección invasiva son el alcoholismo, la neutropenia posquimioterapia y la diabetes mellitus.
Hasta el momento, existen cuatro casos publicados de empiema pleural por C.rectus4,8,16,17, pero ninguno como EN. En los últimos años se han comunicado varios casos de infecciones extraorales y extrapulmonares por C.rectus: absceso mamario3, absceso vertebral2, aneurisma micótico cerebral8, infección necrotizante de piel y partes blandas en el muslo8 y otitis media aguda6. La mayoría fueron infecciones polimicrobianas. Por otro lado, F.varium/nucleatum también forma parte de la microbiota oral humana, y se han reportado dos casos de EN por este microorganismo1,5.
A pesar de no haberse obtenido una muestra directa del árbol respiratorio, creemos que la continuidad entre la condensación pulmonar y las colecciones subcutáneas, sumada a la respuesta favorable al tratamiento antibiótico, habilitan a sostener la unicidad etiológica del proceso.
El tiempo de evolución prolongado favorecería el pasaje de la infección desde el espacio pleural hasta el compartimento subcutáneo.
Existe escasa información sobre los agentes antimicrobianos que podrían utilizarse para el tratamiento de infecciones graves por Campylobacter spp., aunque se han publicado resultados exitosos en cepas resistentes, especialmente con carbapenems10. Estos datos publicados corresponden a las especies zoonóticas como C.jejuni o C.fetus, que suelen mostrar resistencia a penicilinas o cefalosporinas y, por lo tanto, se recomienda tratamiento con imipenem. La elección de este antibiótico en primera instancia estuvo basada en esta información. No obstante, las especies de la cavidad oral presentan sensibilidad a los antibióticos beta-lactámicos como penicilina, ampicilina-sulbactam y piperacilina-tazobactam, y no a beta-lactámicos como clindamicina y metronidazol13. Asimismo, los datos de sensibilidad antibiótica de C.rectus muestran que es altamente sensible a la mayoría de los antibióticos utilizados en el tratamiento de infecciones por anaerobios16. El cambio del esquema antibiótico por amoxicilina-clavulánico se realizó a partir del resultado del antibiograma.
ConclusiónSe presenta un caso infrecuente de empiema necessitatis por C.rectus en asociación con Fusobacterium. La incorporación de técnicas proteómicas, como la espectrometría de masas aplicada a la identificación de microorganismos, permitió acortar sustancialmente el tiempo para la identificación a nivel de especie y conocer agentes etiológicos menos frecuentes de esta patología.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoTodos los procedimientos llevados a cabo en este trabajo cumplen los estándares éticos del Hospital de Clínicas José de San Martín y la declaración de Helsinki de 1964 y demás enmiendas. El paciente brindó su consentimiento informado en este estudio.
FinanciaciónEl presente trabajo ha sido financiado con fondos del Proyecto UBACYT 2018 Modalidad I: Código 20020170100109BA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.