La bacteria esporulada gram positiva Paenibacillus larvae es el agente causal de la loque americana de las abejas. El objetivo de este trabajo fue comparar las CIM de tetraciclina obtenidas por el método Etest y las obtenidas por el método de dilución en agar frente a 22 cepas del patógeno, empleando dos medios de cultivo: Iso-Sensitest y MYPGP. Se encontró una concordancia de categoría entre dichos métodos del 100 % usando agar Iso-Sensitest, mientras que con MYPGP la concordancia de categoría fue del 86,36 % (con 3 errores menores). Los resultados de este estudio sugieren que la combinación de las tiras de Etest con agar Iso-Sensitest sería una alternativa rápida y confiable para determinar las CIM de tetraciclina en P. larvae; sin embargo, estos resultados deberán confirmarse en futuros estudios que contemplen un mayor número de aislamientos.
American foulbrood (AFB) is a bacterial disease caused by the spore-forming, grampositive bacterium Paenibacillus larvae, which affects honeybee broods worldwide. The aim of this work was to compare the Epsilometer test (Etest) to the agar dilution method for testing a collection of 22 P. larvae strains to tetracycline by using MYPGP and Iso- Sensitest agars. Results showed that a categorical agreement of 100% was found when using Iso-Sensitest, while a categorical agreement of 86.36% was found (with 3 minor errors) when MYPGP was tested. In conclusion, the Etest could be a rapid and reliable method for testing MIC values of tetracycline in P. larvae only when used in combination with Iso-Sensitest agar. Nevertheless, these results should be confirmed with future studies involving a larger number of isolates.
La loque americana es la enfermedad más grave y peligrosa que afecta a las larvas y pupas de las abejas melíferas (Apis mellifera L.)11. Está difundida a nivel mundial en todos los países productores de miel y su agente causal es la bacteria esporulada gram positiva Paenibacillus larvae12. Las esporas, que constituyen la forma infectiva y de supervivencia, mantienen su capacidad patógena por largos períodos, además de ser muy resistentes al calor, los agentes químicos y la radiación UV.
En la mayoría de los países desarrollados la quema de colmenas es la única alternativa para el control de loque americana, y existen distintos métodos para recuperar el material inerte, como la esterilización por radiación gamma, la inmersión en parafina o la desinfección con óxido de etileno, soda cáustica o hipoclorito de sodio.
En países como Argentina, EE. UU. y Canadá, se emplean, entre otros, los antibióticos tetraciclina (TET) y oxitetraciclina (OTC) para el control de esta enfermedad, junto con pautas de manejo integrado del colmenar4,14. Las tetraciclinas eliminan los síntomas porque inhiben las formas vegetativas, pero no las esporas, que son las responsables de la diseminación de la enfermedad.
El empleo continuado de TET trajo como consecuencia la aparición de cepas bacterianas resistentes en poblaciones naturales del patógeno. Este antibiótico impide el crecimiento bacteriano por inhibición de la síntesis de proteínas y, hasta el presente, se han identificado tres tipos diferentes de mecanismos de resistencia a este agente en las bacterias: eflujo de tetraciclina, protección ribosómica y modificación de la molécula del antibiótico. Los dos primeros están ampliamente distribuidos en bacterias gram negativas y gram positivas, en las que los genes de resistencia correspondientes se asocian frecuentemente con elementos móviles, como plásmidos y transposones. En el caso de P. larvae se ha podido correlacionar la presencia de cierto tipo de plásmidos con alta resistencia a TET en cepas bacterianas provenientes de EE. UU.4,14.
Al no existir recomendaciones del CLSI para la determinación de las CIM de TET para P. larvae, en estudios previos se propuso como técnica de referencia para esta especie el método de dilución en agar utilizando caldo Muller-Hinton adicionado con extracto de levadura, K2HPO4, glucosa, piruvato de sodio y agar (conocido como MYPGP) como medio basal10, y se establecieron los puntos de corte entre cepas sensibles (S) y resistentes (R), considerando a la cepa S cuando el valor de CIM era < 4μg/ml, I con CIM entre 4 y 8μg/ml y R frente a CIM≥16μg/ml4,9.
El Etest (Epsilometer-test) es una técnica cuantitativa para la determinación de la concentración inhibitoria mínima (CIM) de antibióticos y antifúngicos mediante un gradiente de concentración del antimicrobiano sobre una tira. Es una alternativa sencilla y rápida a las determinaciones convencionales de CIM. El método está calibrado para cumplimentar con los requerimientos de los métodos de referencia del CLSI7,8. No obstante, para ciertas combinaciones de especies bacterianas y antibióticos, se han obtenido resultados controvertidos en relación con la técnica de referencia5,13, Asimismo, no existen comunicaciones acerca de su confiabilidad con respecto a su uso para evaluar la sensibilidad de aislamientos de P. larvae o de otras bacterias patógenas de abejas.
El objetivo de este trabajo ha sido evaluar el desempeño diagnóstico del Etest comparándolo con el método de dilución en agar para la determinación cuantitativa de la sensibilidad/ resistencia de P. larvae hacia tetraciclina, y correlacionar las CIM obtenidas por ambos métodos comparando dos medios de cultivo aptos para el desarrollo de P. larvae, MYPGP e Iso-Sensitest agar (Oxoid Ltd., Basingstoke, Hampshire, Inglaterra).
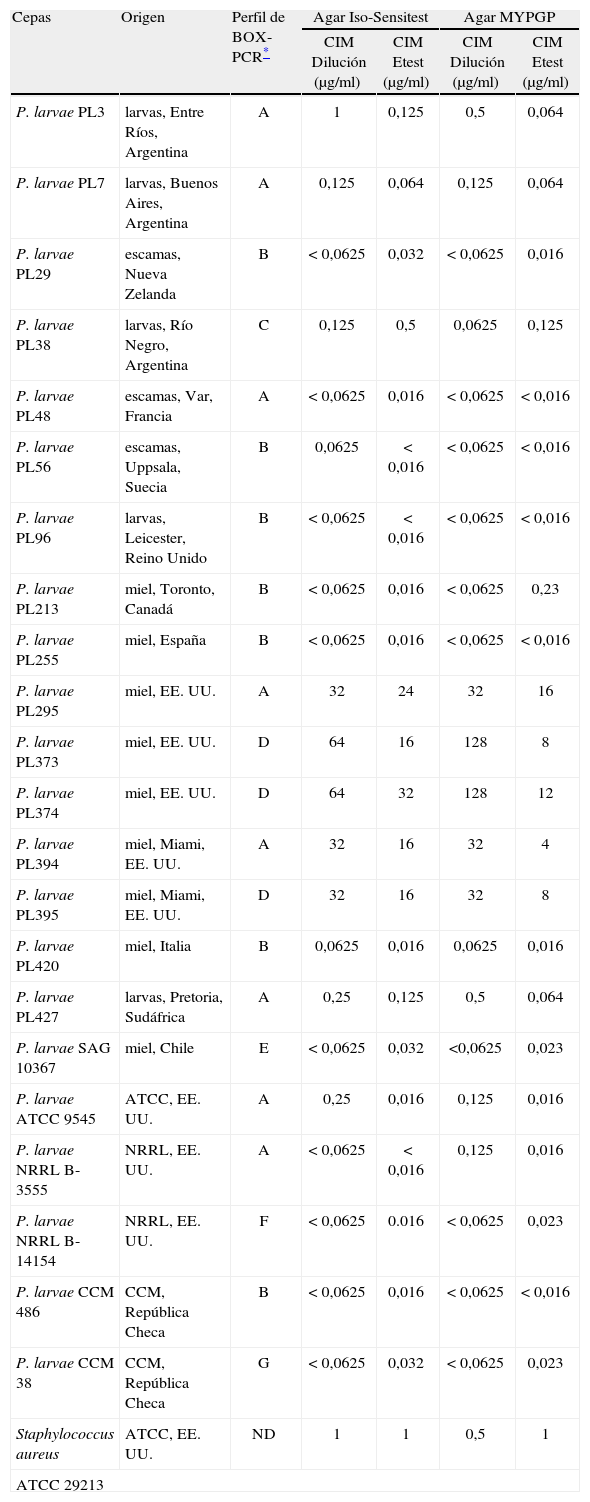
Se probaron 16 cepas de P. larvae provenientes de distintos orígenes geográficos; estas presentaban distinta sensibilidad a TET y distintos perfiles de amplificación obtenidos por rep-PCR empleando cebadores BOX3,9. Se seleccionaron los cebadores BOX porque permiten diferenciar un mayor número de genotipos dentro de las poblaciones de P. larvae; hasta el presente se han encontrado 7 perfiles BOXA1R a nivel mundial, denominados A, B, C, D, E, F y G3,9 (Alippi AM y López AC, resultados no publicados). Adicionalmente, se emplearon 5 cepas de P. larvae (ATCC 9545, NRRL B-3555, NRRL B-14154, CCM486, CCM 38) y la cepa de Staphylococcus aureus ATCC 29213 como controles de referencia y calidad, respectivamente (tabla). Las cepas empleadas (que habían sido aisladas por métodos previamente descritos1,2,3,9 de muestras de larvas infectadas por loque americana o de mieles que contenían esporas del patógeno) se obtuvieron de la Colección bacteriana de la UB-CIDEFI (Unidad de Bacteriología, Centro de Investigaciones de Fitopatología, Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata, Argentina).
Comparación de las CIM de tetraciclina frente a cepas de Paenibacillus larvae, determinadas por las técnicas de dilución en agar y Etest.
| Cepas | Origen | Perfil de BOX-PCR* | Agar Iso-Sensitest | Agar MYPGP | ||
| CIM Dilución (μg/ml) | CIM Etest (μg/ml) | CIM Dilución (μg/ml) | CIM Etest (μg/ml) | |||
| P. larvae PL3 | larvas, Entre Ríos, Argentina | A | 1 | 0,125 | 0,5 | 0,064 |
| P. larvae PL7 | larvas, Buenos Aires, Argentina | A | 0,125 | 0,064 | 0,125 | 0,064 |
| P. larvae PL29 | escamas, Nueva Zelanda | B | < 0,0625 | 0,032 | < 0,0625 | 0,016 |
| P. larvae PL38 | larvas, Río Negro, Argentina | C | 0,125 | 0,5 | 0,0625 | 0,125 |
| P. larvae PL48 | escamas, Var, Francia | A | < 0,0625 | 0,016 | < 0,0625 | < 0,016 |
| P. larvae PL56 | escamas, Uppsala, Suecia | B | 0,0625 | < 0,016 | < 0,0625 | < 0,016 |
| P. larvae PL96 | larvas, Leicester, Reino Unido | B | < 0,0625 | < 0,016 | < 0,0625 | < 0,016 |
| P. larvae PL213 | miel, Toronto, Canadá | B | < 0,0625 | 0,016 | < 0,0625 | 0,23 |
| P. larvae PL255 | miel, España | B | < 0,0625 | 0,016 | < 0,0625 | < 0,016 |
| P. larvae PL295 | miel, EE. UU. | A | 32 | 24 | 32 | 16 |
| P. larvae PL373 | miel, EE. UU. | D | 64 | 16 | 128 | 8 |
| P. larvae PL374 | miel, EE. UU. | D | 64 | 32 | 128 | 12 |
| P. larvae PL394 | miel, Miami, EE. UU. | A | 32 | 16 | 32 | 4 |
| P. larvae PL395 | miel, Miami, EE. UU. | D | 32 | 16 | 32 | 8 |
| P. larvae PL420 | miel, Italia | B | 0,0625 | 0,016 | 0,0625 | 0,016 |
| P. larvae PL427 | larvas, Pretoria, Sudáfrica | A | 0,25 | 0,125 | 0,5 | 0,064 |
| P. larvae SAG 10367 | miel, Chile | E | < 0,0625 | 0,032 | <0,0625 | 0,023 |
| P. larvae ATCC 9545 | ATCC, EE. UU. | A | 0,25 | 0,016 | 0,125 | 0,016 |
| P. larvae NRRL B-3555 | NRRL, EE. UU. | A | < 0,0625 | < 0,016 | 0,125 | 0,016 |
| P. larvae NRRL B-14154 | NRRL, EE. UU. | F | < 0,0625 | 0.016 | < 0,0625 | 0,023 |
| P. larvae CCM 486 | CCM, República Checa | B | < 0,0625 | 0,016 | < 0,0625 | < 0,016 |
| P. larvae CCM 38 | CCM, República Checa | G | < 0,0625 | 0,032 | < 0,0625 | 0,023 |
| Staphylococcus aureus | ATCC, EE. UU. | ND | 1 | 1 | 0,5 | 1 |
| ATCC 29213 | ||||||
Para determinar las CIM mediante el método de dilución en agar se emplearon como medios basales agar MYPGP10 y agar Iso-Sensitest, dado que P. larvae no desarrolla o lo hace muy pobremente en agar Muller-Hinton (MH)9, que es el medio recomendado por el CLSI para las pruebas de sensibilidad a tetraciclina7,8. Para la preparación del agar MYPGP se empleó caldo Muller-Hinton (Britania, Argentina), agar (Oxoid, Basingstoke, Hampshire, Inglaterra) y K2HPO4, glucosa y piruvato de sodio (Merck, Darmstadt, Alemania).
Los medios de cultivo previamente esterilizados fueron mantenidos a 45°C hasta la incorporación de las soluciones de tetraciclina (Sigma-Aldrich, Chemie, Steinheim, Alemania) para obtener el siguiente gradiente de concentraciones crecientes en las placas: 0,0625; 0,125; 0,25; 0,5; 1; 2; 4; 8; 16; 32; 64 y 128μg/ml. Como controles se emplearon ambos medios de cultivo sin el agregado de TET. La preparación del inóculo bacteriano se efectuó a partir de cultivos de P. larvae de 24–48h de incubación en MYPGP a 36±1°C como suspensiones en agua destilada estéril, ajustadas a una concentración 1 de la escala Mc Farland (A620nm=0,4), y se sembraron según los criterios definidos oportunamente para P. larvae4,9. Antes de efectuar las suspensiones, se verificó que todas las cepas presentaran un porcentaje superior al 95 % de células vegetativas mediante conteos con microscopio con contraste de fase (Leica ICC50). Para el control de calidad (Staphylococcus aureus ATCC 29213) se siguieron las especificaciones del CLSI, pero empleando agar MYPGP o Iso-Sensitest en reemplazo de MH. En todos los casos, se efectuaron 2 repeticiones por cada cepa y por cada concentración a probar, sembrando 15 gotas de 10μl cada una por placa4. Las placas se incubaron en posición invertida a 36±1°C y las lecturas se efectuaron a las 48 h para P. larvae y a las 24 h para S. aureus ATCC 29213, tomando el valor de CIM como la menor concentración de TET que inhibió el crecimiento bacteriano visible en la placa de cultivo.
Para los ensayos empleando las tiras Etest, se siguieron las recomendaciones del fabricante (bioMèrieux S.A., Marcy l’Etoile, Francia), usando agar MYPGP o Iso-Sensitest. El inóculo bacteriano se preparó de la misma forma que la detallada para el método de dilución en agar. Las placas sembradas con P. larvae se incubaron en posición invertida a 36±1 °C durante 48 h, al cabo de las cuales se leyó el valor de CIM en el punto de intersección de la elipse de inhibición con la tira. Para el control de calidad de S. aureus ATCC 29213, la lectura se efectuó a las 24 h. Cuando se emplearon las tiras Etest, se consideró una cepa S cuando el valor de CIM fue < 4μg/ml, I para CIM entre 4-15μg/ml y R para MIC≥16μg/ml, dado que las tiras plásticas están calibradas con un gradiente predefinido de concentraciones de antibiótico con 15 diluciones dobles seriadas, dentro de un rango de 0,012μg/ml y 256g/ml.
Para el análisis de los resultados, se definió como concordancia de categoría cuando de acuerdo a los resultados obtenidos por ambos métodos, los aislamientos cayeron dentro de la misma categoría clínica (R, S o I). Para la categorización de los errores, se consideró que los valores obtenidos por Etest que llevaron a las siguientes discrepancias con respecto al método de dilución en agar, S vs. I, R vs. I, I vs. R o I vs. S, fueron errores menores. Los resultados que fueron S por Etest y R por dilución en agar fueron interpretados como errores muy mayores o de falsa sensibilidad; y los que fueron R por Etest pero S por dilución en agar se consideraron errores mayores o de falsa resistencia6.
Los valores de CIM obtenidos mediante la técnica de dilución en agar con ambos medios de cultivo solo difirieron dentro del rango de ± 1 log2 de dilución. Por ello fue posible comparar los valores de CIM determinados por Etest con los establecidos por la técnica de dilución en agar en medio Iso-Sensitest, a pesar de que este medio no es el del método de referencia.
Los valores de CIM de TET determinados por Etest y los determinados por la técnica de dilución en agar para todas las cepas ensayadas en ambos medios de cultivo se presentan en la tabla.
Mediante la técnica de dilución en agar, tanto en MYPGP como en Iso-Sensitest, se encontraron 17 cepas de P. larvae sensibles y 5 resistentes (n=22), con valores de CIM que oscilaron entre < 0,0625 y 128μg/ml al emplear MYPGP y entre < 0,0625 y 64μg/ml cuando se utilizó el Iso-Sensitest, de acuerdo con la cepa probada (tabla). Los valores de CIM obtenidos para el control de calidad S. aureus ATCC 29213 en ambos medios de cultivo y por ambos métodos (tabla) cayeron dentro del rango aceptable para la cepa control en agar MH (0,125-1μg/ml)8.
Al comparar las CIM obtenidas por Etest con las obtenidas por dilución en agar, en el caso del agar Iso-Sensitest hubo concordancia de categoría del 100 %, dado que no se encontraron errores de tipo menor, mayor o muy mayor (tabla). Se encontró la misma proporción de cepas sensibles y resistentes que por la técnica de dilución en agar, 17 S y 5 R, con valores de CIM que oscilaron entre < 0,016 y 32μg/ml de TET (tabla). Como se observa en la tabla, el medio Iso-Sensitest muestra una tendencia a presentar valores de CIM más bajos por Etest que los obtenidos por dilución en agar; esta misma tendencia ha sido observada por otros autores para distintas combinaciones de antibióticos5,13.
En el caso del agar MYPGP, al comparar las CIM obtenidas por Etest con las obtenidas por dilución en agar, la concordancia de categoría resultó del 86,36 %, dado que se hallaron 3 errores de tipo menor (correspondientes a 3 cepas que por dilución en agar resultaron R y por Etest I) (tabla). Por Etest, 17 cepas resultaron S, 2 cepas cayeron en la categoría R y 3 cepas en la categoría I con valores de CIM que oscilaron entre < 0,016 y 16μg/ml, mientras que por dilución en agar se encontraron 5 cepas R y 17 S. En el caso de la cepa PL374, el valor de CIM obtenido por Etest fue de 12μg/ml; como este se encuentra entre dos diluciones de CIM (8 y 16μg/ml), se redondeó a la inmediata superior, considerándose como R y no como I. También en el caso del agar MYPGP, los valores de CIM resultaron más bajos cuando se empleó Etest comparados con los obtenidos por dilución en agar, pero estas diferencias fueron mucho mayores que para el caso del agar Iso-Sensitest (tabla).
En conclusión, consideramos que la combinación de las tiras de Etest con el agar Iso-Sensitest sería una excelente alternativa para determinar las CIM de tetraciclina en cepas de P. larvae; sin embargo, estos resultados deberán confirmarse en futuros estudios que contemplen un mayor número de aislamientos.
La técnica empleando las tiras de Etest es considerablemente más rápida y requiere una menor cantidad de medio de cultivo que la técnica de dilución en agar, por lo que puede adaptarse fácilmente al trabajo de laboratorio para el análisis de numerosas cepas bacterianas. Es importante destacar que todas las cepas de P. larvae ensayadas mostraron un desarrollo confluente en Iso-Sensitest, el cual podría usarse también como medio alternativo para el desarrollo de las células vegetativas de este patógeno.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosAMA es miembro de la Carrera del Investigador Científico de la CIC (Comisión de Investigaciones Científicas de la Provincia de Buenos Aires); ACL y FJR son miembros de la Carrera del Investigador Científico de CONICET (CCT-La Plata). Esta investigación fue subsidiada por la ANPCyT y la CIC.