Clostridioides difficile es el principal agente causal de diarreas asociadas al cuidado de la salud. Esta bacteria produce toxinas y una enzima que se encuentra muy conservada en la especie: la glutamato deshidrogenasa (GDH). El diagnóstico rápido y el tratamiento efectivo permiten la pronta mejoría del paciente, con el consecuente control de la diseminación del microorganismo. Sin embargo, aún no se cuenta con un método diagnóstico óptimo y se propone la realización de diversas pruebas, cuyos resultados se interpretan en el contexto de ciertos algoritmos. En este trabajo se evaluó el desempeño de la GDH como prueba de tamizaje en el diagnóstico de la diarrea por C. difficile. Se estudiaron 615 muestras de materia fecal. Se determinó la presencia de GDH y de toxinas mediante el equipo diagnóstico de enzimoinmunoensayo de membrana C. DIFF QUIK-CHEK COMPLETE® (TECHLAB) y se realizaron cultivos para la búsqueda de C. difficile. Se calcularon los valores de sensibilidad, especificidad, VPP y VPN con un nivel de significación p < 0,05. Se detectó GDH en 266 muestras (43,25%), con una sensibilidad del 100% y una especificidad del 87,10%, IC95: 84,58–91,42. Se hallaron toxinas en 218 muestras (35,45%) y C. difficile desarrolló en 235 cultivos (38,21%). De 48 muestras GDH positivas y sin producción de toxina/s, 17 fueron positivas al cultivo de C. difficile, con 15 aislamientos toxigénicos y 2 no toxigénicos. No hubo desarrollo de C. difficile en las 31 muestras restantes. Ninguna muestra GDH negativa dio resultado positivo de toxina/s ni desarrollo en el cultivo, por lo cual el VPN de la GDH fue del 100%, mientras que el VPP fue del 81,9%. Concluimos que la determinación de GDH representa un screening adecuado para descartar casos de diarrea por C. difficile, por lo tanto de valor en los algoritmos diagnósticos de las diarreas infecciosas.
Clostridioides difficile is the main etiological agent of diarrhea associated with health care, it produces toxins and glutamate dehydrogenase (GDH), an enzyme that is highly conserved in this species. Rapid diagnosis and effective treatment produce prompt improvement of the patient and subsequent control of the microorganism spread. There are several techniques whose results are interpreted in the context of algorithms. However, the optimal diagnostic method is yet unknown. The performance of GDH as a screening test for the diagnosis of C. difficile diarrhea was assessed. Six hundred and fifteen stool samples were studied. The presence of GDH and toxins presence was determined by TECHLAB® C. DIFF QUIK-CHEK COMPLETE and the samples were cultured for the search of C. difficile. The values of sensitivity, specificity, PPV and NPV were calculated with a p value of 0.05 or less. GDH was detected in 266 samples (43.25%), with a sensitivity of 100% and specificity of 87.10%, IC95: 84.58-91.42; toxin/s were detected in 218 (35.45%) and C. difficile developed in 235 cultures (38.21%). From 48 samples with positive GDH and negative toxin/s, 15 toxigenic and 2 non-toxigenic isolates were obtained, the remaining 31 samples were negative for C. difficile. All GDH-negative samples were negative for toxins or culture, therefore, GDH NPV was 100%, while PPV was 81.9%. We conclude that GDH is a suitable screening test for the diagnostic algorithm of C. difficile diarrhea.
Clostridioides (Clostridium) difficile es un bacilo gram positivo anaerobio esporulado, causante de diarreas asociadas al cuidado de la salud8,13. Entre los factores de virulencia de este agente infeccioso se encuentran dos toxinas: la enterotoxina A (TcdA) y la citotoxina B (TcdB). Dichas toxinas están codificadas en el locus de patogenicidad PaLoc, donde los genes tcdA y tcdB están flanqueados por tcdR (gen regulador positivo) y tcdC (gen regulador negativo); el locus se completa con tcdE, gen que codifica una holina que interviene en la excreción de las toxinas. Algunas cepas también producen una toxina binaria formada por dos subunidades codificadas por cdtA y cdtB, que en función conjunta desorganizan el citoesqueleto, con el consecuente aumento de la adherencia de C. difficile al epitelio intestinal15.
Otro gen de importancia y con impacto en el diagnóstico de la enfermedad causada por C. difficile es el que codifica la enzima glutamato deshidrogenasa (GDH). Este gen, denominado gluD, se ubica fuera del PaLoc y se presenta altamente conservado en cepas toxigénicas y no toxigénicas de todos los ribotipos2.
En el desarrollo de la enfermedad, además de la infección con cepas toxigénicas de C. difficile, inciden los factores de riesgo de cada paciente. Entre ellos cabe mencionar los tratamientos con antibióticos y la internación prolongada dentro de los dos meses previos al episodio, la edad mayor de 65 años, la administración reiterada de enemas, la colocación de sonda nasogástrica por tiempo prolongado, las cirugías intestinales, la administración de antiácidos, la permanencia en instituciones geriátricas y el déficit de la inmunidad3–5,8.
Existen distintos métodos para el diagnóstico de la diarrea causada por C. difficile (DCD). Los más difundidos se basan en la detección de las toxinas como única determinación, o junto con la determinación de la GDH. Cabe mencionar entre ellos el enzimoinmunoanálisis de membrana, el inmunoanálisis en placa, los estudios de citotoxicidad sobre líneas celulares, el cultivo toxigénico y los métodos moleculares. Estos métodos varían en su sensibilidad, especificidad, complejidad, tiempo de procesamiento y costo, así como en las toxinas que detectan. No obstante, a pesar de la variedad de métodos disponibles, aún no se cuenta con un método óptimo, por lo cual se recomienda la utilización de más de una determinación y la interpretación de los resultados en el contexto de algoritmos diagnósticos6–8,10,11.
El objetivo de este trabajo fue evaluar la utilidad de la determinación de la GDH como prueba de screening en el diagnóstico de DCD.
Se estudiaron 615 muestras de materia fecal (una muestra por episodio) de pacientes con diagnóstico de diarrea, asistidos en el Hospital F. J. Muñiz: 465 muestras se procesaron entre enero y diciembre de 2011, las otras 150, entre julio y diciembre de 2014. Fueron excluidas de este estudio las heces formadas y las derivadas de otros nosocomios. Las muestras fueron colectadas en frascos estériles, sin conservantes y remitidas de inmediato al laboratorio.
El rango de edad de los pacientes fue de 15 a 85 años. Todos ellos tenían infección con HIV y estaban cursando un tratamiento antibiótico.
La detección de la GDH y de las toxinas A/B en materia fecal se realizó con el equipo diagnóstico de enzimoinmunoensayo de membrana C. DIFF QUIK CHEK COMPLETE® producido por la firma TECHLAB (Alere International Limited, Ballybrit, Galway, Irlanda), y se procedió según las instrucciones del fabricante.
Se realizó el cultivo para la búsqueda de C. difficile en las 615 muestras estudiadas.
La metodología empleada para el aislamiento fue el cultivo en agar sangre, después de la selección de esporas mediante un shock alcohólico. Para ello se mezclaron de 2 a 3ml de materia fecal con igual volumen de etanol absoluto. Después de 30 min de reposo, se procedió a sembrar la mezcla en placas de agar sangre base Columbia, las cuales se incubaron en jarras con generadores de anaerobiosis. Se realizó una primera lectura de las placas a las 48h y una segunda a las 96h. Las colonias recuperadas se identificaron mediante pruebas de tolerancia al oxígeno, hidrólisis de gelatina, fermentación de glucosa y fructosa, ONPG y producción de indol.
Adicionalmente, se evaluó la toxicidad de aquellos aislamientos identificados como C. difficile procedentes de muestras de materia fecal con resultado negativo en el ensayo de producción de toxinas. La prueba se hizo sobre colonias aisladas de medios de cultivo sólidos con 48h de incubación y se empleó el mismo equipo utilizado para la detección de toxina/s en heces.
Los cultivos toxigénicos se interpretaron de la siguiente manera: ausencia de desarrollo de C. difficile o desarrollo de C. difficile no productor de toxina/s, negativo; desarrollo de C. difficile productor de toxina/s, positivo.
El diagnóstico microbiológico se consideró positivo cuando se detectó GDH y toxinas A/B en las heces, o cuando el cultivo toxigénico resultó positivo (o ambos). En las otras situaciones se descartó el diagnóstico de DCD.
Se realizó el análisis descriptivo de los datos con el programa SPSS 17.0 (SPSS, INC, Chicago, IL). Se calcularon los porcentajes de especificidad y sensibilidad, así como el VPP y el VPN, con sus correspondientes intervalos de confianza. El nivel de significación considerado fue 0,05.
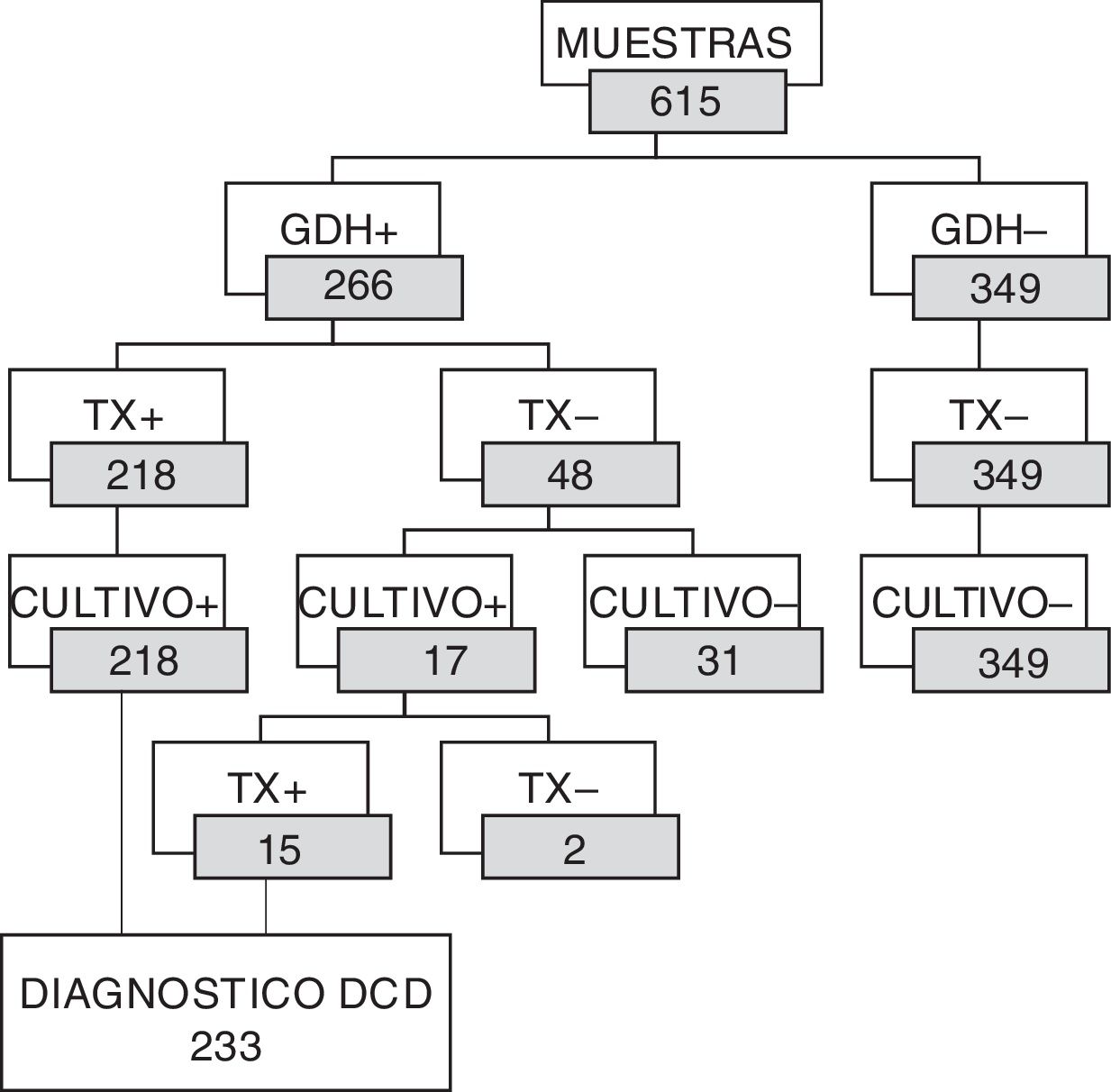
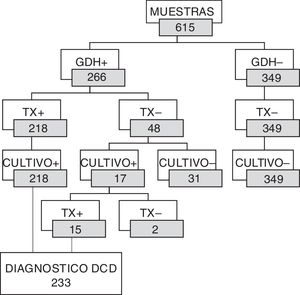
Se detectó GDH en 266 de las 615 muestras de materia fecal estudiadas (43,25%). De esas 266 muestras, 218 fueron también positivas a la producción de toxina/s. De las 48 muestras GDH positivas pero toxina/s negativas, 17 fueron positivas al cultivo de C. difficile, con 15 aislamientos toxigénicos (31,25%) y 2 no toxigénicos. No hubo desarrollo de C. difficile en las 31 muestras restantes (64,58%). La adición de estos 15 casos a aquellos diagnosticados mediante la detección de toxina/s en la materia fecal hacen un total de 233 episodios de infección por C. difficile (37,89%). Estos 15 casos adicionales representaron el 2,44% de los episodios estudiados y el 6,44% de los casos diagnosticados. Se esquematiza esta secuencia de resultados en la figura 1.
Distribución de resultados de GDH y toxinas según el cultivo.
GDH+: glutamato deshidrogenasa positivo; Tx+: toxinas positivas; Tx–: toxinas negativas; Cultivo –: no se obtuvo desarrollo de C. difficile; Cultivo +: se obtuvo desarrollo de C. difficile; DCD: diarrea por C. difficile.
La sensibilidad de la determinación de la GDH fue del 100% y la especificidad del 87,1% (IC95: 0,84576 a 0,9142); el VPN fue 100% y el VPP 81,9% (IC95: 0,77146 a 0,86764).
C. difficile es un patógeno entérico relacionado con el ámbito hospitalario, pero también se puede encontrar en el tracto gastrointestinal de los animales y del hombre1,8,13. Entre los factores de riesgos conocidos, la administración de antibióticos es el más frecuente para el padecimiento de diarrea por esta bacteria, aunque en el último tiempo se reportaron casos de DCD en pacientes procedentes de la comunidad, algunos sin factores de riesgo aparentes.
Esta bacteria causa diarrea con niveles de gravedad variable: puede producir desde manifestaciones leves, con más de tres deposiciones diarias, hasta cuadros graves con complicaciones como megacolon tóxico y perforaciones intestinales. En algunos casos, la supresión de los antibióticos es suficiente para superar la diarrea, pero en otros, dicha suspensión puede ser contraproducente y es necesario instaurar un tratamiento específico contra este patógeno. Por ello y con el fin de evitar tratamientos innecesarios y la diseminación en el medio, es fundamental contar con diagnósticos eficaces y rápidos3,5,8,10.
La GDH es una enzima metabólica que se produce en grandes cantidades y se encuentra altamente conservada en las cepas de C. difficile. Su sensibilidad diagnóstica es > 90%, pero su especificidad es baja2,12. En varios estudios se constató el elevado valor predictivo negativo (VPN) de la GDH en muestras de materia fecal, su bajo valor predictivo positivo (VPP) y su inadecuada especificidad, por lo cual la presencia del antígeno en ausencia de toxina/s exige la confirmación por otra metodología. La mayoría de los trabajos realizados arrojaron datos similares, independientemente del equipo utilizado para la detección de la enzima12,14.
En 2011, Shetty et al.12 presentaron un metanálisis de 13 trabajos sobre el rol diagnóstico de la GDH. Se informan allí intervalos de VPN y VPP de 97 a 100% y de 42,2 a 100%, respectivamente. Entre los trabajos incluidos en ese metanálisis están el de Eastwood et al., que señala un VPN de 98% y un VPP de 78%; el de Wren et al., con un VPN de 99,5% y un VPP de 67,5%; y el de Reyes et al., que comunica un VPN de 100% y un VPP de 94,6%12. La Subcomisión de Bacterias Anaerobias SADEBAC-AAM, por su parte, comunicó en 2012 un VPN de 94,1% y un VPP de 57,3%6.
En este estudio se utilizó el equipo comercial C. DIFF QUIK CHEK COMPLETE® de TECHLAB como único método para la determinación de la GDH, y se obtuvo, tal como informan los trabajos antes mencionados, un VPN muy elevado (100%), mientras que el VPP fue de 81,9%. Este VPP alto en relación con otros documentados previamente podría estar asociado con la elevada prevalencia de DCD en nuestra institución, donde en 2011 se detectaron toxinas de C. difficile en el 33,98% de las muestras estudiadas, y en el segundo semestre de 2014, en el 24,39% (datos no publicados).
El gen que codifica la GDH en C. difficile tiene una alta tasa de conservación, lo cual se mantiene en los distintos ribotipos y cepas, sean estas toxigénicas o no toxigénicas. Es por ello que un resultado negativo de GDH indicaría la ausencia del microorganismo en las heces, mientras que la presencia de la enzima no es suficiente para arribar al diagnóstico etiológico de DCD, ya que además de presentarse en las cepas no toxigénicas, se describen reacciones cruzadas de GDH con Clostridium sordellii2,9.
Sobre la base de estos trabajos y con el fin de aumentar la sensibilidad diagnóstica y reducir los costos, se propone la utilización de algoritmos. Estos algoritmos combinan una prueba con un alto VPN (GDH) en un primer paso, y en un segundo paso otra, con un elevado VPP5,7,8,10.
Por su gran sensibilidad, la determinación de la GDH como screening no dejaría a ningún paciente sin diagnóstico, pero un resultado positivo obliga a la detección de las toxinas en un segundo paso y a su ulterior cultivo, cuando fuera necesario7,8,11.
Existen equipos para la detección de la GDH como única prueba y otros que detectan la enzima en forma simultánea con las toxinas A y B. Los últimos, además de hacer un adecuado tamizaje, tienen la ventaja de evitar un paso en el procesamiento de la muestra y, de ese modo, acelerar el procedimiento diagnóstico7,8,11.
Como se ha publicado, un resultado de toxina/s negativo en la materia fecal no excluye la presencia de cepas toxigénicas de C. difficile, ni descarta el diagnóstico de DCD8,12. Nuestro trabajo verifica dicha observación, ya que diagnosticamos 15 casos adicionales (6,44% de todos los diagnosticados) mediante el cultivo toxigénico. Estos 15 casos representaron el 3,77% de los 397 episodios en los cuales no se había demostrado la presencia de toxina/s en las muestras fecales y el 5,64% de los casos de muestras con GDH. Debemos destacar que en ninguna muestra sin GDH se diagnosticó DCD, ni por la presencia de las toxinas ni mediante el cultivo toxigénico.
El cultivo toxigénico es un método sensible propuesto como método de referencia; sin embargo, es laborioso, requiere de operadores experimentados y su tiempo de respuesta es prolongado. Es por ello que con el fin de optimizar la utilización de los recursos, se sugiere realizar el cultivo toxigénico solo en aquellas muestras con resultado de GDH positivo y de toxinas negativo.
Los métodos moleculares son una herramienta de alta sensibilidad y especificidad para el diagnóstico rápido de numerosas patologías infecciosas, incluida la DCD6,8,10. Algunos equipos, además, detectan cepas hipervirulentas del RT 027 (toxinotipo III, ST-1, BI/NAP1), descritas en brotes y cuadros graves de diarrea8,9. Sin embargo, su especificidad clínica no es adecuada y el elevado costo de los equipos y de las determinaciones constituyen importantes desventajas para su utilización en las primeras instancias del diagnóstico. En oposición, la detección de la GDH como prueba de tamizaje tiene un costo menor, un elevado VPN, es fácil de realizar y da un resultado confiable en menos de 2 h12. Por estos motivos, con el fin de optimizar el empleo de los recursos y de los métodos disponibles, la determinación de la GDH como prueba de tamizaje mejora la eficiencia del diagnóstico microbiológico y ayuda a evitar tratamientos innecesarios, internaciones más prolongadas y complicaciones eludibles.
Por lo dicho, concluimos que la determinación de la GDH representa un método de screening adecuado para descartar casos de diarrea por C. difficile, por lo tanto de valor en los algoritmos diagnósticos de DCD.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.