La fusariosis es una de las enfermedades más importantes de los cereales, Fusarium graminearum es su principal agente etiológico. Este hongo posee la capacidad de producir distintos tipos y niveles de toxinas, en especial deoxinivalenol (DON). En la campaña 2012–2013 se dieron condiciones ambientales predisponentes para el desarrollo de esta enfermedad. El objetivo de este trabajo fue evaluar la presencia del hongo y el contenido de DON en 50 muestras de trigo. Los resultados demostraron la presencia de Fusarium graminearum en el 80 % de las muestras analizadas. El 24 % de las muestras presentó valores de DON ≥ 1μg/g, el 26 % varió entre 0,5 y 0,99μg/g, mientras que el 50 % restante mostró valores inferiores a 0,5μg/g. Se observó correlación entre la presencia de Fusarium graminearum y de DON. Es necesario establecer valores límites de DON en granos de trigo destinados al consumo humano.
One of the most important diseases in cereal crops is Fusarium head blight, being Fusarium graminearum the main etiological agent. This fungus has the ability to produce a wide spectrum and quantity of toxins, especially deoxynivalenol (DON). During the last crop season (2012–2013) the climatic conditions favored Fusarium colonization. The objective of this work was to determine the presence of this fungus as well as the DON content in 50 wheat grain samples. Our results showed that 80% of the samples were contaminated with Fusarium graminearum. Twenty four percent (24%) of the samples contained ≥ 1μg/g DON, 26% ranged from 0,5 and 0,99μg/g, and the remaining 50% had values lower than 0,5μg/g. Correlation was found between the presence of Fusarium graminearum and DON. It is necessary to establish DON limit values in wheat grains for human consumption.
El trigo (Triticum aestivum L.) es uno de los cultivos invernales más importantes de la Argentina, sus granos son utilizados principalmente para la elaboración de harinas destinadas al consumo humano. Una de las principales enfermedades de este cultivo a nivel mundial es producida por el género Fusarium y se la conoce como fusariosis de la espiga o golpe blanco. Esta enfermedad está distribuida en todas las regiones de cultivo de este cereal y se la observa principalmente en zonas con clima húmedo y moderadas a altas temperaturas, en coincidencia con los estadios de floración del trigo. La reducción en los rendimientos del cultivo a causa de esta enfermedad y la posibilidad que poseen distintas especies de Fusarium de producir micotoxinas en los granos la hacen destacar entre otras enfermedades. Entre las especies de este género de hongos que se han aislado de los granos de trigo podemos nombrar a Fusarium graminearum, F. culmorum, F. poae, F. avenaceum y F. tricinctum; la primera de estas es considerada la de mayor importancia a nivel mundial por causar importantes mermas en los rendimientos y porque produce la micotoxina deoxinivalenol (DON).
Las micotoxinas son metabolitos secundarios producidos por ciertos géneros de hongos, entre ellos Fusarium. Este género tiene como principales toxinas asociadas a los tricotecenos. Los tricotecenos son metabolitos sesquiterpenoides, biológicamente activos, de bajo peso molecular y de elevada termoestabilidad. Son tóxicos potentes de las células eucarióticas y causan lesiones dérmicas, alteraciones de la respuesta inmunológica e inhibición de la síntesis de macromoléculas, con acción letal en dosis altas2. Los tricotecenos producidos por el género Fusarium pueden ser clasificados en dos tipos: el A, caracterizado por poseer en el C-8 un grupo funcional distinto de una cetona, y el B, caracterizado por poseer una cetona como grupo funcional en el C-86. Los de tipo A incluyen al diacetoxiscirpenol (DAS), al monoacetoxiscirpenol (MAS), al T-2 y al HT-2, entre otros. Los de tipo B comprenden deoxinivalenol (DON), 3 acetil- DON (3-ADON), 15 acetil-DON (15-ADON); nivalenol (NIV); fusarenona-X (FUS), y otros. El tipo y la cantidad de micotoxinas producidas por una especie fúngica pueden variar de un año a otro, dependiendo fundamentalmente de los factores ambientales, de los cultivos y del almacenamiento9.
En la Argentina, la principal toxina producida por Fusarium graminearum es el DON1,4,10. En la última campaña de trigo (2012–2013) se dieron condiciones ambientales predisponentes para la infección de esta especie en varias localidades de la provincia de Buenos Aires. Debido a ello, el objetivo del presente trabajo fue analizar la presencia de F. graminearum en muestras de trigo destinadas a la elaboración de harinas para su posterior consumo y el impacto de la presencia de este hongo en la producción de DON.
Se evaluaron 50 muestras de trigo (200g cada una) de distintas localidades (con sus respectivos controles de calidad realizados), que fueron cedidas gentilmente por un molino situado en la provincia de Buenos Aires. Estas muestras habían sido previamente analizadas por el molino, sin que se hubieran detectado valores superiores al 2 % de contaminación con Fusarium. Cada muestra se redujo a 200 semillas (utilizando un cuarteador) para el análisis de la presencia de F. graminearum, y a 25g para el análisis de DON.
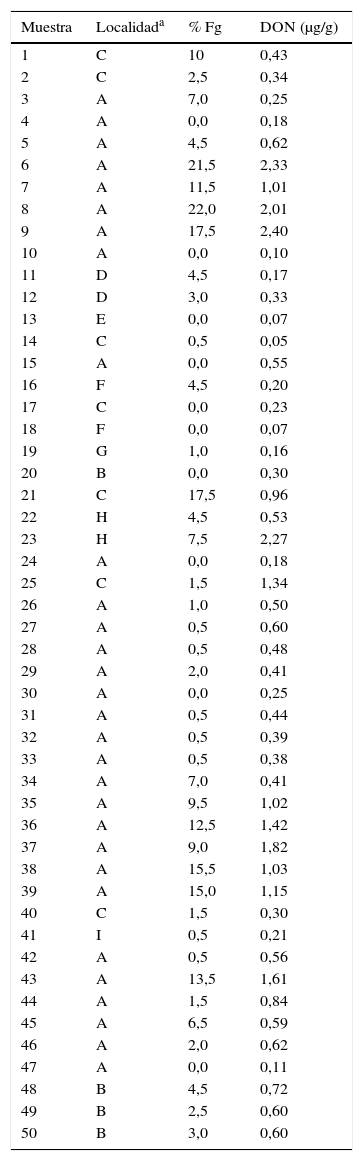
Las 200 semillas de cada muestra fueron desinfectadas con alcohol etílico al 70 % e hipoclorito de sodio al 1 %, con inmersión durante 2min en cada agente, y luego se realizaron dos lavados con agua destilada estéril durante 2min. Las semillas se depositaron en cajas de Petri (9 cm diámetro) con medio de cultivo agar papa glucosado al 2 % (APG) con cloranfenicol (0,25g/l) y se trasladaron a una cámara de cultivo con alternancia de 12h de luz/oscuridad a 25°C ± 2, durante un período de 46 días. Las colonias fúngicas desarrolladas fueron repicadas a tubos pico de flauta con APG y a cajas de Petri con medio agar-clavel, bajo las condiciones antes mencionadas, para ser identifi- cadas a nivel de especie7. Sobre la base del número de aislamientos de Fusarium graminearum obtenidos por muestra se determinó el porcentaje de presencia del hongo (tabla 1).
Presencia de Fusarium graminearum y contenido de deoxinivalenol en las muestras de trigo analizadas.
| Muestra | Localidada | % Fg | DON (μg/g) |
|---|---|---|---|
| 1 | C | 10 | 0,43 |
| 2 | C | 2,5 | 0,34 |
| 3 | A | 7,0 | 0,25 |
| 4 | A | 0,0 | 0,18 |
| 5 | A | 4,5 | 0,62 |
| 6 | A | 21,5 | 2,33 |
| 7 | A | 11,5 | 1,01 |
| 8 | A | 22,0 | 2,01 |
| 9 | A | 17,5 | 2,40 |
| 10 | A | 0,0 | 0,10 |
| 11 | D | 4,5 | 0,17 |
| 12 | D | 3,0 | 0,33 |
| 13 | E | 0,0 | 0,07 |
| 14 | C | 0,5 | 0,05 |
| 15 | A | 0,0 | 0,55 |
| 16 | F | 4,5 | 0,20 |
| 17 | C | 0,0 | 0,23 |
| 18 | F | 0,0 | 0,07 |
| 19 | G | 1,0 | 0,16 |
| 20 | B | 0,0 | 0,30 |
| 21 | C | 17,5 | 0,96 |
| 22 | H | 4,5 | 0,53 |
| 23 | H | 7,5 | 2,27 |
| 24 | A | 0,0 | 0,18 |
| 25 | C | 1,5 | 1,34 |
| 26 | A | 1,0 | 0,50 |
| 27 | A | 0,5 | 0,60 |
| 28 | A | 0,5 | 0,48 |
| 29 | A | 2,0 | 0,41 |
| 30 | A | 0,0 | 0,25 |
| 31 | A | 0,5 | 0,44 |
| 32 | A | 0,5 | 0,39 |
| 33 | A | 0,5 | 0,38 |
| 34 | A | 7,0 | 0,41 |
| 35 | A | 9,5 | 1,02 |
| 36 | A | 12,5 | 1,42 |
| 37 | A | 9,0 | 1,82 |
| 38 | A | 15,5 | 1,03 |
| 39 | A | 15,0 | 1,15 |
| 40 | C | 1,5 | 0,30 |
| 41 | I | 0,5 | 0,21 |
| 42 | A | 0,5 | 0,56 |
| 43 | A | 13,5 | 1,61 |
| 44 | A | 1,5 | 0,84 |
| 45 | A | 6,5 | 0,59 |
| 46 | A | 2,0 | 0,62 |
| 47 | A | 0,0 | 0,11 |
| 48 | B | 4,5 | 0,72 |
| 49 | B | 2,5 | 0,60 |
| 50 | B | 3,0 | 0,60 |
% Fg: Porcentaje de Fusarium graminearum; DON: deoxinivalenol.
Se obtuvo un total de 502 aislamientos de Fusarium graminearum aislados de granos de trigo con síntomas de fusariosis (granos decolorados y/o chuzos y/o con manifestación de signo: coloración superficial salmón-rosado) o sin estos.
De los aislamientos determinados morfológicamente como Fusarium graminearum se seleccionaron 40 al azar para ser confirmados molecularmente, con la precaución de analizar al menos uno por muestra. Se utilizó como control positivo un aislamiento de la misma especie, cedido gentilmente por el Dr. Paul Nicholson, John Innes Centre, Reino Unido.
Para la extracción del ADN fúngico se utilizó la metodología que emplea cetil-trimetil-bromuro de amonio (CTAB)11. La reacción en cadena de la polimerasa (PCR) especie-específica se realizó en un termociclador XP termal cycler (BioerTechnology Co), utilizando los cebadores Fg16F (5’-CTCCGGATATGTTGCGTCAA-3’) y Fg16R (5’-GGTAGGTATCCGACATGGCAA- 3’), bajo las condiciones descritas por Nicholson et al.8. Las reacciones de PCR se realizaron en un volumen final de 25μl, que contenía 10–20ng de ADN genómico, buffer de reacción 10X (20mM Tris-HCl pH 8, 100mM KCl, 0,1mM EDTA, 1mM DTT, 50 % glicerol, 0,5 % Tween 20® y 0,5 % Nonidet P40Ò), 2,5mM de MgCl2, 200μM de cada dNTP, 0,5μM de cada cebador, 1,25 unidades de Taq polimerasa (InbioHighway, Tandil, Argentina), 10 % de solución de rojo cresol (Sigma-Aldrich), 0,05 % de Tween 20®, 0,05 % de Nonidet P40®, y agua destilada estéril hasta completar el volumen total. Los fragmentos amplificados se separaron por electroforesis en geles de agarosa al 1,5 % con 4μl de GelRed™ (Biotium, Hayward, EE.UU.), sumergidos en buffer TBE 1X. Los tamaños de los fragmentos fueron comparados empleando un marcador de peso molecular conocido (100 bp DNA Ladder, Genbiotech, Buenos Aires, Argentina). Las corridas electroforéticas se realizaron a una corriente de 80 voltios durante 2h. La visualización de los fragmentos se realizó por irradiación con luz UV.
Para la cuantificación de DON, 25g de semillas de cada muestra se molieron y tamizaron (tamiz Zonitest N.° 20, hasta que el 75 % de la muestra pasó a través del tamiz). De la harina resultante, 20g fueron utilizados para realizar el ensayo por inmunoabsorción ligado a enzimas (ELISA), siguiendo las especificaciones del fabricante (AgraQuant DON, RomerLabs.), con un límite de detección de 0,2μg/g. La lectura de absorbancia se realizó con un lector de placas automático Rayto RT-6000.
Se calculó el coeficiente de correlación de Pearson entre el porcentaje de Fusarium graminearum y la concentración de DON, utilizando el programa InfoStat3.
En ciertas muestras fue posible aislar de manera esporádica a Fusarium poae y a F. tricinctum (datos no presentados). Los aislamientos analizados molecularmente amplificaron un fragmento de ≈ 400 pares de bases, acorde con lo esperado y confirmando las observaciones morfológicas. El 80 % de las muestras analizadas presentó contaminación con F. graminearum en distintos niveles (tabla 1). En todas las localidades de las cuales se obtuvieron muestras para analizar se aisló F. graminearum (tabla 1).
El 24 % de las muestras analizadas presentó valores de DON ≥ 1μg/g, el 26 % presentó valores entre 0,5 y 0,99μg/g y el 50 % restante menos de 0,5μg/g (tabla 1). El cálculo del coeficiente de correlación arrojó un valor significativo, con un R2 de 0,78.
En la actualidad, los molinos nacionales no cuentan con ninguna reglamentación que estipule la aceptación o el rechazo de muestras con Fusarium para su comercialización y posterior consumo, y menos aún, con normativas que establezcan niveles de DON determinantes de la aceptación o el rechazo de las partidas de granos/harinas, aunque recientemente se ha elaborado un anteproyecto de niveles máximos de DON para la Argentina. En este se consideran los siguientes valores límites: 2μg/g para cereales en granos sin elaborar, 1μg/g para las harinas y 0,5μg/g para los alimentos a base de cereales destinados a lactantes y niños de corta edad (ftp://ftp.fao.org/codex/Meetings/cccf/cccf7/cf07_07_Add1s.pdf).
En este trabajo no solo se ha confirmado la presencia de una de las principales especies micotoxigénicas en muestras de trigo con síntomas de la enfermedad o sin ellos que se destinan al consumo humano, sino que también se han encontrado niveles considerables de DON. Aun cuando es sabido que la producción de micotoxinas depende, además de la especie o el aislamiento específico, de varios factores ambientales, cabe destacar que muestras con porcentajes relativamente bajos de Fusarium graminearum arrojaron resultados considerables de DON y viceversa, aunque el coeficiente de correlación resultó significativo.
En las campañas 2001–2002 y 2003–2004 se detectaron distintos niveles de contaminación con DON en diferentes muestras de trigo obtenidas de la provincia de Buenos Aires4,5. En la primera de estas campañas (2001–2002) se evaluaron 19 muestras de trigo afectadas con fusariosis, en 17 de ellas se aisló Fusarium graminearum (entre 0 y 88 %) y la concentración de DON varió de 0,3 a 70μg/g4. Algo similar se pudo observar en la campaña siguiente (2003-2004), aunque con valores de F. graminearum y DON menores (entre no detectable y 2,78μg/g)5.
La Food and Drug Administration (FDA) (http://www.fda.gov) establece como valor de advertencia el de 1μg/g para las harinas de trigo, y si observamos los resultados obtenidos en este trabajo, un 24 % de las muestras analizadas entraría dentro de esta consideración. Cabe resaltar que todas estas muestras de trigo analizadas fueron comercializadas, por lo tanto, se hace necesario, al menos en los años en los que se dan condiciones predisponentes para la aparición de fusariosis, que tanto los productores como los molinos y demás integrantes de los canales de comercialización de alimentos realicen estudios exhaustivos de los granos y de las harinas, para evitar riesgos en la salud de los consumidores.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de paciente
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes
Este trabajo pudo ser realizado gracias a un subsidio de interés provincial otorgado por la Comisión de Investigaciones Científicas de la provincia de Buenos Aires, al ANPCyT-PICT 030/2011 y a la Universidad Nacional del Centro.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.