Pseudomonas stutzeri se encuentra ampliamente distribuido en el medio ambiente, ocupando diversos nichos ecológicos; pero su aparición en procesos infecciosos de interés clínico es el de patógeno oportunista. El aislamiento de P. stutzeri en un quiste inflamatorio odontogénico es un verdadero hallazgo microbiológico que no presenta antecedentes en la bibliografía científica odontológica. En este caso particular, el aislamiento se obtuvo a partir de material quirúrgico proveniente de un quiste odontogénico inflamatorio ubicado en la pieza dentaria 1.2 con necrosis pulpar concomitante. Se emplearon técnicas diagnósticas complementarias como radiografías, tomografías, estudios anatomopatológicos y microbiológicos. Los resultados permitieron clasificar el proceso como quiste inflamatorio infectado con P. stutzeri. La tipificación y la caracterización del perfil de sensibilidad de la cepa aislada permitieron adecuar la terapéutica antibiótica de manera específica. El análisis microbiológico permitió establecer la etiología del proceso infeccioso, la adecuación del tratamiento y el restablecimiento de los tejidos comprometidos.
Pseudomonas stutzeri is distributed widely in the environment, and occupies different ecological niches. However, it is found in clinically relevant infections as an opportunistic pathogen. Isolation of P. stutzeri from an odontogenic inflammatory cyst is an uncommon microbiological finding that has not been reported to date. In the case presented here, the bacterium was isolated from surgical material obtained from excision of an inflammatory odontogenic cyst located in the tooth 1.2, and presenting with concomitant pulp necrosis. Complementary techniques such as radiographs, CAT scans, and histopathological and microbiological studies were used to establish definitive diagnosis. The obtained results allowed classifying the process as an inflammatory cyst infected by P. stutzeri. Biotyping and characterization of the susceptibility profile of the isolated strain allowed adjusting the antibiotic therapy more specifically. The microbiological studies allowed establishing the etiology of the infectious process, adjusting the treatment plan, and re-establishing tissue integrity.
La Organización Mundial de la Salud (OMS) clasifica a los quistes odontogénicos en 2 grupos principales de acuerdo con la patogénesis de la entidad. El primer grupo incluye los quistes radiculares de origen inflamatorio. El segundo, las lesiones producidas durante el desarrollo odontogénico y no odontogénico, que se pueden transformar en una patología con carácter de malignidad3.
El quiste radicular es una lesión inflamatoria crónica, cerrada, limitada parcial o completamente por un epitelio escamoso estratificado no queratinizado. El tejido conectivo fibroso subyacente se encuentra inflamado con distintos grados de infiltrado celular y pequeños vasos sanguíneos.
El estudio histopatológico de las lesiones periapicales es una técnica útil para esclarecer los signos radiográficos de las alteraciones perirradiculares, distinguiéndose de los procesos no inflamatorios, como el ameloblastoma5.
Pseudomonas stutzeri se encuentra ampliamente distribuido en el medio ambiente, ocupando diversos nichos ecológicos, pero es infrecuente aislarlo como patógeno de los seres humanos. Su aparición en procesos infecciosos de interés clínico es el de una bacteria oportunista. P. stutzeri fue descripta por primera vez por Burri y Stutzer en 18952. En 1952, van Niel y Allen32, basados en el trabajo taxonómico realizado por Lehman y Neumann13, definieron sus características fenotípicas y discutieron su designación definitiva como P. stutzeri. Estudios fenotípicos llevados a cabo por Stanier et al. en 196628 demostraron que, además de las particulares características morfológicas macroscópicas de sus colonias, presentaban versatilidad nutricional y empleaban compuestos de carbono rara vez utilizados por otras Pseudomonas (p. ej., almidón, maltosa, etilenglicol). En 1970, Palleroni et al.21 demostraron, a través de técnicas de hibridación ADN-ADN, la presencia de variabilidad genética entre cepas de la misma especie. Actualmente, P. stutzeri pertenece al género Pseudomonas «sensu stricto» juntamente con especies relacionadas, como Pseudomonas mendocina, Pseudomonas alcaligenes, Pseudomonas pseudoalcaligenes y Pseudomonas balearica34.
A pesar de existir reportes de aislamientos de P. stutzeri desde la década de los 50, ningún informe presentó una asociación clara entre este agente infeccioso y el proceso del cual fue aislado20.
Los estudios de perfiles de sensibilidad a los antibióticos realizados para una amplia variedad de especies bacterianas demostraron que P. stutzeri presenta un perfil más amplio que Pseudomonas aeruginosa9,22,30 (especie estrechamente relacionada como patógeno humano).
Objetivo: enfatizar la importancia del diagnóstico microbiológico en los procesos de origen odontogénico para la adecuación de las conductas terapéuticas.
Materiales y métodos. Situación clínicaPaciente de sexo femenino, de 25 años de edad, que concurrió al Servicio de Cirugía y Traumatología Bucomaxilofacial II, Hospital Odontológico Universitario, Facultad de Odontología, Universidad de Buenos Aires, que refiere aumento indoloro de volumen de la cara desde hace 3 meses. Los datos de la anamnesis refirieron ausencia de medicación y de antecedentes sistémicos.
A la inspección clínica y bucal, el maxilar superior presentó una tumefacción intra y extraoral con compromiso del espacio canino, no fistulizada, sin cambios de coloración y leve renitencia a la compresión. La pieza 1.2 involucrada no presentó vitalidad pulpar, además de múltiples caries penetrantes y restos radiculares. Se indicaron estudios complementarios, microbiológicos, anatomopatológicos y por imágenes. Este último permitió determinar el abordaje quirúrgico acorde con el compromiso del proceso. La paciente participó voluntariamente y dio su consentimiento a la Cátedra de Cirugía y Traumatología BMF II.
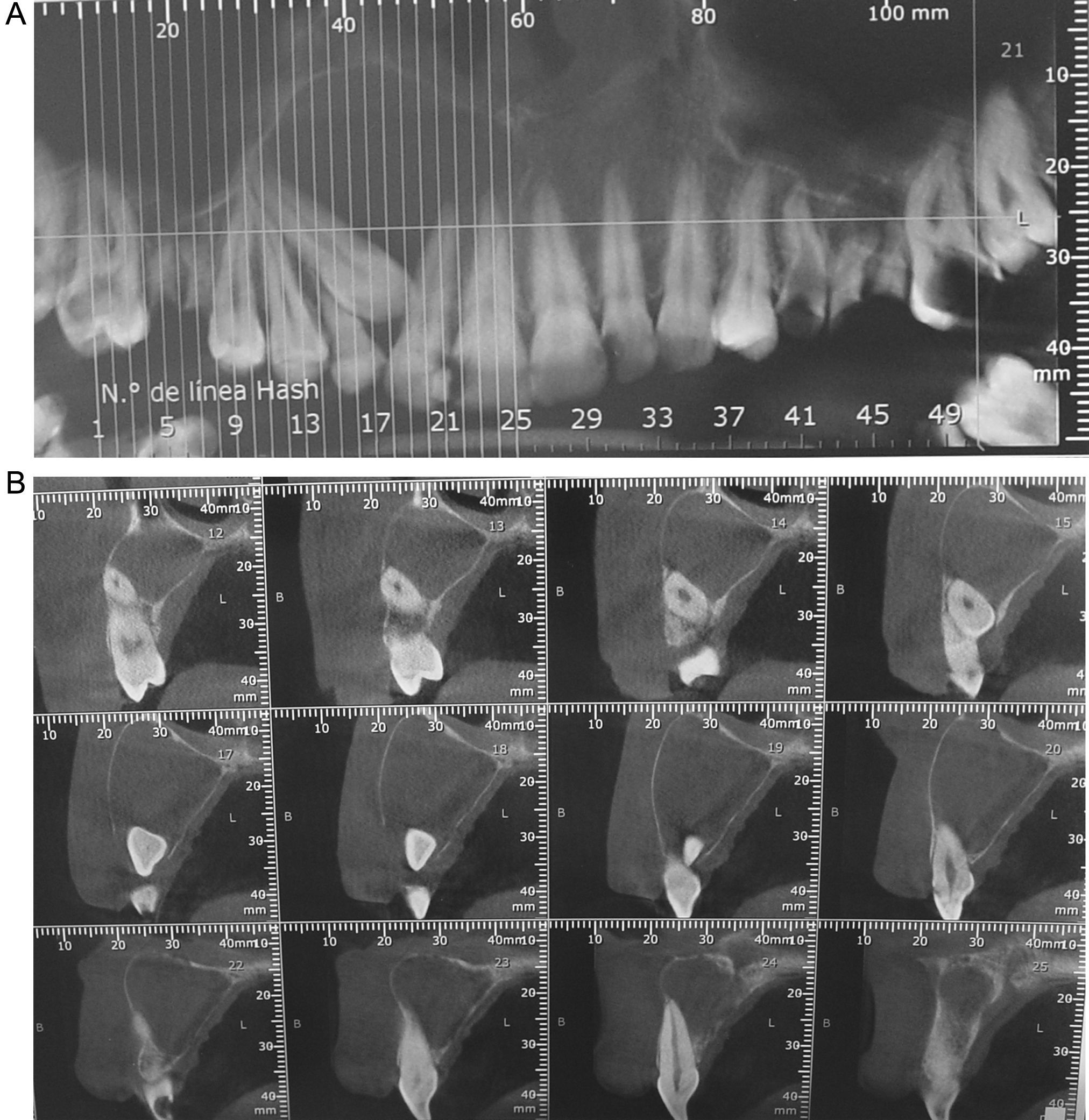
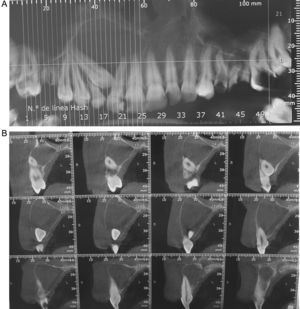
Diagnóstico por imágenesEl examen radiográfico y los estudios tomográficos computarizados informaron de la presencia de un proceso de apariencia quística con imagen radiolúcida unilocular. La técnica permitió analizar el tamaño del tumor (3cm de diámetro), observar las características de una cortical reactiva y la extensión del proceso que comprendía desde el ápice de la pieza 1.4 hasta el de la pieza 2.1, con presencia de la pieza 1.3 retenida e involucrada en el proceso (figs. 1A y 1B).
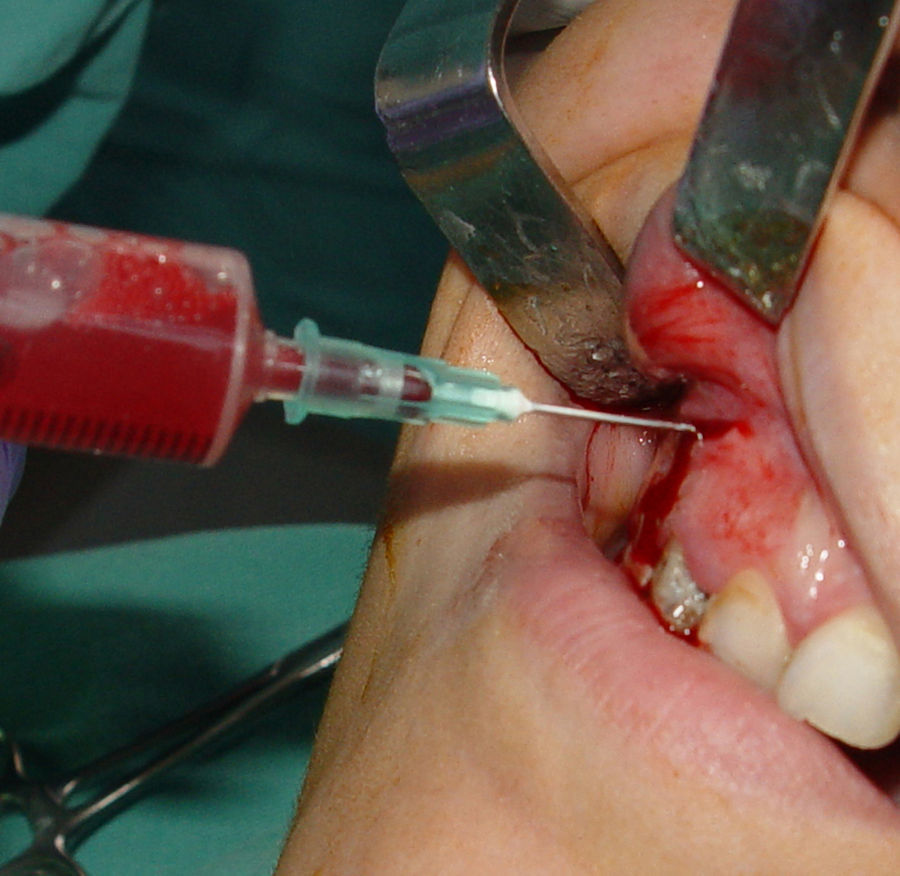
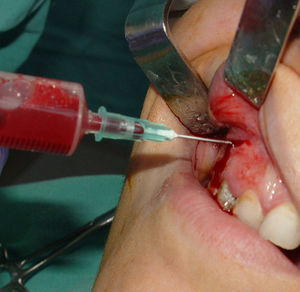
Técnica quirúrgica y toma de materialCon el objetivo de disminuir la cantidad y la actividad de la microbiota bucal, se indicó realizar un buche con digluconato de clorhexidina al 0,12% durante un minuto. Posteriormente, se anestesió por fondo de surco y paladar. Se realizó antisepsia por fricción en la zona del abordaje quirúrgico con solución de yodo povidona al 10%. Se realizó incisión semilunar y levantamiento a colgajo mucoperióstico. En el momento del abordaje, se observaron la integridad y el adelgazamiento de la cortical vestibular, probablemente debido a la reabsorción y el soplamiento que generó la entidad patológica. Para el estudio microbiológico se procedió a la toma de material por punción aspirativa (fig. 2). La muestra se colocó en medio de transporte RTF (refrigerated-transport-fluid medium)26 y se acompañó de 2 extendidos. El conjunto fue remitido al laboratorio de microbiología para su procesamiento cumplimentando con las condiciones para el transporte de muestras biológicas.
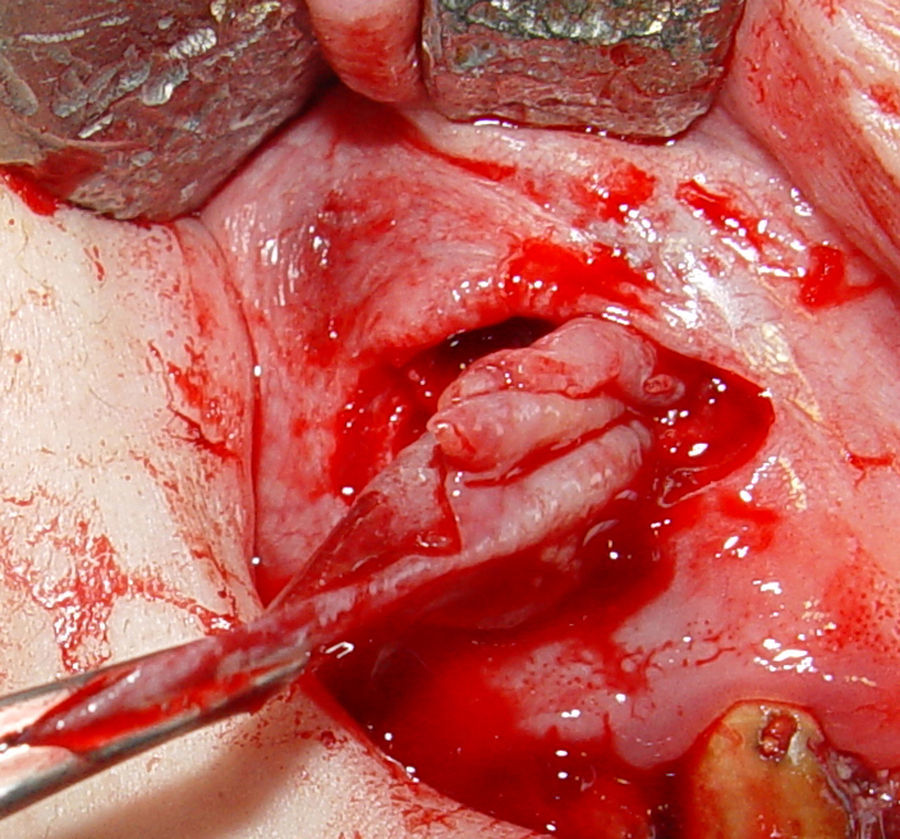
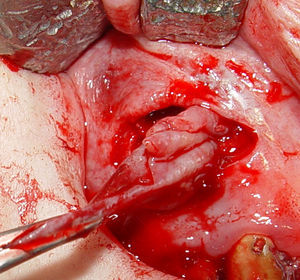
Posteriormente, se realizaron maniobras quirúrgicas pertinentes para acceder a la entidad patológica. La misma presentó cápsula firme, fibrosa de fácil enucleación por lo que se procedió a su remoción total. La biopsia se colocó en formol al 10% y se derivó para estudios anatomopatológicos (fig. 3). Para el reposicionamiento del colgajo se realizaron puntos simples con sutura de hilo de seda.
El fragmento de tejido obtenido presentó textura blanda, de color ocre claro, de aspecto membranoso de 3×2×0,4cm, que al corte no presentó particularidades.
El fragmento biópsico fue procesado por técnicas histológicas y coloreado con hematoxilina-eosina.
Estudios microbiológicosPara la observación microscópica directa de los extendidos se realizaron coloraciones con técnica de Gram y Giemsa prolongado. Para la obtención de los cultivos, la muestra se homogeneizó por agitación en vórtex. Se sembraron 100μl del homogenato por diseminación con espátula de Drigalsky en medios: Agar sangre-Agar Tripticasa Soya (Difco®, BD Diagnostics, Sparks, MD) suplementados con 5% sangre ovina estéril (Lab. Gutiérrez, Argentina); agar sangre lacada-Agar Tripticasa Soya (Difco®, BD Diagnostics, Sparks, MD) suplementados con 5% sangre ovina estéril (Lab. Gutiérrez, Argentina), 5μg/ml de hemina (Sigma-Aldrich, Argentina) y 1μg/ml de menadiona (Sigma-Aldrich, Saint Louis, MO); Agar Manitol Salado (Oxoid®, Inglaterra); Agar eosina azul de metileno-Levine (Oxoid®, Inglaterra); Agar Bilis Esculina suplementado con telurito de potasio 0,04% (Laboratorio Britania, Argentina); medio selectivo para Aggregatibacter actinomycetemcomitans AASM31. Las placas de AS se incubaron a 36±1°C en condiciones de aerobiosis; las placas de AASM en atmósfera enriquecida en dióxido de carbono (Campypack; Mitsubishi Gas Chemical Company, INC, Japón) por 48 h y las placas de ASA en anaerobiosis estricta con sistema de jarra (Anaeropack Mitsubishi Gas Chemical Company, INC. Japón y Oxoid®, Inglaterra) por 5 días.
La identificación de la cepa aislada se realizó empleando pruebas bioquímicas convencionales (RapID NF PLUS System®, remel, Thermo Fisher Scientific Inc) y la identificación definitiva mediante la técnica de espectrometría de masa-MALDI-TOF MS®25, sobre tarjetas de análisis (Bruker Daltonics®, Bremen, Alemania). Para la calibración del espectrómetro se utilizó un estándar consistente en el perfil proteico de una cepa de Escherichia coli DH5 péptido alfa, que posee proteínas adicionales (BTS; Bruker Daltonics®). Los espectros fueron analizados por el software MALDI Biotyper RTC 3.1 (rangos especificados por el fabricante: < 1,70 no se puede establecer identificación; 1,7 a 1,99 identificación a nivel de género; ≥ 2 identificación satisfactoria). Se consideraron válidos los resultados con scores ≥ 2.
Se ensayaron antibióticos antipseudomónicos: piperacilina-tazobactam; ceftazidima; imipenem; meropenem; ciprofloxacina, y amikacina. Las pruebas de sensibilidad antibiótica fueron realizadas con monodiscos (Antimicrobial Susceptibility Test System, Oxoid®, Inglaterra), según las recomendaciones del Clinical and Laboratory Standards Institute23 (EE. UU., M39-A4) y se emplearon cepas patrones de P. aeruginosa ATCC® 27853 y E. coli ATCC® 25922.
ResultadosInforme anatomopatológicoEn la observación microscópica se describió la presencia de una pared quística fibrosa con extensos focos hemorrágicos; infiltrado inflamatorio mixto y revestimiento epitelial de tipo escamoso estratificado y sectores con marcada hiperplasia. Diagnóstico: quiste epitelial inflamatorio.
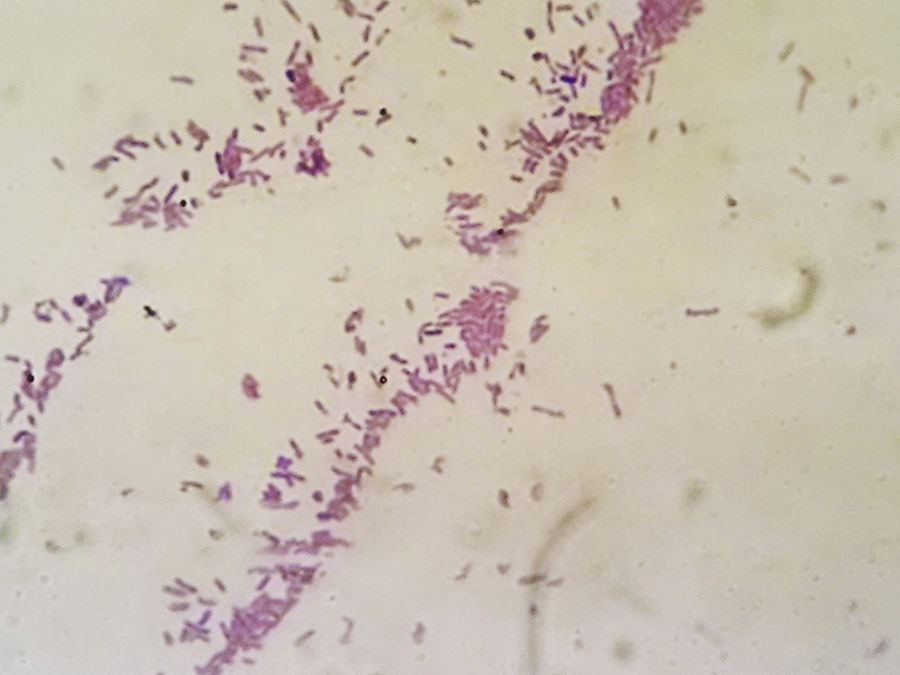
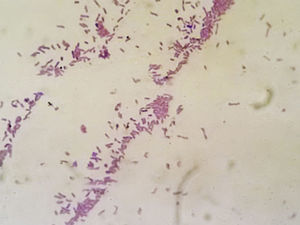
Informe microbiológicoLos estudios de microscopia directa realizados mediante coloración de Giemsa evidenciaron la presencia de respuesta inmunitaria inflamatoria positiva y de elementos baciliformes; los coloreados con técnica de Gram permitieron la visualización de bacilos gramnegativos delicados.
Los primocultivos desarrollaron cultivo microbiano positivo a las 48 h. Las colonias presentaron características macroscópicas y morfológicas particulares, como adherencia a la superficie del agar, de apariencia seca, coloración marrón rojiza con protuberancias mucoides en la periferia32 (fig. 4). La caracterización microscópica de la cepa confirmó la presencia de bacilos gram negativos (fig. 5) que fueron positivos a la reacción de la oxidasa (Tabletas ROSCO®). La identificación realizada con equipos comerciales (RapID NF PLUS System®, remel, Thermo Fisher Scientific Inc) determinaron un biotipo compatible con P. stutzeri con el 98% de homología. Dicho resultado se confirmó por MALDI-TOF MS® con un score de 2,2 para P. stutzeri.
El perfil de susceptibilidad de la cepa aislada confirió un antibiotipo de amplia sensibilidad a los fármacos ensayados: ceftazidima 30μg (S) 34mm (R<14; I15-17; S>18); imipenem 10μg (S) 26mm (R < 13; I 14-15; S > 16); piperacilina-tazobactam 100/10μg (S) 20mm (R<17-S>18); gentamicina 10 μg (S) 17mm (R<12; I 13-14; S > 15); ciprofloxacina 30 μg (S) 40mm (R < 12; I 13-17; S > 18) y trimetroprima sulfametoxazol 1,25/23,75 μg (S) 18mm (R < 10; I 11-15; S > 16).
DiscusiónLos quistes de los maxilares se consideran lesiones no tumorales y, por lo tanto, benignas, aunque en algunos casos se produzca malignización y sobreinfección de los mismos. Sus aspectos clínicos y radiográficos pueden ser engañosamente banales y tras la supuesta inocuidad puede ocultarse una lesión potencialmente invasiva, recurrente y susceptible de transformación maligna. Esto hace necesario realizar el estudio anatomopatológicos de todas las piezas quirúrgicas extirpadas5.
P. stutzeri representa menos del 1% de los aislamientos reportados del género Pseudomonas. Sin embargo, a pesar de su baja prevalencia, origina brotes intrahospitalarios debido a la contaminación de líquidos de uso parenteral8 o soluciones jabonosas10. Produce infecciones graves en pacientes inmunocomprometidos, con enfermedades subyacentes15 o bien cuando existen causas predisponentes, como cirugía previa, traumatismo expuesto o escoriación de piel infectada. En 1973, se publicó el primer caso documentado de la infección por P. stutzeri en una fractura de tibia6. Otros reportes de infecciones por P. stutzeri se han asociado con bacteriemia, septicemia1, infección conjuntival17, osteomielitis24, artritis18, endocarditis8, endoftalmitis, panoftalmitis12, meningitis29, neumonía11, empiema35, infección de la piel, ectima gangrenoso, infección del tracto urinario27 y ventriculitis33.
Solo 2 casos de los reportados carecían de alguno de estos factores: un hombre con osteomielitis vertebral24 y un niño de 4 años con neumonía y empiema11.
El antibiotipo que presentó nuestro aislamiento coincide con los reportados en los casos de cepas contaminantes. Los mismos muestran amplia sensibilidad de esta especie7 a los aminoglucósidos, quinolonas, carbapenemes antipseudomonadales (excluyendo ertapenem), ceftazidima, cefalosporinas de tercera generación, polimixina y trimetoprima-sulfametoxazol. Sin embargo, Nicolosi et al.19, detectaron 2 de 3 aislamientos (2:3) de P. stutzeri resistentes a ceftazidima y las cefalosporinas de cuarta generación, por lo que no recomiendan su uso. Loyse et al.16 publicaron la recuperación de P. stutzeri intratratamiento con ciprofloxacina por vía oral y gentamicina parenteral en un paciente inmunosuprimido (virus de la inmunodeficiencia humana/sida). Lin et al.15 obtuvieron un aislamiento de P. stutzeri resistente a gentamicina, ciprofloxacina, levofloxacina y ceftazidima en un paciente con neumonía necrosante con tuberculosis pulmonar previa. Recientemente, Lima et al.14 reportaron el aislamiento P. stutzeri con genotipo AmpC, resistente a cefoxitina, en un 16% de la saliva de trabajadores de la salud en un hospital oncológico de Brasil. Esto podría poner de manifiesto la plasticidad genómica de la especie para incorporar distintos mecanismos de resistencia en su genoma y disminuir su espectro de sensibilidad4,9 cuando se encuentra con las condiciones de selección propicias.
No hemos encontrado descriptos en la bibliografía trabajos que notifiquen aislamientos de P. stutzeri en quistes inflamatorios odontogénicos. Este hallazgo es el resultado de la incorporación de estudios microbiológicos como parte del proceso diagnóstico de rutina.
En nuestro caso, P. stutzeri se encontraba como colonizador del quiste inflamatorio, por lo que podría pensarse en una fuente de contaminación exógena, cuya puerta de entrada pudo ser la caries penetrante en el incisivo lateral superior derecho. La anamnesis y los estudios clínicos no evidenciaron enfermedades sistémica ni inmunocompromiso preexistentes.
La información aportada por el estudio microbiológico permitió realizar un diagnóstico diferencial y abrió la posibilidad de adecuar las conductas antibióticas para la resolución del agente infeccioso. En este caso, el aislamiento de un bacilo gram negativo no fermentador pone en duda la utilidad de los antibióticos betalactámicos empleados como primera elección en los procesos odontológicos, ya que no son los indicados para el tratamiento de estos microorganismos.
Con la identificación a nivel de especie y los datos del perfil de sensibilidad, se decidió la rotación antibiótica a trimetroprima/sulfametoxazol de 20mgkg/día de trimetroprima (100mgkg/día sulfametoxazol) cada 8 h por 7 días. La evolución fue favorable, presentó cicatrización adecuada y no se produjeron complicaciones infecciosas locales, periféricas ni sistémicas. La paciente fue controlada clínicamente y, una vez cicatrizado el colgajo, discontinuó el tratamiento.
En conclusión, es importante sistematizar la realización de estudios microbiológicos en paralelo a los anatomopatológicos, en todos los procesos infecciosos quirúrgicos de origen odontogénicos. Estos serán capaces de aportar datos que orienten o modifiquen conductas terapéuticas cuando se recuperen microorganismos oportunistas o con perfiles de susceptibilidad especiales.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.