Se realizó una revisión retrospectiva durante 12 años de las infecciones por Staphylococcus aureus en pacientes adultos (PA) y pediátricos (PP) asistidos en el Hospital Interzonal General de Agudos Evita de Lanús, para conocer la incidencia, los focos y el origen de la infección, y analizar el perfil de resistencia antimicrobiana. Se documentaron 2125 casos de infección en PA y 361 en PP. La incidencia de casos en PA descendió significativamente en el último trienio (χ2; p<0,05); en los PP aumentó significativamente durante los últimos 5 años (χ2; p<0,0001). En ambas poblaciones se detectó un aumento significativo en las infecciones de piel y estructuras asociadas (PEA), de bacteriemias a punto de partida de un foco en PEA y de infecciones por S. aureus de inicio en el hospital (χ2; p<0,005). La meticilino-resistencia (SAMR) aumentó del 28 al 78% en PP; en PA se mantuvo alrededor del 50%, con reducción significativa de la resistencia acompañante a antimicrobianos no betalactámicos en los SAMR de ambas poblaciones. En S. aureus documentados de infecciones de inicio en la comunidad (SAMR-CO) del último trienio, el porcentaje de meticilino-resistencia resultó del 57% en PP y 37% en PA; en infecciones con inicio en el hospital fue del 43 y el 63%, respectivamente. Si bien demostramos que S. aureus continúa siendo un patógeno asociado al ámbito nosocomial, hubo un aumento de infecciones por SAMR-CO, con compromiso en PEA en ambas poblaciones.
A twelve-year retrospective review of Staphylococcus aureus infections in adult and pediatric patients (AP and PP respectively) assisted in the Hospital Interzonal General de Agudos Evita in Lanús was performed to determine the incidence, foci of infection, the source of infection and to analyze the profile of antimicrobial resistance. An amount of 2125 cases of infection in AP and 361 in PP were documented. The incidence in AP decreased significantly in the last three years (χi2; p<0.05); in PP it increased significantly during the last five years (χ2; p<0.0001). In both populations was detected a notable increase in skin infections and associated structures (PEA) in bacteremia to the starting point of a focus on PEA, and in total S. aureus infections of hospital-onset (χ2; p < 0.005). Methicillin-resistance (MRSA) increased from 28 to 78% in PP; in AP it remained around 50%, with significant reduction in accompanying antimicrobial resistance to non-β-lactams in both groups of MRSA. In S. aureus documented from community onset infections (CO-MRSA) in the last three years, the percentage of methicillin-resistance was 57% in PP and 37% in AP; in hospital-onset infections it was 43% and 63% respectively. Although data showed that S. aureus remains a pathogen associated with the hospital-onset, there was an increase of CO-MRSA infections with predominance in PEA in both populations.
Staphylococcus aureus (S. aureus) es uno de los microorganismos aislados con mayor frecuencia en patología humana y es agente causal de infecciones de piel y estructuras asociadas (PEA), infecciones endovasculares, neumonías, artritis sépticas, osteomielitis, infecciones asociadas a cuerpos extraños y sepsis.
S. aureus resistente a meticilina (SAMR) tiene la particularidad de ser resistente a todas las penicilinas y a los antibióticos betalactámicos disponibles, excepto ceftarolina. Durante mucho tiempo, SAMR estuvo vinculado con las infecciones de pacientes hospitalizados o asociadas al cuidado de la salud11. Estas cepas se caracterizan por presentar, además de la resistencia a la penicilina, resistencia acompañante a otros antibióticos, como clindamicina, eritromicina, rifampicina, fluoroquinolonas y trimetoprima/sulfametoxazol (TMS).
Entre 1996 y 1998, en Minnesota17, se detectaron infecciones por SAMR en pacientes jóvenes, sin factores de riesgo ni antecedentes de frecuentar instituciones sanitarias. Este hallazgo se asoció a la aparición de una nueva cepa de S. aureus asociada a la comunidad (SAMR-AC), responsable del incremento de las infecciones por este microorganismo en la última década. Como particularidad, estos SAMR no presentaron resistencia acompañante a otros antimicrobianos (ATM) no betalactámicos.
SAMR-AC ha tenido una rápida expansión en los EE. UU. y ha afectado a pacientes con y sin exposición al ámbito hospitalario, pero también se detectó un aumento en otros países por la circulación de clones internacionales de SAMR-AC11,15,26. Esta situación se detectó en Argentina a partir del 20036,19–21. Dado este contexto, nos propusimos analizar si se produjeron cambios en la incidencia de las infecciones por S. aureus en los pacientes asistidos en el Hospital Evita de Lanús, a lo largo de 12 años. Como objetivos secundarios se realizó la comparación entre la población adulta y pediátrica, con el fin de conocer los focos de infección más frecuentes, determinar el lugar de adquisición de la infección y analizar si se produjeron modificaciones en el perfil de resistencia antimicrobiana.
Materiales y métodosSe realizó un análisis retrospectivo a partir de la información clínico-microbiológica disponible en la base de datos del Laboratorio de Bacteriología, de las infecciones por S. aureus documentadas entre 2002 y 2013, en pacientes adultos (PA) y pediátricos (PP), y entre ambos grupos. Para ello la muestra bajo análisis se dividió en 3 períodos de 4 años: período 1 (PE1): 2002-2005; período 2 (PE2): 2006-2009, y período 3 (PE3): 2010-2013.
Se estimó la tasa de incidencia de casos a partir de la información del departamento de estadísticas del hospital, tomando como numerador la cantidad de pacientes infectados por S. aureus y como denominador el número total de egresos para ese año para cada población, respectivamente, excluyéndose los casos de Neonatología.
Se consideró como caso de infección el evento clínicamente significativo de infección microbiológicamente documentado por S. aureus, el que puede incluir la aparición de más de un sitio de infección.
Se valoró si el inicio de la infección estuvo asociado al hospital o a la comunidad empleando los criterios del Centers for Disease Control and Prevention (CDC), Atlanta, EE. UU.)3, considerando de inicio en el hospital a aquella infección que se manifiesta luego de 48 h desde la atención médica, durante la hospitalización o como consecuencia de ella y sin estar presente o en incubación al ingreso del paciente. Se asumieron como infecciones de inicio en la comunidad aquellas diagnosticadas en el momento de la consulta inicial de pacientes ambulatorios sin antecedentes de asistencia o procedimientos médicos, o las que sin manifestarse en el momento del ingreso lo hacen dentro de las 48 h de internación.
Para analizar la existencia de diferencia estadísticamente significativa entre los períodos de estudio y las variables en las 2 poblaciones de pacientes, se aplicó el test χ2 adoptando un valor p<0,05. Se calcularon el valor del odds ratio (OR) y el intervalo de confianza (IC) del 95%. Se emplearon los programas Whonet versión 5.6 (OPS), Excel (Microsoft office 2007) y Epidat versión 3.0 (OPS). Se incluyeron solo los aislados documentados de un procedimiento diagnóstico para investigar la etiología de un proceso infeccioso, aplicando métodos y técnicas de procesamiento normalizadas vigentes en la institución, resguardando la identidad de la persona de quien se realizó el estudio. Se excluyeron los estudios de portación/colonización.
Estudios microbiológicos: la identificación de los aislados se realizó por pruebas bioquímicas manuales normalizadas. A fin de no duplicar la información, se consideró solo el primer aislado de cada caso. La sensibilidad a meticilina (SAMS) se determinó mediante pruebas de difusión con discos de oxacilina de 1μg y/o de cefoxitina de 30μg, según la norma del Clinical Laboratory Standard Institute vigente en el momento del ensayo4. Se testaron además los siguientes ATM: gentamicina, rifampicina, trimetoprima-sulfametoxazol, minociclina, eritromicina, clindamicina, fluoroquinolonas y vancomicina. A partir del 2009, la sensibilidad a ATM se ensayó simultáneamente por difusión y por dilución en el Sistema Phoenix (SPh) versión 6.01A empleando paneles PMIC/ID-107 (Becton Dickinson, EE. UU.). Linezolid y daptomicina se testaron solo por dilución en SPh y tigeciclina por difusión interpretando para este ATM los resultados con los puntos de corte recomendados por la Food and Drug Administration10.
En los casos donde se obtuvieron resultados discordantes entre las pruebas de difusión y dilución para meticilina, se realizó la prueba de aglutinación en látex para la detección de la proteína PBP2a (Biomérieux), resultado de la expresión del gen mecA determinante de la meticilino-resistencia.
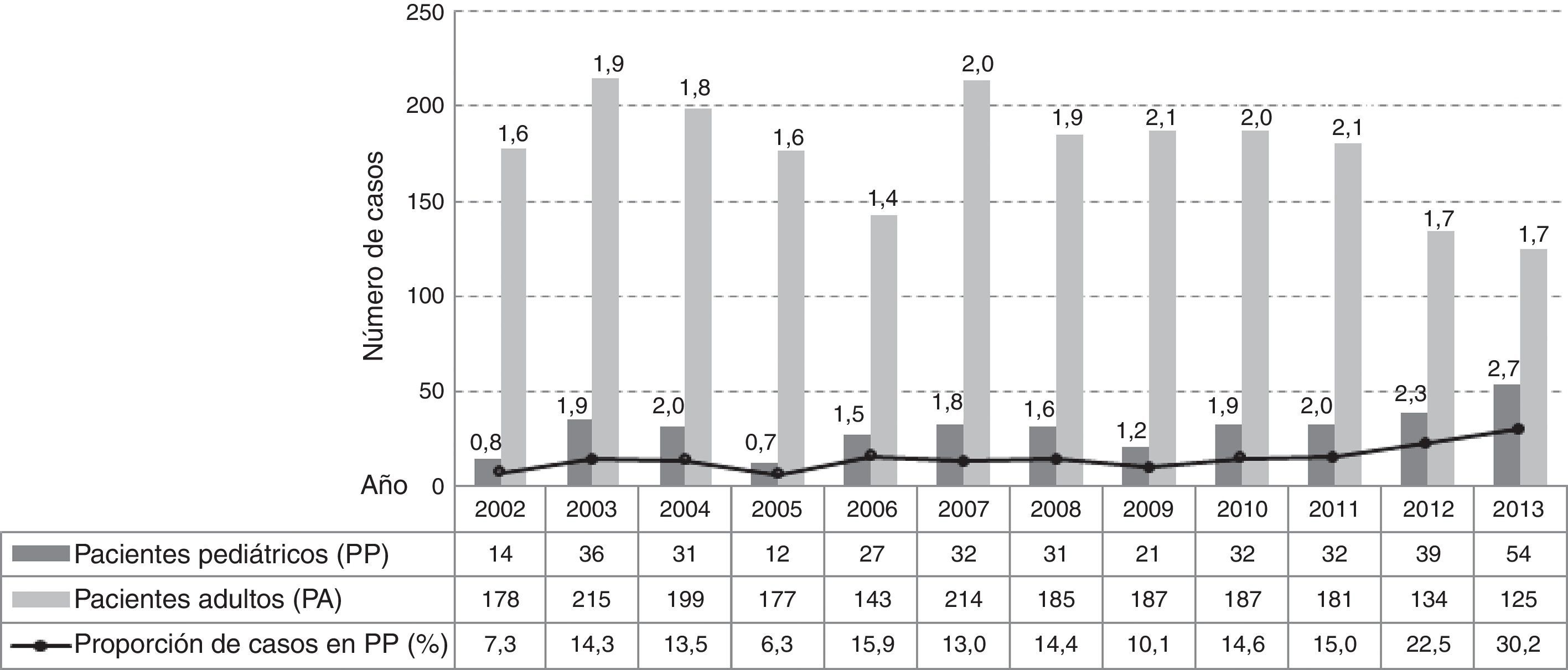
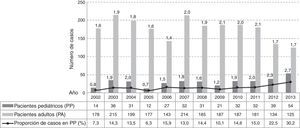
ResultadosNúmero de casos y tasa de incidencia. En el período de estudio se detectaron 2486 casos de infección por S. aureus: 2125 en PA y 361 en PP, su distribución anual y la tasa de incidencia para cada grupo de pacientes se detalla en la figura 1.
La proporción de infecciones por S. aureus en PP respecto de los adultos señaló un aumento muy significativo de casos en el último período en relación con el primero (χ2=28,12; p<0,0001; OR=2,09 [1,58-2,76]) y al segundo (χ2=14,46; p<0,0001; OR=1,66 [1,28-2,17]), con porcentajes (n) de 11% (93/862), 13% (111/840) y 20% (157/784) en P1, P2 y P3, respectivamente (figura 1).
Del análisis se desprende que la incidencia de casos en los PA no evidenció cambios entre el principio y el final del período (χ2=0,65; p>0,05); se registró un aumento significativo entre 2006 y 2007 (χ2 =4,88; p<0,05) y un descenso significativo en los últimos 3 años (p<0,05). En la población de PP la tasa de incidencia tuvo un aumento muy significativo entre el inicio y el final del período, un descenso significativo entre 2004 y 2005 (p<0,05) y un aumento más acentuado y continuo a partir del 2009 (χ2=7,24; p<0,00001).
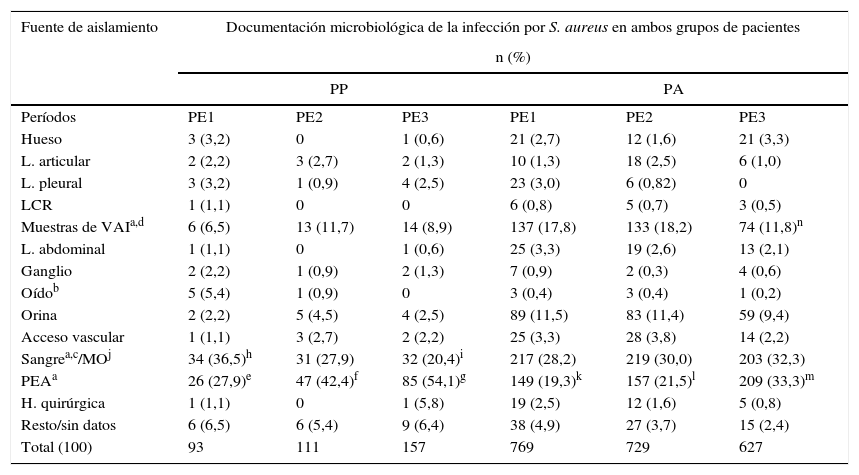
Fuente de aislamiento en PP. Las muestras a partir de las que documentó una infección por S. aureus en los PP correspondieron por frecuencia a: el 43,8% muestras de PEA (n=158), el 26,7% sangre (n=97), el 9,4% materiales de vías respiratorias inferiores (n=33) y el 20% restante a muestras varias (n=73).
Al comparar el número de muestras con aislamiento de S. aureus para las 3 fuentes de infección más frecuentes (n=288), se encontró un aumento significativo de infecciones de PEA en el tercer (χ2=16,24; p=0,0001; OR=3,04 [1,75-5,28]) y el segundo período (χ2=4,55; p=0,03; OR=0,52 [0,29-0,95]) respecto del primero. No ocurrió lo mismo entre PE3 y PE2 (p>0,05). Al comparar el número de bacteriemias por S. aureus, se observó un descenso significativo en el último período (χ2=7,86; p<0,005; OR=0,44 [0,25-0,78]); no obstante, se encontró un aumento significativo de bacteriemias a partir de un foco asociado a PEA (celulitis, absceso, impétigo, etc.) en PE2 y PE3 respecto de PE1 (χ2=4,39; p=0,03; OR=0,23 [0,05-0,97] y χ2=4,12; p=0,04; OR=0,24 [0,06-0,95], respectivamente).
La cantidad de muestras con rescate de S. aureus asociado a infecciones de vías aéreas inferiores no presentó diferencias entre los 3 períodos (p>0,05) (tabla 1).
Fuente de aislamiento de Staphylococcus aureus en los pacientes pediátricos (PP) y adultos (PA) en los 3 períodos
| Fuente de aislamiento | Documentación microbiológica de la infección por S. aureus en ambos grupos de pacientes | |||||
|---|---|---|---|---|---|---|
| n (%) | ||||||
| PP | PA | |||||
| Períodos | PE1 | PE2 | PE3 | PE1 | PE2 | PE3 |
| Hueso | 3 (3,2) | 0 | 1 (0,6) | 21 (2,7) | 12 (1,6) | 21 (3,3) |
| L. articular | 2 (2,2) | 3 (2,7) | 2 (1,3) | 10 (1,3) | 18 (2,5) | 6 (1,0) |
| L. pleural | 3 (3,2) | 1 (0,9) | 4 (2,5) | 23 (3,0) | 6 (0,82) | 0 |
| LCR | 1 (1,1) | 0 | 0 | 6 (0,8) | 5 (0,7) | 3 (0,5) |
| Muestras de VAIa,d | 6 (6,5) | 13 (11,7) | 14 (8,9) | 137 (17,8) | 133 (18,2) | 74 (11,8)n |
| L. abdominal | 1 (1,1) | 0 | 1 (0,6) | 25 (3,3) | 19 (2,6) | 13 (2,1) |
| Ganglio | 2 (2,2) | 1 (0,9) | 2 (1,3) | 7 (0,9) | 2 (0,3) | 4 (0,6) |
| Oídob | 5 (5,4) | 1 (0,9) | 0 | 3 (0,4) | 3 (0,4) | 1 (0,2) |
| Orina | 2 (2,2) | 5 (4,5) | 4 (2,5) | 89 (11,5) | 83 (11,4) | 59 (9,4) |
| Acceso vascular | 1 (1,1) | 3 (2,7) | 2 (2,2) | 25 (3,3) | 28 (3,8) | 14 (2,2) |
| Sangrea,c/MOj | 34 (36,5)h | 31 (27,9) | 32 (20,4)i | 217 (28,2) | 219 (30,0) | 203 (32,3) |
| PEAa | 26 (27,9)e | 47 (42,4)f | 85 (54,1)g | 149 (19,3)k | 157 (21,5)l | 209 (33,3)m |
| H. quirúrgica | 1 (1,1) | 0 | 1 (5,8) | 19 (2,5) | 12 (1,6) | 5 (0,8) |
| Resto/sin datos | 6 (6,5) | 6 (5,4) | 9 (6,4) | 38 (4,9) | 27 (3,7) | 15 (2,4) |
| Total (100) | 93 | 111 | 157 | 769 | 729 | 627 |
MO: médula ósea; VAI: muestras de vías aéreas inferiores, tomadas en pacientes para diagnóstico de neumonía.
Sangre/MO: el número de bacteriemias secundario a un foco en PEA en cada período fue 3, 9 y 9 en PP y 12, 19 y 23 en PA.
En PP: dp > 0,05 (NS); g respecto de e: p = 0,001; g respecto de fp > 0,05 (NS); f respecto de e: p = 0,03; i respecto de h: p < 0,005.
En PA: jp > 0,05 (NS); m respecto de l: p < 0,001; m respecto de k: p < 0,001; l respecto de k: p > 0,05 (NS); n: p < 0,05.
Fuente de aislamiento en PA. Las muestras a partir de las que se documentó una infección por S. aureus correspondieron por frecuencia a: 30,0% sangre (n = 39), 24,3% PEA (n=515), 16,2% muestras de vías respiratorias inferiores (n=344), 10,9% orina (n=231) y 18,6% (n=396) a muestras varias.
Al comparar por períodos, el número de muestras con aislamiento de S. aureus para las 3 fuentes de infección más frecuentes (n=1498) se detectó un marcado aumento de infecciones de PEA en el tercer período respecto de PE2 (χ2=23,80; p<0,0001; OR=0,54 [0,43-0,69]) y PE1 (χ2=35,28; p<0,0001; OR=0,48 [0,37-0,61]), pero no entre PE2 y PE1, y una disminución significativa de neumonías en el último período (χ2=10,81; p<0,001; OR=0,59 [0,44-0,81]). No se evidenció diferencia en las bacteriemias (p>0,05), pero al analizarlas de acuerdo con el foco, se documentó un aumento significativo de bacteriemias a partir de un foco asociado a PEA en PE3 (χ2=4,61; p<0,05; OR=0,45 [0,22-0,94]) (tabla 1).
Dado que S. aureus frecuentemente es responsable de bacteriuria de salida a partir de un foco distante, las muestras de orina con rescate de S. aureus se excluyeron del análisis.
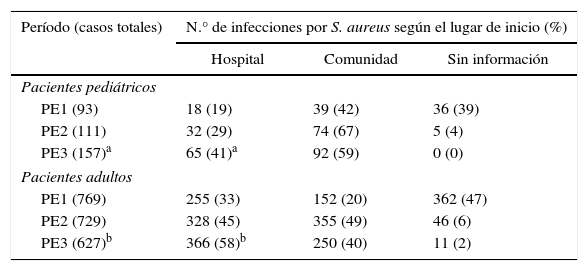
Origen de la infección. Se investigó si el lugar de inicio de las infecciones por S. aureus se relacionó a la asistencia hospitalaria (HO) o a la comunidad (CO) acorde con criterios recomendados en la literatura8,18. Debido a la falta de datos, solo se analizaron los 2 últimos períodos; no obstante, se puso en evidencia que en los PP hubo un aumento significativo (χ2=4,45; p<0,05; OR=0,57 [0,34-0,96]) y en los PA un aumento muy significativo (χ2=24,15; p<0,001; OR=0,58 [0,47-0,72]) de infecciones por S. aureus originadas en el hospital en el último período. Los datos se detallan en la tabla 2.
Distribución del número de casos de infección por Staphylococcus aureus de acuerdo con el lugar de inicio en ambas poblaciones
| Período (casos totales) | N.° de infecciones por S. aureus según el lugar de inicio (%) | ||
|---|---|---|---|
| Hospital | Comunidad | Sin información | |
| Pacientes pediátricos | |||
| PE1 (93) | 18 (19) | 39 (42) | 36 (39) |
| PE2 (111) | 32 (29) | 74 (67) | 5 (4) |
| PE3 (157)a | 65 (41)a | 92 (59) | 0 (0) |
| Pacientes adultos | |||
| PE1 (769) | 255 (33) | 152 (20) | 362 (47) |
| PE2 (729) | 328 (45) | 355 (49) | 46 (6) |
| PE3 (627)b | 366 (58)b | 250 (40) | 11 (2) |
Perfil de resistencia a los ATM entre PE1 y PE3. Al analizar el perfil de resistencia a los ATM a lo largo de la vigilancia, el 78% de las cepas aisladas de PP durante PE3 presentó resistencia a meticilina (SAMR), mientras que en PE1 la SAMR fue del 28% (χ2=56,67; p<0,0001; OR=0,11 [0,06-0,24]). También se detectó una modificación en el perfil de resistencia a ATM no betalactámicos en los SAMR, con un aumento significativo de cepas sin resistencia acompañante en el tercer (χ2=24,2; p<0,0001; OR=0,07 [0,01-0,25]) y segundo períodos (χ2=14,9; p<0,0001; OR=0,09 [0,02-0,36]) respecto del primero, con valores de 66, el 58 y el 12%, respectivamente (tabla 3).
Resultado de las pruebas de sensibilidad a meticilina en los Staphylococcus aureus aislados en los 3 períodos de estudio, en pacientes adultos (PP) y pediátricos (PA)
| Resultados de las pruebas de sensibilidad en PP | |||||||
|---|---|---|---|---|---|---|---|
| Período | SAU totales | SAU testados n (%) | SAMS n (%) | SAMR n (%) | SAMR sin resistencia acompañante, n (%)** | SAMR resistente a un solo ATM no betalactámico, n (%) | SAMR resistente a más de un ATM no betalactámico, n (%) |
| PE1 | 93 | 88 (94) | 63 (72) | 25 (28) | 3 (12) | 5 (20) | 17 (68) |
| PE2 | 111 | 91 (82) | 36 (40) | 55 (60) | 32 (58) | 3 (5) | 20 (37) |
| PE3 | 157 | 150 (96) | 33 (22) | 117 (78)* | 77 (66) | 25 (21) | 15 (13) |
| Resultados de las pruebas de sensibilidad en PA | |||||||
|---|---|---|---|---|---|---|---|
| Período | SAU totales | SAU testados n (%) | SAMS n (%) | SAMR n (%)*** | SAMR sin resistencia acompañante, n (%)**** | SAMR resistente a un solo ATM no betalactámico, n (%) | SAMR resistente a más de un ATM no betalactámico, n (%) |
| PE1 | 769 | 727 (95) | 399 (55) | 328(45) | 28 (9) | 17 (5) | 283 (86) |
| PE2 | 729 | 606 (83) | 292 (48) | 314 (52) | 79 (25) | 21 (7) | 214 (68) |
| PE3 | 627 | 610 (97) | 305 (50) | 305 (50) | 148 (49) | 55 (18) | 102 (33) |
ATM: antimicrobiano; SAMR: meticilino-resistente; SAMS: meticilino-sensible.
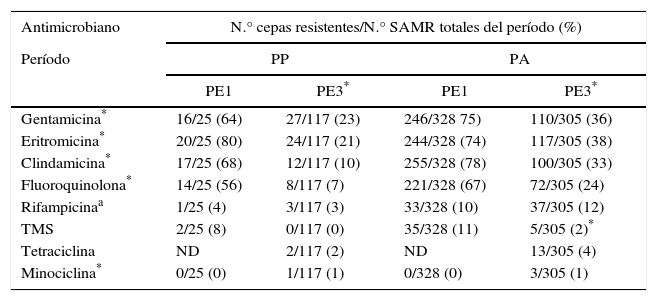
El porcentaje de resistencia individual a los ATM no betalactámicos en SAMR mostró una disminución significativa en PE3 (p<0,001) (tabla 4).
Porcentaje de resistencia individual a los antimicrobianos no betalactámicos en SAMR documentados en pacientes pediátricos (PP) y adultos (PA) entre los períodos PE1 y PE3
| Antimicrobiano | N.° cepas resistentes/N.° SAMR totales del período (%) | |||
|---|---|---|---|---|
| Período | PP | PA | ||
| PE1 | PE3* | PE1 | PE3* | |
| Gentamicina* | 16/25 (64) | 27/117 (23) | 246/328 75) | 110/305 (36) |
| Eritromicina* | 20/25 (80) | 24/117 (21) | 244/328 (74) | 117/305 (38) |
| Clindamicina* | 17/25 (68) | 12/117 (10) | 255/328 (78) | 100/305 (33) |
| Fluoroquinolona* | 14/25 (56) | 8/117 (7) | 221/328 (67) | 72/305 (24) |
| Rifampicinaa | 1/25 (4) | 3/117 (3) | 33/328 (10) | 37/305 (12) |
| TMS | 2/25 (8) | 0/117 (0) | 35/328 (11) | 5/305 (2)* |
| Tetraciclina | ND | 2/117 (2) | ND | 13/305 (4) |
| Minociclina* | 0/25 (0) | 1/117 (1) | 0/328 (0) | 3/305 (1) |
ND: no determinado.
En 153 S. aureus aislados entre 2009 y 2013, se determinó la concentración inhibitoria mínima (CIM) a vancomicina empleando el SPh con los siguientes resultados: CIM50=1mg/l, CIM90=1mg/l y rango 0,5-2,0mg/l. Solo 2 aislados tuvieron CIM=2,0mg/l.
En los PA el porcentaje de SAMR no presentó variaciones significativas a lo largo de la vigilancia y se mantuvo en un valor promedio del 50%. Al igual que en los PP, se obtuvo un aumento en la proporción de cepas SAMR sin resistencia acompañante, con porcentajes del 9, el 25 y el 49% en PE1, PE2 y PE3, respectivamente (χ2 > 100; p<0,0001; OR=0,09 [0,06-0,15]) (tabla 3).
El porcentaje de resistencia individual a los ATM no betalactámicos en SAMR resultó significativamente menor en PE3 (p<0,001) (tabla 4).
En 651 S. aureus aislados entre 2009 y 2013 se determinó la CIM a vancomicina por el SPh con los siguientes resultados: CIM50=1mg/l, CIM90=1mg/l y rango 0,5-2,0mg/l. Solo 5 aislados tuvieron CIM=2,0mg/l.
Resistencia a meticilina según el lugar de inicio de la infección en el tercer período (PE3). El porcentaje de SAMR entre las infecciones de inicio en la comunidad (SAMR-CO) resultó del 57% en los PP y el 37% en los PA; en infecciones con inicio en el hospital (SAMR-HO) fue del 43 y el 63%, respectivamente.
Infecciones de PEA por SAMR-CO. Debido a que en ambos grupos de pacientes se evidenció un aumento de infecciones de PEA a lo largo de los años, se analizó cuál fue el porcentaje de estas infecciones con inicio en la comunidad causadas por SAMR, en relación con el total de casos. En los PP el porcentaje fue (n): 4,3 (4/93); 16 (18/111) y 31 (48/157) desde el PE1 hasta el PE3, señalando un aumento muy significativo (χ2=24,47; p<0,00001; OR=0,10 [0,03-0,29]).
En los PA resultó: 0,8 (6/769); 6,9 (50/729) y 11,8 (74/627), demostrando también un aumento muy significativo de infecciones de PEA por SAMR-CO (χ2 =77,6; p<0,00001; OR=0,05 [0,02-0,13]) en relación con el resto de los focos de infección.
DiscusiónLos SAMR se documentaron por primera vez en 1961 y durante mucho tiempo estuvieron circunscriptos al ámbito hospitalario. A mediados de los años 90 se describieron infecciones por SAMR en pacientes de la comunidad17. Estas cepas se denominaron SAMR-AC, definición que fue dada por el CDC en el año 2000, para diferenciarlos de aquellas vinculadas al ámbito nosocomial o SAMR-H11.
Tanto SAMR-AC como SAMR-H son resistentes a meticilina, evento clave que condiciona la elección del tratamiento, pues determina la resistencia a todos los ATM betalactámicos. A nivel molecular, es el resultado de la adquisición, en una cepa sensible a meticilina, de un elemento genético móvil llamado cassette cromosómico del estafilococo (SCCmec), portador del gen mecA, que codifica para una proteína ligadora de penicilina (PBP 2a) con afinidad reducida por los antibióticos.
Estudios moleculares permitieron demostrar que las cepas responsables de infecciones de inicio en la comunidad diferían de las hospitalarias en el tipo de material genético que expresa la resistencia antimicrobiana. Mientras que las cepas hospitalarias portaban los SCCmec de tipo i, ii y iii, que incluyen genes de resistencia a antibióticos no betalactámicos, las SAMR-AC portaban el SCCmec tipo iv, que en general no presentan multirresistencia5,6,11,16,17. Otra característica diferencial está dada por la presencia de factores de virulencia en los SAMR-AC7,25. Estos estudios también evidenciaron la rápida diseminación de unos pocos clones, distintos de los responsables de la diseminación de los SAMR-H14,17,24. Esta propagación epidémica de infecciones por S. aureus se transformó en un evento preocupante, que motivó a realizar diferentes estudios de vigilancia6,7,13,15,14,26,27. En Uruguay, desde el año 2001, SAMR no multirresistente se estableció como un patógeno emergente que causó la muerte de 18 personas en Montevideo entre 2003 y 200412. Amorín et al.1 realizaron un estudio prospectivo entre 2003 y 2007, describiendo las características clínicas y evolutivas de niños hospitalizados por infecciones invasivas por SAMR-AC, demostrando una tasa de mortalidad del 6,4% y alto porcentaje de secuelas. Pedreira Anzalone et al.23 realizaron un estudio prospectivo de infecciones supuradas de PEA, atribuyendo a SAMR-AC el 85% de 1650 infecciones invasivas.
En Argentina, un estudio de vigilancia de infecciones por S. aureus, realizado en Córdoba en 2005, demostró una prevalencia de SAMR-AC del 16%28. En 2009, un estudio entre 66 hospitales distribuidos en 20 provincias determinó una prevalencia de infecciones por SAMR del 54%; el 37% correspondió a SAMR-AC. Además, se demostró que el 12% de los S. aureus con fenotipo SAMR-AC correspondieron a infecciones asociadas al cuidado de la salud y evidenció el predominio del clon ST5-IVa, LPV (+) y la circulación del clon ST30-IVc-LPV (+), responsable de infecciones de inicio en la comunidad en adultos no hospitalizados y también vinculado a infecciones invasivas de la comunidad5,8,9,13,29,28.
Paganini et al., en un trabajo multicéntrico realizado en niños, publicado en 2008, detectaron una prevalencia del 53% para las infecciones por S. aureus adquiridas en la comunidad, el 62% causadas por SAMR-AC20. En un nuevo estudio multicéntrico prospectivo publicado en 2009, compararon las infecciones causadas por SAMR-AC en niños con enfermedad de base o con antecedentes de consultas previas o internación en hospitales, con niños antes sanos, con el mismo tipo de infección. Demostraron que el 68% de 840 infecciones por S. aureus se originaron en la comunidad, el 61% causadas por SAMR21. Luego, en 201022, Paganini et al. publicaron los resultados de un estudio retrospectivo tras 17 años (1993-2007) de vigilancia de bacteriemias por SAMR-AC en niños, demostrando un aumento significativo de casos asociado a un foco en PEA a partir de 2004, motivando a revalorar el tratamiento empírico de las infecciones graves.
Anodal et al.2 publicaron en 2012 un estudio prospectivo que involucró a pacientes entre 2 y 90 años con infecciones profundas de PEA, que requirieran tratamiento oral. Documentaron infecciones por SAMR-AC en el 81% de los 37 pacientes. Todos los aislados fueron sensibles a TMS y el 21% de ellos presentó resistencia a clindamicina, destacando la importancia de la documentación microbiológica.
Del análisis de nuestros datos pudimos demostrar que a través del tiempo se produjeron cambios en las infecciones por S. aureus con las siguientes características.
En la población pediátrica, la incidencia de casos resultó significativamente mayor en los últimos 5 años; el conjunto de infecciones de PEA resultó el foco de infección prevalente, ocupando el 54% del total de las muestras en el último período, acompañado de un aumento significativo de bacteriemias asociadas a ese foco.
En el último período de la vigilancia (PE3) hubo un aumento significativo: a) del número de infecciones por S. aureus con inicio en el hospital, el 43% causadas por aislados meticilino-resistentes (SAMR), y b) del grupo de infecciones de PEA con inicio en la comunidad causadas por SAMR, con una prevalencia del 31% en relación con el total de casos. La resistencia a meticilina aumentó del 28 al 78%, con reducción significativa de la resistencia a ATM no betalactámicos en aislados SAMR. Clindamicina, TMS, minociclina, vancomicina y linezolid resultaron los ATM de mayor utilidad potencial.
En los PA el hemocultivo resultó la fuente de aislamiento prevalente en todo el período; se demostró un aumento significativo de las infecciones de PEA y de bacteriemias asociado ese foco en los últimos 4 años. Si bien la tasa de incidencia de infecciones por S. aureus descendió en el último trienio, hubo un aumento muy significativo de infecciones por S. aureus con inicio en el hospital, el 63% debido a SAMR. Al igual que en los PP, el subgrupo de infecciones de PEA por SAMR originadas en la comunidad (SAMR-CO) aumentó significativamente, con una prevalencia del 12% al final de la vigilancia.
La meticilino-resistencia promedió un valor del 50%, con una reducción significativa de la resistencia a ATM no betalactámicos en aislados SAMR. TMS, minociclina, tigeciclina, vancomicina y linezolid fueron los ATM de mayor utilidad potencial.
Esta modificación en los porcentajes de meticilino-resistencia y resistencia acompañante en aislados SAMR podría ser una evidencia del tipo de cepa circulante en nuestra población, tal como demuestran los trabajos de epidemiología molecular. Pero la falta de estudios moleculares no permite efectuar ninguna especulación al respecto; además, excede los objetivos planteados para este estudio. Cabe destacar que el criterio empleado para considerar los aislados como vinculados a la comunidad o al hospital se basó en el lugar de inicio de la infección18, adoptando las siglas HO para infecciones asociadas al hospital y CO a las de inicio en la comunidad. Es importante señalar que en el primer período de estudio el 39% de las infecciones en pediatría y el 47% de las infecciones de los PA no pudieron ser clasificadas como infecciones HO o CO. Esta falta de datos podría cambiar una de las conclusiones sobre la existencia de un aumento en la proporción de infecciones HO entre PE3 y PE1 que, junto al carácter retrospectivo del estudio, puede ser una limitante del mismo. Coincidiendo con la literatura en ambos grupos de pacientes, hubo un notorio aumento de infecciones de piel y estructuras relacionadas2,6,8,19–22,27,25.
La documentación microbiológica del caso y el conocimiento de los cambios en el perfil de la resistencia antimicrobiana a través de la vigilancia permanente son las herramientas fundamentales para adecuar la terapia empírica inicial y su posterior seguimiento individual.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesA la fecha, los participantes del estudio declaran no tener conflicto de intereses.
A los Dres. Carlos Piovano y Sonia Gómez, por la lectura crítica del manuscrito.