La ectomicorriza es una simbiosis mutualista de enorme importancia en la producción de árboles de valor forestal. Uno de los criterios de selección de hongos ectomicorrícicos de gran interés es su comestibilidad, por la importancia económica, ecológica y cultural de los hongos comestibles ectomicorrícicos como un producto forestal no maderable. En este estudio se evaluó el efecto de la inoculación con los hongos comestibles ectomicorrícicos, Laccaria laccata, Laccaria bicolor y Hebeloma leucosarx, en el crecimiento y el contenido nutricional de Pinus greggii, crecido en un sustrato experimental, o en un sustrato comercial enriquecido con un fertilizante de liberación lenta. Dos años después de la siembra, se observaron diferencias en el crecimiento aéreo y radical y en el contenido de macro- y micronutrientes entre plantas inoculadas y no inoculadas, independientemente de la especie fúngica y del sustrato utilizado. Las plantas crecidas en el sustrato comercial tuvieron mayor crecimiento y contenido de nutrientes; sin embargo, sus porcentajes de colonización fueron menores que los de plantas crecidas en el sustrato experimental. Existieron diferencias en la transferencia de nutrientes a la parte aérea de las plantas inoculadas, al comparar entre las especies fúngicas implicadas. Se observó transferencia de Ca por L. laccata, de Na por L. bicolor y de Mn por H.leucosarx en el sustrato experimental. La selección de sustratos constituye un factor clave en la producción de plantas ectomicorrizadas y las tres especies de hongos comestibles ectomicorrícicos evaluados tienen un potencial relevante para la micorrización controlada de P. greggii.
An ectomycorrhiza is a mutualistic symbiosis of paramount importance in forestry and tree production. One of the selection criteria of ectomycorrhizal fungi that has currently gained importance is their edibility due to the economic, ecological and cultural relevance of edible ectomycorrhizal mushrooms as a non-timber forest product. The effect of the inoculation with three edible ectomycorrhizal mushrooms: Laccaria laccata, Laccaria bicolor y Hebeloma leucosarx, which are widely sold in Mexico, on the growth and nutrient contents of Pinus greggii grown in an experimental substrate and a commercial substrate enriched with a slow-release fertilizer, was evaluated. Two years after sowing, differences in terms of shoot and root biomass and macro and micronutrient contents between inoculated and non-inoculated plants, were recorded independently of the fungal species and the substrate. Despite the fact that plants grown in the commercial substrate had higher growth and nutrient contents, their ectomycorrhizal colonization percentages were smaller than those of the plants grown in the experimental substrate. The differences in the nutrient transfer to the inoculated plant shoots among the evaluated fungal species were recorded. Ca mobilization by L. laccata, Na by L. bicolor and Mn by H. leucosarx were observed in the plants growing in the experimental substrate. It has been demonstrated that the selection of substrates constitutes an important factor in the production of ectomycorrhizal plants and that the three evaluated species of edible ectomycorrhizal mushrooms have an enormous potential in the controlled mycorrhization of P. greggii.
La ectomicorriza es una simbiosis mutualista que se establece entre las raíces de gimnospermas y angiospermas y alrededor de 20.000 especies de hongos, principalmente basidiomycetes y ascomycetes50. Los hongos ectomicorrícicos están involucrados en la movilización de nutrientes, tanto minerales como orgánicos, del suelo a las plantas hospedantes asociadas, así como en su protección contra patógenos y en el incremento de la tolerancia a factores de estrés, entre ellos sequía, presencia de metales pesados, salinidad y alta temperatura46,60.
La bioinoculación con hongos ectomicorrícicos en la producción de plantas ha cobrado gran interés en países con tradición forestal, dado que se ha demostrado que plantas ectomicorrizadas tienen con frecuencia mayor crecimiento y contenido de nutrientes, y también mayor posibilidad de supervivencia al ser trasplantadas de vivero a campo4,19,55,57. La selección de las combinaciones óptimas de micobiontes y fitobiontes es un factor clave en la inoculación exitosa de árboles de importancia forestal, dado que frecuentemente existen hongos que originan mayores beneficios en relación con otros, en una especie hospedera dada11,12,36. Uno de los criterios de selección, que ha cobrado gran interés en las últimas décadas, es la comestibilidad de los cuerpos fructíferos de los micobiontes, debido a que los hongos comestibles silvestres constituyen un producto forestal no maderable de enorme importancia económica, ecológica y cultural en diversas partes del mundo17,43,45,70.
La micorrización controlada de plantas requiere modificaciones de los métodos convencionales de producción en vivero, ya que la composición de los sustratos, la fertilización química y la esterilización del medio de crecimiento, entre otros, son factores clave que afectan diferencialmente la colonización ectomicorrízica21,61,68.
Diversos estudios han demostrado que la composición de los sustratos y la fertilización química afectan la micorrización y el crecimiento de plantas inoculadas con hongos ectomicorrícicos23–25,54,59,65. Sin embargo, existe escasa información de cómo el contenido de nutrientes y la movilización, principalmente de micronutrientes, resultan afectados por la composición de los sustratos y la fertilización química en plantas micorrizadas artificialmente.
La mayor parte de la información generada con relación a la influencia de la composición del sustrato en el crecimiento de hospederos asociados y ectomicorrización se ha centrado en especies forestales de distribución boreal y templada; en contraste, las especies de importancia subtropical y tropical han sido escasamente estudiadas.
Pinus greggii Engelm. (pino neotropical nativo de Mesoamérica) es una especie de gran importancia económica y ecológica a nivel internacional por dos motivos: 1) su madera se utiliza ampliamente en la industria de aserrío; 2) tiene un rápido crecimiento, por lo que es muy utilizada en plantaciones comerciales y en reforestaciones para la recuperación de suelos degradados20,66,69. Por estas características, se han establecido exitosamente plantaciones de esta especie tropical y subtropical en Brasil, Sudáfrica, India y Nepal16,22,26.
La diversidad y funcionalidad de las ectomicorrizas de dicha especie arbórea han sido escasamente estudiadas. Por su parte, los géneros de hongos comestibles ectomicorrícicos utilizados, Hebeloma y Laccaria, tienen una distribución cosmopolita y una gran diversidad de especies. Mueller33 reconoció 75 especies a nivel mundial para el género Laccaria y, en el caso de Hebeloma se ha estimado que existen de 250 a 600 especies7. Las especies Laccaria bicolor (Maire) P.D. Orton, Laccaria laccata (Scop.) Cooke y Hebeloma leucosarx P.D. Orton se seleccionaron debido a su enorme importancia social, económica y cultural en el centro de México10,44. Adicionalmente, estas son especies pioneras que se asocian con estadios tempranos de sus hospederos y están adaptadas a condiciones de baja fertilidad34,63.
En el presente trabajo se evaluó el efecto sobre el crecimiento, el contenido de macronutrientes (N, P, K, Ca y Mg) y micronutrientes (Na, Fe, Cu, Mn y Zn) y la micorrización controlada de la inoculación con tres hongos comestibles ectomicorrícicos ampliamente consumidos y de gran importancia económica, social y cultural en el centro de México: L. laccata, L. bicolor y H. leucosarx.
Materiales y métodosMaterial vegetal y fúngicoLos bioensayos fueron efectuados en el Área de Microbiología del Colegio de Posgraduados, Texcoco, México. Los esporomas de L. bicolor, L. laccata y H. leucosarx empleados para producir el inóculo ectomicorrícico fueron adquiridos en el mercado de Ozumba, estado de México (fig. 1a). Estos esporomas fueron recolectados en los bosques de pinos aledaños a la comunidad de Ozumba, ubicada a 19°02’ de latitud norte y 98°48’14” de longitud oeste. Se utilizaron semillas de P. greggii provenientes de bosques naturales de Xochicoatlán, Hidalgo.
Aspectos generales del bioensayo. Venta de hongos comestibles ectomicorrícicos Laccaria spp. y H. leucosarx en el mercado de Ozumba, México a); preparación de inóculo en un deshidratador b); efecto de la inoculación ectomicorrícica con H. leucosarx (Hl), L. bicolor (Lb) y L. laccata (Ll) en comparación con plantas testigo (T) no inoculadas crecidas en el sustrato experimental c) o en el sustrato comercial d); ectomicorriza de L. bicolor mostrando la micromorfología de los morfotipos con textura gelatinosa e) y el manto (m), la red de Hartig (rH) y el micelio externo (me) f); ectomicorriza de H. leucosarx mostrando abundantes hifas emanantes (he) g) y micelio externo (me), manto (m) y red de Hartig (rH) h).
El inóculo se obtuvo a partir de esporomas frescos, de los cuales se cortaron los píleos de sus estípites y se deshidrataron a 35°C en un secador de frutas (JERSA, Cuautitlán Izcalli, México) (fig. 1b). Los píleos deshidratados de cada especie fúngica se molieron y el inóculo final así obtenido se almacenó en viales de 1,5ml a 5°C hasta su utilización. Las semillas se desinfectaron con H2O2 al 30% durante 20 min y luego se enjuagaron tres veces con agua estéril. Para el cultivo de las plantas se utilizaron contenedores (tubetes de plástico negro) de 130 cm3 (Merck, Baltimore, EE. UU.), previamente lavados y desinfectados con alcohol al 70%. Estos se llenaron con el sustrato (al 90% del volumen del contenedor) y se sembraron las semillas. Cuatro meses después se aplicó el inóculo fresco de esporomas efectuando una oquedad cilíndrica de 5mm de diámetro por 20mm de profundidad en la parte superior del sustrato, en cuyo interior se colocó el inóculo ectomicorrícico deshidratado. Finalmente se cubrió cada oquedad con el sustrato. Cada planta recibió 107 a 108 esporas de los hongos inoculados, según conteos previos realizados en cámara de Neubauer (Marienfeld, Lauda-Königshofen, Alemania). En estas condiciones, se produjeron plantas micorrizadas de P. greggii, las cuales fueron mantenidas en un invernadero durante 12 meses bajo una temperatura media anual de 20°C (9°C y 31°C de mínima y máxima, respectivamente), una humedad media anual de 47% (23 y 81% la humedad mínima y máxima, respectivamente) y un fotoperíodo promedio anual de 11,9 h (10,9 h y 13,1 h el fotoperíodo mínimo y máximo respectivamente).
Se seleccionaron plantas de P. greggii de 12 meses de viverización con un porcentaje de micorrización de 90% o superior, para ser trasplantadas a recipientes de 5 litros. Paralelamente, se produjeron plantas no micorrizadas, bajo las mismas condiciones. En esta etapa se utilizaron en los recipientes de 5 l dos tipos de sustrato: 1) una mezcla de arena, corteza de pino compostada y suelo forestal de textura franco arenosa, en una proporción 2:2:1; este fue el «sustrato experimental»; 2) una mezcla de 60% de peatmoss, 20% de vermiculita (Agrolita de México, ciudad de México), 15% de agrolita, 5% de corteza y el fertilizante de liberación lenta Osmocote®, en una proporción de 2g/l, cuya composición N-P-K es 15-9-12g/l; este fue el «sustrato comercial». Estos sustratos se esterilizaron en autoclave a 1,3kg/cm3 y a 125°C durante 5h, se repitió la esterilización en tres días consecutivos, antes de montar el experimento.
Tanto las plantas inoculadas como las no inoculadas permanecieron 12 meses más en las macetas de 5 l, durante este tiempo fueron regadas cada tres días a capacidad de campo con agua destilada estéril.
Diseño experimental y análisis estadísticoEl diseño experimental fue completamente al azar. Las plantas de P. greggii fueron inoculadas con tres especies de hongos: 1) L. laccata, 2) L. bicolor, 3) H. leucosarx; el tratamiento 4) correspondió a las plantas testigos sin inocular. Estos tratamientos se hicieron crecer en el sustrato experimental o en el sustrato comercial en las macetas de 5 l, de modo que se obtuvieron 8 tratamientos con 7 réplicas y un total de 56 unidades experimentales. Se realizó un análisis de varianza y cuando existieron diferencias entre tratamientos para las variables evaluadas, se analizaron los datos mediante la prueba de Tukey para la comparación de medias con un p ≤ 0,0553. El número de repeticiones que se consideraron para el análisis estadístico fue de cuatro para evaluar la altura, el diámetro del tallo y el peso seco; y de tres para evaluar el porcentaje de colonización ectomicorrícica y el contenido de macro- y micronutrientes.
Evaluación de variablesTodas las plantas de P. greggii fueron cosechadas 24 meses después de la siembra. Para ello se extrajeron las plantas de las macetas, separando la parte aérea de la parte radical (cepellón). Posteriormente, la mezcla de raíces y suelo contenida en los cepellones se lavó con agua corriente y se utilizó un tamiz de malla 16 (Grupo FIICSA, ciudad de México) de 1,18mm de abertura, con la finalidad de recuperar la mayor cantidad posible de raíces. Se evaluó la totalidad de raíces cortas vivas micorrizadas, vivas no micorrizadas y muertas para estimar el porcentaje de colonización ectomicorrícica8,30. El promedio de raíces cortas totales evaluadas por planta fue de 2.759. La parte aérea y la radical fueron deshidratadas en estufa de secado a 80°C para evaluar su peso seco. Adicionalmente, se realizó un análisis de macro- (N, P, K, Mg y Ca) y micronutrientes (Fe, Mn, Zn, Na y Cu). El N se determinó por digestión húmeda5; el P total, según el método de Allen et al.2; el K, mediante extracción con acetato de amonio y medición por fotometría de llama; y el Ca y el Mg mediante determinación colorimétrica en un espectrofotómetro de absorción atómica (Varian SpectrAA 220, Palo Alto, California, EE. UU.). Los micronutrientes Fe, Mn, Zn, Na y Cu fueron evaluados por absorción atómica, previa digestión con una mezcla de HNO3 y HClO4 en proporción 2:1.
ResultadosAltura, diámetro del tallo y peso secoIndependientemente de la especie de hongo utilizado en la inoculación, existió una mayor altura y diámetro del tallo en las plantas crecidas en el sustrato comercial con relación a aquellas crecidas en el sustrato experimental (figs. 1c y d; tabla 1). Plantas de 24 meses de edad mostraron diferencias significativas en estas variables (Tukey p≤0,05) entre los dos tipos de sustratos para todos los tratamientos inoculados. Una tendencia similar se observó en las plantas no inoculadas. Adicionalmente, existió siempre mayor altura y diámetro del tallo en las plantas inoculadas en comparación con las no inoculadas, independientemente del hongo ectomicorrícico empleado.
Peso seco de parte aérea y parte radical, altura y diámetro del tallo de P. greggii, de 24 meses de edad inoculado con tres hongos, crecido en dos sustratos
| Tratamiento | Parte aérea (g) | Raíz (g) | Total (g) | Altura (cm) | Diámetro del tallo (mm) |
|---|---|---|---|---|---|
| Sustrato comercial Plantas inoculadas | |||||
| H leucosarx | 42,55±4,02 a | 20,27±1,06 a | 62,88±4,73 a | 108,74±10,75 a | 12,09±0,43 a |
| L. bicolor | 41,39±1,26 b | 14,93±0,23 b | 56,32±1,49 b | 100,50±3,88 a | 13,30±2,19 a |
| L. laccata | 42,59±2,64 a | 11,73±2,13 b | 54,37±3,09 b | 90,00±6,54 a | 10,85±0,27 a |
| Plantas sin inocular | 3,55±0,70 c | 3,20±3,14 c | 6,75±3,80 c | 61,33±7,53 b | 7,22±0,64 b |
| Sustrato experimental Plantas inoculadas | |||||
| H. leucosarx | 7,08±0,28 a | 4,80±0,46 a | 11,88±0,29 a | 61,00±1,15 a | 7,59±0,68 a |
| L. bicolor | 6,95±0,28 a | 3,73±0,26 a | 10,69±0,16 a | 56,33±5,23 a | 7,12±0,47 a |
| L. laccata | 6,74±0,85 a | 4,80±0,46 a | 11,54±1,27 a | 57,00±7,03 a | 7,65±1,18 a |
| Plantas sin inocular | 2,13±0,26 b | 2,13±0,27 b | 4,26±0,52 b | 30,66±5,81 b | 4,08±0,34 b |
Los datos son promedios±error estándar de la media, n=4, valores con la misma letra en la misma columna, para cada tipo de sustrato, son iguales de acuerdo con Tukey (p ≤ 0,05).
Se encontró mayor producción de biomasa aérea en plantas crecidas en el sustrato comercial en comparación con aquellas crecidas en el sustrato experimental, tanto en plantas inoculadas como no inoculadas. Estas diferencias fueron particularmente evidentes en plantas inoculadas con H. leucosarx y con L. laccata, tanto para la biomasa aérea como la biomasa total. Estas diferencias fueron menos evidentes en el caso de la biomasa radical, sobre todo en plantas crecidas en el sustrato experimental.
Hubo siempre mayor crecimiento en plantas inoculadas en comparación con aquellas no inoculadas, tanto en el sustrato comercial como en el sustrato experimental (tabla 1 y figs. 1c y d).
Colonización micorrícicaEn general, existió mayor colonización ectomicorrícica (figs. 1e-h) en plantas inoculadas en comparación con plantas no inoculadas, independientemente del hongo empleado. Esto fue bien evidente 24 meses después del trasplante (figura 2). Un contraste se registró en el caso de plantas crecidas en el sustrato comercial, en las que de los tres hongos evaluados, solo L. bicolor presentó mayor colonización (Tukey p ≤ 0,05) en comparación con L. laccata y H. leucosarx (figura 2). Existió una mayor colonización en las plantas crecidas en el sustrato experimental comparadas con aquellas crecidas en el sustrato comercial. Los porcentajes de colonización ectomicorrícica alcanzaron hasta el 30% (figura 2).
Porcentaje de colonización de plantas de P. greggii inoculadas con tres hongos comestibles ectomicorrícicos, a los 12 y 24 meses del trasplante a contenedores de 5 l. Hl=H. leucosarx; Lb=L. bicolor y Ll=L. laccata. Barras con la misma letra para cada fecha en cada tratamiento, son iguales de acuerdo con el test de Tukey (p ≤ 0,05). Los valores son promedios±error estándar de la media (n=3).
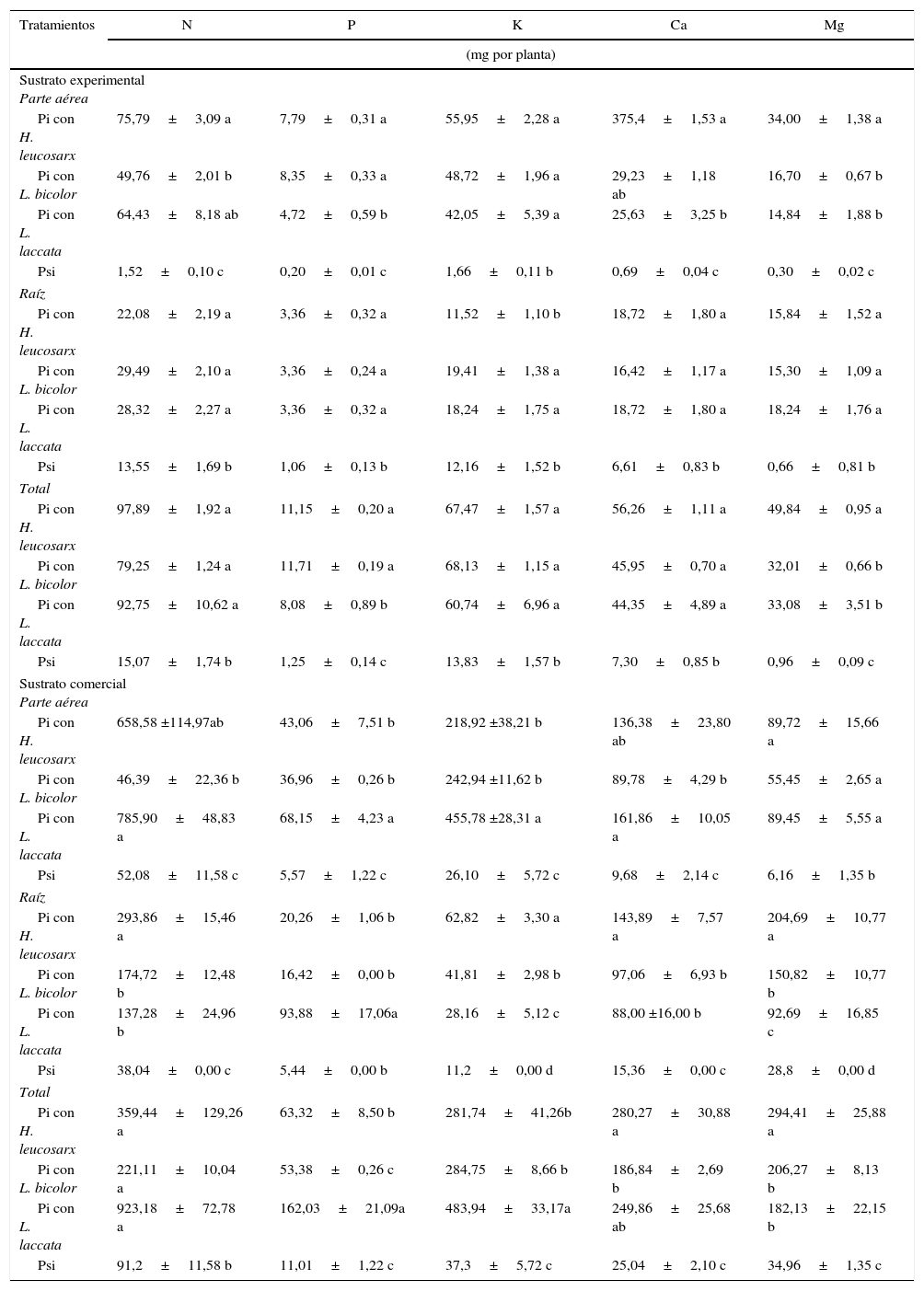
Macronutrientes. En general se observó mayor contenido de macronutrientes tanto en la parte aérea como radicular en las plantas inoculadas a los 24 meses. Esta tendencia fue independiente, de la especie de hongo y del sustrato (tablas 2 y 3). El contenido de macro- y micronutrientes fue generalmente mayor cuando las plantas fueron crecidas en el sustrato comercial en comparación con plantas crecidas en el sustrato experimental (tablas 2 y 3).
Contenido de macronutrientes de P. greggii, de 24 meses de edad, inoculado con tres hongos, crecidos en dos sustratos
| Tratamientos | N | P | K | Ca | Mg |
|---|---|---|---|---|---|
| (mg por planta) | |||||
| Sustrato experimental Parte aérea | |||||
| Pi con H. leucosarx | 75,79±3,09 a | 7,79±0,31 a | 55,95±2,28 a | 375,4±1,53 a | 34,00±1,38 a |
| Pi con L. bicolor | 49,76±2,01 b | 8,35±0,33 a | 48,72±1,96 a | 29,23±1,18 ab | 16,70±0,67 b |
| Pi con L. laccata | 64,43±8,18 ab | 4,72±0,59 b | 42,05±5,39 a | 25,63±3,25 b | 14,84±1,88 b |
| Psi | 1,52±0,10 c | 0,20±0,01 c | 1,66±0,11 b | 0,69±0,04 c | 0,30±0,02 c |
| Raíz | |||||
| Pi con H. leucosarx | 22,08±2,19 a | 3,36±0,32 a | 11,52±1,10 b | 18,72±1,80 a | 15,84±1,52 a |
| Pi con L. bicolor | 29,49±2,10 a | 3,36±0,24 a | 19,41±1,38 a | 16,42±1,17 a | 15,30±1,09 a |
| Pi con L. laccata | 28,32±2,27 a | 3,36±0,32 a | 18,24±1,75 a | 18,72±1,80 a | 18,24±1,76 a |
| Psi | 13,55±1,69 b | 1,06±0,13 b | 12,16±1,52 b | 6,61±0,83 b | 0,66±0,81 b |
| Total | |||||
| Pi con H. leucosarx | 97,89±1,92 a | 11,15±0,20 a | 67,47±1,57 a | 56,26±1,11 a | 49,84±0,95 a |
| Pi con L. bicolor | 79,25±1,24 a | 11,71±0,19 a | 68,13±1,15 a | 45,95±0,70 a | 32,01±0,66 b |
| Pi con L. laccata | 92,75±10,62 a | 8,08±0,89 b | 60,74±6,96 a | 44,35±4,89 a | 33,08±3,51 b |
| Psi | 15,07±1,74 b | 1,25±0,14 c | 13,83±1,57 b | 7,30±0,85 b | 0,96±0,09 c |
| Sustrato comercial Parte aérea | |||||
| Pi con H. leucosarx | 658,58 ±114,97ab | 43,06±7,51 b | 218,92 ±38,21 b | 136,38±23,80 ab | 89,72±15,66 a |
| Pi con L. bicolor | 46,39±22,36 b | 36,96±0,26 b | 242,94 ±11,62 b | 89,78±4,29 b | 55,45±2,65 a |
| Pi con L. laccata | 785,90±48,83 a | 68,15±4,23 a | 455,78 ±28,31 a | 161,86±10,05 a | 89,45±5,55 a |
| Psi | 52,08±11,58 c | 5,57±1,22 c | 26,10±5,72 c | 9,68±2,14 c | 6,16±1,35 b |
| Raíz | |||||
| Pi con H. leucosarx | 293,86±15,46 a | 20,26±1,06 b | 62,82±3,30 a | 143,89±7,57 a | 204,69±10,77 a |
| Pi con L. bicolor | 174,72±12,48 b | 16,42±0,00 b | 41,81±2,98 b | 97,06±6,93 b | 150,82±10,77 b |
| Pi con L. laccata | 137,28±24,96 b | 93,88±17,06a | 28,16±5,12 c | 88,00 ±16,00 b | 92,69±16,85 c |
| Psi | 38,04±0,00 c | 5,44±0,00 b | 11,2±0,00 d | 15,36±0,00 c | 28,8±0,00 d |
| Total | |||||
| Pi con H. leucosarx | 359,44±129,26 a | 63,32±8,50 b | 281,74±41,26b | 280,27±30,88 a | 294,41±25,88 a |
| Pi con L. bicolor | 221,11±10,04 a | 53,38±0,26 c | 284,75±8,66 b | 186,84±2,69 b | 206,27±8,13 b |
| Pi con L. laccata | 923,18±72,78 a | 162,03±21,09a | 483,94±33,17a | 249,86±25,68 ab | 182,13±22,15 b |
| Psi | 91,2±11,58 b | 11,01±1,22 c | 37,3±5,72 c | 25,04±2,10 c | 34,96±1,35 c |
Pi:plantas inoculadas; Psi:plantas sin inocular.
Los valores son promedios±error estándar de la media, n=3.Valores con la misma letra en la misma columna, para cada parte vegetal, en cada sustrato, son iguales de acuerdo con Tukey (p ≤ 0,05).
Contenido de micronutrientes de P. greggii, de 24 meses de edad inoculado con tres hongos, crecido en dos sustratos
| Tratamientos | Na | Fe | Cu | Zn | Mn |
|---|---|---|---|---|---|
| (μg por planta) | |||||
| Sustrato experimental | |||||
| Parte aérea | |||||
| Pi con H. leucosarx | 2,01±0,08 a | 1.055,41±43,13 a | 14,16±0,57 a | 1.870±76,42 a | 5.100,00± 208,44 a |
| Pi con L. bicolor | 0,41±0,016a | 692,52±27,97 b | 6,96±0,28 b | 288,84±11,66 b | 3.908,04±157,85ab |
| Pi con L. laccata | 2,32±0,29 a | 576,84±73,24 b | 16,86±2,14 a | 209,16±26,55bc | 3.440,08±436,90b |
| Psi | 0,05±0,03 c | 17,25±1,15 c | 0,09±0,06 c | 8,04±0,56 c | 33,45±2,23c |
| Raíz | |||||
| Pi con H. leucosarx | 0,96±0,09 a | 18.712,08±1.800,64 a | 140,4±1,38 c | 1.471,02±141,56 a | 1.392,00±133,94 b |
| Pi con L. bicolor | 1,21±0,08 a | 14.897,86±1.064,13ab | 44,08±3,20 a | 190,04±13,60 b | 5.249,06±374,93 a |
| Pi con L. laccata | 0,40±0,39 a | 12.336,00±1.187,03b | 28,08±2,77 b | 156,00 ±15,01b | 1.116,00±107,38 bc |
| Psi | 0,67±0,08 a | 3.749,33±468,66c | 6,04±0,26 d | 89,06±11,2 b | 233,06±29,2 c |
| Total | |||||
| Pi con H. leucosarx | 2,97±0,05 a | 19.768,21±1.766,85 a | 28,56±0,99 b | 3.341,02±94,00a | 6.492,00±131,91b |
| Pi con L. bicolor | 1,62±0,07 b | 15.590,38±1.041,37ab | 51,76±2,97 a | 479,24±7,83b | 9.157,01±262,01a |
| Pi con L. laccata | 2,73±0,35 a | 12.912,84±1.251,00 b | 45,66±4,74 a | 365,14±40,26b | 4.556,08±532,61c |
| Psi | 0,67±0,08 c | 3.766,25±469,24 c | 7,03±0,30 c | 98,00±11,49 c | 266,51±30,37 d |
| Sustrato comercial | |||||
| Parte aérea | |||||
| Pi con H. leucosarx | 1,25±0,21b | 1.920,11±335,20b | 143,56±25,06a | 1.686,83±294,48ab | 8.344,42±1.456,73b |
| Pi con L. bicolor | 4,35±0,20 a | 1.175,09±56,23b | 66,01±3,15b | 1.082,67±51,81b | 4.898,43±234,40b |
| Pi con L. laccata | 1,49±0,09b | 40.019,56±2.486,59 a | 191,68±11,91 a | 1.916,85±119,10 a | 12.885,49±800,63a |
| Psi | 0,11±0,02c | 280,13±61,48b | 3,153±0,69c | 136,4±29,93c | 912,26±200,22c |
| Raíz | |||||
| Pi con H. leucosarx | 2,02±0,10b | 39.763,02±20.292,08b | 618,13±32,53 a | 1317,33±69,33 a | 1.742,93±91,73 a |
| Pi con L.bicolor | 2,53±0,18 a | 54.499,02±3.892,08a | 433,06±30,93b | 978,13±69,86 a | 1.351,46±96,53 a |
| Pi con L. laccata | 0,70±0,12c | 20.146,13±3,66c | 410,66±74,66b | 198,76±191,02b | 932,08±169,09b |
| Psi | 0,88±7,85c | 14.808,00±0,00d | 84,08±0,00c | 291,02±0,00b | 307,02±0,00c |
| Total | |||||
| Pi con H. leucosarx | 3,28±0,31b | 41.683,31±2.403,18b | 761,69±56,37 a | 3.004,16±358,98 a | 10.087,35±1.541,07ab |
| Pi con L. bicolor | 6,89±0,03a | 55.674,29±3.836,88ab | 499,08±27,79b | 2.060,80±19,13b | 6.249,09±138,78b |
| Pi con L. laccata | 2,19±0,21c | 60.165,70±6.059,29 a | 602,35±85,95ab | 2.115,61±126,3ab | 13.818,29±961,73 a |
| Psi | 0,99±0,02d | 15.088,13±61,48c | 87,95±0,69c | 427,06±29,93c | 1219,46±200,22c |
Pi:plantas inoculadas; Psi:plantas sin inocular.
Los valores son promedios±error estándar de la media, n=3. Valores con la misma letra en la misma columna, para cada parte vegetal, son iguales de acuerdo con Tukey (p ≤ 0,05).
En las plantas crecidas en el sustrato experimental se observaron diferentes tendencias en el contenido de macronutrientes dependiendo de las especies de hongos ectomicorrícicos utilizados, de la parte de la planta analizada, y del macronutriente evaluado. En la parte aérea, el contenido de todos los macronutrientes excepto el K fue mayor en las plantas inoculadas con H. leucosarx que en las inoculadas con L. bicolor o L. laccata. Contrariamente, el contenido de macronutrientes no varió en la raíz de plantas inoculadas, excepto el K, cuyo contenido fue menor en plantas inoculadas con H. leucosarx en comparación con plantas inoculadas con L. bicolor o L. laccata.
En lo concerniente a macronutrientes totales, se observaron diferencias en el contenido de Mg en plantas inoculadas con H. leucosarx en comparación con plantas inoculadas con L. bicolor o L. laccata (tabla 2). No existieron diferencias en el contenido total de N, K y Ca entre plantas inoculadas con diferentes hongos crecidas en sustrato experimental.
El contenido de macronutrientes de las plantas crecidas en el sustrato comercial mostró una tendencia distinta a aquellas crecidas en el sustrato experimental. El contenido de macronutrientes en la parte aérea en este caso fue mayor en plantas inoculadas con L. laccata en comparación con plantas inoculadas con L. bicolor y H. leucosarx, excepto el Mg. El mayor contenido de macronutrientes en la raíz de plantas crecidas en el sustrato comercial se registró en aquellas inoculadas con H. leucosarx, pero el contenido más alto de P no se registró en estas plantas, sino en las inoculadas con L. laccata.
No se observaron diferencias entre plantas inoculadas con diferentes hongos en el contenido de N. Las plantas inoculadas con L. laccata presentaron los mayores contenidos de P y K en comparación con plantas inoculadas con los otros dos hongos, y las plantas inoculadas con H. leucosarx presentaron mayor contenido de Mg que plantas inoculadas con L. bicolor o L. laccata (tabla 2).
Micronutrientes. En la parte aérea de plantas crecidas en el sustrato experimental, el contenido de Fe y Zn fue mayor cuando fueron inoculadas con H. leucosarx, en comparación con las plantas inoculadas con alguno de los otros dos hongos y con plantas no inoculadas. El mayor contenido de Cu y Zn de la raíz se registró en plantas inoculadas con H. leucosarx. Se observó una mayor cantidad total de Zn en plantas inoculadas con H. leucosarx comparadas con plantas inoculadas con L. bicolor o L. laccata, y un mayor contenido de Mn en plantas inoculadas con L. bicolor en comparación con plantas inoculadas con cualquiera de los otros dos hongos y con plantas no inoculadas.
En las plantas crecidas en el sustrato comercial se observó una tendencia similar a la registrada en las plantas crecidas en el sustrato experimental. El contenido de Fe y Mn en la parte aérea fue mayor en plantas inoculadas con L. laccata en comparación con plantas inoculadas con L. bicolor y H. leucosarx. El mayor contenido de Na y Fe se observó en plantas inoculadas con L. bicolor y la mayor cantidad de Cu se registró en plantas inoculadas con H. leucosarx en comparación con plantas inoculadas con L. laccata, L. bicolor o con el testigo sin inocular. Se observó mayor contenido total de Na en plantas inoculadas con L. bicolor en comparación con plantas inoculadas con L. laccata o H. leucosarx.
Relaciones de nutrientes parte aérea: raízEl análisis de las relaciones del contenido de nutrientes entre la parte aérea y la raíz nos permite comparar plantas inoculadas versus plantas no inoculadas y conocer así la eficiencia de translocación de nutrientes medida por los hongos ectomicorrícicos, no solo a la raíz, sino también a la parte aérea. Según estas relaciones, en el caso de translocación de macronutrientes en plantas crecidas en el sustrato experimental las proporciones fueron mayores que las observadas en plantas crecidas en sustrato comercial (tabla 4). Adicionalmente, existieron claras diferencias en la transferencia nutricional a la parte aérea de los pinos inoculados con las distintas especies fúngicas. Las mayores translocaciones de macronutrientes a la parte aérea se observaron en plantas inoculadas con H. leucosarx, las cuales translocaron principalmente N, K y Mg cuando las plantas fueron crecidas en sustrato experimental. L. laccata translocó principalmente Ca en dicho sustrato. Una tendencia similar se observó en el caso de algunos micronutrientes como Na con L. bicolor, y Mn con H. leucosarx, en el sustrato experimental (tabla 4).
Relaciones parte aérea: raíz de macro- y micronutrientes de P. greggii, de 24 meses de edad inoculado con tres hongos, crecido en dos sustratos
| Tratamientos | N | P | K | Ca | Mg | Na | Fe | Cu | Zn | Mn |
|---|---|---|---|---|---|---|---|---|---|---|
| Sustrato experimental | ||||||||||
| Pi con H. leucosarx | 3,43 | 2,31 | 4,85 | 2,00 | 2,14 | 2,09 | 0,05 | 0,10 | 1,27 | 3,66 |
| Pi con L. laccata | 1,68 | 2,48 | 2,53 | 2,51 | 1,09 | 0,33 | 0,04 | 0,15 | 1,51 | 0,74 |
| Pi con L. bicolor | 2,27 | 1,40 | 2,30 | 1,36 | 0,81 | 5,08 | 0,04 | 0,60 | 1,34 | 3,08 |
| Psi | 0,11 | 0,18 | 0,13 | 0,10 | 0,45 | 0,07 | 0,004 | 1,49 | 0,09 | 0,14 |
| Pi con H. leucosarx:Psi | 31,18 | 12,83 | 37,31 | 20,0 | 4,74 | 29,86 | 12,5 | 0,07 | 14,11 | 26,14 |
| Pi con L. laccata:Psi | 0,74 | 13,78 | 19,46 | 25,1 | 2,42 | 4,71 | 10,0 | 0,10 | 16,78 | 5,29 |
| Pi con L. bicolor:Psi | 20,64 | 7,78 | 17,69 | 13,60 | 1,80 | 82,86 | 10,0 | 0,40 | 14,89 | 22,00 |
| Sustrato comercial | ||||||||||
| Pi con H. leucosarx | 0,22 | 2,12 | 3,48 | 0,94 | 0,43 | 0,61 | 0,04 | 0,23 | 12,28 | 4,74 |
| Pi con L. laccata | 0,24 | 2,25 | 5,81 | 0,92 | 0,36 | 1,71 | 0,02 | 0,15 | 1,10 | 3,62 |
| Pi con L. bicolor | 5,72 | 0,72 | 16,18 | 1,83 | 0,96 | 2,12 | 1,98 | 0,46 | 9,64 | 13,82 |
| Psi | 1,36 | 1,02 | 2,33 | 0,63 | 0,21 | 0,12 | 0,01 | 0,03 | 0,46 | 2,97 |
| Pi con H. leucosarx:Psi | 0,16 | 2,08 | 1,49 | 1,49 | 2,05 | 5,08 | 4,00 | 7,67 | 26,70 | 1,60 |
| Pi con L. laccata:Psi | 0,18 | 2,21 | 2,49 | 1,49 | 1,71 | 14,25 | 2,00 | 5,00 | 2,39 | 1,22 |
| Pi con L. bicolor:Psi | 4,21 | 0,71 | 6,94 | 2,90 | 4,47 | 17,67 | 198 | 15,33 | 20,96 | 4,65 |
Pi:plantas inoculadas; Psi:plantas sin inocular.
Los valores son promedios±error estándar de la media, n=3. Valores con la misma letra en la misma columna, para cada parte vegetal, son iguales de acuerdo con Tukey (p ≤ 0,05).
En el presente trabajo se registró un efecto favorable en el crecimiento y contenido nutricional de la especie neotropical P. greggii cuando se realizó la micorrización controlada con cualquiera de las dos especies de Laccaria empleadas y con H. leucosarx. Estos resultados muestran el gran potencial que podría tener el inóculo esporal estas tres especies en la producción de plantas micorrizadas de P. greggii.
El hecho de que las especies de hongos aquí estudiados son ampliamente comercializadas en el centro de México10,44 simplifica la producción de inóculo esporal con los métodos empleados en este estudio, ya que es fácil conseguir estos hongos en los mercados locales. El efecto favorable en términos de crecimiento y contenido nutricional como consecuencia de la inoculación con especies de los géneros Laccaria y Hebeloma en otras gimnospermas, principalmente de distribución boreal y templada, ha sido documentado previamente en Pinus pinaster inoculado con L. laccata41; Pseudotsuga menziesii37,39,40, Pinus pinea39,47, P. pinaster39,40,42 y Pinus sylvestris13 inoculadas con L. bicolor; y en Pinus pseudostrobus inoculado con Hebeloma mesophaeum, L. bicolor y L. laccata9.
La importancia de la inoculación ectomicorrícica como un factor en la producción de plantas de interés forestal, para el incremento del contenido de macro- y micronutrientes, ha sido ampliamente documentada11. Se han informado incrementos en el contenido de macronutrientes (N, P, K y Mg) como consecuencia de la inoculación ectomicorrícica1,4,14,19,67. Los estudios referidos a los micronutrientes son más escasos; sin embargo, se ha documentado la transferencia de Fe y Zn como consecuencia de la inoculación ectomicorrícica6,51.
En el presente trabajo se comprobó la transferencia de Ca, Na y Mn en plantas de P. greggii inoculadas con L. laccata, L. bicolor y H. leucosarx, respectivamente. Después de 24 meses, las colonizaciones ectomicorrícicas fueron bajas en comparación con registros previos9,30,44. En plantas crecidas en el sustrato comercial (con adición de Osmocote®), las colonizaciones fueron de hasta 15%. Se observaron mayores colonizaciones, de hasta 30%, en plantas inoculadas crecidas en el sustrato experimental.
Se han documentado niveles de colonización similares a los encontrados en el presente estudio con la inoculación de diversas especies de hongos ectomicorrícicos. Trocha et al.63 informaron una colonización de 18 a 22% en raíces de Betula pendula con H. mesophaeum, en tanto que Rincón et al.48 registraron un 34% de micorrización por L. laccata en P. pinea. Por su parte, Jonsson et al.25 reportaron colonizaciones de 0 a 2,8% en P. sylvestris inoculado con Cenoccocum geophilum. Barroetaveña et al.3 reportaron colonizaciones de 11,4, 34,9 y 38,4% al inocular Pinus ponderosa con H. mesophaeum, Rhizopogon roseolus y Suillus luteus, respectivamente. Sin embargo, también se documentaron niveles de colonización superiores. Jonsson et al.25 registraron colonizaciones de 55 a 78% y de 95 a 99% en P. sylvestris inoculados con Hebeloma crustuliniforme y L. bicolor, respectivamente. Rincón et al.48 reportaron una colonización de 81,3% en P. pinea inoculado con Rhizopogon roseolus, mientras que Parladé et al.38 observaron colonizaciones de 50 a 80%, 84 y 90% por Tuber maculatum, Scleroderma citrinum y R. roseolus en P. pinaster, y Duñabeitia et al.15 comunicaron un porcentaje de colonización de 50 a 80% por R. roseolus en Pinus radiata.
La composición del sustrato puede influir en la colonización micorrícica. Al respecto, Rincón et al.48 encontraron que los porcentajes de colonización de diversos hongos ectomicorrícicos en plantas de P. pinea crecidas en turba y corteza fueron significativamente menores en comparación con plantas crecidas en turba y vermiculita. Estos autores reportaron reducciones significativas en la micorrización de pinos inoculados con Melanogaster ambiguus, Pisolithus tinctorius y Scleroderma verrucosum, las que pasaron de 30,9, 58 y 65,7%, respectivamente, a 0% en todos los casos como consecuencia del tipo de sustrato.
En el presente trabajo, se constató que las plantas crecidas en el sustrato con fertilizante de liberación lenta presentaron en general mayor biomasa aérea y radical, así como mayor contenido de macro- y micronutrientes en comparación con las plantas crecidas en el sustrato experimental, pero su colonización ectomicorrícica fue significativamente menor. Molina y Trappe32 informaron que la adición del fertilizante de liberación lenta Osmocote® originó reducciones en la colonización ectomicorrícica de P. menziesii inoculada con esporas de Rhizopogon vinicolor y Rhizopogon colossus. También se registraron reducciones moderadas (de 100 a 81%) en los porcentajes de colonización por P. tinctorius en Populus tremuloides con la aplicación de Osmocote®, en relación con plantas no fertilizadas28.
Diversas publicaciones dan cuenta de que la fertilización química en términos generales, reduce la colonización de diversos hongos ectomicorrícicos25,35,52,58,64. Sin embargo, Mason et al.31 reportaron que la reducción de la colonización ectomicorrícica de Hydnangeum carneum y Laccaria fraterna en Eucalyptus globulus depende principalmente de las dosis de fertilización fosfatada, más que de la fertilización nitrogenada. Estos autores encontraron que altas dosis de fertilización con P originaron reducciones en la colonización ectomicorrícica, independientemente de la fertilización nitrogenada, lo cual deja en claro la importancia de la interacción entre nutrientes minerales disponibles en la solución del suelo. Rincón et al.49 encontraron que la fuente de fertilización, incluyendo fertilizantes de liberación lenta o solubles, fue un factor que afectó diferencialmente la colonización ectomicorrícica de P. tinctorius y M. ambiguus en P. pinea, una especie de pino mediterráneo. Sin embargo, existen también estudios en los que la fertilización no fue un factor que no modificara los porcentajes de colonización ectomicorrícica, por ejemplo, los de R. roseolus en P. ponderosa29 y los de Hebeloma longicaudum, L. bicolor, Paxillus involutus, y P. tinctorius en diferentes especies de Pinus, Picea y Larix27. Esto podría demostrar que otro factor implicado en la influencia de la fertilización en la colonización ectomicorrícica sería la combinación de micobiontes y fitobiontes, dado que es poco probable que todas las combinaciones ectomicorrícicas presenten las mismas respuestas a la fertilización química.
Se ha demostrado previamente que la influencia de la fertilización en la colonización ectomicorrízica puede estar influenciada por diversos factores, dentro de los que se incluyen los siguientes: 1) las diferentes combinaciones de micobiontes-fitobiontes; 2) la interacción entre nutrientes, por ejemplo, relaciones N-P; y 3) las fuentes de fertilización, ya sean fertilizantes de liberaciones lentas o solubles. Asimismo, la frecuencia incrementada de fertilización puede modificar la estructura de las comunidades ectomicorrícicas presentes, dado que, por ejemplo, existen especies nitrofílicas que toleran altas tasas de fertilización, o que resultan beneficiadas con dicha práctica, tal es el caso de Thelephora terrestris, Hebeloma spp. y C. geophilum18,62. Ciertas especies como Piloderma spp. pueden resultar no afectadas, mientras que otras pueden ser más sensibles y reducir su abundancia relativa bajo dicha fertilización, como Suillus spp. y Cortinarius spp.24.
En el presente trabajo, se observó una reducción significativa en la colonización de las tres especies fúngicas en presencia del fertilizante de liberación lenta Osmocote®. La importancia de este hecho es que si las plantas crecidas en el sustrato comercial con el fertilizante químico Osmocote® son luego trasplantadas a áreas deforestadas, que carecen de propágulos ectomicorrícicos, a pesar de su mayor biomasa sus posibilidades de supervivencia serían más reducidas en comparación con las de aquellas plantas con menor biomasa crecidas en ausencia de Osmocote®, las cuales, por sus mayores porcentajes de colonización, tendrían mayores posibilidades de sobrevivir al ser trasplantadas a condiciones de campo. Como ya se ha demostrado la colonización ectomicorrízica es un factor crucial en la supervivencia de pinos al ser llevados de vivero a campo56.
En conclusión, las plantas del árbol neotropical P. greggii inoculadas con L. laccata, L. bicolor y H. leucosarx presentaron mayor altura, mayor diámetro del tallo y mayor biomasa aérea y radical en comparación con plantas no inoculadas, independientemente del sustrato de crecimiento. Una tendencia similar se observó en el contenido de macronutrientes, principalmente de N, K y Ca, y de micronutrientes, principalmente Na, Zn y Mn. A pesar de que las plantas crecidas en el sustrato comercial presentaron mayor biomasa aérea y radical, así como mayor contenido nutricional, tuvieron una colonización ectomicorrícica menor. Plantas crecidas en el sustrato experimental presentaron una mayor transferencia nutricional a la parte aérea, principalmente de N, P, Ca, K, Na y Mg, en comparación con las plantas crecidas en el sustrato comercial.
Los resultados de este estudio demuestran que las tres especies de hongos comestibles ectomicorrícicos evaluados, especies ampliamente comercializadas en el centro de México, constituyen una importante fuente potencial de inóculo ectomicorrícico para la producción de plantas de P. greggii, un pino nativo de Mesoamérica con gran potencial en el establecimiento de plantaciones y reforestaciones en áreas tropicales y subtropicales.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se agradece el apoyo financiero del proyecto CONACyT 246674.