La administración de soluciones con potasio puede causar hiperpotasemia durante la cirugía; la solución salina normal (SSN), usada tradicionalmente en trasplante renal, puede generar acidosis hiperclorémica.
ObjetivoComparar la seguridad del lactato de Ringer (LR) con SSN en el trasplante renal.
Estrategia de búsquedaSe realizó una revisión sistemática en el Registro Cochrane Central de ensayos controlados, Medline, Lilacs, EBSCO y Embase, en artículos de revisión y contactando clínicos expertos. No hubo restricción de idioma.
Criterios de selecciónSe incluyeron ensayos controlados aleatorizados en pacientes adultos sometidos a trasplante renal.
Recogida y análisis de datosDe forma independiente se realizó selección de estudios, evaluación de la calidad y extracción de datos. Se calculó la diferencia de medias con su intervalo de confianza del 95% (IC95%). Se evaluó la heterogeneidad con el estadístico I-cuadrado (I2). Se usaron los modelos de efectos fijos y aleatorios.
ResultadosSe incluyeron 4 estudios con un total de 237 pacientes. Al final de cirugía la diferencia de potasio no fue significativa (diferencia de medias [DM]: −0,26 mEq/l; IC95%: −0,58 a 0,05; p=0,10; I2: 75%), el pH fue menor en el grupo de SSN (DM: 0,06; IC95%: 0,05 a 0,08; p<0,001; I2: 17%). No hubo diferencia en la creatinina al tercer día postoperatorio (DM: −0,05; IC95%: −0,59 a 0,48; p=0,85; I2: 0%).
ConclusionesEl uso de LR comparado con SSN en el perioperatorio de trasplante renal genera menores niveles de potasio y cloro y mayor pH, sin cambios significativos en la creatinina.
Administration of solutions with potassium can produce hyperkalemia during surgery, so normal saline (NS) is used in kidney transplantation, but it is known to cause hypercloremic acidosis.
ObjectiveTo compare the safety of Lactated Ringer's Solution (LR) with NS in kidney transplantation.
Search strategyFor this updated review we searched Cochrane Central Register of Controlled Trials Medline (1966 to 2013), Lilacs (1982 to 2013), EBSCO and Embase (1980 to 2013), review articles and clinical experts. There was no language restriction.
Selection criteriaWe included randomized controlled trials (RCTs) in adults undergoing kidney transplantation.
Data collection and analysisWe independently performed study selection, risk of bias assessment and data extraction. We estimated mean difference with the confidence intervals of 95% (95%CI). We measured statistical heterogeneity using the I2 statistic. We used a random-effects and fixed models.
Mean resultsWe included a total of four RCTs involving 237 participants. At the end of surgery potassium level was lower in LR group (mean difference [MD]: −0.26 mEq/L; 95%CI: −0.58 to 0.05; P=.10; I2: 75%), pH was lower in NS group (MD: 0.06; 95%CI: 0.05 to 0.08; P<.001; I2: 17%). There was no difference in creatinine on the third post-operatory day (MD: −0.05; 95%CI: −0.59 to 0.48; P=.85; I2: 0%).
ConclusionsUse of LR produces lower potassium and chloride levels and higher pH, without changes in creatinine compared with NS in the perioperative period of kidney transplantation.
La fluidoterapia en el intraoperatorio de trasplante renal se ha realizado tradicionalmente con solución salina normal (SSN), pues la administración de grandes volúmenes en pacientes quirúrgicos de soluciones con potasio, como lactato de Ringer (LR), puede causar hiperpotasemia1. Se han publicados diversos trabajos sobre el tema, los cuales muestran que la administración de SSN en grandes volúmenes, como ocurre frecuentemente en los pacientes sometidos a trasplante renal, está asociada con acidosis metabólica hiperclorémica1-4.
Se sabe, basados en la teoría de Stewart, que los líquidos comúnmente administrados en cirugía pueden alterar el equilibrio ácido-base predisponiendo a acidosis metabólica por aumento del nivel de cloro5,6. Dicha acidosis puede generar hiperpotasemia por un movimiento transcelular de iones potasio hacia el exterior1-3,7. La hipercloremia a su vez puede causar vasoconstricción de la arteriola aferente causando daño al injerto renal2,3. Otras complicaciones derivadas de la acidosis pueden ser cambios en el estado mental y molestias abdominales por alteración en la vasculatura esplácnica7, e incluso se ha asociado a mayor mortalidad en pacientes quirúrgicos8.
El renal es el trasplante más frecuente en nuestro país y en el mundo9. Los resultados del trasplante renal han mejorado con el avance de las técnicas quirúrgicas, inmunosupresoras y de anestesia. La presencia de hiperpotasemia asociada a acidosis metabólica hiperclorémica puede ayudar a producir disfunción del injerto, por lo cual se deben evitar en estos pacientes10.
Se han publicado varios estudios que comparan el uso de LR con la SSN, pero incluyen pocos pacientes2,3,11-14. Realizamos un metaanálisis para evaluar los efectos de LR comparado con SSN en la incidencia de acidosis metabólica hiperclorémica, hiperpotasemia, volumen de líquidos infundidos y disfunción del injerto renal en los pacientes sometidos a trasplante renal.
MetodologíaEsta revisión sistemática se realizó con la metodología recomendada por la Colaboración Cochrane14. Este protocolo no ha sido publicado y no fue registrado.
Criterios de elegibilidadLa búsqueda incluyó ensayos clínicos controlados con asignación aleatorizada (ECA) sin restricción de lenguaje, fecha o estado de publicación, que compararan el uso de LR con SSN, como fluidoterapia en pacientes intervenidos para trasplante renal, mayores de 18años y que evaluaran como desenlaces el valor sérico de potasio, bicarbonato, cloro, creatinina y el pH en el postoperatorio. La fecha límite de publicación establecida para la búsqueda fue el 8 de julio de 2013.
Estrategias de búsquedaDe manera independiente, los 3 autores realizaron una búsqueda en bases de datos electrónicas, contactando clínicos expertos y buscando artículos de revisión. No se aplicaron restricciones por idioma, ni por fecha de publicación.
Las bases de datos consultadas fueron el Registro Cochrane Central de Ensayos Controlados, Medline (1966-2013), Lilacs (1982-2013), EBSCO y Embase (1980-2013).
Los términos de búsqueda fueron «trasplante renal», «acidosis», «acidemia», «hiperpotasemia», «disfunción de injerto», «lactato Ringer» y «solución salina».
Selección y evaluación de los estudiosDos de los autores revisaron de forma independiente todos los títulos y resúmenes identificados en la búsqueda bibliográfica y excluyeron los ensayos que no eran pertinentes. Se evaluaron los ensayos restantes en texto completo. Los desacuerdos se resolvieron con el tercer autor.
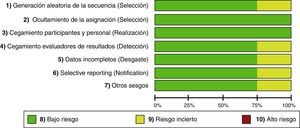
La validez de los estudios elegidos se evaluó independientemente por los 3 investigadores de acuerdo a la guía de la Colaboración Cochrane15, se valoró la generación de la secuencia aleatorizada, el ocultamiento de la secuencia, cegamiento, recogida de la información, pérdidas de seguimiento en el estudio, presencia de datos incompletos, informe selectivo de resultados y otros sesgos. Basados en esta metodología, se clasificaron los riesgos de sesgos como alto, incierto y bajo.
Recogida de datosPara el análisis de la información extraída de los estudios incluidos se usó una tabla de extracción de información, basada en las recomendaciones de Cochrane Consumers and Communication Review Group's data extraction template14. Los datos requeridos que no se encontraron a partir de la lectura directa de los artículos se solicitaron directamente a los autores. Del artículo que contenía la mayor muestra solo se pudo obtener el resumen en inglés, pero la versión completa estaba en idioma persa13. Se intentó contactar a los autores para obtener los datos completos, pero no fue posible. La información fue extraída de los estudios por un investigador, apegado a la tabla desarrollada, y la información obtenida fue revisada por un segundo investigador, garantizando certeza de los datos.
Resultados analizadosLos resultados analizados fueron promedio de potasio sérico en mEq/l en el postoperatorio, creatinina sérica en mg/dl al tercer día postoperatorio, pH después de cirugía, volumen en litros de solución infundida y bicarbonato y cloro en mEq/l en sangre arterial después de la cirugía.
Análisis estadísticoEn el presente metaanálisis se calculó la diferencia de medias con su respectivo intervalo de confianza del 95% (IC95%) para las variables consideradas. Usando el software Review Manager versión 5.1. se realizó un análisis por el modelo de efectos fijos o aleatorios de acuerdo a la presencia de heterogeneidad estadística. La presencia de heterogeneidad estadística se evaluó por la prueba Q de Cochrane y el estadístico I2. Si el I2 fue menor de 40%, nosotros usamos el modelo de efectos fijos, y si el I2 fue mayor de 40%, se usó el modelo de efectos aleatorios. Se realizó análisis de sensibilidad según la calidad metodológica de los estudios, retirando estudios y reanalizando los datos. Igualmente se realizó análisis de subgrupos según las características de los pacientes y forma de la intervención administrada.
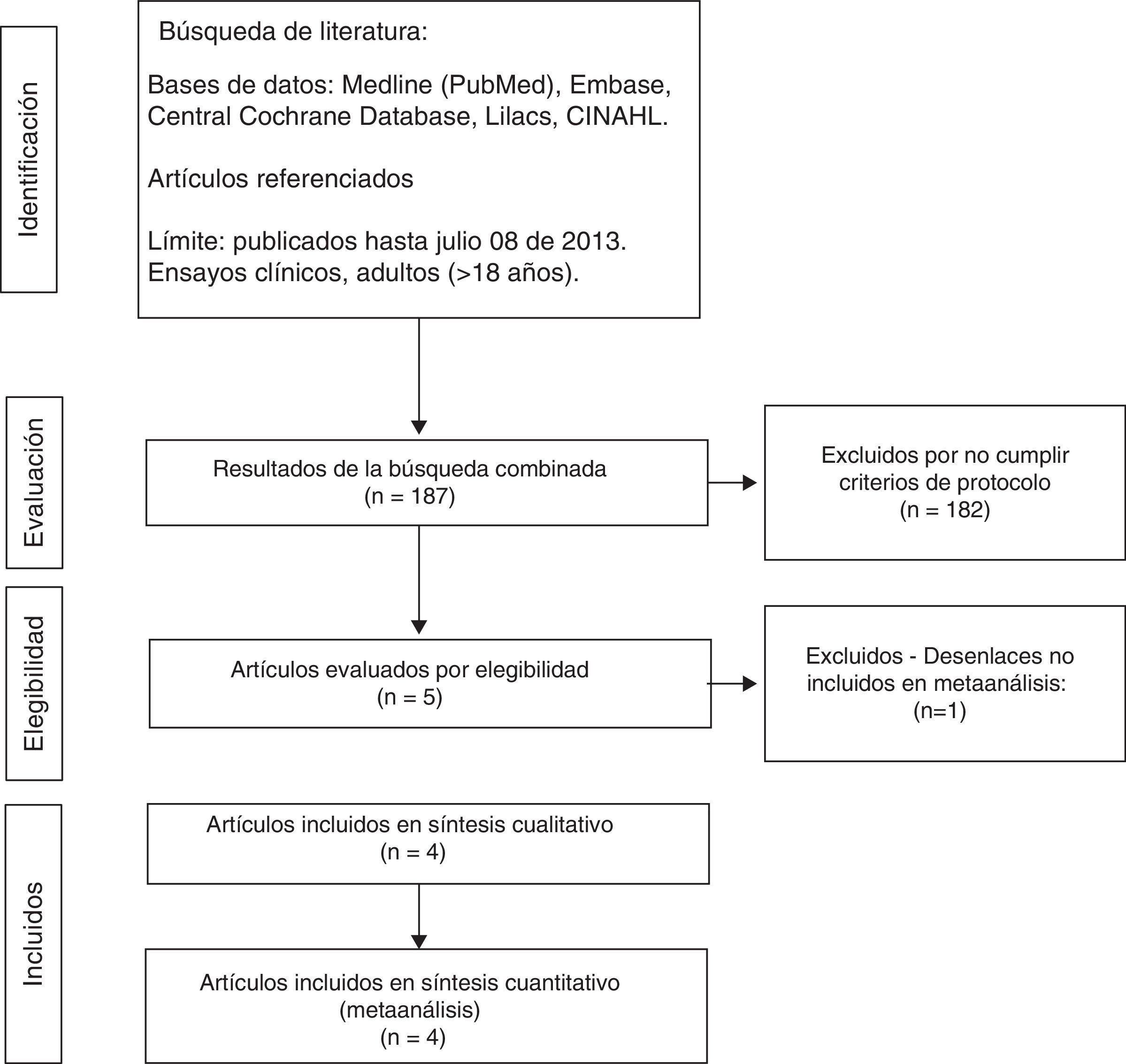
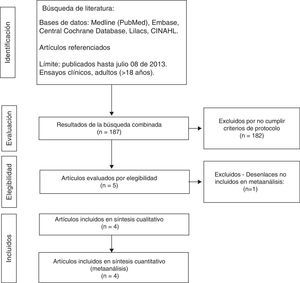
ResultadosProceso de selección de estudiosEn la búsqueda inicial se identificaron 187 artículos; de estos fueron excluidos 182 por no cumplir los criterios de elegibilidad (fig. 1).
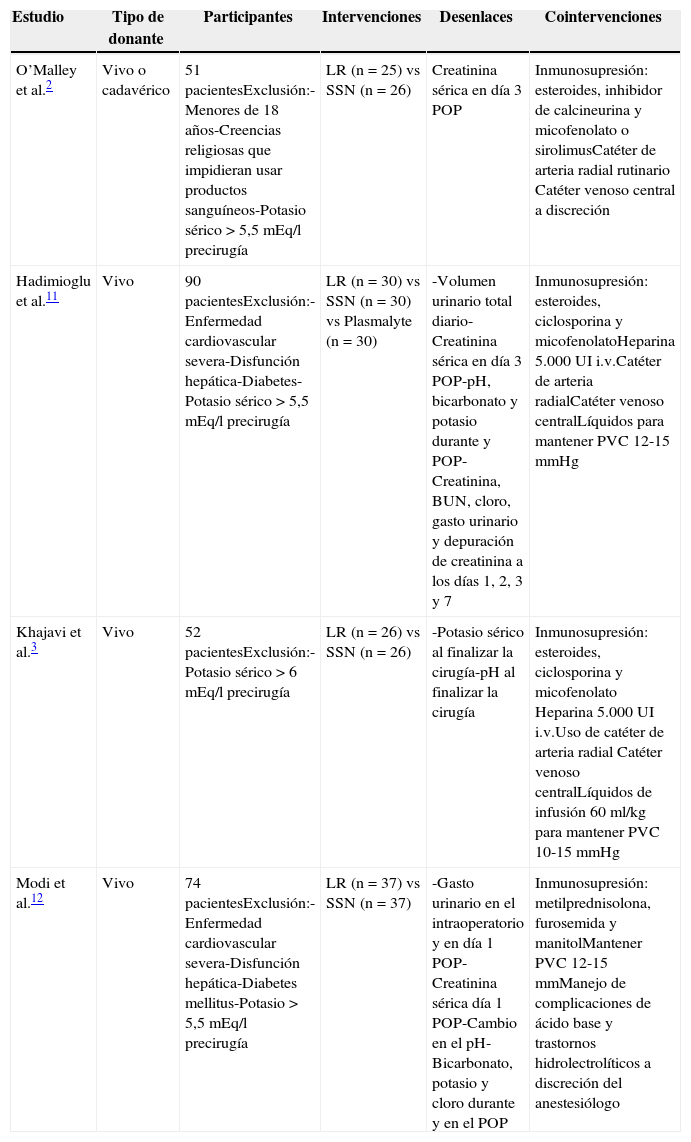
Características de los estudios incluidosSe identificaron 4 ECA, con 237 participantes, que cumplieron los criterios de inclusión. Todos los estudios fueron a doble ciego. Las principales características de estos estudios se presentan en la tabla 1. Se tomó como intervención «experimental» el LR y como «control» la SSN. Los tiempos de observación y seguimiento posterior al trasplante renal fueron variables en los diferentes estudios, por lo cual se tomaron los resultados de las mediciones a intervalos similares para hacerlos comparables.
Características de los estudios elegidos en el metaanálisis (Fuente: autores)
| Estudio | Tipo de donante | Participantes | Intervenciones | Desenlaces | Cointervenciones |
|---|---|---|---|---|---|
| O’Malley et al.2 | Vivo o cadavérico | 51 pacientesExclusión:-Menores de 18 años-Creencias religiosas que impidieran usar productos sanguíneos-Potasio sérico >5,5 mEq/l precirugía | LR (n=25) vs SSN (n=26) | Creatinina sérica en día 3 POP | Inmunosupresión: esteroides, inhibidor de calcineurina y micofenolato o sirolimusCatéter de arteria radial rutinario Catéter venoso central a discreción |
| Hadimioglu et al.11 | Vivo | 90 pacientesExclusión:-Enfermedad cardiovascular severa-Disfunción hepática-Diabetes-Potasio sérico >5,5 mEq/l precirugía | LR (n=30) vs SSN (n=30) vs Plasmalyte (n=30) | -Volumen urinario total diario-Creatinina sérica en día 3 POP-pH, bicarbonato y potasio durante y POP-Creatinina, BUN, cloro, gasto urinario y depuración de creatinina a los días 1, 2, 3 y 7 | Inmunosupresión: esteroides, ciclosporina y micofenolatoHeparina 5.000 UI i.v.Catéter de arteria radialCatéter venoso centralLíquidos para mantener PVC 12-15 mmHg |
| Khajavi et al.3 | Vivo | 52 pacientesExclusión:-Potasio sérico >6 mEq/l precirugía | LR (n=26) vs SSN (n=26) | -Potasio sérico al finalizar la cirugía-pH al finalizar la cirugía | Inmunosupresión: esteroides, ciclosporina y micofenolato Heparina 5.000 UI i.v.Uso de catéter de arteria radial Catéter venoso centralLíquidos de infusión 60 ml/kg para mantener PVC 10-15mmHg |
| Modi et al.12 | Vivo | 74 pacientesExclusión:-Enfermedad cardiovascular severa-Disfunción hepática-Diabetes mellitus-Potasio >5,5 mEq/l precirugía | LR (n=37) vs SSN (n=37) | -Gasto urinario en el intraoperatorio y en día 1 POP-Creatinina sérica día 1 POP-Cambio en el pH-Bicarbonato, potasio y cloro durante y en el POP | Inmunosupresión: metilprednisolona, furosemida y manitolMantener PVC 12-15 mmManejo de complicaciones de ácido base y trastornos hidrolectrolíticos a discreción del anestesiólogo |
BUN: nitrógeno ureico en sangre; LR: lactato de Ringer; POP: postoperatorio; PVC: presión venosa central; SSN: solución salina normal.
Fuente: autores.
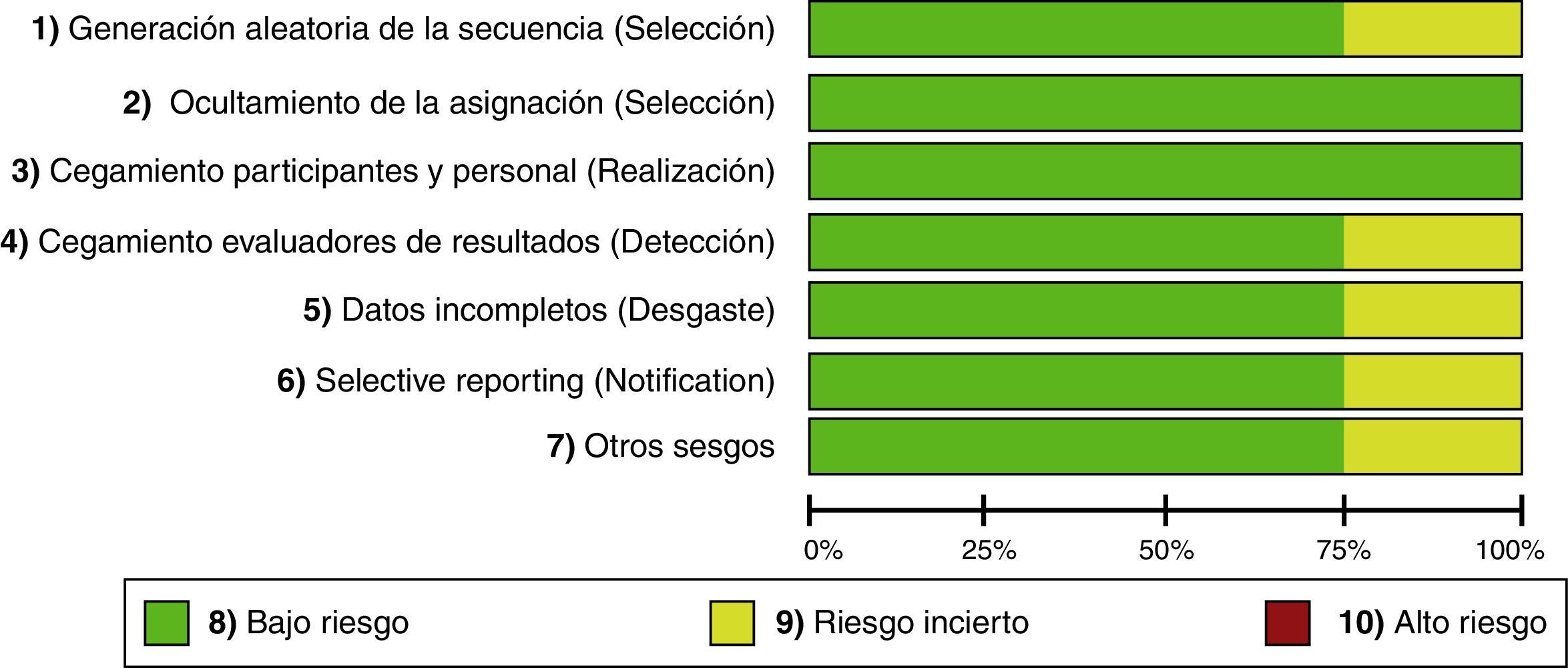
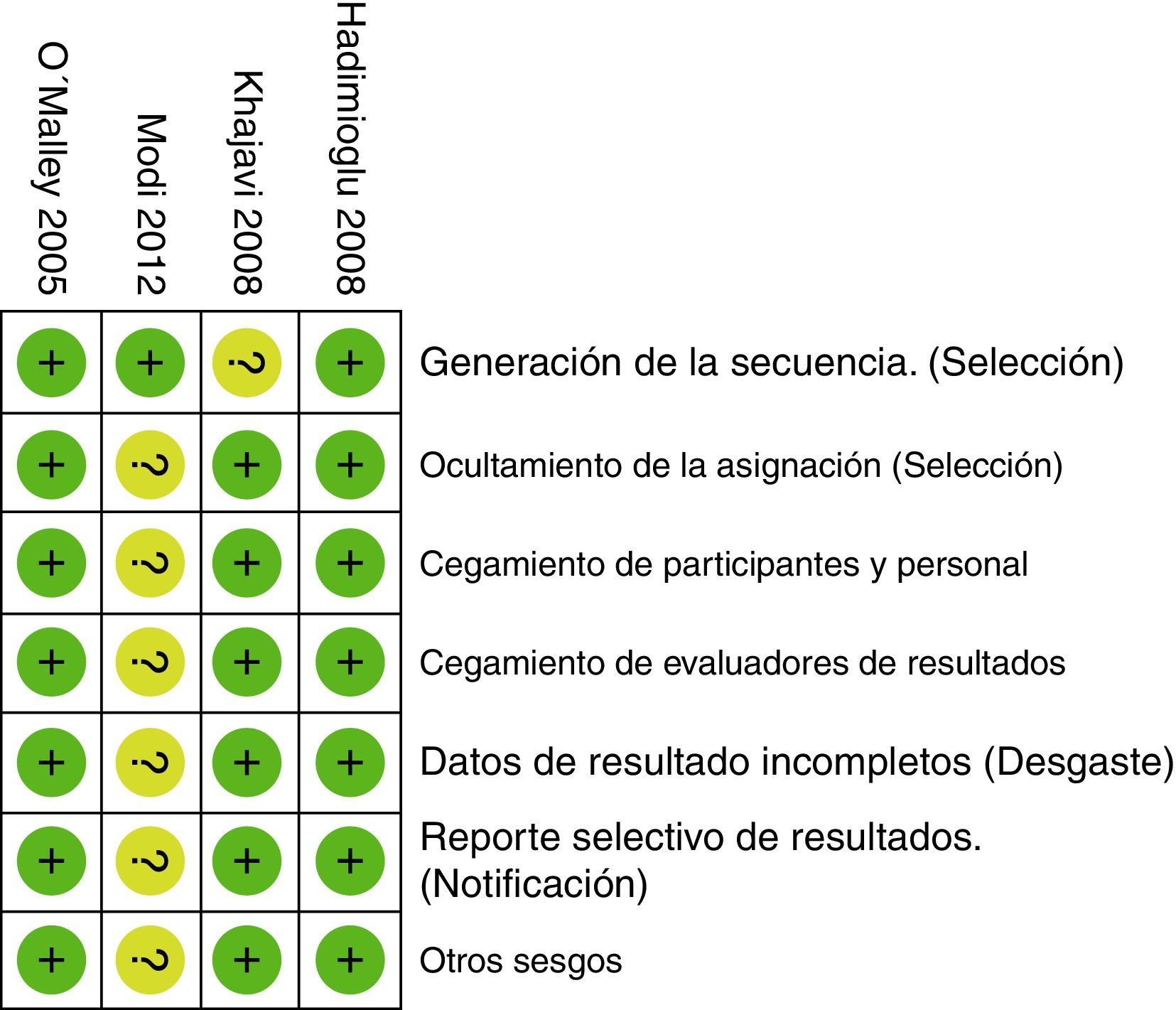
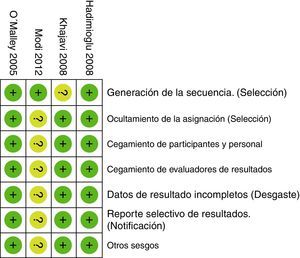
Al evaluar los riesgos de sesgos de los artículos incluidos se encontró que la mayoría usó programas de computador para generar la asignación aleatoria. Solo en el estudio de Khajavi et al.3 no está claro cómo se hizo. Todos usaron sobres opacos para ocultar la asignación y en todos hubo un adecuado método de enmascaramiento. El estudio de Modi et al.12 fue calificado con «riesgo incierto», pues no tiene suficiente información para descartar sesgos de detección, desgaste y notificación. El riesgo de sesgo de los estudios se muestra en las figuras 2 y 3.
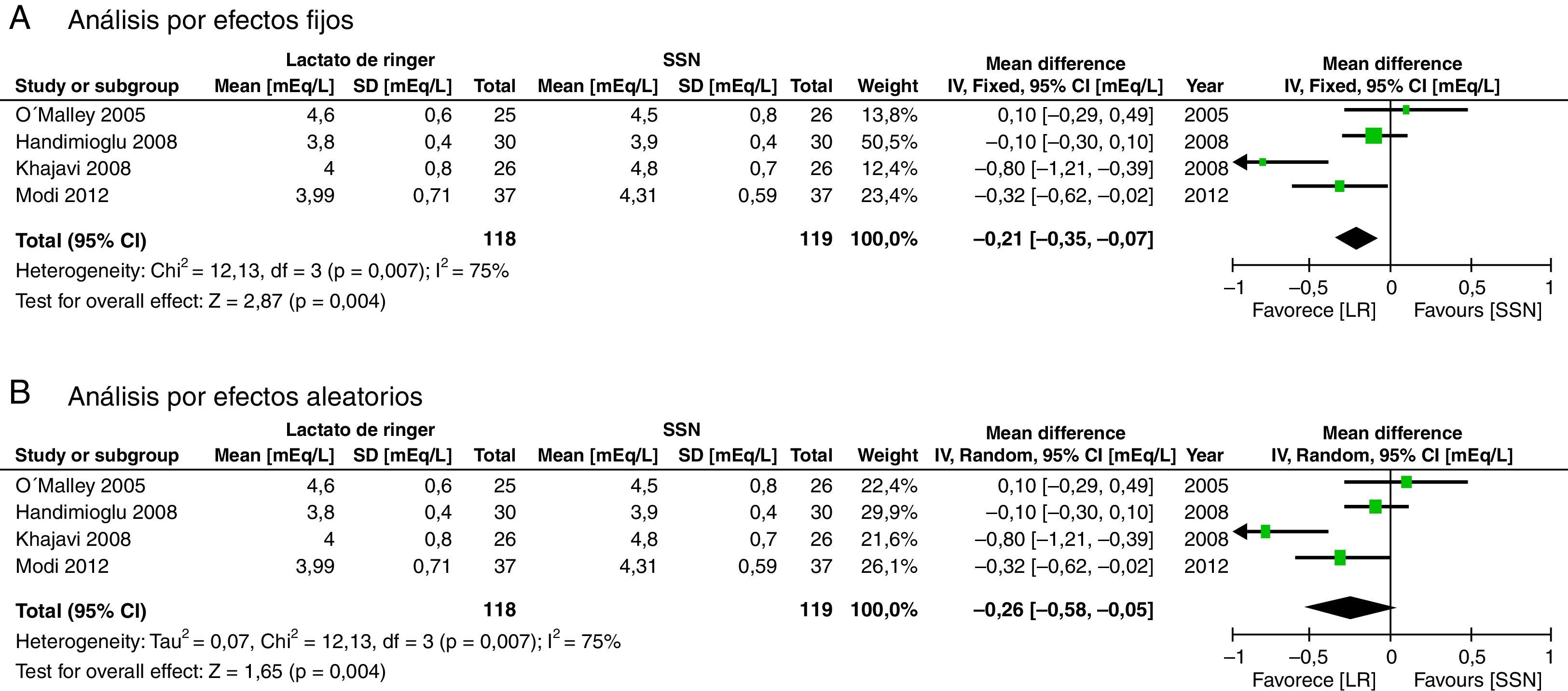
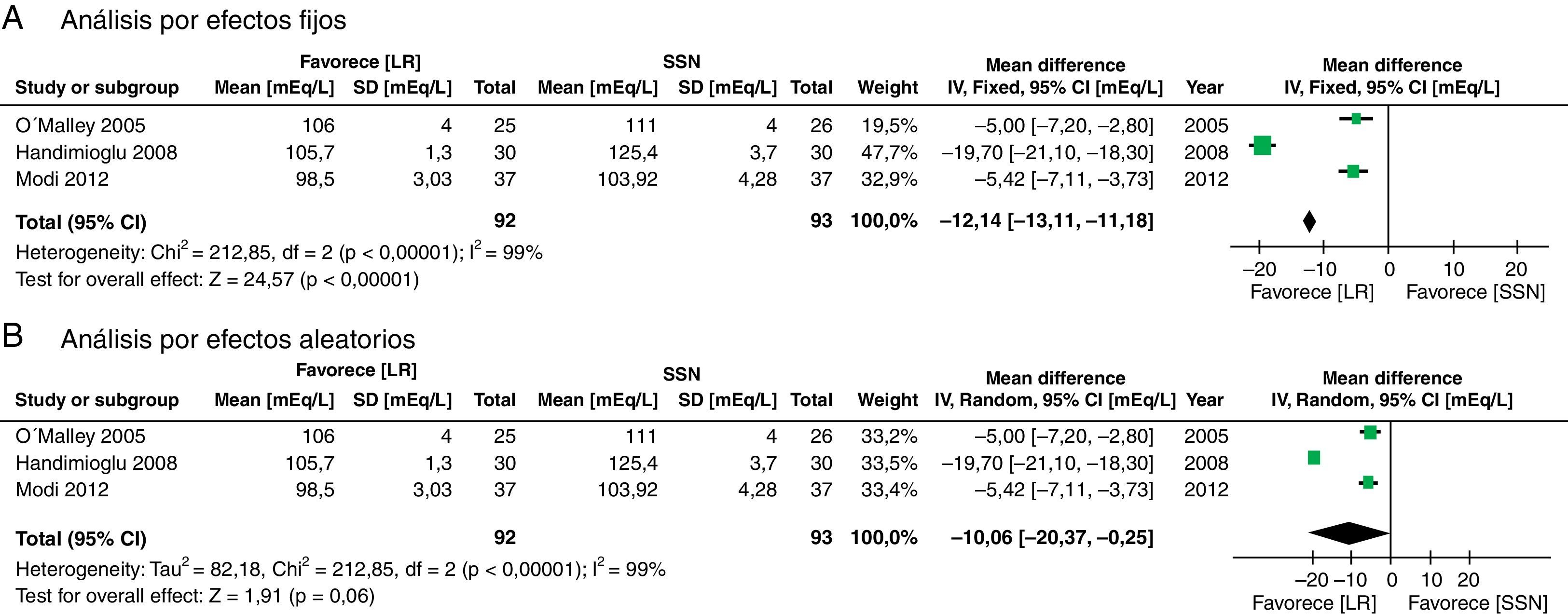
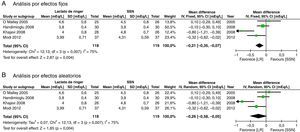
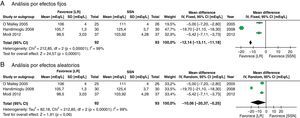
Los resultados considerados para el análisis incluyeron las mediciones de laboratorio durante el perioperatorio calificadas como más importantes por los autores. Al final de cirugía la diferencia de potasio no fue significativa (diferencia de medias [DM]: −0,26 mEq/l; IC95%: −0,58 a 0,05; p=0,10; I2: 75%), aunque cuando se hizo por efectos fijos se encuentra menor valor en el LR (fig. 4).
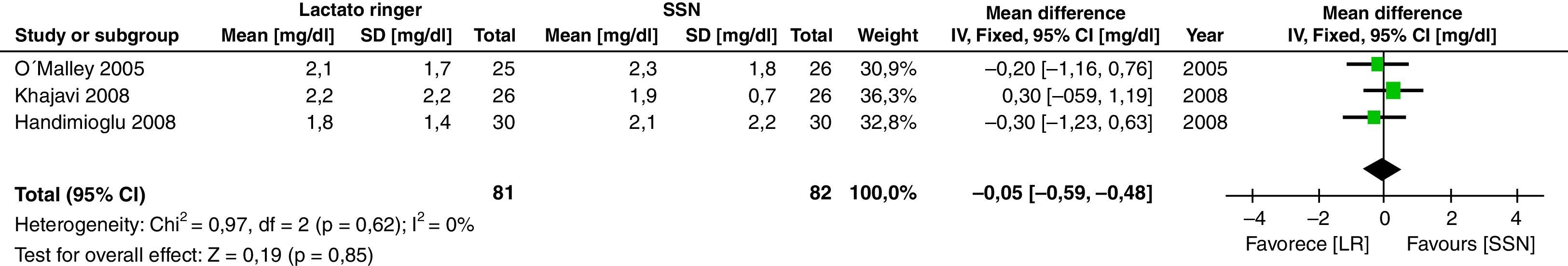
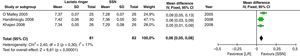
Los resultados secundarios considerados muestran que no hay diferencia en el valor de creatinina en mg/dl al tercer día del postoperatorio (DM: −0,05; IC95%: 0,59 a 0,48; p=0,85; I2: 0%) (fig. 5).
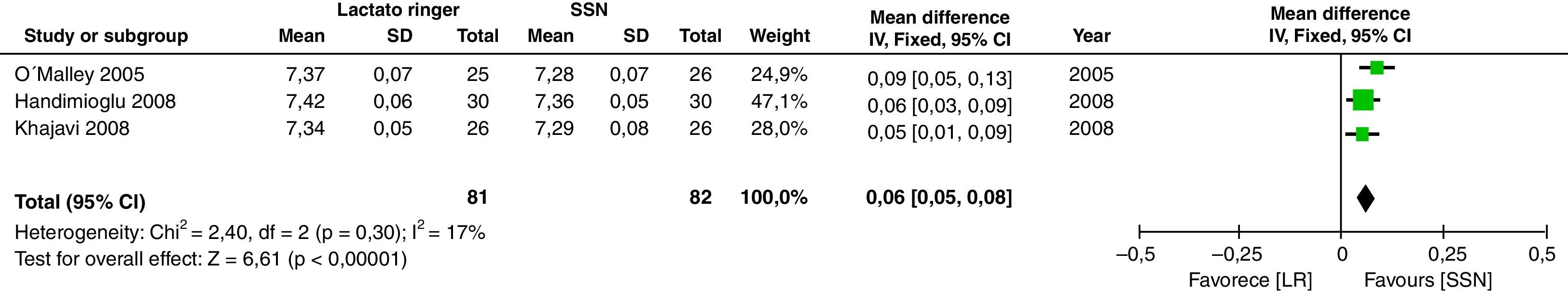
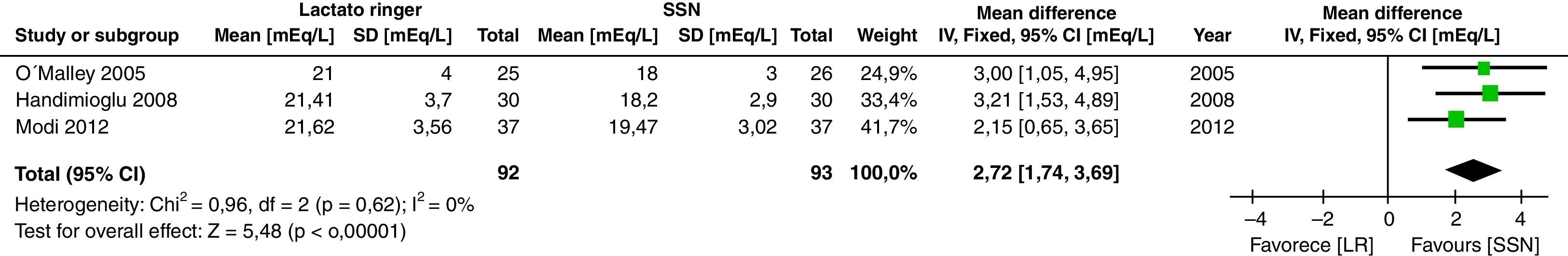
Respecto al estado ácido-base hay mayor acidosis en el grupo de SSN, se encontró que el pH fue mayor en el grupo de LR (DM: 0,06; IC95%: 0,05 a 0,08; p<0,001; I2: 17%) (fig. 6) así como el bicarbonato fue mayor en el grupo de LR (DM: 2,72; IC95%: 1,74 a 3,69; p<0,001; I2: 0%) (fig. 7) y el valor de cloro fue menor en el postoperatorio, aunque por el método de análisis aleatorizado no alcanza diferencia estadística (DM: 10,06; IC95%: −20,37 a 0,25; p=0,06; I2: 99%) (fig. 8).
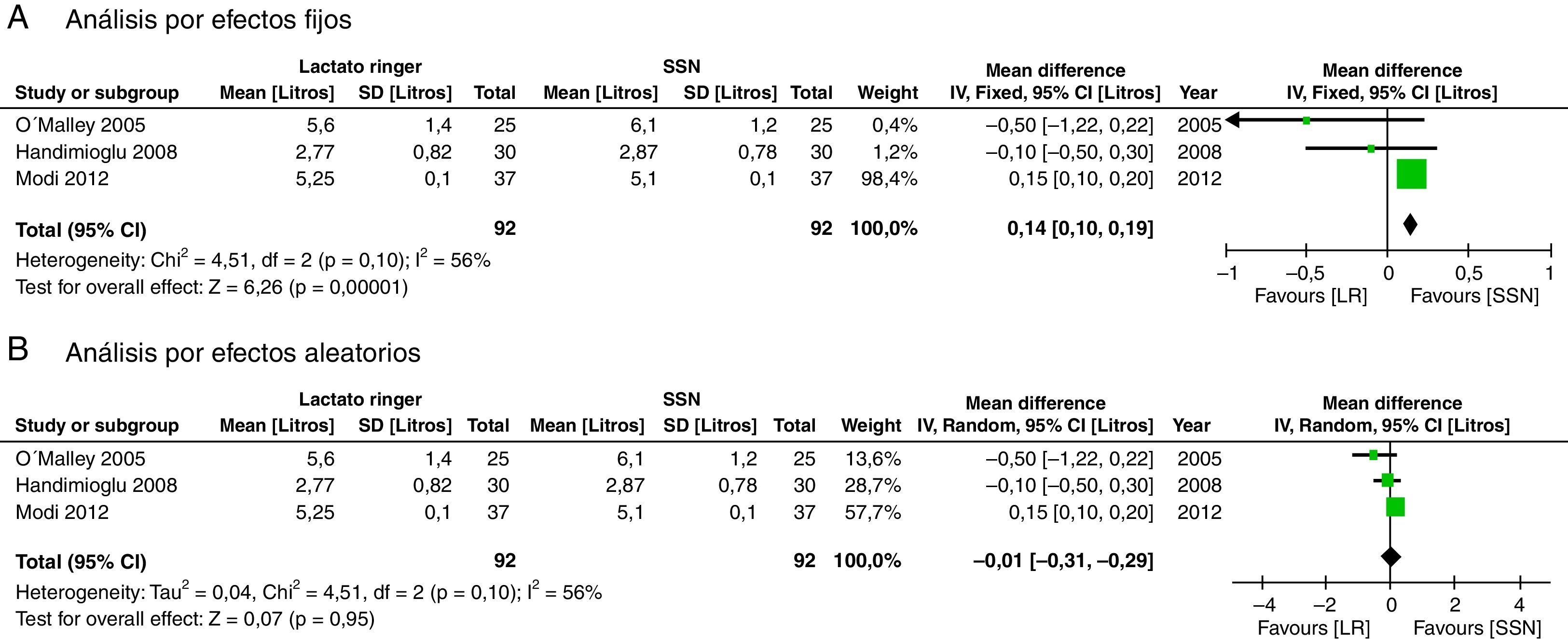
No hubo diferencia significativa en el volumen infundido de líquidos en litros (DM: −0,01; IC95%: −0,31 a 0,29; p=0,95; I2: 56%), aunque por métodos fijos se muestra que es mayor en el grupo de LR (fig. 9).
DiscusiónEl trasplante renal se ha convertido hoy en día en una alternativa más en el tratamiento de la enfermedad renal crónica15. La supervivencia a 5años es del 70% mientras que los pacientes que continúan con diálisis solo sobreviven el 30%9,15-18. Los pacientes que son sometidos a trasplante renal tienen múltiples comorbilidades, como las cardiovasculares18, hipertensión, dislipidemia, hiperfosfatemia e hiperhomocisteinemia19-22, e hipertensión pulmonar23. Esto genera un reto anestésico para el periodo perioperatorio24. El trasplante renal en Colombia, de acuerdo con datos del gobierno, en 2008 fueron 2.693 pacientes y en 2010 fueron 3.691 trasplantes; esto indica un número creciente de este tipo de procedimientos en el país25,26. Actualmente la anestesia general es la técnica de elección; sin embargo, técnicas regionales han mostrado beneficio principalmente en cuanto a dolor postoperatorio27,28. Es importante un conocimiento de las diferentes fases de la cirugía para optimizar las condiciones quirúrgicas29-31.
En el intraoperatorio se ha descrito clásicamente la utilización de grandes volúmenes de fluidos que se ha asociado con mejoría en función del injerto10,24,31-39.
La fluidoterapia hace parte importante del manejo intraoperatorio del paciente llevado a trasplante renal10,40, especialmente porque las múltiples variables fisiológicas y patológicas lo hacen complejo41. Clásicamente la administración de grandes volúmenes de soluciones con potasio, como el LR, puede causar hiperpotasemia, y tradicionalmente se ha utilizado entonces la SSN1, y diversos estudios muestran que la SSN sigue siendo la elección para este procedimiento2. Sin embargo, estudios recientes sugieren que soluciones más balanceadas, como el LR, podrían evitar la acidosis metabólica hiperclorémica3-5; no sucede así con el uso de grandes volúmenes de SSN, que, como ha sido demostrado en otro tipo de pacientes, sí la produce4,8,42-45.
Existe controversia sobre qué tipo de cristaloides es la mejor opción en el paciente sometido a trasplante renal46-48. La utilización de coloides en estos pacientes es limitada34,48, y en la actualidad no se recomienda por sus efectos adversos, que incluyen insuficiencia renal49-52.
Este metaanálisis mostró que la administración del LR puede ser una alternativa para el manejo de la terapia hídrica en el trasplante renal, dado que contrariamente a la creencia anterior, esta solución no demostró mayor hiperpotasemia ni mayor disfunción del injerto evidenciado, por que no se encontraron diferencias en el valor de creatinina al tercer día postoperatorio. Al final de la cirugía la diferencia de potasio no fue significativa, aunque cuando se hizo por efectos fijos se encuentra menor valor en el LR (fig. 4). Al analizar más en detalle esta variable observamos que aunque existe una importante heterogeneidad en el resultado, esta se reduce cuando se retira el estudio de Khajavi et al.3, y esto pudiera estar explicado por la diferencia en el tiempo de isquemia renal, que fue mayor en el grupo de SSN. La presencia de hiperpotasemia en el grupo de SSN se explicaría principalmente porque el potasio actúa como tampón ante la presencia de acidosis y, como se mencionó con anterioridad, la administración de grandes volúmenes de SSN genera acidosis metabólica hiperclorémica4,8,42-45.
El metaanálisis confirma que la SSN genera acidosis metabólica, posiblemente por hipercloremia, como se demuestra en las figuras 6–8. Los pacientes que recibieron SSN tuvieron menores valores de pH y valores más bajos de bicarbonato sérico, con datos que no tuvieron heterogeneidad entre los estudios. El cloro sérico fue mayor en el grupo de SSN, al compararlos con los pacientes que recibían LR, aunque existe heterogeneidad significativa en esta variable en particular. Es importante mencionar que otros aniones como sulfatos, fosfatos, entre otros, se pueden acumular en pacientes con enfermedad renal crónica. Sin embargo, los cristaloides no afectan su concentración, y sería el cloro el principal determinante en el desarrollo de acidosis metabólica52. A la fecha, varios estudios muestran que la hipercloremia per se puede ser causa de evolución desfavorable en la función renal44,45,52-54. El éxito de la prevención de las complicaciones en el perioperatorio incluye la identificación y optimización de los pacientes, teniendo un plan anestésico que integre las diferentes variables que afectan el curso del trasplante renal55. Es de destacar que cuando se analiza la cantidad de solución infundida en los 3 estudios analizados no se encuentra diferencia significativa entre los 2 grupos; esto se debe considerar, dado que clásicamente la acidosis metabólica hiperclorémica se ha asociado con la infusión de grandes volúmenes. Sin embargo, se requieren más estudios con la inclusión de un número mayor de pacientes con un seguimiento a largo plazo para conocer mejor las implicaciones clínicas que se tienen con la acidosis metabólica hiperclorémica.
El resultado clínico importante, creatinina al tercer día, no mostró diferencias entre los 2 grupos, lo que demuestra que la administración de LR es segura para el paciente que recibe un trasplante renal. La heterogeneidad entre los estudios en esta variable es baja, lo que fortalece el resultado. No se describieron en ninguno de los estudios los eventos adversos con la terapia con LR, por lo cual no se pueden dar conclusiones sobre el tema.
Este metaanálisis tiene varias limitaciones, dentro de las que destaca el número bajo de estudios incluidos con un número pequeño de pacientes, además con diferencias en los tiempos de seguimiento y en las variables evaluadas. Los tiempos de observación y seguimiento posterior al trasplante renal variaron entre los diferentes estudios, pero se tomaron los resultados de las mediciones a intervalos similares para hacerlos comparables. En el desenlace que valora la función renal por medio de la creatinina al tercer día postoperatorio, solo 3 estudios la reportaron. Esto limita la interpretación de esta variable, puesto que el número de pacientes se ve reducido. La heterogeneidad en algunas de las variables fue importante; sin embargo, la ausencia de heterogeneidad en este tipo de estudio es imposible, considerando las diferencias de las poblaciones evaluadas, sus protocolos de tratamiento y la duración de los mismos. No se incluyó el estudio de Nuraei et al.13, el cual está en idioma persa y no se obtuvo respuesta por parte de los autores a pesar de que se les contactó en varias oportunidades. Los criterios de exclusión fueron estrictos en los estudios y pueden quedar por fuera los pacientes con complicaciones cardiovasculares, lo cual impide dar una conclusión certera en este subgrupo de enfermos.
A pesar de lo anterior, este trabajo puede ser la mejor evidencia disponible para enfocar el problema de la búsqueda de la mejor estrategia de fluidoterapia para los pacientes llevados a trasplante renal.
ConclusiónEl uso de LR en el perioperatorio de trasplante renal genera niveles similares de potasio en el postoperatorio, mayores valores de pH y bicarbonato y menor nivel de cloro, sin generar cambios significativos en la creatinina del tercer día postoperatorio, a pesar de usar similar volumen infundido cuando se compara con la SSN.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.