La amiloidosis cardiaca es una manifestación de un grupo de enfermedades sistémicas que se caracteriza por el mal plegamiento de proteínas que causa un depósito extracelular de la amiloide, conocido como amiloidosis. Es una causa importante de las enfermedades infiltrativas, que pueden ser responsables tanto del compromiso cardiaco como de otros órganos. Es importante el reconocimiento de su etiología primaria o secundaria para dar el tratamiento adecuado según su causa. Describimos un caso de un paciente de 69años de edad, con amiloidosis que ingresa al servicio de urgencias con un bloqueo auriculoventricular completo.
Cardiac amyloidosis is a manifestation of a systemic diseases group characterized by protein misfolding caused by extracellular deposition of amyloid, known as amyloidosis. It is the main cause of infiltrative diseases that can be responsible of cardiac involvement as to other organs. It is important to recognize its primary or secondary etiology to give the appropriate treatment depending of the cause. We describe a case of a 69year old patient with cardiac amyloidosis debuting in the emergency room with complete atrioventricular block.
La amiloidosis cardiaca es una forma de manifestación de una serie de patologías sistémicas. Es una enfermedad poco conocida y muchas veces subdiagnosticada, en la cual aun contando con el diagnóstico de compromiso cardiaco, es necesario aclarar su origen debido a las múltiples causas e implicaciones en su manejo y pronóstico.
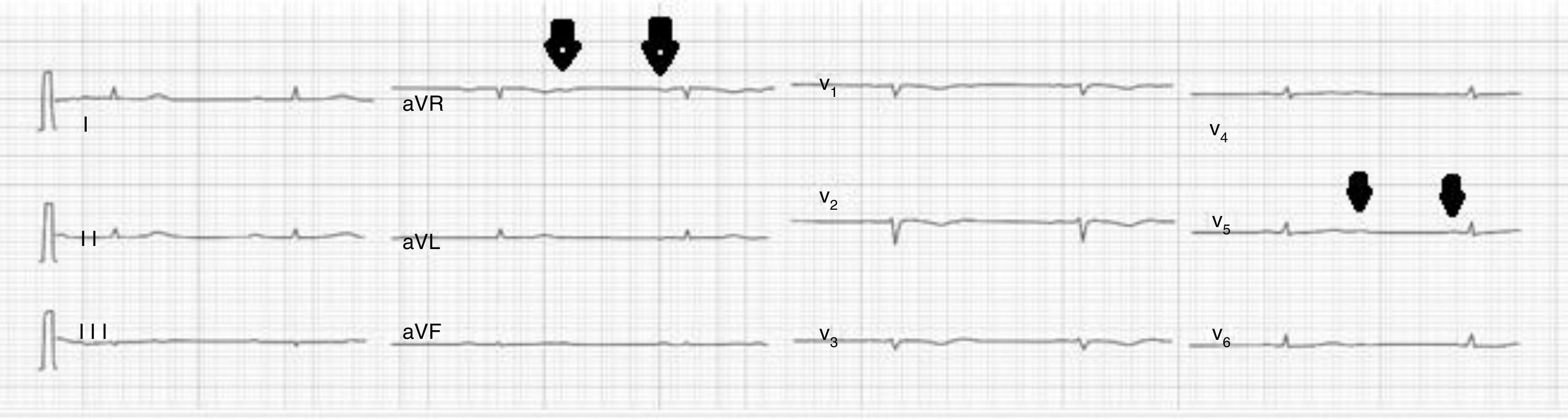
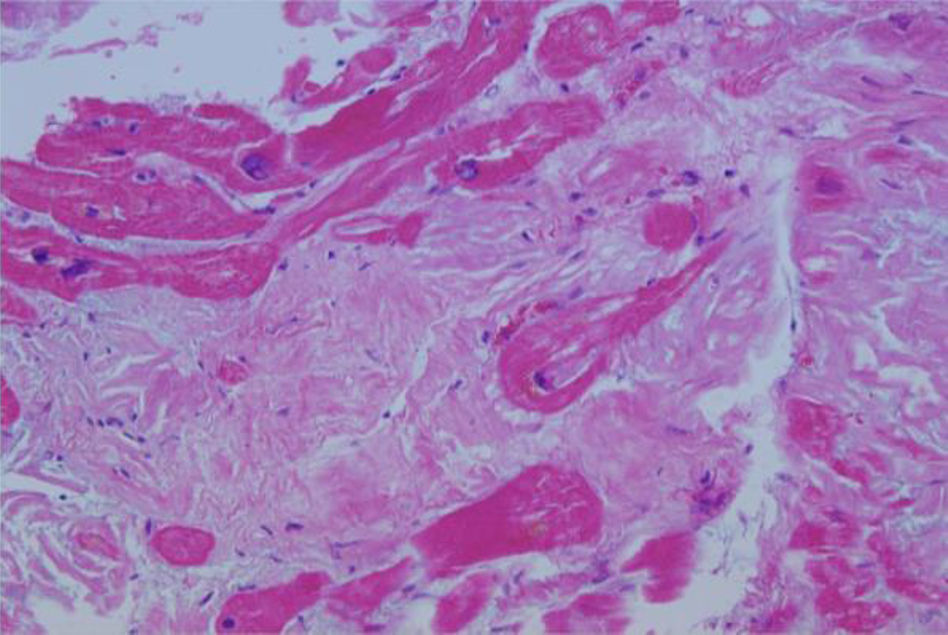
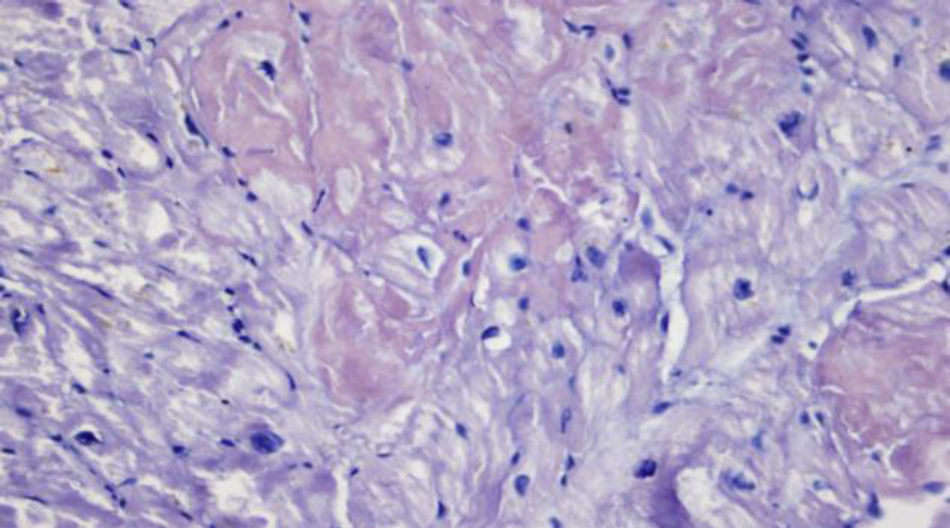
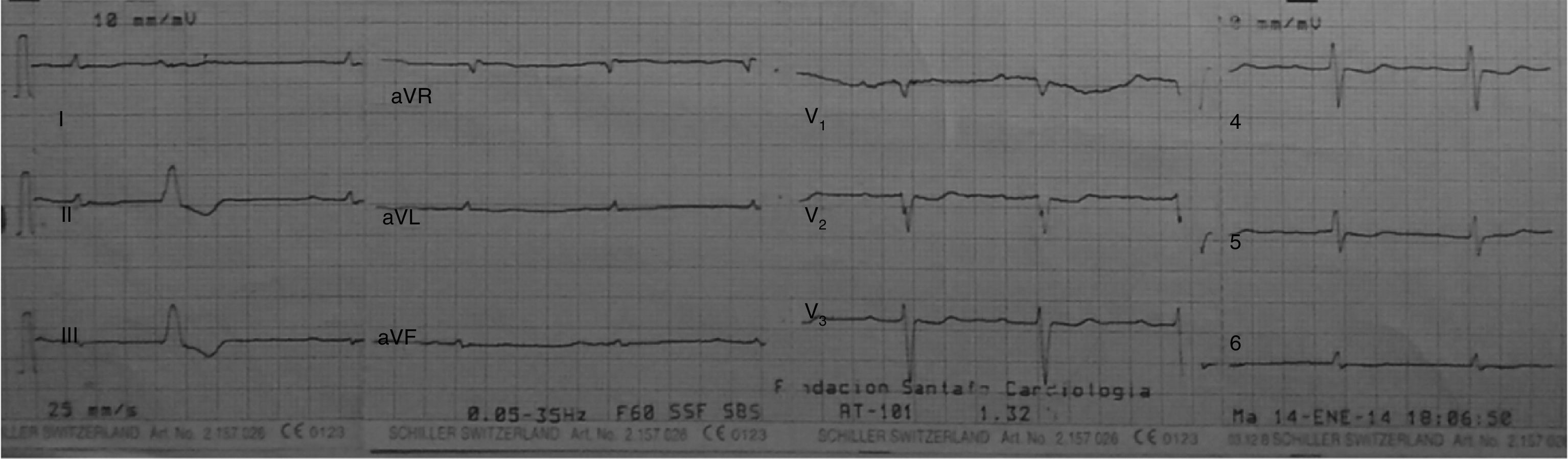
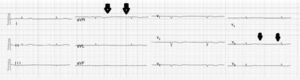
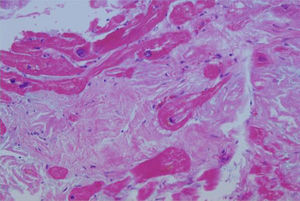
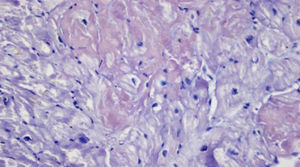
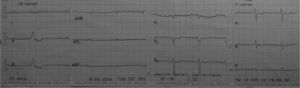
Caso clínicoPaciente de 69años de edad que asiste al servicio de urgencias por deterioro de la clase funcional, con disnea clase funcionaliv/iv, ortopnea, disnea paroxística nocturna y edema de miembros inferiores. El paciente tiene antecedente previo hace un mes de implante de cardiorresincronizador en otra institución por bloqueo AV completo (fig. 1). El implante posiblemente se relacionó con deterioro severo de la fracción de eyección del ventrículo izquierdo (FEVI) del 20% y necesidad de estimulación ventricular frecuente. Al ingreso se encuentra al paciente con PA 90/40, FC 72/min, FR 16/min. Tiene ingurgitación yugular G-II a 45¿, ruidos cardiacos rítmicos velados, hepatomegalia lisa dolorosa 7cm debajo del reborde costal derecho y edema gradoiii de miembros inferiores. Se le realiza un ecocardiograma, que muestra hipertrofia concéntrica severa de características infiltrativas que sugiere amiloidosis con compromiso de la función sistólica por trastorno global difuso más marcado en la pared lateral e inferior con FEVI del 20%, disfunción diastólica con aumento de las presiones de llenado, dilatación biauricular y dilatación de las cavidades derechas con función sistólica disminuida. Se evalúa el funcionamiento del dispositivo, encontrando adecuados los umbrales de estimulación y captura. Se llevó a arteriografía coronaria con evidencia de las arterias epicárdicas sanas. Se le realiza un estudio de biopsia endomiocárdica documentando en la histoquímica como reactividad en el material amorfo extracelular para el rojo Congo alcalino, confirmando que se trata de la amiloide (figs. 2 y 3). Este material no reacciona en la inmunohistoquímica con los anticuerpos para la proteínaAA y muestra una mayor reactividad para las cadenas kappa sobre lambda, sin ser enteramente conclusivo de reacción monotípica. En estudios adicionales se descarta amiloidosis primaria con biopsia de la médula ósea, la electroforesis de proteínas, la serie ósea y la biopsia de grasa subcutánea. Durante su evolución presenta signos de infección en zona del bolsillo del dispositivo que lleva a necesidad de explante del generador y sus electrodos. Los cultivos mostraron Staphylococcus aureus sensible a la meticilina. Se da tratamiento antibiótico con ceftriaxona. Al retiro del dispositivo se encuentra con bradicardia sinusal sin bloqueo AV avanzado (fig. 4), no presenta episodios de bajo gasto o síncope. Se realiza Holter cardiaco con reporte de extrasístoles ventriculares frecuentes y severa disminución de la variabilidad cardiaca sin demostrar bloqueo auriculoventricular. Se considera, en conjunto con la familia y dado el mal pronóstico de su patología de base, no realizar nuevo implante del dispositivo.
Es valorado por hematología, quienes inician quimioterapia con el melfalán y dexametasona. En el seguimiento a los 3 meses, el paciente se encuentra en clase funcionaliii-iv, no ha presentado presíncope o síncope. Al examen físico presenta hipotensión (80/40), FC 64/min, ingurgitación yugular GIII, disminución bibasal del murmullo vesicular sin estertores, con ascitis y edema gradoiii en miembros inferiores. Recibe manejo para falla cardiaca con digoxina (con adecuados niveles séricos) y furosemida. No recibe inhibidor ECA por hipotensión ni betabloqueador por su antecedente de bloqueo AV. El ecocardiograma de control muestra como único cambio solo leve mejoría de la FEVI (34%).
DiscusiónPresentamos un caso de compromiso cardiaco de amiloidosis que se manifiesta como bloqueo auriculoventricular completo paroxístico, en un paciente con signos clínicos de falla cardiaca y con compromiso severo de la FEVI. El manejo de estos pacientes es un reto para el clínico, dada la poca tolerancia a varios medicamentos cardiovasculares, y la piedra angular del tratamiento es el reconocimiento de su etiología primaria o secundaria para un manejo adecuado según su causa.
Rudolf Virchow describe en el año 1853 el término «amiloide» (del griego amylon, «almidón»), al observar su similitud con la tinción de yodo y ácido sulfúrico1. La amiloidosis es un grupo de enfermedades sistémicas que se caracteriza por el mal plegamiento de las proteínas que causa depósito extracelular de material proteico fibrilar, insoluble y resistente a la acción de las enzimas proteolíticas. Es una causa importante de las enfermedades infiltrativas, que pueden ser responsables tanto del compromiso cardiaco como de otros órganos, generando mal funcionamiento de estos2,3.
Se han identificado en la histología características como su policromatismo con cristal violeta, el aspecto violáceo con el ácido periódico de Schiff, aunque el criterio histológico más utilizado es la positividad para el rojo Congo (observándose una birrefringencia verde manzana característica en el estudio de luz polarizada)1-3.
La amiloidosis se puede clasificar de acuerdo a 2 criterios:
- •
Según la distribución de los depósitos amiloideos, en formas localizadas o sistémicas.
- •
Según la proteína fibrilar constituyente específica de cada variedad.
Los 4 tipos principales de amiloidosis sistémica son: la amiloidosis primaria, la amiloidosis familiar (o la amiloidosis hereditaria), la amiloidosis secundaria (amiloidosis reactiva) y la amiloidosis sistémica senil4.
La amiloidosis primaria o de cadena ligera tiene una incidencia de aproximadamente un caso por cada 100 000 personas/año en los países occidentales. Se asocia a la discrasia de las células plasmáticas, siendo la principal el mieloma múltiple. El amiloide es generado a partir de un clon celular que produce de forma anormal cadenas ligeras de inmunoglobulinas. Su diagnóstico es importante, dado que el tratamiento se basa en la quimioterapia y el trasplante de la médula ósea4.
La amiloidosis secundaria es debida a enfermedades inflamatorias crónicas (por ejemplo, artritis reumatoide, enfermedad inflamatoria intestinal e infecciones crónicas, como la TBC). Tiene una afectación más limitada, infiltrando el riñón, las suprarrenales, el hígado y el bazo5.
La amiloidosis hereditaria o relacionada con la transtirretina se debe a mutaciones de la Transtirretín. Este tipo, junto con la amiloidosis sistémica senil, produce mayor compromiso cardiaco. No obstante, en nuestro medio no contamos con la posibilidad de realizar test genéticos, limitando el manejo de esta entidad4,5.
Los pacientes con amiloidosis cardiaca sufren de una miocardiopatía restrictiva debido a la sustitución de los elementos contráctiles miocárdicos normales por infiltrado intersticial de depósitos del amiloide. Los pacientes comienzan con signos de insuficiencia cardiaca derecha, incluyendo una elevada presión venosa yugular, edema de miembros inferiores y hepatomegalia6.
El depósito del amiloide puede ocurrir en el nodo sinusal, en el nodo auriculoventricular y en las ramas del haz de His, favoreciendo una variedad de arritmias que parecen estar correlacionadas con la gravedad de la insuficiencia cardiaca y los hallazgos electrocardiográficos7. Entre estos hallazgos se encuentran el bajo voltaje, los bloqueos auriculoventriculares de alto grado y la disfunción del nodo sinusal, aunque son raros. También se observa fibrilación auricular debida a la dilatación progresiva de las aurículas y la fisiología restrictiva. Entre otras anomalías eléctricas están las arritmias ventriculares, las cuales son frecuentes, aunque rara vez producen síncope y no suelen ser el síntoma de presentación8. Un estudio efectuado en 168 pacientes con compromiso cardiaco por amiloidosis encontró presencia de arritmias auriculares en el 15,9%, bajo voltaje en derivaciones de las extremidades en el 54,5% e imagen de pseudoinfarto en el 40,2%8. Nuestro paciente se presentó como falla cardiaca asociado a bloqueo AV.
En el ecocardiograma se ha descrito el engrosamiento de las paredes de los ventrículos de predominio izquierdo, la disfunción diastólica, la dilatación auricular, la presencia de un patrón «granular» del miocardio y el derrame pericárdico. Cuando hay limitaciones técnicas en las imágenes ecocardiográficas, otra opción es la realización de una resonancia magnética, que permite una caracterización morfológica excelente dado que el depósito del amiloide afecta específicamente la cinética de distribución del gadolinio entre la sangre y el miocardio9.
La confirmación del diagnóstico de amiloidosis cardiaca requiere la demostración de depósito amiloide en una biopsia, aunque no tiene que ser necesariamente cardiaca. Otros tejidos más accesibles que el cardiaco, y habitualmente utilizados, son la mucosa rectal (sensibilidad del 75-85%) o el aspirado de grasa abdominal, que es incluso más sensible (84-88%) y no tiene riesgo de sangrado o perforación. Si la biopsia de otros tejidos es negativa y la sospecha persiste, la biopsia cardiaca es necesaria8,9. En nuestro paciente la biopsia de grasa no mostró el amiloide, pero sí se documentó en la biopsia endomiocárdica.
El tratamiento y el pronóstico de la amiloidosis cardiaca dependen directamente de la etiología. Generalmente, los antagonistas del calcio están contraindicados debido a informes de casos de empeoramiento de la función ventricular izquierda, y se cree que está relacionado con sus efectos inotrópicos negativos. Los betabloqueadores son a menudo evitados por la misma razón. La digoxina se debe usar con cautela debido al riesgo de almacenamiento en los depósitos amiloides. Los marcapasos pueden ser necesarios en función del grado de la enfermedad del sistema de conducción10. En nuestro paciente no se pudieron usar inhibidores ECA ni betabloqueadores por hipotensión y antecedente de bradiarritmia.
El pronóstico para los pacientes con amiloidosis primaria es pobre. La mediana de supervivencia es de 13meses sin tratamiento, y se puede ampliar a 17meses con melfalán oral de la terapia cíclica y prednisona. No obstante, tal tratamiento rara vez resulta en la remisión completa de la enfermedad o la reversión de la disfunción de órganos final debido a los depósitos del amiloide. Solo el 5% de los pacientes sobreviven más de 10años4-6.
Recientemente, altas dosis de melfalán intravenoso se han combinado con el trasplante de células madre de sangre periférica autóloga, resultando en mayor o menor grado de respuesta hematológica, disminución de la disfunción de órganos diana y aumento en la supervivencia en algunos pacientes. La talidomida en dosis altas y la dexametasona se han intentado también, pero pocos pacientes son capaces de tolerar la toxicidad de este régimen. El trasplante cardiaco se ha utilizado en algunos pacientes con amiloidosis primaria, pero la supervivencia a largo plazo es menos favorable que en los pacientes trasplantados por otras condiciones11. En nuestro paciente hubo mejoría de la fracción de eyección en el ecocardiograma de control, recibiendo melfalán y dexametasona. Sin embargo, posteriormente no se continuó el tratamiento por dificultades con su EPS, por lo cual es difícil saber si tuvo relación con el tratamiento, si hubo un fenómeno agudo intercurrente (por ejemplo, miocarditis) o cambios en el observador, ya que clínicamente no hubo ninguna mejoría.
El compromiso del sistema de conducción no ha sido evaluado en forma sistemática en este grupo de pacientes. Un estudio en 25 pacientes con amiloidosis primaria utilizó el estudio electrofisiológico, encontrándose que 23 tenían prolongación del HV (>55ms) y en 12 esta prolongación era severa (>80ms). Esta prolongación del HV fue el único predictor independiente de muerte súbita12. Esto sugiere que el compromiso cardiaco a nivel del sistema de conducción es muy frecuente, como se manifestó en nuestro paciente, y debe ser rutinariamente evaluado en cualquier paciente con amiloidosis, a través de la toma de un electrocardiograma en el paciente asintomático o de formas más completas en los sintomáticos cardiovasculares (Holter, monitor de eventos o estudio electrofisiológico). En algunas series se ha estimado que el compromiso de bloqueo cardiaco en la amiloidosis alcanza el 45%12.
En pacientes con bloqueo AV el implante de un marcapasos no previene el riesgo de muerte súbita, e incluso se ha descrito un caso de muerte inmediatamente colocado el dispositivo, relacionada con posible isquemia y disociación electromecánica. Por otra parte, se ha descrito la asociación de miocarditis con amiloidosis, probadas las 2 con biopsia endomiocárdica, manifestada como bloqueo AV transitorio13.
Sin embargo, el bloqueo AV no es la única manifestación de bradiarritmias en pacientes con amiloidosis cardiaca. Se ha descrito también disfunción sinusal manifestada como bloqueo sinoauricular y comprobada en un estudio electrofisiológico. Un comentario aparte merece la amiloidosis familiar con polineuropatía, la cual se asocia muy comúnmente a trastornos de conducción y disfunción sinusal13. Esta es una enfermedad autosómica dominante con alto riesgo de muerte súbita en quien incluso se plantea el uso profiláctico de marcapasos. Un estudio evaluó a 262 pacientes asintomáticos con HV≥70ms, HV>55ms asociado a bloqueo fascicular, bloqueo AV de primer grado o presencia de Wenckebach anterógrado a frecuencia menor a 100lpm. En 100 pacientes se implantó marcapasos profilácticamente y el 25% desarrollaron bloqueo AV completo en el seguimiento14.
El implante de resincronizadores es poco estudiado, posiblemente por el pobre pronóstico en muchos de estos pacientes. No obstante, hay reportado que pacientes con amiloidosis tenían marcada disincrónica, aunque no ha sido reportado por otros autores. Recientemente, Zizek et al.14 implantaron un resincronizador en un paciente con amiloidosis primaria y administraron quimioterapia, encontrando mejoría en la función y volúmenes ventriculares a los 12meses de seguimiento.
ConclusionesSe presenta un paciente con amiloidosis cardiaca manifestada inicialmente como bloqueo AV paroxístico con compromiso de la función ventricular izquierda y falla cardiaca en clase funcionaliv. El compromiso cardiaco en estos pacientes es de pobre pronóstico y se puede manifestar como deterioro severo de la FEVI asociado a falla cardiaca o, como en nuestro paciente, por compromiso de la conducción AV. La respuesta al tratamiento convencional es pobre.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.