La falla cardiaca avanzada se caracteriza por un compromiso circulatorio clínicamente significativo que requiere opciones de manejo avanzadas como el trasplante cardiaco, la inotropía intravenosa continua o intermitente, la asistencia ventricular o la terapia paliativa. El paciente con falla cardiaca avanzada no candidato a trasplante o asistencias ventriculares, es terminal y hace parte de un grupo heterogéneo con una condición clínica que fluctúa, con síntomas que condicionan el deterioro de la calidad de vida, y finalmente la muerte. El cuidado paliativo hace parte de las opciones de tratamiento avanzado cuyo objetivo principal es el control de los síntomas en el paciente con enfermedad avanzada, la planificación de los cuidados del final de la vida y los que permiten tener una muerte digna. No es una estrategia reservada para el paciente agónico. Es importante tener una comunicación asertiva con el paciente y su familia, y contar con las herramientas adecuadas para tomar decisiones y comunicarlas. Este documento presenta de forma concreta y práctica la forma de identificar y manejar el paciente con falla cardiaca terminal, con estrategias farmacológicas y no farmacológicas para el control de los síntomas más comunes en esta etapa de la enfermedad, así como de los aspectos relevantes sobre el manejo de dispositivos y conceptos sobre la transición del cuidado y la sedación paliativa.
Advanced heart failure is characterised by a clinically significant circulatory involvement that requires advances management options such as cardiac transplantation, continuous or intermittent inotropic infusions, ventricular assist devices or palliative therapy. Patients with advanced heart failure who are not candidate for a transplant or ventricular assist devices are terminal and belong to an heterogeneous group with a fluctuating clinical condition, with symptoms that impart their quality of life and eventually cause death. Palliative care is a part of the advanced therapy options whose main goal is to control symptoms in the patient with advanced disease, to plan care in the final stage of life and to allow for a dignified death. It is not a strategy limited to terminal patients. It is important to maintain assertive communication with the patient and their relatives, and to have the necessary tools to make and communicate decisions. This document presents in a concrete and practical manner the way of identifying and managing patients with terminal heart failure, with pharmacological and non-pharmacological strategies to control the most common symptoms at this stage of the disease, as well as the relevant aspects on handling devices and concepts about care transition and palliative sedation.
La falla cardiaca es el estadio terminal de las enfermedades cardiológicas. Su espectro clínico va desde la presencia de factores de riesgo para desarrollar falla cardiaca, hasta síntomas persistentes y refractarios, como se resume en los Estadios de Falla Cardiaca de la American Heart Association1. Las metas de tratamiento en falla cardiaca crónica son la optimización de la terapia modificadora de pronóstico y el manejo de síntomas, las intervenciones educativas para lograr un autocuidado excelente y la identificación de la progresión de la enfermedad.
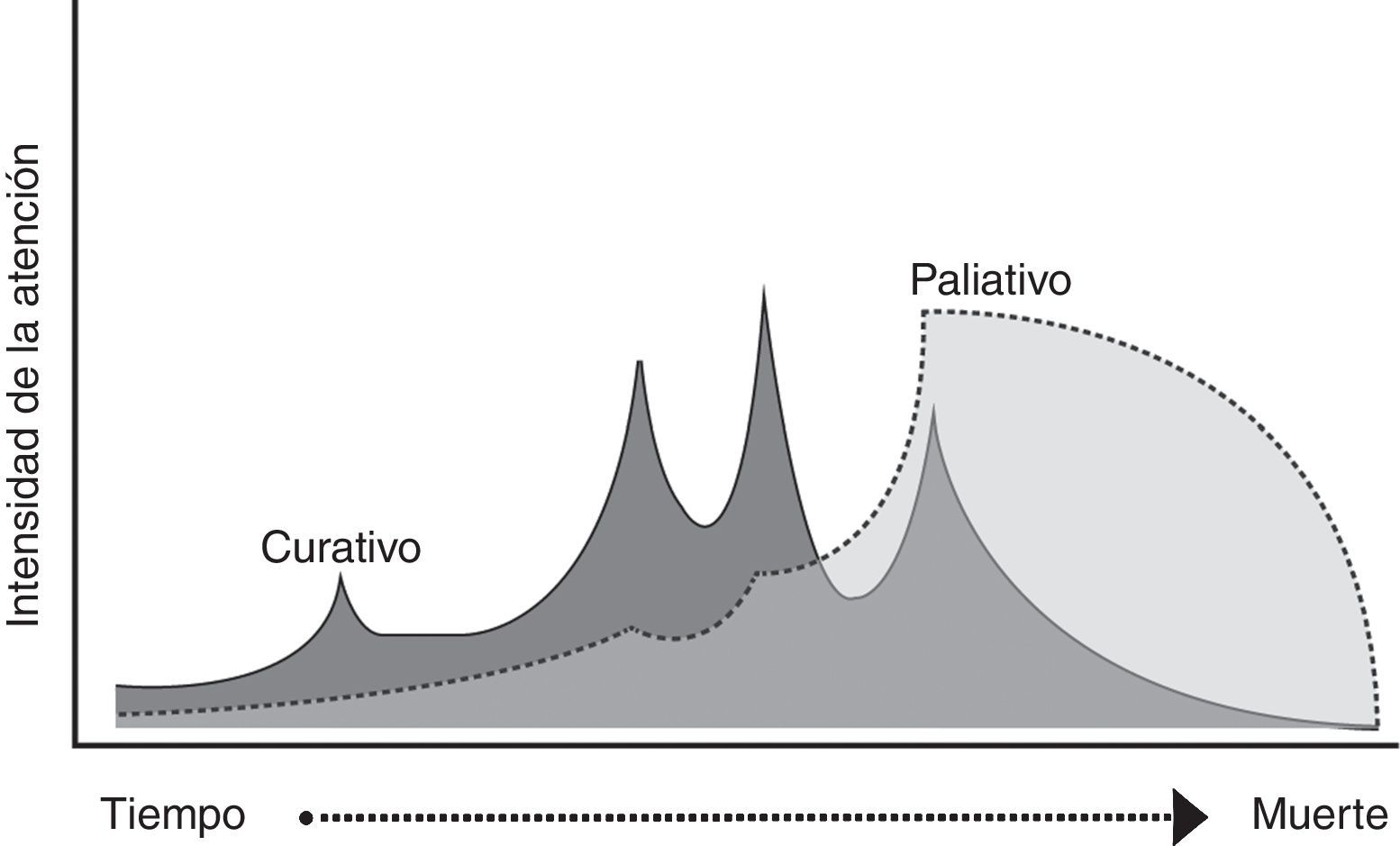
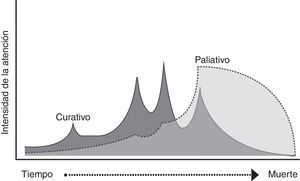
Las causas de muerte en falla cardiaca son la progresión de la enfermedad, la muerte súbita y las causas no cardiovasculares2. La falla cardiaca avanzada se caracteriza por síntomas severos, reingresos hospitalarios en los últimos seis meses y limitación funcional, asociados a una disfunción cardiaca severa objetivada, a pesar del manejo médico óptimo3. Las descompensaciones recurrentes marcan un deterioro global progresivo, en el cual difícilmente hay recuperación completa después de cada agudización (fig. 1)4. El curso de la enfermedad es variable y es difícil predecir quiénes tendrán un deterioro clínico y funcional marcado. El compromiso hemodinámico clínicamente significativo precisa opciones de manejo avanzadas (trasplante cardiaco, asistencia ventricular). Un paciente que no califique para este tipo de tratamientos es terminal y sus objetivos de manejo cambian y se enfocan en el control de los síntomas y el mantenimiento de la calidad de vida3,5,6.
El cuidado paliativo se define como el cuidado total y activo del paciente con enfermedad que no responde al tratamiento curativo, e históricamente se ha reservado para el paciente oncológico5,7. La interacción entre el cuidado curativo y el cuidado paliativo era vista como un fenómeno de “todo o nada” en el que este último iniciaba cuando todos los tratamientos curativos se habían agotado. La visión más moderna del cuidado paliativo plantea una trayectoria paralela en la que, según la necesidad del paciente, prima el cuidado paliativo sobre el curativo (fig. 2)5. Sin embargo, es frecuente iniciar el manejo paliativo cuando la muerte del paciente es inminente y no de forma más temprana.
La comunicación honesta, asertiva y directa con el paciente y su familia permite satisfacer las necesidades de educación y consejería, y de apoyo al núcleo familiar, incluso durante el duelo. Los cuidados médicos y de enfermería que se brinden no deben perturbar la dignidad del enfermo ni su condición humana. Para asegurar que esto ocurra, deben aplicarse los principios de bioética: no maleficencia, beneficencia y autonomía8. La no maleficencia se refiere a no hacerle daño a la persona, en tanto que la beneficencia es hacer el bien al paciente. La autonomía es permitir que el paciente y su familia sean responsables de sus decisiones, y aplica cuando todos deciden acerca de las actividades médicas que no desean que se realicen. El Grupo de Bioética y el Comité de Ética Médica de la institución pueden brindar apoyo para tomar decisiones complejas en torno al cuidado paliativo.
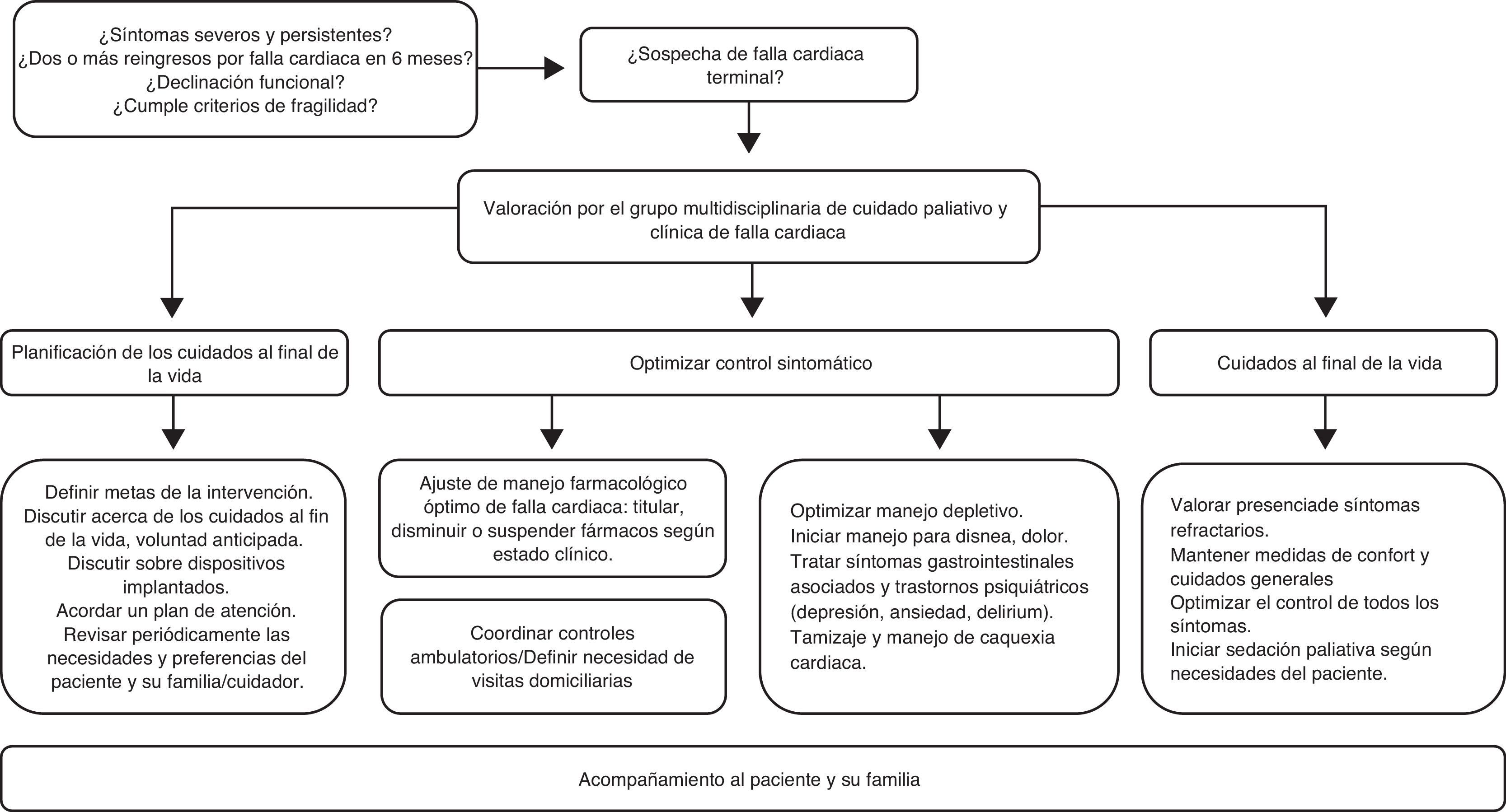
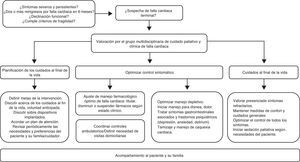
En la falla cardiaca terminal, síntomas como disnea, dolor y fatiga son muy recurrentes9,10, y el tratamiento médico convencional suele ser insuficiente para satisfacer las necesidades de estos pacientes11. Por ende, es necesario brindar atención en un centro hospitalario de alta complejidad con personal experto, para ofrecer un cuidado integral, oportuno y continuo, con intervención multidisciplinaria de cardiología, cuidado paliativo y enfermería, apoyados incluso en otros profesionales de la salud (psicología, terapia física, etc.). El acceso a esta intervención debe basarse en la necesidad del paciente y no en su diagnóstico. Una vía clínica estructurada delimita las metas de la intervención y las actividades a realizar garantizando la satisfacción de las necesidades del paciente y su familia (fig. 3). Una primera valoración debe identificar las áreas a intervenir, plantear metas a corto y mediano plazo, programar el seguimiento y optimizar el tratamiento médico de los síntomas del paciente, manteniendo siempre un nivel adecuado de autocuidado.
Los pacientes con falla cardiaca crónica necesitan un manejo farmacológico óptimo, basado en la evidencia. En estadios avanzados es común que el paciente no tolere el manejo instaurado, así que es posible ajustar el manejo y retirar medicamentos como nitratos o calcioantagonistas, si su uso condiciona obstáculos para la titulación del bloqueo neurohormonal12. Si se presenta hipotensión, bradicardia sintomática o falla renal, se puede disminuir la dosis o suspender los medicamentos que generen los síntomas, según sea el caso. En la tabla 1 se resume información sobre los medicamentos más usados en falla cardiaca y las consideraciones en el paciente terminal.
Fármacos de empleo frecuente en falla cardiaca crónica y su uso en falla cardiaca terminal y últimos días de vida
| Grupo terapéutico | ¿Mejora sobrevida? | ¿Ayuda en el control sintomático? | Falla cardiaca terminal | Últimos días de vida |
|---|---|---|---|---|
| IECA y ARA II | Sí | Sí | Continuar si son tolerados, excepto en hipovolemia. | Suspender |
| Betabloqueadores | Sí | Sí | Continuar si se toleran, o ajustar la dosis para disminuir bradicardia o hipotensión sintomática. | Suspender |
| Antagonistas del receptor mineralocorticoide | Sí | Sí | Suspender si existe contraindicación por función renal deteriorada o hipercalemia. | Suspender |
| Ivabradina | Sí | Sí | Continuar si se toleran. | Suspender |
| Diuréticos | No | Sí | Continuar ajustados a la necesidad del paciente. | Continuar si aportan al control de síntomas. |
| Antiagregantes plaquetarios | Sí | No | Suspender si no hay antecedente reciente de síndrome coronario agudo. | Suspender |
| Estatinas | No | No | Suspender | Suspender |
Existen indicadores de mal pronóstico como clase funcional, biomarcadores y características clínicas13. Determinar con certeza cuál es el pronóstico de un paciente con falla cardiaca avanzada es complicado y a menudo estos indicadores no se correlacionan con la realidad y el curso de la enfermedad en un paciente específico. En la tabla 2 se enumeran algunos factores de mal pronóstico13.
Características de mal pronóstico en pacientes con falla cardiaca avanzada
| Características demográficas: − Edad avanzada − Sexo masculino |
| Características clínicas: − Clase funcional III o IV − Etiología isquémica − Fracción de eyección reducida − Más de un ingreso hospitalario por falla cardiaca en los últimos 6 meses − Intolerancia al bloqueo neurohormonal (que justifique cambios en el manejo o suspensión de fármacos) − Hipotensión − Percepción de fracaso del tratamiento − Persistencia de síntomas a pesar del manejo médico óptimo − Aumento en los requerimientos de manejo depletivo parenteral − Declinación funcional severa − Dependencia en tres o más actividades de la vida diaria − Antecedente de paro cardiaco reanimado − Comorbilidades |
| Paraclínicos: − Electrocardiograma: taquicardia en reposo, complejo QRS ancho − Química sanguínea: hiponatremia, aumento de azoados, anemia, alteración del perfil hepático, elevación de biomarcadores (troponina, BNP), hipoalbuminemia − Ecocardiograma: objetivación de disfunción ventricular severa (FEVI reducida, aumento de volumen telediastólico, disminución del TAPSE), insuficiencia mitral severa, dilatación auricular − Cateterismo cardiaco derecho: aumento de resistencias pulmonares |
| Pruebas funcionales: − Incapacidad para realizar pruebas de ejercicio − Consumo pico de oxígeno bajo − Distancia recorrida en caminata de 6 minutos menor a 300 metros |
Gran porcentaje de los pacientes con falla cardiaca avanzada son adultos mayores con comorbilidades complejas, de ahí que un factor pronóstico común sea la fragilidad, en cuyo caso se valoran aspectos clínicos, funcionales, socioeconómicos, afectivos y cognitivos para determinar si hay prefragilidad o fragilidad14,15. A medida que el perfil de fragilidad progresa y se hace más severo, es apropiado priorizar el control de síntomas sobre la modificación del pronóstico.
La aplicación de una escala de riesgo multivariable validada, como la Heart Failure Survival Scale o la Seattle Heart Failure Model, pueden ser útiles para predecir el pronóstico del paciente1,12. Quienes cursen con deterioro funcional y dependencia para actividades de la vida diaria, síntomas severos y pobre calidad de vida a pesar del manejo farmacológico instaurado, reingresos o descompensaciones frecuentes, o caquexia cardiaca y no son candidatos a trasplante cardiaco o asistencia ventricular, deben ser valorados para confirmar la presencia de falla cardiaca terminal y definir el inicio de una intervención por cuidado paliativo1,13.
DisneaLa sensación subjetiva de dificultad para respirar es el síntoma más común en los pacientes con falla cardiaca terminal9,10 y condiciona una limitación funcional y dependencia para actividades básicas. La congestión pulmonar, el derrame pleural, la hipoxemia e hipercapnia, la caquexia y la sarcopenia, están directamente ligados con la aparición de disnea. Las conexiones neurológicas del sistema nervioso central y periférico generan una interacción de señales en la corteza cerebral, el tallo cerebral y de diferentes mecanorreceptores y quimiorreceptores centrales y periféricos. El ciclo y las conexiones son relevantes porque pueden explicar el alivio de la disnea con opioides, y también los síntomas ansiosos asociados con la disnea (por la asociación de señales neurológicas con el sistema límbico). Se deben identificar y analizar causas y potenciales ajustes al manejo que ayuden al control sintomático. Para valorar la intensidad inicial del síntoma y su modificación posterior al tratamiento, se pueden usar herramientas como la escala numérica (de 0 a 10) o la escala visual análoga (1 a 10cm).
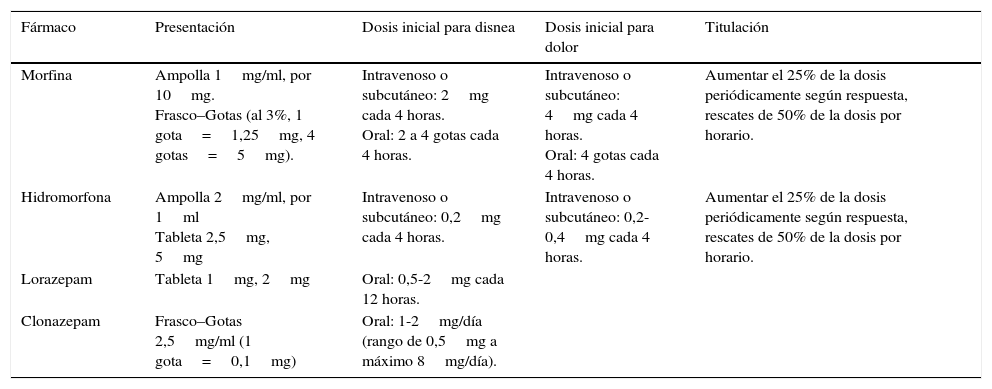
El diurético es fundamental para controlar la disnea secundaria a la congestión pulmonar. Otros fármacos que pueden aliviarla son vasodilatadores como la nitroglicerina o el dinitrato de isosorbide, aunque su uso puede estar limitado por la hipotensión. La eficacia y seguridad de los opioides para el control de la disnea ha sido probada, usando dosis menores a las analgésicas16. La morfina es la primera opción por economía y disponibilidad. La hidromorfona puede usarse en pacientes con insuficiencia renal crónica por tener menos metabolitos activos. El manejo inicial es con dosis de rescate17, escalonándose a dosis por horario con titulación periódica, según necesidades y efectos secundarios18. Existe relación entre la disnea y la ansiedad, por tanto las benzodiacepinas de acción prolongada a dosis bajas son la segunda línea de manejo16. En la tabla 3 se resume la información sobre las opciones farmacológicas para el tratamiento de la disnea.
Opciones farmacológicas para el manejo de la disnea
| Fármaco | Presentación | Dosis inicial para disnea | Dosis inicial para dolor | Titulación |
|---|---|---|---|---|
| Morfina | Ampolla 1mg/ml, por 10mg. Frasco–Gotas (al 3%, 1 gota=1,25mg, 4 gotas=5mg). | Intravenoso o subcutáneo: 2mg cada 4 horas. Oral: 2 a 4 gotas cada 4 horas. | Intravenoso o subcutáneo: 4mg cada 4 horas. Oral: 4 gotas cada 4 horas. | Aumentar el 25% de la dosis periódicamente según respuesta, rescates de 50% de la dosis por horario. |
| Hidromorfona | Ampolla 2mg/ml, por 1ml Tableta 2,5mg, 5mg | Intravenoso o subcutáneo: 0,2mg cada 4 horas. | Intravenoso o subcutáneo: 0,2-0,4mg cada 4 horas. | Aumentar el 25% de la dosis periódicamente según respuesta, rescates de 50% de la dosis por horario. |
| Lorazepam | Tableta 1mg, 2mg | Oral: 0,5-2mg cada 12 horas. | ||
| Clonazepam | Frasco–Gotas 2,5mg/ml (1 gota=0,1mg) | Oral: 1-2mg/día (rango de 0,5mg a máximo 8mg/día). |
La principal manifestación de la congestión sistémica es el edema; genera una carga sintomática alta, y causa dolor y limitaciones de movilidad. La pobre adherencia al manejo farmacológico, a la restricción hídrica, el uso de ciertos medicamentos y la misma progresión de la enfermedad, empeoran la congestión. Para el control de todos los síntomas por sobrecarga de volumen se aplica la restricción hídrica y el manejo con diuréticos. Cuando hay una falla para disminuir la congestión sistémica o pulmonar, a pesar del uso de dosis altas de diurético intravenoso se habla de resistencia a diuréticos19.
La furosemida es el principal diurético usado en nuestro medio. Actúa en el asa de Henle inhibiendo la bomba transportadora sodio–potasio–cloro. Para su transporte en el espacio intravascular, la furosemida se une a proteínas plasmáticas, y al llegar al glomérulo es secretada hacia la luz del túbulo contorneado proximal donde genera natriuresis y diuresis20. Tiene una dosis umbral, a partir de la cual se genera el efecto de natriuresis y diuresis, que varía según las características del paciente. También tiene una dosis techo a partir de la cual no se genera más efecto diurético porque todas las bombas transportadoras sodio–potasio–cloro están inhibidas. Los ajustes de la dosis entre el umbral y el techo permiten optimizar el manejo depletivo del paciente, teniendo en cuenta que la respuesta diurética en esta franja es dosis-dependiente. La eficacia de la terapia con furosemida está condicionada por su absorción intestinal (errática en la descompensación) y la excreción urinaria (disminuida por bajo gasto, hipoperfusión renal e hipoalbuminemia). Entre tanto, el deterioro de la función renal se asocia con resistencia al diurético, y en las descompensaciones la dosis umbral es mayor.
Las estrategias para optimizar la respuesta al diurético se deben ajustar según el tipo de paciente (ambulatorio, hospitalizado o en hospitalización domiciliaria), y se enumeran a continuación:
- 1.
Régimen flexible de diurético: duplicar dosis habitual de furosemida oral por tres días consecutivos.
- 2.
Régimen flexible de diurético parenteral: tres dosis de 20mg de furosemida separadas por 30 minutos, hidroclorotiazida vía oral 25mg, suplemento de potasio oral, con repetición por tres días consecutivos.
- 3.
Furosemida parenteral por horario: ajustar dosis y horario según necesidad.
- 4.
Furosemida en infusión continua.
- 5.
Bloqueo secuencial/completo de nefrona: furosemida en dosis alta, con hidroclorotiazida (12,5-25mg cada día) y antagonista mineralocorticoide (espironolactona o eplerenona, 12,5-25mg cada día)21,22.
En el bloqueo secuencial de la nefrona se usan diuréticos que actúen en puntos diferentes de la nefrona para lograr un efecto diurético aditivo20,22. Es una estrategia para pacientes refractarios con congestión prominente y función renal preservada. Al usarla se debe monitorizar la función renal y el potasio sérico a diario.
La hipoalbuminemia determina menor unión de la furosemida a proteínas plasmáticas, con mayor distribución del fármaco a nivel extravascular y menores concentraciones disponibles en el volumen intravascular. En teoría, la infusión de albúmina seguida de furosemida, puede aumentar la permanencia del fármaco a nivel intravascular y aumentar su efecto en la nefrona. Esta práctica puede ser considerada en el paciente con resistencia al diurético, aunque la evidencia para apoyarla sea insuficiente19.
La solución salina hipertónica (al 1,5 y 3%) puede utilizarse en infusiones periódicas asociada a dosis altas de furosemida (250-500mg/día) en quienes tengan congestión pulmonar y sistémica, no tengan bajo gasto, sean refractarios al manejo diurético y con diuresis reducida, sin hipotensión, con creatinina mayor a 2mg/dl y tasa de filtración glomerular menor a 35ml/min23. La ultrafiltración es otra alternativa en el paciente refractario1, que requiera alivio de la congestión pulmonar y sistémica de forma rápida, sin generar efectos sobre la tensión arterial o la función renal. Esta opción puede considerarse cuando se indica y es tratada por un equipo multidisciplinario.
DolorEl estudio PAIN HF identificó que el 85% de los pacientes hospitalizados por falla cardiaca terminal reportaron dolor24, el cual puede ser causado por cardiopatía isquémica (angina), desacondicionamiento físico, edema persistente de miembros inferiores, compresión nerviosa, hipoperfusión o congestión de órganos abdominales. También reportaron dolor inespecífico25.
Para manejar adecuadamente el dolor, se debe valorar la localización, tipo e intensidad, y su posible causa. Las opciones de manejo farmacológico son los opioides y el acetaminofén, evitando antiinflamatorios no esteroideos por los efectos cardiovasculares y riesgos que conllevan en pacientes mayores y con múltiples comorbilidades1. La titulación se realiza partiendo de una dosis analgésica del opioide elegido, ajustándola según la respuesta y los efectos adversos que se presenten18.
Para pacientes con dolor de intensidad leve a moderada se puede usar la combinación de acetaminofén con hidrocodona. El acetaminofén actúa como ahorrador de opioide. Al iniciar el manejo analgésico se usan opioides de acción corta para determinar la dosis total diaria requerida, y de ser necesario se ajusta el manejo con opioides de mayor periodo de acción según requiera el paciente. En casos de dolor moderado a severo, que se den de manera frecuente o permanente, sea de difícil control o en pacientes con poca aceptación/tolerancia a la vía oral, se puede usar opioide intravenoso o subcutáneo, o sistemas transdérmicos de fentanilo o buprenorfina.
Caquexia cardiacaLa caquexia es un síndrome metabólico complejo que se caracteriza por la pérdida de masa muscular, objetivado por pérdida de peso mayor o igual al 5%, o mayor o igual al 2% en pacientes con índice de masa corporal menor a 20kg/m2 o sarcopenia26,27. Se asocia a patologías crónicas, y su causa es un estado de inflamación prolongado en el que predomina el catabolismo muscular, la baja ingesta de alimentos, el balance calórico negativo y la resistencia a la insulina. La congestión del lecho esplácnico e hipoperfusión abdominal, contribuyen a la hiporexia, el tránsito intestinal lento y a menor absorción intestinal, que empeoran la pérdida de peso26,28.
La caquexia cardiaca genera una carga emocional elevada para el paciente y su familia, además de ser un factor de mal pronóstico y un criterio de enfermedad terminal29. El 15% de los pacientes con falla cardiaca terminal tienen caquexia cardiaca30. Todos los pacientes con falla cardiaca deben tener una valoración nutricional para prevenir e identificar el riesgo nutricional, que puede hacerse utilizando el índice de masa corporal y cuestionarios como la valoración global subjetiva. El manejo médico óptimo genera bloqueo neurohormonal y reduce la inflamación crónica, por lo que de tolerarlo se debe continuar. Además, debe buscarse mantener ingesta oral adecuada, y aumentar la actividad física, actividades que han demostrado algún grado de utilidad en caquexia cardiaca28. El uso de soporte nutricional enteral/parenteral debe considerarse cuidadosamente en el contexto del paciente en cuidado paliativo, y así mismo debe discutirse con el paciente y su familia, recalcando que la caquexia hace parte de la enfermedad terminal, es secundario a la progresión de la enfermedad y su uso puede no generar impacto real en la sobrevida.
Se han estudiado opciones farmacológicas como manejo de la caquexia en la enfermedad terminal oncológica y no oncológica, las cuales se resumen en la tabla 431–33. Estos medicamentos generan un efecto orexígeno, y favorecen un aumento de peso que no es secundario a retención hídrica. Su uso puede generar una mejoría en la percepción de calidad de vida del paciente y su familia.
Manejo farmacológico de la caquexia cardiaca
| Fármaco | Presentación | Mecanismo de acción e indicación | Dosis |
|---|---|---|---|
| Olanzapina | Tableta 5mg | Antipsicótico atípico con efecto en las vías dopaminérgica, serotoninérgica y adrenérgica, y en receptores muscarínicos y de histamina. Aumento del apetito, adyuvante para el control de delirium y náuseas. | 2,5-5mg cada noche, vía oral. |
| Corticosteroides | Prednisolona: tableta 5mg Dexametasona: tableta 0,75mg (deltafluorene) | Inhibición de la síntesis de citoquinas, efecto modulador sobre la leptina, factor liberador corticotropina y circuito serotoninérgico. Puede incrementar la congestión sistémica. Su uso puede asociarse a un régimen flexible de diurético y a la vigilancia estricta del empeoramiento de síntomas como disnea. | Prednisolona: vía oral 5mg cada 8 horas por 5 días. Dexametasona: vía oral, 3-6mg cada día por 5 días. |
| Acetato de megestrol | Tableta 160mg | Progestágeno sintético (aprobado para caquexia oncológica por la FDA). Estimula el apetito a través del neuropéptido Y e inhibiendo la actividad de citoquinas inflamatorias. Su uso se asocia a mayor frecuencia de eventos adversos: trombosis venosa profunda, aumento de la disnea y síntomas congestivos36. | Vía oral, 160mg cada 12 horas por 8 semanas. |
El desfibrilador automático implantable (DAI) es un dispositivo avanzado que está indicado para prevención de muerte súbita en pacientes con falla cardiaca con buen pronóstico vital y funcional a mediano plazo1,3. La función de marcapasos y de resincronización cardiaca ayuda a mejorar la calidad de vida de los pacientes con fracción de eyección menor de 35%, que tengan pronóstico vital mayor de un año y clase funcional menor de IV ambulatoria. La mayoría de pacientes con DAI fallecen por progresión de la falla de bomba, y tienen una mortalidad anual que varía de 11 a 16%9. Un DAI no mejora el control de los síntomas y puede generar mayor carga de enfermedad (complicaciones asociadas al implante, descargas inapropiadas, ansiedad y dolor asociado a las descargas en general o en el paciente agónico, etc.).
En Estados Unidos, el 97% de las unidades de Cuidado Paliativo tienen pacientes con DAI; el 58% reportan que los pacientes han recibido descargas en el último año de vida y únicamente el 10% de los grupos tienen protocolos relacionados con la desactivación del dispositivo34. Es poco común que el médico tratante discuta con el paciente y sus familiares sobre la posibilidad de desactivar el DAI y usualmente permanecen activos hasta el momento de muerte34. Un estudio cualitativo desarrollado con un grupo pequeño de pacientes con DAI, identificó que la mayoría preferiría que su médico tomara la decisión sobre la desactivación del dispositivo35. La Sociedad Europea de Ritmo Cardiaco y la Sociedad de Ritmo Cardiaco, han emitido consensos sobre la desactivación de dispositivos implantables en el paciente en cuidado paliativo y ante la solicitud del mismo36,37. A continuación se listan los puntos esenciales que plantean estos documentos:
- 1.
La desactivación del DAI en el paciente en cuidado paliativo es éticamente aceptada, y los dilemas que surjan deben valorarse teniendo en cuenta la autonomía, beneficencia y no maleficencia.
- 2.
Desactivar el DAI no tiene relación con la eutanasia o el suicidio asistido médicamente.
- 3.
Para decidir sobre la desactivación del DAI debe valorarse la situación clínica, las necesidades y deseo del paciente y su familia. El Comité de Ética institucional puede apoyar la toma de decisiones en torno al DAI relacionadas con el implante o la desactivación del dispositivo.
- 4.
La posibilidad de desactivar el DAI debe informarse al paciente y su familia al momento del implante, si hay incremento en el número o frecuencia de las descargas, si hay progresión de la falla cardiaca (diagnóstico de falla cardiaca u otra enfermedad terminal), y en el paciente en sedación paliativa.
- 5.
Se debe explorar sobre las creencias religiosas y percepciones erróneas sobre la desactivación del DAI, para aclararle al paciente y su familia que este es un paso que permite morir dignamente.
- 6.
El equipo que trabaje con el paciente y su familia debe informar, aconsejar y asistir en el proceso de toma de la decisión y de llevarla a cabo. La comunicación abierta y efectiva es fundamental en este proceso.
- 7.
Existen múltiples opciones sobre los modos que se pueden desactivar en un DAI (tabla 5).
Tabla 5.Modos de desactivación del DAI según características clínicas del paciente
Características clínicas Modos de desactivación Últimos días de la vida, en pacientes con falla cardiaca terminal. Desactivar todas las terapias antitaquicardia (la taquicardia ventricular/fibrilación ventricular pueden llevar a la muerte sin prolongar el sufrimiento). Situación cardiaca estable, con falla cardiaca terminal. Desactivar desfibrilación únicamente.
Las terapias antitaquicardia controlan la taquicardia ventricular lenta (100-160rpm) que de aparecer podrían agravar los síntomas de falla cardiaca.Últimos días de la vida o situación cardiaca estable, en dispositivos con opción de marcapasos. Las medidas antibradicardia del dispositivo no afectan significativamente la sobrevida del paciente y ayudan a controlar enfermedad del nodo o bloqueos AV completos que de aparecer podrían agravar los síntomas de falla cardiaca. Últimos días de la vida o situación cardiaca estable, en dispositivos con opción de resincronización cardiaca. La resincronización cardiaca hace parte del tratamiento sintomático de la falla cardiaca, por lo que no debe desactivarse al final de la vida.
Al desactivar un dispositivo, se deben valorar las opciones farmacológicas disponibles para minimizar los síntomas asociados a arritmias, cuando sea necesario36. La reprogramación del dispositivo debe estar a cargo de personal calificado, como en la Unidad de Electrofisiología. En el paciente agónico con descargas frecuentes, y ante la no disponibilidad de los equipos/personal para reprogramar el dispositivo, el médico tratante puede poner un imán sobre éste, de modo que desactive temporalmente las terapias antitaquicardia36.
Síntomas refractarios y sedación paliativaLos pacientes con falla cardiaca terminal, en sus últimos días o semanas de vida, pueden cursar con bajo gasto, alteración del estado de conciencia, alucinaciones, agitación psicomotora, mioclonías, dolor, disnea y edema. Cuando los síntomas sean considerados refractarios, se acompañen de incomodidad para el paciente y su familia, y el pronóstico sea de días se debe considerar el inicio de la sedación paliativa. Esta práctica consiste en el uso monitorizado de medicamentos con la intención de reducir el estado de conciencia, para aliviar la carga de síntomas intratables, de manera que sea éticamente aceptado por el paciente, su familia y los profesionales de la salud que tratan al paciente38.
La decisión de iniciar la sedación paliativa es una decisión médica. El equipo interdisciplinario debe realizar una valoración completa para determinar el plan de manejo y plantear la sedación paliativa si se considera la única opción para el alivio de síntomas refractarios en un paciente con mal pronóstico vital a corto plazo. La comunicación entre los tratantes, el paciente y su familiar debe ser asertiva, asegurar la comprensión total sobre el objetivo de la sedación y aclarar que probablemente el desenlace final sea la muerte del paciente.
La deshidratación y la desnutrición no generan dolor o incomodidad y hacen parte del proceso de muerte. Iniciar o mantener hidratación intravenosa y el soporte nutricional es controvertido, y debe individualizarse según el deseo del paciente y su familia. Si el estado de conciencia del paciente lo permite, puede continuarse la administración de alimentos y líquidos vía oral.
Para la sedación paliativa se utilizan benzodiacepinas, opioides y/o hipnóticos, para mantener un nivel mínimo de sedación que genere alivio de los síntomas. En algunos casos se puede intentar lograr una sedación consciente, en la que el paciente tiene alivio de los síntomas, pero puede alertarse al llamado y conserva interacción con el medio38. Si esto no genera alivio de los síntomas, se debe escalonar el manejo y generar mayor sedación para lograr el control completo de los síntomas y comodidad para el paciente. La sedación continua y profunda se usa en pacientes con sufrimiento intenso, cuando los síntomas son refractarios y la muerte se anticipa para horas o días38. Una vez se alcance el control de los síntomas, la dosis solo debe aumentarse si reaparecen (quejas de dolor, disnea, agitación).
En el paciente con falla cardiaca en quien se ha iniciado el manejo con opioide para control previo de disnea o dolor, se debe tomar la dosis equivalente a la analgésica y convertirla en una tasa de infusión (miligramos por hora), para titular la infusión según la respuesta del paciente38,39. Adicional a la infusión de opioide se puede usar otro medicamento, que comúnmente es midazolam, aunque existen otras opciones. En infusión continua se usa una tasa de infusión y rescates a necesidad. Periódicamente se debe titular la tasa de infusión ajustando la dosis según el uso de rescates, efectos secundarios y síntomas. En la tabla 6 se resume la información sobre los fármacos usados en la sedación paliativa acorde con las recomendaciones de la Sociedad Europea de Cuidados Paliativos37,40 (tabla 3). La ketamina y la dexmedetomidina son medicamentos con evidencia limitada en cuidado paliativo pero un grupo experto puede usarlo cuando los síntomas sean refractarios a los medicamentos más comunes.
Fármacos usados en sedación paliativa
| Fármaco | Dosis | Titulación y rescates |
|---|---|---|
| Morfina Opción económica y fácilmente disponible. | Manejo previo con opioide por horario: convertir la dosis analgésica diaria a tasa de infusión en mg por hora. Sin manejo previo con opioide por horario: Iniciar infusión a 1mg por hora. | Aumentar 25-100% de la dosis según la respuesta y nivel de sedación requerida cada 4 horas. Bolos de rescate equivalentes al 50-150% de la dosis por hora si hay exacerbación del dolor o disnea. Revalorar ante uso frecuente de rescates y ajustar la tasa de infusión. |
| Hidromorfona Menos metabolitos activos, útil en enfermedad renal crónica. | Manejo previo con opioide por horario: convertir dosis analgésica diaria a tasa de infusión en miligramo por hora. Convertir dosis analgésica de la morfina a dosis de hidromorfona y ajustarla a tasa de infusión en miligramo por hora. Inicio a 0,5-1mg/hora (7-15mg/kg/día). | Progresiva. Aumentar 25-100% de la dosis según la respuesta y nivel de sedación requerida. Bolos de rescate equivalentes al 50-150% de la dosis por hora si hay exacerbación del dolor o disnea. Revalorar uso frecuente de rescates y ajustar la tasa de infusión. |
| Midazolam Benzodiacepina de uso intravenoso e inicio de acción rápido. Uso conjunto con opioide. | Bolo de inicio: 1-5mg cada 5 minutos hasta lograr control de síntomas. Dosis de inicio de infusión (sin bolo inicial): 0,5-1mg/h Administración intravenosa o subcutánea, en dosis frecuentes o infusión continua (vida media corta). | Iniciar con bolos y repetirlos cada 5 minutos si hay síntomas exacerbados y se requiere sedar más rápidamente. Titular la infusión cada 15 minutos hasta lograr el nivel de sedación requerido. Rescates de 1-5mg si hay exacerbación de síntomas. Ajustar la dosis de mantenimiento según necesidades cada 2 horas, teniendo en cuenta uso de rescates. Dosis diaria: 30-100mg. Si la tasa de infusión supera los 20mg/hora debe considerarse adicionar o cambiar el manejo farmacológico. |
| Propofol Anestésico general de inicio de acción rápido. Efecto antiemético y broncodilatador. | Administración intravenosa únicamente. Bolo de inicio de 0,25-0,5mg/kg en 3-5 minutos. Dosis de mantenimiento: 0,25mg/kg/hora, máximo 4mg/kg/hora. Administrar en infusión continua (vida media corta). | Repetir bolo de inicio cada 5-15min hasta lograr nivel de sedación. Dosis efectiva usual entre 1-4mg/kg/h. Pueden usarse bolos antes de cada cambio de posición, baño en cama o aseo. |
| Ketamina Precaución en pacientes con hipertensión arterial. | Ampolla 50m/5ml Administración subcutánea o intravenosa. Dosis de inicio: 50-150mg/día | Titular cada 24 horas, incrementando dosis en 50-100mg. Dosis efectiva usual entre 50 y 600mg/día. |
| Dexmedetomidina Agonista alfa 2 con propiedades sedativas y analgésicas. | Vial de 400 mcg/100ml Dosis de inicio: 0,2 mcg/kg/h | Titular con incrementos de 0,1 mcg/kg/h cada 30-60 minutos hasta lograr nivel de analgesia o sedación requerida. |
Se deben tener los siguientes cuidados generales durante la sedación paliativa:
- 1.
Cabecera a 30-45 grados (manejar las secreciones y evitar la aspiración).
- 2.
Hidratación del globo ocular y medidas de prevención de úlceras por presión.
- 3.
Terapia respiratoria por horario (cada 8-12 horas), y de ser necesario:
- a.
Aspiración mecánica de secreciones orales y nasales.
- b.
Micronebulizaciones con solución salina hipertónica o atropina.
- c.
Butilbromuro de hioscina intravenoso como agente adyuvante en el manejo secreciones.
- a.
- -
Ser capaz de comunicar información con amabilidad, sensibilidad y empatía hace parte del buen actuar médico. Reconocer las necesidades insatisfechas en un paciente paliativo, sean físicas, emocionales o espirituales, también hace parte de las habilidades de comunicación propias del equipo de profesionales de la salud que tratan enfermedades complejas.
- -
Al igual que en otras enfermedades crónicas no oncológicas, el curso de la falla cardiaca terminal es menos predecible, con agudizaciones y periodos estables variables. Es vital identificar al paciente terminal para planear sus cuidados de manera oportuna, ajustando el manejo a las necesidades del mismo.
- -
El manejo médico paliativo busca controlar disnea, dolor, edema, síntomas gastrointestinales y trastornos neurológicos y psiquiátricos. Hay herramientas farmacológicas y no farmacológicas para el control de estos síntomas, y el manejo debe ajustarse según la respuesta y necesidad de cada paciente.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflictos de interés.