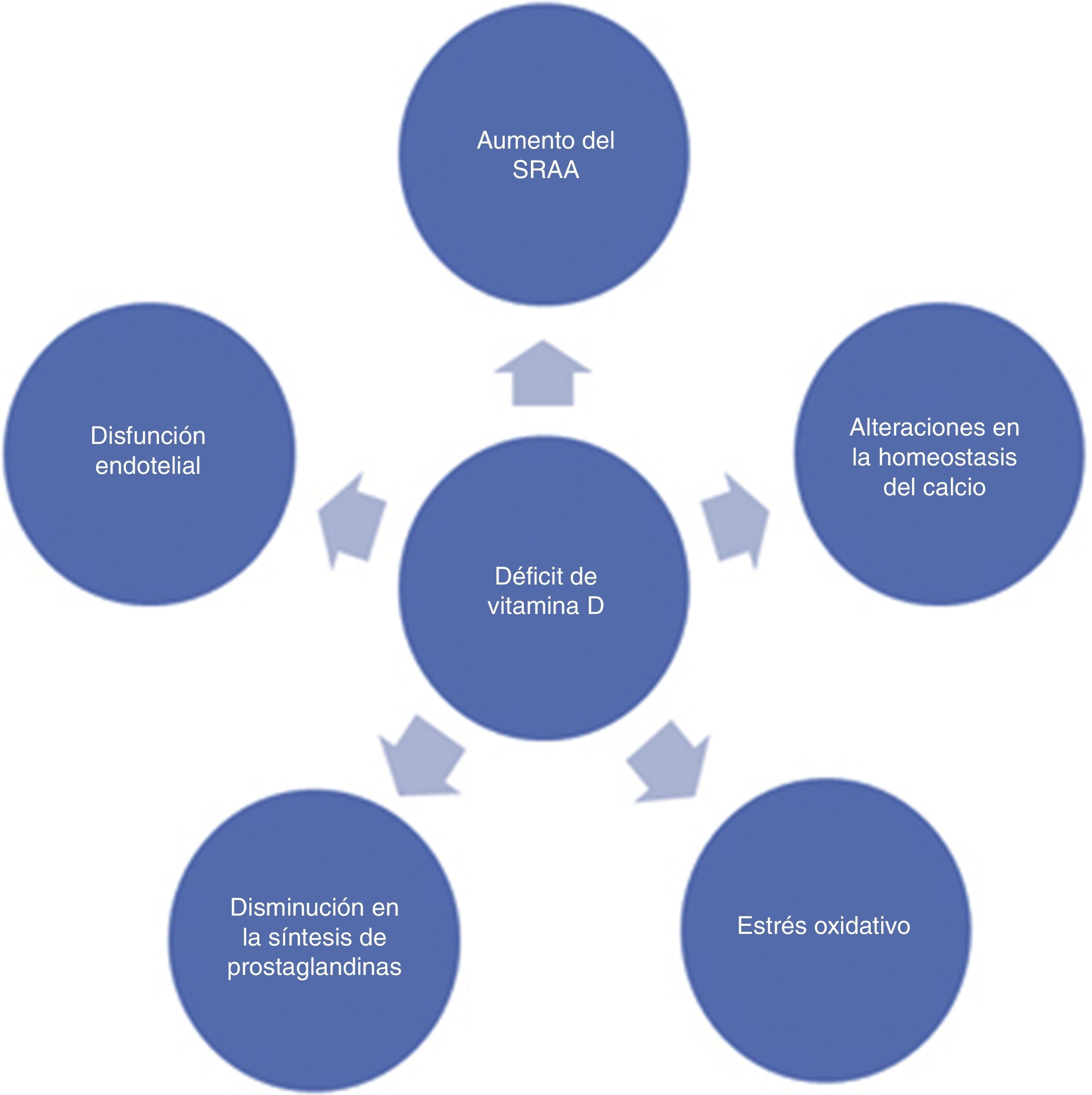
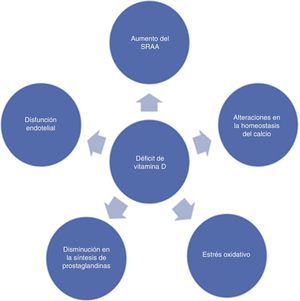
El déficit de la vitamina D se ha relacionado con el aumento en las cifras de la presión arterial. Un incremento en la actividad del sistema renina-angiotensina-aldosterona, la disfunción endotelial, las alteraciones en la homeostasis del calcio, el aumento del estrés oxidativo y la disminución en la síntesis de las prostaglandinas parecen ser los principales mecanismos fisiopatológicos involucrados en los pacientes con déficit de la vitamina D y aumento de la presión arterial. El uso de suplementos de la vitamina D para reducir el riesgo o la progresión de la hipertensión arterial puede ser una alternativa en los pacientes con bajos niveles de esta vitamina. El déficit de la vitamina D se ha relacionado con el fallo de la terapéutica antihipertensiva y debe continuar evaluándose la efectividad del tratamiento hipotensor en pacientes con bajos niveles de este compuesto
Vitamin D deficiency has been related with a rise in blood pressure values. An increase in renin-angiotensin-aldosterone system activity, endothelial dysfunction, calcium homeostasis modifications, a rise in oxidative stress and reduction in prostaglandins production appear to be the main pathophysiological mechanisms associated in patients with low vitamin D levels and high blood pressure values. The use of supplements of vitamin D for reducing the risk or progression of hypertension could be a choice for patients with low levels of this vitamin. Low levels of vitamin D have been related with a failure in antihypertensive treatment, and further evaluation of efficacy of antihypertensive treatment in patients with low levels of this substance should be continued.
Se estima que la prevalencia de la hipertensión arterial (HTA) es del 30 al 45% en la población general1. Solo en los Estados Unidos, aproximadamente 78 millones de personas mayores de 20 años son hipertensas2. Las complicaciones de la HTA están asociadas a las principales causas de muerte a nivel mundial1.
En los últimos tiempos se han mostrado evidencias relacionando el déficit corporal de la vitamina D y el aumento en las cifras de la presión arterial (PA). Los primeros reportes fueron publicados en la década de 19803,4.
Se ha demostrado que la vitamina D inhibe el sistema renina-angiotensina-aldosterona, favorece la protección de los vasos sanguíneos y contribuye a la homeostasis del calcio5. Estos mecanismos pueden explicar, en parte, la asociación inversa entre los niveles de la vitamina D y la PA observado en múltiples estudios. Se calcula que el déficit de la vitamina D en la población general es del 30-50%6, lo que representa un importante problema de salud en numerosos países.
La presente revisión se propone describir las evidencias a favor de la relación entre el déficit de la vitamina D y la elevación de la PA. Se revisan los posibles mecanismos involucrados y se abordan tópicos que deben ser estudiados con mayor profundidad, como la posibilidad del uso de suplementos de la vitamina D en pacientes con riesgo de HTA o la posible relación entre bajos niveles de la vitamina D y el fallo en la terapéutica antihipertensiva.
Para alcanzar estos objetivos se realizó una búsqueda en las bases de datos Medline/PubMed, EBSCO, Scopus y DOAJ con los términos hipertensión arterial, vitamina D, calcio, 25 hidroxicolecalciferol y enfermedad cardiovascular. Se seleccionaron aquellas investigaciones que se consideraron útiles para la realización de esta revisión por la evidencia y novedad aportadas.
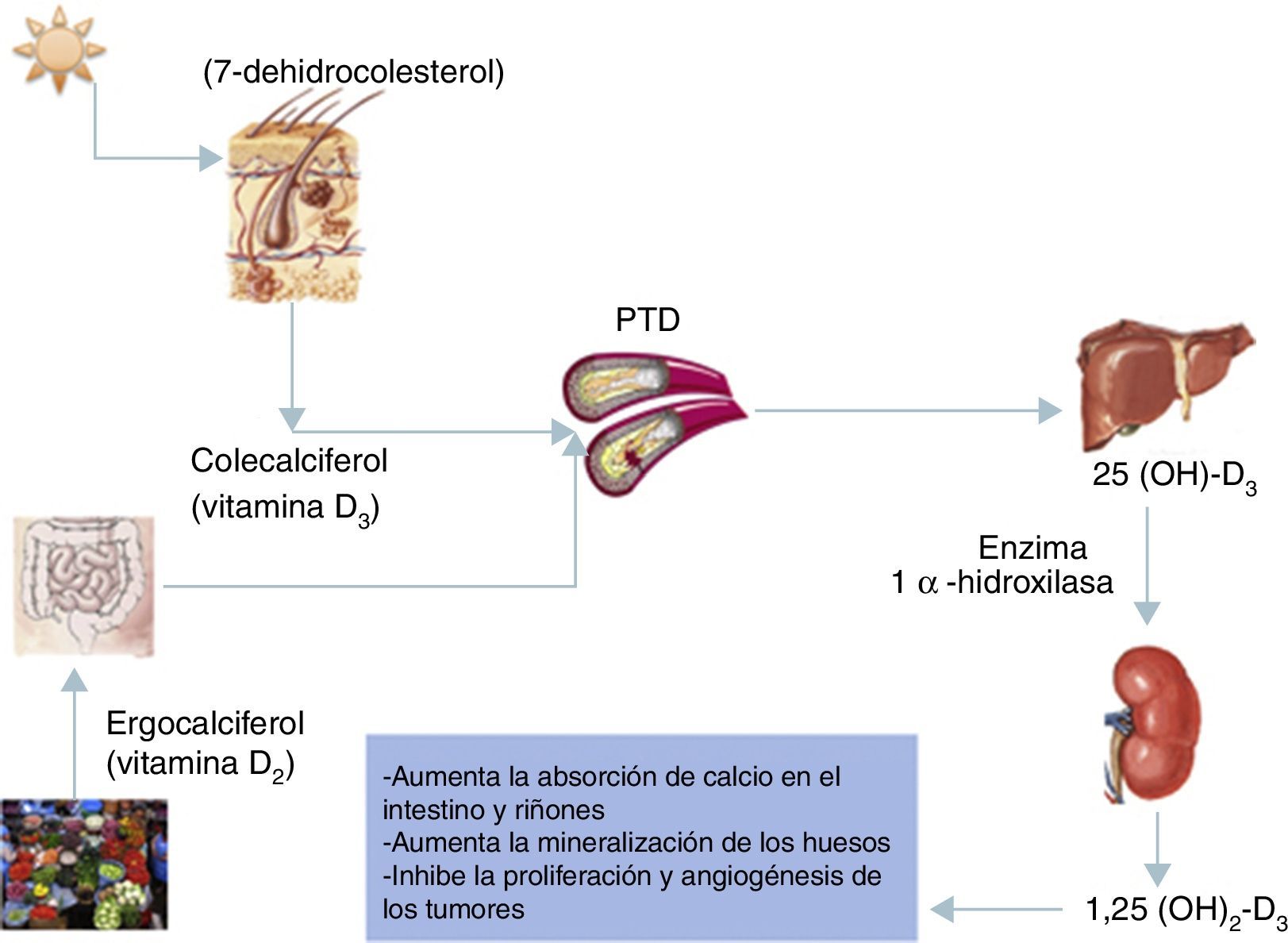
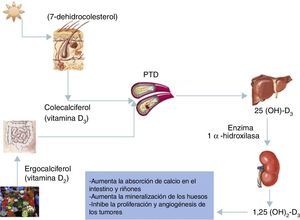
Metabolismo de la vitamina DVarios compuestos del grupo de los esteroles pertenecen a la familia de la vitamina D y todos realizan similares funciones. Existen 5 formas de la vitamina D (D1-D5), de ellas la vitamina D2 y la D3 son las más ampliamente estudiadas. El ergocalciferol o vitamina D2 es sintetizado fundamentalmente en las plantas y los animales invertebrados. Su ingreso al organismo es esencialmente a través de la dieta o en suplementos vitamínicos. El colecalciferol (vitamina D3) es un compuesto hallado principalmente en los animales vertebrados y comúnmente consumido mediante aceites de pescado. La vitamina D3 es, además, sintetizada en la piel del cuerpo humano, mediante la acción de los rayos ultravioleta solares actuando sobre el 7-dehidrocolesterol. La vitamina D sintetizada de manera endógena y la consumida en la dieta se almacenan en las células del tejido adiposo. Esta es transportada en la circulación sanguínea mediante una glucoproteína (proteína transportadora de la vitamina D). En el hígado la vitamina D es convertida a 25-hidroxicolecalciferol (25[OH]-D3) y luego en los riñones es transformada a su forma activa el 1,25-dihidroxicolecalciferol (1,25[OH]2-D3), mediante la acción de la enzima 1α-hidroxilasa7,8 (fig. 1).
Metabolismo y acciones biológicas de la vitamina D. La presente figura muestra el metabolismo de la vitamina D y sus principales acciones biológicas. La acción de los rayos solares sobre la piel transforma el 7-dehidrocolesterol en colecalciferol. A través de la dieta y los suplementos vitamínicos, ingresa fundamentalmente el ergocalciferol. Ambas son transportadas en la circulación sanguínea mediante la PTD hasta llegar al hígado. En este órgano son transformados en 25-hidroxicolecalciferol y luego en el riñón, finalmente adquieren la forma activa, el 1,25-dihidroxicolecalciferol mediante la acción de la enzima 1α-hidroxilasa.
PTD: proteína transportadora de vitamina D; 1,25 (OH)2-D3: 1,25-dihidroxicolecalciferol; 25 (OH)-D3: 25-hidroxicolecalciferol.
La forma activa de la vitamina D interactúa con receptores localizados en el núcleo de varias células del organismo, como: los enterocitos, los osteoblastos, las glándulas paratiroides, las células del túbulo contorneado distal, las células endoteliales de la aorta y en el músculo liso vascular9. El gen que codifica para el receptor de la vitamina D se ubica en el brazo largo del cromosoma 1210 y hasta la actualidad se han encontrado varios polimorfismos del mismo11. Un estudio reciente indica que las personas que presentan el polimorfismo FokI en el gen que codifica para el receptor de la vitamina D tienen un riesgo incrementado de desarrollar HTA12. La unión de la vitamina D con su receptor forma un complejo heterodímero que, unido a otros factores, altera la transcripción de genes en las células y su posterior expresión, provocando el aumento en la absorción de calcio desde el intestino, las células de los túbulos renales y suprimiendo, además, la secreción de parathormona9,13.
Consumo de la vitamina DLa exposición a la luz solar es la mayor fuente de vitamina D en el humano (80 al 90%) en condiciones naturales14. La acción de los rayos ultravioleta sobre la piel durante pequeños intervalos aporta entre 250μg a 500μg (10.000 UI a 20.000 UI) diarios de la vitamina D15. Los ingresos a través de la dieta son menores en comparación con la formación cutánea; no obstante, pueden resultar importantes si se agregan en suplementos alimentarios16. La cantidad de vitamina D producida en el cuerpo puede verse afectada por varios factores, como la edad, la exposición a la luz solar, la latitud, la masa corporal y el color de la piel17. Las concentraciones sanguíneas de 25-hidroxicolecalciferol aceptadas como beneficiosas se observan con valores ≥ 30ng/ml (75 nmol/l). La insuficiencia de este elemento se presenta con niveles entre 21ng/ml y 29ng/ml, mientras que cifras<20ng/ml (< 50nmol/L) indican deficiencia6,8,18.
Actualmente, la dosis diaria de la vitamina D aceptada para cubrir los requerimientos de este compuesto son de 400 UI entre los 0 y 18 años de edad, 600 UI entre los 19 y 70 años de edad y 800 UI para personas mayores de 70 años de edad19. Por cada 100 UI de vitamina D ingresada al cuerpo los niveles sanguíneos de 25-hidroxicolecalciferol aumentan en 1ng/ml (2,5 nmol/l)20,21. En caso de deficiencia de la vitamina D, el consumo de 800 UI a 1 000 UI/día (20μg-25μg) de la vitamina D3 puede restaurar las concentraciones séricas de 25-hidroxicolecalciferol a niveles adecuados22.
Mecanismos que explican la relación entre el déficit de la vitamina D y la hipertensión arterialLa vitamina D tiene un importante efecto en la disminución de la actividad del sistema renina-angiotensina-aldosterona, lo que produce consecuencias para la regulación de la PA. Li et al.23 han aportado evidencias sobre este aspecto. Sus estudios demuestran que el déficit de receptores de la vitamina D en ratones se asocia a elevados niveles de renina en el plasma, lo que provoca HTA en estos. En otro estudio, Zhou et al.24 demuestran una disminución en la actividad de la enzima 1α-hidroxilasa, con aumento en los valores de renina plasmática y de la PA en ratones de laboratorio. Además, advierten de que esta condición puede ser revertida con la administración de 1,25-dihidroxicolecalciferol. Estos resultados en animales de laboratorio también han sido reproducidos en seres humanos. Luego de estudiar a un grupo de pacientes normotensos, Forman y Williams plantean que una disminución en los valores plasmáticos de 25-hidroxicolecalciferol favorece un aumento en la actividad del sistema renina-angiotensina-aldosterona y en las concentraciones de angiotensina ii25.
Otro de los mecanismos propuestos es la relación entre la vitamina D y la homeostasis del calcio en el organismo26. En el año 1980, un grupo de investigadores plantearon que los desórdenes del metabolismo del calcio pueden estar relacionados con el desarrollo de la HTA. Además, demuestran que los pacientes hipertensos tienen mayores niveles de hipercalciuria que los normotensos, sugiriendo que las concentraciones de calcio en el cuerpo son necesarias para lograr un correcto control de la PA27. Resnick et al.28 apoyan estos resultados, pues plantean que la vitamina D está vinculada con la regulación de la entrada de calcio en las células del músculo liso de los vasos sanguíneos, determinando así las concentraciones intracelulares de calcio y el tono vascular, y disminuyendo la secreción de renina en las células yuxtaglomerulares del riñón.
Existen otras hipótesis que permiten explicar los efectos prohipertensivos del déficit de la vitamina D. Se ha demostrado que los bajos niveles de la vitamina D favorecen un aumento del estrés oxidativo29, la disfunción endotelial30 y una disminución en la producción de prostaglandinas31 (fig. 2).
Evidencias que apoyan la asociación entre el déficit de la vitamina D y la hipertensiónEstudios de casos y controles, y cohorteUn análisis del tercer NHNES en 12.644 pacientes ha permitido demostrar que las personas con valores sanguíneos de 25-hidroxicolecalciferol ≥ 85,7 nmol/l, mantienen cifras de la PA sistólica de 3,0mmHg (p=0,0004) y PA diastólica de 1,6mmHg (p=0,011) menos, en comparación con los que presentan valores plasmáticos de 25-hidroxicolecalciferol ≤ 40,4 nmol/l. Las diferencias entre los valores de 25-hidroxicolecalciferol y las cifras de la PA fue mayor en los participantes ≥ 50 años de edad, en comparación con los jóvenes (p=0,021). Estos resultados apoyan la hipótesis que plantea una relación entre la capacidad de producción y/o absorción de la vitamina D en las personas de la tercera edad y el riesgo de presentar HTA. En la propia investigación, un análisis de los niveles de 25-hidroxicolecalciferol según grupos étnicos muestra que los sujetos de raza negra no hispánicos tienen las menores concentraciones de 25-hidroxicolecalciferol (49 nmol/l), seguidos por los latinoamericanos de origen mexicano (68 nmol/l). Los valores más altos se presentan en individuos de raza blanca no hispánicos (79 nmol/l)32. Los anteriores datos confirman la menor capacidad de los sujetos de piel negra para sintetizar la vitamina D comparada con otros grupos étnicos. Este mecanismo permite explicar las observaciones clásicas sobre la mayor susceptibilidad de estos individuos para desarrollar la HTA, con mayores grados de severidad y complicaciones asociadas.
El Estudio Tromso reporta una asociación entre los niveles séricos de 25-hidroxicolecalciferol y la PA durante 14 años de seguimiento a un grupo de pacientes. Los valores de la PA sistólica son 3,6mmHg mayores en individuos con cifras de 25-hidroxicolecalciferol<16,6ng/ml en comparación con los que presentan valores de 25-hidroxicolecalciferol>25,0ng/ml33.
Con el objetivo de determinar la variación de la PA a partir de los niveles de 25-hidroxicolecalciferol y parathormona, se estudiaron los datos de 7.561 participantes en el NHNES. En la investigación, las concentraciones séricas de 25-hidroxicolecalciferol están inversamente relacionadas de manera significativa con la PA sistólica. En pacientes con valores de 25-hidroxicolecalciferol ≤ 13ng/ml, la diferencia en la PA sistólica y PA diastólica es mayor en 3,5mmHg y 1,8mmHg, respectivamente, cuando se compara con aquellos que tienen valores de 25-hidroxicolecalciferol ≥ 30ng/ml. La propia investigación demuestra que los niveles de parathormona están positivamente relacionados con las cifras de la PA. En este caso, los valores de esta hormona ≥ 59ng/l favorece la elevación de la PA sistólica y la PA diastólica. Luego de estos resultados los autores llegaron a la conclusión que la parathormona puede ser un mediador en las variaciones entre los niveles de 25-hidroxicolecalciferol y la PA34.
Forman et al.35 en un análisis prospectivo estudiaron la relación entre los niveles de 25(OH)-D3 y el riesgo de desarrollar HTA. Incluyeron en la investigación 613 hombres pertenecientes al Health Professionals’ Follow-Up Study y 1.198 mujeres del Nurses’ Health Study, los cuales fueron seguidos durante 4 a 8 años. Los resultados demuestran que los hombres con niveles de 25-hidroxicolecalciferol<15ng/ml tienen un riesgo de desarrollar HTA 6,13 superior a los que presentan valores ≥ 30ng/ml (IC: 1,00 a 37,8). En el caso de las mujeres, la misma comparación revela un riesgo incrementado de desarrollar HTA de 2,67 (IC: 1,05 a 6,79). Además, se encuentra una vulnerabilidad mayor a padecer esta condición en personas que reciben dosis de la vitamina D<1.000 UI/día.
Algunos autores han estudiado el riesgo de mujeres embarazadas a desarrollar preeclampsia cuando presentan niveles bajos de 25-hidroxicolecalciferol. En un trabajo en 2.969 mujeres, los resultados demuestran que el riesgo de presentar esta condición se reduce a la mitad en mujeres que reciben suplementos de la vitamina D de manera regular durante sus primeros años de vida36. Algunos datos refieren que aproximadamente el 29% de las mujeres embarazadas de raza negra tienen cifras de 25-hidroxicolecalciferol<37,5 nmol/l, mientras solo el 5% de las de raza blanca alcanzan esta cifra37. Este dato puede demostrar porque las embarazadas de raza negra tienen un mayor riesgo de desarrollar preeclampsia severa comparada con las de raza blanca38.
Estudios aleatorizadosLa acción de la luz solar sobre la piel representa la principal fuente de la vitamina D en el ser humano. Sobre la base de este conocimiento, un grupo de investigadores se propuso determinar la variación en las cifras de la PA luego de la irradiación con rayos ultravioletas A o B. Para ello estudió a 18 pacientes con HTA leve, sin tratamiento hipotensor y edades comprendidas entre los 26 y los 66 años. Luego de 6 semanas de seguimiento, el grupo que recibió exposición a los rayos ultravioleta B, tuvo un aumento en 162% en las concentraciones séricas de 25-hidroxicolecalciferol en el plasma, con una disminución promedio de la PA sistólica y la PA diastólica de 6 mmHg39.
Esta investigación apoya la idea sobre la necesidad de la exposición diaria a los rayos solares, lo que permite un incremento en la producción endógena de la vitamina D y secundariamente la reducción de la PA. Los diversos grados de exposición a la luz solar en diferentes grupos poblacionales a nivel mundial es un elemento a tener en cuenta dentro de los mecanismos involucrados en la génesis y la evolución de la HTA. Esto daría una explicación a los diferentes grados de prevalencia y severidad de esta condición entre personas de diferentes latitudes y etnias. No obstante, resulta interesante que la disminución de las cifras tensionales en los pacientes del estudio se presenta solo con la irradiación de un grupo específico de rayos ultravioleta, lo que presupone nuevas interrogantes que deben ser investigadas en el futuro.
Las mujeres posmenopáusicas tienen un riesgo incrementado de enfermedades cardiovasculares. La relación entre la vitamina D, los niveles de calcio e HTA en mujeres posmenopáusicas fue estudiada por un grupo de investigadores. Estos desarrollaron un seguimiento durante 8 semanas a 148 mujeres mayores de 70 años de edad y niveles plasmáticos de 25-hidroxicolecalciferol<50ng/ml. Para la investigación fueron divididas en 2 grupos. Uno de ellos recibió solamente suplementos de calcio (1 200mg/día), mientras que el otro recibió suplementos de calcio (igual dosis) más la vitamina D (800 UI/día). Los resultados revelan que el grupo que recibe suplementos de calcio más la vitamina D tiene un incremento de 25-hidroxicolecalciferol en el plasma del 72% (p<0,01) y una disminución en las cifras de la PA sistólica de 9,3% (p=0,02) en comparación con las mujeres que solo reciben el calcio40. Esto demuestra que los trastornos en el metabolismo de la vitamina D en mujeres posmenopáusicas puede ser un elemento adicional a tener en cuenta cuando se presenta un aumento en las cifras de la PA a estas edades. Incluso algunos autores han planteado la necesidad de aumentar moderadamente la exposición a la luz solar, y/o agregar suplementos de la vitamina D en pacientes femeninas mayores de 65 años de edad, con el objetivo de reducir las cifras de la PA41.
Continuando sobre el tema, Goel y Lal realizaron una investigación de corte prospectivo que estudió a 200 pacientes hipertensos con un seguimiento durante 3 meses. La misma tuvo como objetivo observar las modificaciones en las cifras de la PA en los pacientes que recibieron suplementos de la vitamina D a lo largo del estudio. La muestra fue dividida en 2 grupos. El grupo i recibió tratamiento solo con drogas antihipertensivas, mientras que el grupo ii recibió adicionalmente suplementos de la vitamina D (33.000 UI) cada 2 semanas durante los 3 meses. Los resultados demostraron que el grupo i tiene una disminución mayor en la PA sistólica al compararse los valores de esta al inicio de la investigación y luego de finalizada la misma (149,1±0,88 vs. 141,6±0,92 p<0,05)42.
MetaanálisisRecientemente, también se ha encontrado una relación inversa entre la administración de la vitamina D y las cifras de la PA. En un metaanálisis publicado por Pittas et al.43, se demuestra que pacientes con altas dosis de la vitamina D (> 1.000 UI/día) presentan una reducción significativa en la PA diastólica de 1,5mmHg en comparación con los que utilizan dosis<1.000 UI/día (p=0,039). Un estudio de corte similar percibe una reducción significativa en las cifras de la PA diastólica en personas que reciben la vitamina D como suplemento, en relación con los que usan placebo44.
También el déficit de la vitamina D ha sido asociada a otras enfermedades como: la diabetes mellitus, la hiperlipidemia, las miocardiopatías y las enfermedades vasculares periféricas45. Todas estrechamente relacionadas con la evolución y el pronóstico de los pacientes con la HTA.
Preguntas sin responder y perspectivas futurasAún no se ha podido llegar a un consenso definitivo respecto al tema, pues aunque existen evidencias de la relación inversa entre los niveles plasmáticos de la vitamina D y el desarrollo de la HTA, existen estudios que no apoyan esta hipótesis. Hay elementos a tener presente y que pueden influir en estos resultados. Dentro de ellos se halla la gran heterogeneidad de las poblaciones estudiadas, las dosis de la vitamina D administradas, la duración del tratamiento y la adherencia de los pacientes, los métodos para determinar los niveles plasmáticos de la vitamina y la existencia de comorbilidad asociada. Algunas preguntas quedan por responder y constituyen un reto presente. ¿Qué mecanismos fisiopatológicos explican la relación entre las concentraciones de la vitamina D y la actividad del sistema renina-angiotensina-aldosterona? ¿Qué papel exactamente desempeña la vitamina D en la homeostasis del calcio y la disfunción endotelial? ¿Pudieran otras hormonas del cuerpo ser un elemento fundamental en la comprensión de este tema, como recientemente se ha publicado en relación con la parathormona? Se necesitan nuevas investigaciones que permitan aclarar estos y otros aspectos, y llegar a conclusiones definitivas. Son necesarias mayores evidencias para implementar el uso extendido de suplementos de la vitamina D para reducir el riesgo de la HTA. Generalmente, es recomendable la exposición dosificada a la luz solar y el uso de suplementos en pacientes con otras comorbilidades o riesgo incrementado. Ciertamente, algunas sociedades justifican la administración de la vitamina D en determinados grupos con riesgo elevado46. Aunque el uso de esta vitamina puede ser beneficioso, la ingestión excesiva puede desarrollar hipercalcemia y calcinosis renal, complicaciones poco frecuentes, pero de gran gravedad47.
Recientemente, ha sido demostrado que los niveles bajos de la vitamina D pueden afectar a la efectividad del tratamiento antihipertensivo48. Estos resultados fueron demostrados en pacientes que recibieron una terapia de denervación renal para el tratamiento de la HTA resistente. Aunque esta alternativa es relativamente nueva y necesita futuros estudios para validar su efectividad49,50, este estudio permite establecer la hipótesis que bajos niveles séricos de la vitamina D pueden estar relacionados con el fallo en la terapéutica antihipertensiva, pues, como se ha demostrado, los niveles sanguíneos de la vitamina D intervienen en la actividad del sistema renina-angiotensina-aldosterona, el estrés oxidativo, la disfunción endotelial y la síntesis de prostaglandinas. Estos factores están presentes en la fisiopatología de la HTA esencial, y su mayor o menor expresión puede modificar las cifras de la PA. Si las concentraciones de la vitamina D afectan a la efectividad de la terapia antihipertensiva convencional, en el futuro puede ser necesario determinar los niveles plasmáticos de esta vitamina para alcanzar mejores resultados en el tratamiento de nuestros pacientes.
ConclusionesExisten evidencias de una relación inversa entre los niveles plasmáticos de la vitamina D y el desarrollo de HTA. El aumento en la actividad del sistema renina-angiotensina-aldosterona, la disfunción endotelial, las alteraciones en la homeostasis del calcio, un incremento del estrés oxidativo y la disminución en la síntesis de las prostaglandinas parecen ser los principales mecanismos involucrados en el aumento de las cifras de la PA en pacientes con bajas concentraciones séricas de la vitamina D. La administración de suplementos de la vitamina D puede representar una alternativa terapéutica en pacientes hipertensos con bajos niveles de esta vitamina. Finalmente, los niveles de la vitamina D pueden estar relacionados con el fallo en la terapéutica antihipertensiva, y deben continuar los estudios para demostrar el grado de efectividad del tratamiento antihipertensivo en pacientes con déficit de esta vitamina.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNo existen conflictos de intereses.