Con el uso de stents medicados de primera generación, el riesgo de trombosis es de 1,9% a 18 meses, con consecuencias que suelen ser graves y potencialmente fatales. La antiagregación doble, que previene tal efecto, conlleva un riesgo de sangrado que se incrementa según la duración de la misma, por tanto, tratar de alcanzar el equilibrio entre riesgo y beneficio es el objetivo primordial.
ObjetivoPresentar la evidencia actual sobre la duración óptima de la doble antiagregación y brindar pautas para establecer cuál debe ser esta para los pacientes.
La antiagregación doble busca evitar el riesgo de trombosis temprana y reducir los eventos coronarios no relacionados con el inicial, sobretodo en pacientes con alto riesgo de eventos cardiovasculares o trombosis tardía. La terapia de corta duración puede ser una alternativa más segura que el estándar de un año y sin diferencia en eficacia en pacientes de bajo riesgo cardiovascular. La antiagregación de larga duración disminuye la trombosis del stent y los eventos coronarios, pero puede incrementar el riesgo de sangrado clínicamente importante.
ConclusionesHasta hoy la literatura no permite definir un tiempo ideal para la antiagregación dual; este debe definirse para cada caso en particular.
With the use of first-generation drug-eluting stents, the risk of thrombosis is of 1.9% at 18 months, with consequences that are usually severe and are potentially fatal. Dual antiaggregation therapy, that prevents such effects, entails a bleeding risk that is increased according to its duration, therefore, trying to achieve a balance between risk and benefit is the key goal.
ObjectiveTo present current evidence of the optimal duration of dual antiaggregation therapy and to provide guidelines to establish the duration for patients.
Dual antiaggregation therapy seeks to avoid the risk of early thrombosis and to reduce coronary events not related to the initial one, specially in patients with high risk of cardiovascular events or late thrombosis. Short duration therapy can be a safer alternative than the standard of one year and without a difference in patients with low cardiovascular risk. Long duration antiaggregation therapy reduces the risk of stent thrombosis and coronary events, but can increase the risk of a clinically important bleeding.
ConclusionsUntil today literature does not allow to define an ideal time for dual antiaggregation therapy; this must be defined according to each particular case.
El intervencionismo percutáneo en el tratamiento de la enfermedad coronaria ha evolucionado significativamente en los últimos 40 años; desde las angioplastias con balón hasta el uso de los stents, inicialmente no medicados (convencionales o desnudos) y posteriormente medicados, con diferentes agentes antiproliferativos que permiten disminuir las tasas de restenosis y necesidad de nuevas revascularizaciones. A pesar de esta ventaja, el uso de stents medicados retarda la endotelialización, con un consecuente riesgo de trombosis tardía, lo cual llevó a la recomendación de alargar el tiempo de doble antiagregación con ASA e inhibidores de P2Y12 por 12 meses. Sin embargo, la balanza entre el riesgo de sangrado y el riesgo trombótico para cada paciente, no está muy clara. La evidencia más reciente se enfoca en una terapia individualizada, por encima de la recomendación usual de un año para todos. En tal sentido son muchas las variables que influyen en la elección de la duración de la terapia; interrogantes tales como la duración de la antiagregación dual si el paciente requiere anticoagulación son frecuentes.
Esta revisión se propone presentar la evidencia actual sobre la duración óptima de la doble antiagregación y brindar pautas para establecer cuál debe ser esta en los pacientes.
¿Por qué es importante?La enfermedad coronaria es la principal causa de mortalidad en el mundo y tiene un amplio espectro de manifestaciones. En Estados Unidos se implantan anualmente alrededor de 500.000 stents y aunque el riesgo de trombosis es relativamente raro, 1,9% a 18 meses usando stents de primera generación (Cypher con sirolimus y Taxus con placlitaxel)1, las consecuencias de esta suelen ser graves y potencialmente fatales. Por otra parte, la doble antiagregación conlleva un riesgo de sangrado que se incrementa según la duración de la misma; de ahí que tratar de alcanzar el equilibrio entre riesgo y beneficio es el objetivo primordial.
Relevancia de los stentsLos primeros stents no medicados se asociaron con incremento de proliferación intimal, fenómeno que acarreó un riesgo de restenosis de 10 a 20% anual y global entre 11 y 40%2. Como solución, aparecieron los stents medicados, que lograron disminuir las tasas de restenosis entre 50 a 70%, pero a merced de un enlentecimiento en la reendotelialización, hecho que incrementó el riesgo de trombosis tardía del stent2, incluso con datos iniciales que sugerían incremento en la mortalidad comparado con stents no medicados, efecto que se hacía evidente a partir del sexto mes de implantación3 con stents de primera generación sirolimus y paclitaxel y originó las recomendaciones de antiagregación dual por al menos 12 meses4. La evolución hacia stents de everolimus y zotarolimus, mostró menor riesgo de trombosis tardía del stent, infarto y revascularización repetida, lo cual planteó el interrogante de reevaluar la duración adecuada de la doble antiagregación, pues con estos5 una antiagregación dual prolongada podría no ser esencial y repercutir en un riesgo de sangrado innecesario.
Un estudio realizado en 2007 con stents medicados de primera generación y seguimiento hasta 540 días en 3.020 pacientes, encontró una tasa de trombosis del stent del 1,9%; el 50% de los casos ocurrió en los primeros 30 días postimplante del stent. Así mismo, se determinó que la suspensión de la tienopiridina fue el factor predictor de trombosis más importante, al menos en los primeros 180 días1.
Objetivos de la antiagregación dobleA corto plazo se busca evitar el riesgo de trombosis temprana, debido principalmente a la falta de endotelialización del stent y a largo plazo la función de esta estrategia es reducir los eventos coronarios no relacionados con el inicial, principalmente en pacientes con alto riesgo de eventos cardiovasculares o trombosis tardía6. Con el estudio DAPT7 se abre el interrogante sobre si existe un tercer momento, como efecto rebote del riesgo al suspender el medicamento.
¿Cuál es el equilibrio?Son varios los elementos que alteran el equilibrio de la balanza de la antiagregación dual, de modo que puede incrementar el riesgo de sangrado o el de trombosis, o incluso ambos, haciendo que la decisión sobre un tiempo específico de terapia doble, deba individualizarse6.
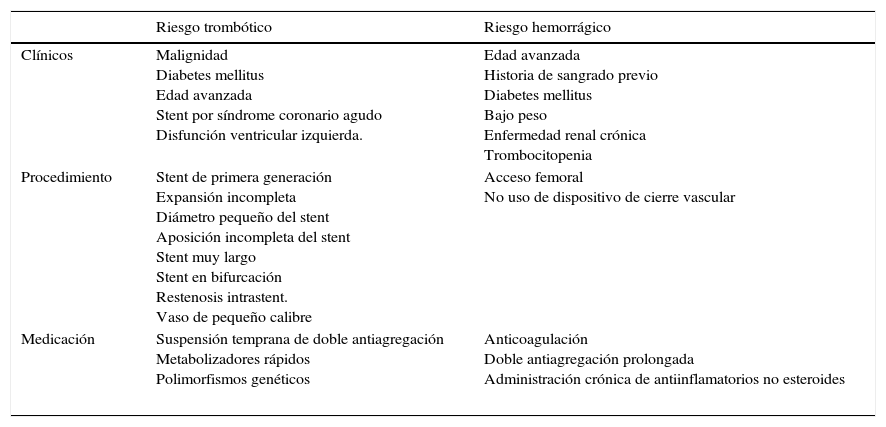
De otro lado, es fundamental conocer la descripción de la intervención en hemodinamia, las características clínicas del paciente y la farmacología del medicamento a usar8 (tabla 1).
Factores de riesgo para trombosis y sangrado
| Riesgo trombótico | Riesgo hemorrágico | |
|---|---|---|
| Clínicos | Malignidad Diabetes mellitus Edad avanzada Stent por síndrome coronario agudo Disfunción ventricular izquierda. | Edad avanzada Historia de sangrado previo Diabetes mellitus Bajo peso Enfermedad renal crónica Trombocitopenia |
| Procedimiento | Stent de primera generación Expansión incompleta Diámetro pequeño del stent Aposición incompleta del stent Stent muy largo Stent en bifurcación Restenosis intrastent. Vaso de pequeño calibre | Acceso femoral No uso de dispositivo de cierre vascular |
| Medicación | Suspensión temprana de doble antiagregación Metabolizadores rápidos Polimorfismos genéticos | Anticoagulación Doble antiagregación prolongada Administración crónica de antiinflamatorios no esteroides |
Las diferentes guías de práctica clínica, tanto de la Asociación Americana del Corazón (AHA, su sigla en inglés por American Heart Association) como de la Sociedad Europea de Cardiología9–11, emiten recomendaciones sobre la duración aproximada de la doble antiagregación según cada indicación, puesto que ambos riesgos son modificados en función de la razón que llevó a la implantación del stent. En resumen, recomiendan suministrar doble terapia al menos por un mes luego de implantar un stent no medicado en enfermedad coronaria estable10, al menos 6 meses luego de stents medicado en enfermedad coronaria estable y hasta por un año luego de un síndrome coronario agudo independiente de la estrategia de revascularización11.
También hacen recomendaciones sobre terapias acortadas menores a 6 meses en enfermedad coronaria estable, para pacientes con alto riesgo de sangrado, hecho que debe evaluarse en forma individual.
¿Cuál es la duración ideal?Varios ensayos clínicos han buscado definir la duración ideal de la terapia, unos enfocados a terapias más cortas, otros hacia extender la terapia más allá de los 12 meses. Se dividirán estos trabajos entre corta duración (terapia por 6 meses o menos) y antiagregación extendida (más de 12 meses).
Antiagregación de corta duraciónHay cuatro estudios importantes que compararon estrategias de corta duración: los estudios OPTIMIZE12 y RESET13 (ambos demostraron no inferioridad de 3 meses de duración en comparación con un año de doble antiagregación para el desenlace de muerte, eventos cardiovasculares o sangrado mayor), y PRODIGY14 y EXCELLENT15 (con protocolos de 6 meses de duración). El primero no logró demostrar superioridad de 6 meses versus 24 para prevenir muerte, infarto de miocardio o eventos cerebrovasculares, mientras que el segundo demostró no inferioridad de 6 vs. 12 meses para desarrollo de muerte de origen cardiaco, infarto o revascularización del vaso previamente intervenido. Cabe aclarar que la mayoría de los pacientes de estos estudios pertenecían a categorías de bajo riesgo, pues en buena proporción tenían enfermedad coronaria estable y recibieron stents medicados de segunda generación, a excepción del estudio PRODIGY14 que incluyó stents de primera generación y algunos no medicados.
En 2015 Palmerini et al. publicaron un metaanálisis16, en el que se incluyeron estos cuatro estudios con datos de 8.180 pacientes que recibieron ASA más clopidogrel, a fin de evaluar la eficacia y seguridad de la terapia de doble antiagregación de corta duración. Se excluyeron del análisis los stents no medicados del estudio PRODIGY, además reportaron aproximadamente 80% de uso de stents de segunda generación en la población evaluada. En los resultados para el desenlace primario de cualquier evento cardiovascular mayor, luego de un año de seguimiento, hallaron un HR: 1,11; IC 0,86–1,43; p=0,44 y como desenlace de seguridad cualquier sangrado a un año HR: 0,66; IC 0,46–0,94); p=0,03, el cual perdió significancia estadística cuando solo se tuvieron en cuenta los sangrados mayores (HR: 0,58; 0,32 a 1,03; p=0,06).
Concluyeron que la terapia de corta duración puede ser una alternativa más segura que el estándar de un año y sin diferencia en cuanto eficacia; sin embargo, este trabajo fue realizado en su mayoría con pacientes de bajo riesgo cardiovascular, solo con clopidogrel como segundo medicamento y con stents de segunda generación, por lo cual se debe seleccionar bien el paciente antes de extrapolar estos resultados. Tal vez un paciente con alto riesgo de sangrado, bajo riesgo cardiovascular y stents de segunda o tercera generación sería el candidato para esta estrategia.
Antiagregación dual extendidaPor otro lado, hay un grupo de pacientes que podría beneficiarse de extender la antiagregación dual más allá del tiempo estándar de un año. El trabajo más importante en este campo es el estudio DAPT7, que comparó 9.961 pacientes mayores de 18 años postintervención percutánea con stents medicados, de los cuales 5.020 continuaron antiagregación dual hasta completar 30 meses y 4.941 recibieron tratamiento estándar por 12 meses. El desenlace primario fue la incidencia de trombosis o evento vascular mayor y el desenlace de seguridad fue presentar sangrado moderado o grave.
De la población evaluada, un 65% recibió clopidogrel y un 35% prasugrel; además, aproximadamente 37% de pacientes tenían stents de primera generación en cada grupo. Al comparar la estrategia de 30 vs. 12 meses, se encontró diferencia significativa en cuanto a trombosis del stent 0,4% vs. 1,4% (HR 0,29 p<0,001) y para el desarrollo de cualquier evento cardiovascular mayor de 4,3% vs. 5,9% respectivamente (HR 0,7 p<0,001), lo cual indica que la trombosis del stent y los eventos vasculares son menores en la terapia extendida. Adicionalmente, al hacer un segundo análisis a tres meses de suspender la antiagregación dual, encontraron un incremento tanto en la incidencia de trombosis como de eventos cardiovasculares, lo que sugiere un efecto de rebote en el riesgo. Sin embargo, hubo un dato llamativo fue el mayor número estadísticamente significativo de muertes no cardiovasculares, 1% vs. 0,5%, pero sin diferencia en muerte cardiovascular en el grupo de terapia por 30 meses, atribuido a cáncer y trauma, sin tener clara la causa de este hallazgo.
En cuanto a la tasa de infarto agudo de miocardio, fue menor en el grupo que recibió terapia dual por 30 meses, 2,1% vs. 4,1% (HR 0,47; IC 0,37–0,61) y el riesgo de sangrado fue mayor en el grupo que recibió terapia por más tiempo, pero sin diferencia en sangrado grave (riesgo de muerte) entre ambos grupos; por tanto se propone en la discusión evaluar detenidamente el riesgo beneficio para cada paciente y tener en cuenta el tipo de stent implantado.
A partir de la preocupación por el efecto en la mortalidad global que demostró el estudio DAPT7, surgió un metaanálisis publicado en 201517 que pretendía evaluar la relación de la doble antiagregación con mortalidad. Se evaluaron 14 estudios con 696.44 pacientes que tenían diferentes indicaciones para doble antiagregación, buscando alcanzar poder estadístico para definir mortalidad cardiovascular y no cardiovascular por todas las causas. No se detectó asociación alguna con incremento de la mortalidad global (HR 1·04; IC 0,96–1,18) y tampoco al dividirla en cardiovascular (HR 1,01; IC 0,93–1,12) y no cardiovascular (HR 1,04; IC 0,90–1,26). Estos resultados no se modificaron al excluir estudios sin enfermedad coronaria.
Sin embargo, la duda sobre si la antiagregación dual de larga duración era más eficaz para prevenir el desarrollo de eventos cardiovasculares con buen margen de seguridad, persistía y al tratar de responder este interrogante se desarrollaron un par de metaanálisis que evaluaron estos desenlaces.
Giustino et al.18 publicaron un trabajo que tuvo en cuenta diez ensayos clínicos con 30.000 pacientes sometidos a diferentes duraciones de terapia doble y con potencia estadística para definir desenlaces cardiovasculares mayores; dentro de su protocolo incluyeron siete estudios con duración de antiagregación menor a 6 meses y tres estudios de 12 o más meses, entre ellos el DAPT. La terapia de corta duración se asoció con más trombosis del stent, 0,9% vs. 0,5% (OR: 1,71; IC 1,26–2,32), pero con menor aparición de sangrado, 1,2% vs. 1,9% (OR 0,63 IC, 0,52–0,75) y menor mortalidad por todas las causas influenciada por los resultados del DAPT; se encontró, así mismo, menor desarrollo de infarto en la estrategia de larga duración. A partir de este estudio se concluye que la antiagregación a largo plazo disminuye la trombosis del stent y el infarto, pero incrementa el riesgo de sangrado importante, en relación de 2.1 sangrados por cada trombosis del stent prevenida.
En uno de los segmentos de la publicación, incluyeron un análisis interesante en relación con el riesgo según el tipo de stent usado, y hallaron riesgo para trombosis con stents de segunda generación no estadísticamente significativo (OR: 1,54 IC 0,96–2,47), pero para el de primera generación un factor de riesgo claro (OR: 3,94 IC 2,20 - 7,05), con lo que concluyen que tener un stent de segunda generación atenúa el beneficio de la doble antiagregación a largo plazo.
El segundo meta análisis de este tipo también fue publicado por Palmerini et al. en 201519, y plantea un metaanálisis en red, en el que se incluyeron 10 estudios con 31.166 pacientes a fin de evaluar mortalidad por todas las causas como desenlace primario y muerte cardiaca y no cardiaca, infarto agudo miocárdico, evento cerebrovascular, sangrado y trombosis del stent como secundarios. Sus resultados se presentan relacionando tres comparaciones de tiempo, menos de 6 meses vs. un año, menos de 6 meses vs. más de un año y un año vs. más de un año.
El riesgo de sangrado fue significativamente más alto en las comparaciones de mayor duración de tiempo; no encontraron diferencia en mortalidad por todas las causas en ninguno de los subgrupos, aunque sí un incremento en la mortalidad no cardiaca para la terapia a largo plazo en el subgrupo de un año vs. más de un año, influenciada por el estudio DAPT7. En cuanto al riesgo de desarrollar infarto de miocardio, fue significativamente menor en la terapia a largo plazo tanto en los grupos de menos de 6 meses vs. mayor de un año (HR 1,7 IC, 1,3–2,4) como en el de un año vs. más de un año (HR 1,7 IC 1,4–2,1); así mismo para el riesgo de trombosis del stent fue menor en los de largo plazo (HR 2,7 IC 1,5–5,0) para menos de 6 meses vs. más de un año (HR de 2,5 IC 1,7–4,0) en el subgrupo de un año vs. más de un año.
Aún es más reciente la experiencia del estudio OPTI-DUAL20, que buscaba evaluar terapia dual extendida hasta 48 meses vs. suspensión a los 12 meses y continuar con monoterapia de ASA, buscando como desenlace primario mortalidad por toda causa, infarto no fatal, eventos cerebro-vasculares o sangrado. No encontraron diferencia en el desenlace primario compuesto 5,8% vs. 7,5% (HR 0,75 IC 0,50–1,28) y tampoco en los desenlaces individuales, ni hubo diferencia significativa en sangrado de ningún tipo, independiente de su gravedad. Cabe anotar que se trata de un estudio con algunas dificultades que afectan su validez, pues se detuvo debido al lento reclutamiento y a la escasez de recursos, así que no alcanzaron la muestra propuesta al inicio del mismo.
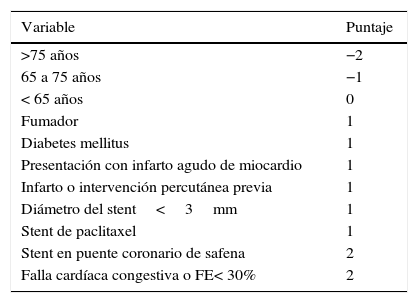
Score de predicción de riesgoComo herramienta para determinar un índice de riesgo beneficio aceptable para usar terapia de doble antiagregación de larga duración, recientemente fue publicada la experiencia con una escala clínica21 que va desde -2 hasta 10 y evalúa edad, características del stent, tabaquismo y variables clínicas como diabetes mellitus, falla cardiaca, fracción de eyección menor al 30% y haber sufrido infarto agudo de miocardio o intervención percutánea previa (tabla 2).
Puntaje DAPT
| Variable | Puntaje |
|---|---|
| >75 años | −2 |
| 65 a 75 años | −1 |
| < 65 años | 0 |
| Fumador | 1 |
| Diabetes mellitus | 1 |
| Presentación con infarto agudo de miocardio | 1 |
| Infarto o intervención percutánea previa | 1 |
| Diámetro del stent<3mm | 1 |
| Stent de paclitaxel | 1 |
| Stent en puente coronario de safena | 2 |
| Falla cardíaca congestiva o FE< 30% | 2 |
Esta escala clasifica los pacientes en dos grupos, uno de bajo riesgo con puntaje menor a 2 y uno de alto riesgo mayor o igual a 2. En el grupo de alto riesgo, continuar la tienopiridina más allá de 12 meses se asoció con una reducción absoluta del riesgo de infarto agudo de miocardio o trombosis del stent, lo cual fue 8,2 veces mayor que el riesgo de desarrollar sangrado moderado o grave. Por otra parte, los pacientes con un puntaje menor a 2 que continuaron la tienopiridina por más de 12 meses, tuvieron un incremento del riesgo de sangrado 2,4 veces mayor que la reducción absoluta del riesgo de infarto o trombosis del stent.
Esta escala de riesgo21 se presenta como una alternativa para definir quiénes se benefician más de continuar con doble antiagregación por más de un año, sin exceder el riesgo de sangrado. Es preciso tener en cuenta sus limitaciones, pues no incluye pacientes con anticoagulación concomitante o con stents no medicados y se basa en los pacientes del estudio DAPT con sus respectivos criterios de inclusión y exclusión. Aún requiere de otros estudios de validación además de evaluación prospectiva.
Hacia una terapia individualizadaDebido a la heterogeneidad de condiciones de los pacientes, puede parecer reduccionista tratar de definir un estándar de tiempo para la doble antiagregación; incluso los diversos estudios que abordan este tema, concluyen que el paciente debe ser evaluado en forma individual y definir el tiempo ideal para recibir los medicamentos según tenga riesgo mayor o menor, tanto de isquemia como de sangrado.
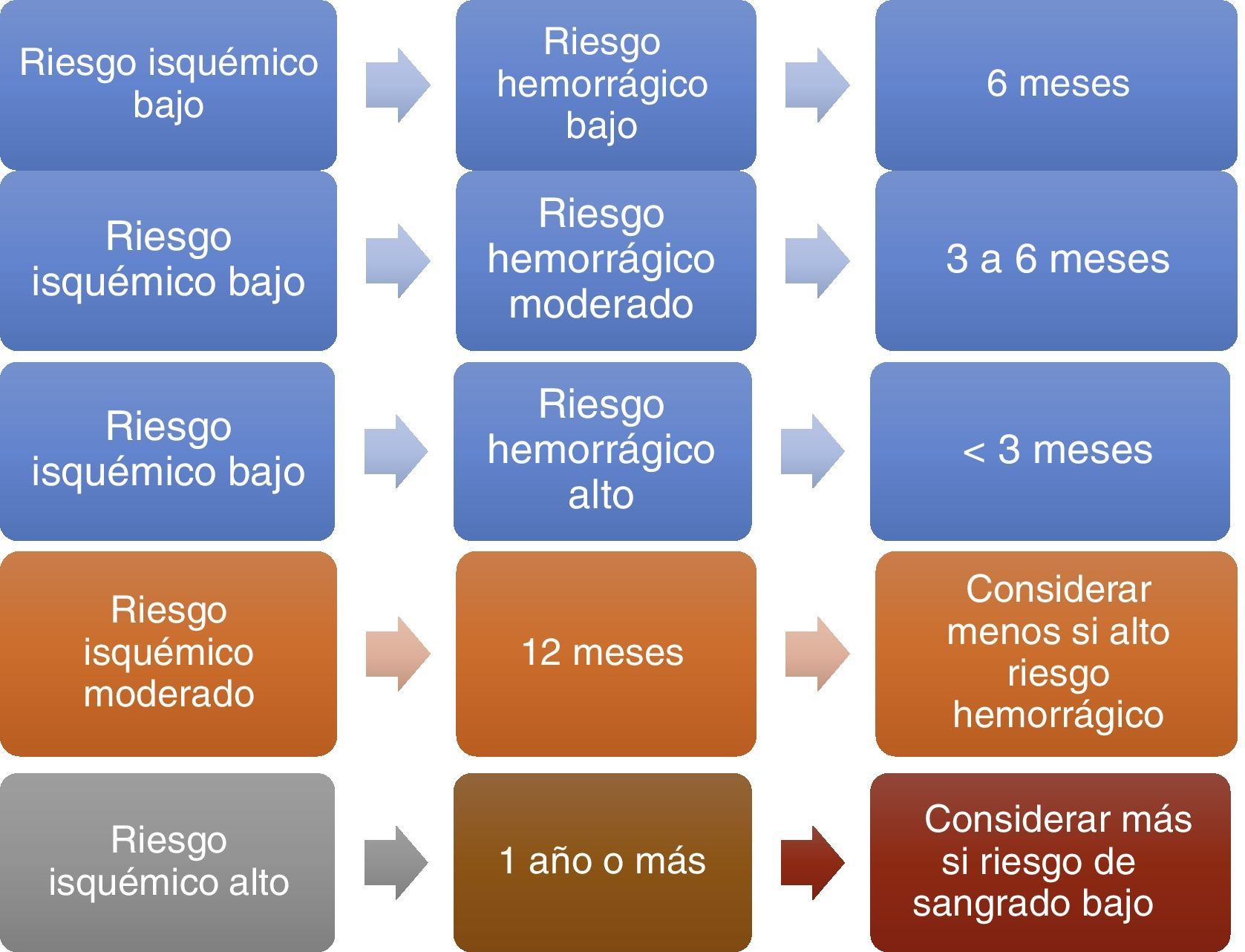
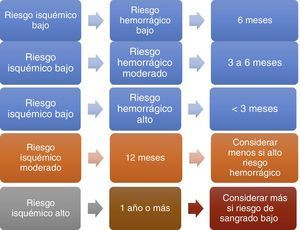
Dos excelentes revisiones de tema5,6 se aproximan a este concepto al definir correlaciones entre la duración estimada y el riesgo individualizado (fig. 1).
Recomendaciones de la guía nuevaLa guía nueva de la AHA y el Colegio Americano de Cardiología sobre antiagregación plaquetaria en pacientes con enfermedad coronaria8 hacen las siguientes recomendaciones:
Enfermedad coronaria estable- -
Luego de implantar un stent metálico se debe dar doble antiagregación con un inhibidor de P2Y12 (clopidogrel) al menos por un mes (IA).
- -
Luego de implantación de stents medicados se debe dar antiagregación dual con inhibidor de P2Y12 (clopidogrel) por al menos 6 meses (IB-R).
- -
En pacientes en doble antiagregación luego de implantación de stent que hayan tolerado esta sin complicaciones hemorrágicas y no tengan riesgo alto de sangrado, puede ser razonable extender la terapia más allá de 1 mes para metálico y de 6 meses para medicado (IIb A).
- -
En pacientes con stent medicado que hayan presentado sangrado o estén en riesgo elevado de sangrado, puede ser razonable suspender la terapia con inhibidor de P2Y12 luego de 3 meses (IIbC).
- -
Los pacientes tratados con doble antiagregación después de la implantación de un stent, deben recibir inhibidor de P2Y12 por al menos 12 meses (IB).
- -
En pacientes con doble antiagregación luego de implantación de stent que hayan tolerado esta sin complicaciones hemorrágicas y no tengan riesgo alto de sangrado, puede ser razonable extender la terapia más allá de 12 meses (IIbA).
- -
En pacientes con stents medicados que hayan presentado sangrado o se encuentren en riesgo elevado de sangrado, puede ser razonable suspender la terapia con inhibidor de P2Y12 luego de 6 meses (IIbC).
No es infrecuente que coincidan en un paciente la indicación de doble antiagregación por implantación de un stent y alguna condición por la que deba estar anticoagulado; pero ¿qué hacer con estos pacientes? Someterles a una “triple terapia” (anticoagulante más doble antiagregación) tiene riesgos inherentes, y es por ello que algunos trabajos han tratado de dar respuesta a este interrogante.
El estudio WOEST22 plantea cuál debe ser la terapia antiplaquetaria óptima en pacientes con anticoagulación e intervención percutánea. Para ello incluyó 573 pacientes con necesidad de anticoagulación mayor a un año y llevados a intervencionismo percutáneo, quienes fueron aleatorizados en dos grupos (clopidogrel más cumarínico y ASA más clopidogrel más cumarínico); como desenlace primario se determinó cualquier episodio de sangrado durante el año de seguimiento y como secundario un compuesto de infarto agudo de miocardio, evento cerebrovascular, revascularización o trombosis del stent. A un año del seguimiento, hallaron una tasa de sangrado mayor en el grupo de terapia triple 44,4% vs. 19,4%, pero sin diferencia en sangrados graves o que amenazaran la vida; sin embargo, sí hubo mayor necesidad de soporte transfusional en el grupo de terapia triple. El desenlace compuesto fue menor en el grupo de terapia doble, pero al analizar de forma individual infarto de miocardio, eventos cerebro-vasculares y trombosis del stent no se encontraron diferencias entre los grupos; si bien el estudio no fue diseñado para mostrar disminución de la incidencia de trombosis, se puede deducir que la terapia doble (clopidogrel más cumarínico) se asocia con menos episodios de sangrado, sin diferencia en trombosis, de manera que podría usarse como una estrategia segura en casos seleccionados.
Los investigadores del estudio ISAR-TRIPLE23 quisieron ir un poco más allá, evaluando no solo el riesgo de sangrado, sino un compuesto de muerte, infarto agudo de miocardio, trombosis, evento cerebrovascular y sangrado mayor en 614 pacientes que recibían anticoagulación más ASA luego de la implantación de stent. Estos fueron separados en dos posibles intervenciones; el primer grupo recibió clopidogrel por seis semanas y el segundo clopidogrel hasta seis meses. La indicación más común de anticoagulación fue fibrilación auricular con 85% y se resalta que 38% de los pacientes tenían stents con everolimus.
En este trabajo la administración de clopidogrel durante seis semanas, no fue superior a seis meses para el desenlace combinado (HR 1,14 IC 0,68–1,91) ni para eventos cardiovasculares mayores (HR 0,93 IC 0,43 - 2,05) o sangrado grave (HR 1,35 IC 0,64–2,84), aunque aparentemente existe una tendencia a incrementar el sangrado con la terapia de clopidogrel por seis meses, así que el clínico debe sopesar el riesgo isquémico y de sangrado del paciente, para escoger una u otra estrategia.
También se publicó un metaanálisis24, en el que se recopiló la información de 23 ensayos con 22.200 pacientes, con el objetivo de evaluar la terapia triple vs. anticoagulante y antiagregante; este trabajo constó de dos partes: un análisis global que incluía estudios retrospectivos y un análisis por subgrupos donde se excluyen estos. Concluyeron que no hay diferencia entre triple terapia y anticoagulante más antiagregante en cuanto al riesgo de eventos cerebrovasculares (RR 0,95 IC 0,79-1,14), mortalidad por toda causa (RR 0,84 IC 0,63–1,12 y RR 1,13 IC 0,78-1,6) en ambos análisis y en eventos cardiovasculares mayores (RR 1,06 IC 0,88–1,27); además confirmaron la hipótesis de que la terapia triple incrementa significativamente el riesgo de sangrado mayor, de ahí que se hace necesario vigilar estrictamente el INR y mantenerlo en rango de seguridad. Así mismo, recomiendan el uso de clopidogrel, pues se asoció con menos eventos de sangrado que otros inhibidores de la P2Y12; en conclusión la triple terapia no debe ser el estándar de elección dados sus riesgos ya conocidos.
¿Cómo tratar al paciente con indicación de terapia triple?La guía europea de síndrome coronario sin elevación del ST de 201511, presenta dentro de sus recomendaciones un abordaje para el paciente con fibrilación auricular postsíndrome coronario: si el paciente está en manejo médico o revascularización quirúrgica debe recibir terapia doble con anticoagulante más antiagregante, no tiene indicación de triple terapia. Por el contrario, si el paciente es llevado a intervención percutánea, se debe establecer el riesgo de sangrado con HAS-BLED; si el paciente es de bajo riesgo (0-2) debe recibir triple terapia hasta el sexto mes y a partir de allí continuar con terapia dual, idealmente con clopidogrel; si el paciente tiene riesgo de sangrado alto (HAS-BLED mayor o igual a 3) debe recibir la triple terapia al menos por 4 semanas y a partir de allí un antiagregante más anticoagulación. Se debe evitar el uso de prasugrel o ticagrelor pues no hay datos que los avalen en este escenario. Usar dosis bajas de ASA y profilaxis con inhibidores de la bomba de protones. En caso de uso de cumarínicos el INR debe estar entre 2 a 2,5 y si se trata de un nuevo anticoagulante oral, dar a la dosis mínima eficaz. Algunas de estas recomendaciones son retomadas por la guía para la duración de la doble antigregación en enfermedad coronaria, recientemente publicada por la AHA8.
ConclusionesAunque las guías recientes brindan pautas por las cuales regirse, hasta hoy la literatura no permite definir un tiempo ideal para la antiagregación dual; por tanto, este debe definirse para cada caso en particular. Por este motivo es fundamental que el médico conozca el tipo de stent usado y la indicación por la que se implantó, además de tener claridad sobre los medicamentos que utilizará.
De igual forma, es indispensable conocer los factores predictores de trombosis y sangrado, pues esto permite acercarse al punto de equilibrio de la balanza del riesgo/beneficio, esto es, qué tanto se justifica una intervención sin agregar riesgo de sangrado; se resalta, además, que aunque la trombosis del stent es relativamente rara, sus complicaciones son graves y potencialmente mortales y en un entorno en el que se tiene una cantidad importante de pacientes con enfermedad coronaria tratada con stents y la necesidad de doble antiagregación amerita saber de este tema.
Quedan muchos interrogantes aún y puntos de controversia como el paciente con necesidad de anticoagulación y el uso de otros antiagregantes diferentes a clopidogrel, de manera que este continuará siendo un tema de interés.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.