La aterosclerosis se considera como la principal causante de enfermedades cardiovasculares. Es una enfermedad multifactorial, caracterizada por procesos inflamatorios y la internalización continua de moléculas lipídicas al interior del vaso. Los estudios de genes candidato han proporcionado conocimiento acerca de la fisiopatología de esta enfermedad y han permitido la postulación de algunos polimorfismos como responsables de la susceptibilidad genética en diversas poblaciones. En particular, estos polimorfismos que modulan ciertas vías moleculares tales como el estrés oxidativo, el metabolismo lipídico y la trombogénesis se asocian con el desarrollo de las enfermedades cardiovasculares. Se han conducido varios estudios para identificar nuevas variantes asociadas con la enfermedad que han permitido el descubrimiento de nuevas vías de la enfermedad. Aunque el hallazgo de nuevos genes asociados a la enfermedad cardiovascular a través de enfoques como el escaneo global del genoma ha contribuido al entendimiento del desarrollo de esta condición, el conocimiento aún es limitado y poco concluyente. El objetivo de esta revisión es identificar los genes y las variantes polimórficas asociadas a la enfermedad cardiovascular, de acuerdo con los diferentes enfoques de análisis de asociación genética.
Atherosclerosis is considered the main cause of cardiovascular diseases. This is a multifactorial disease, characterized by inflammatory processes and the continuous internalization of lipid molecules into the blood vessel. Candidate gene studies have provided knowledge on the pathophysiology of this disease and have allowed postulating some polymorphisms as responsible for the genetic susceptibility in several populations. In particular, these polymorphisms that modulate certain molecular pathways such as oxidative stress, lipid metabolism and thrombogenesis are associated to the development of cardiovascular diseases. Several studies have been used to identify new variants associated with the disease enabling the discovery of new disease pathways. Although the discovery of novel genes associated with cardiovascular disease through approaches such as global scan of the genome has contributed to understanding the development of this disease, knowledge is still limited and inconclusive. The aim of this review is to identify genes and polymorphic variants associated with cardiovascular disease, according to the different approaches of genetic association analysis.
Las enfermedades cardiovasculares constituyen la principal causa de muerte y discapacidad a largo plazo1. Según la Organización Mundial de la Salud, en 2008 se registraron cerca de 17,3 millones de muertes por enfermedades cardiovasculares, de las cuales la enfermedad arterial coronaria fue responsable de 7,3 millones de muertes y el accidente cerebrovascular de 6,2 millones2. En Colombia, las enfermedades cardiovasculares son la principal causa de muerte no violenta; fueron, así mismo, causantes del 28% del total de muertes en 2008, con una tasa de mortalidad de 205,9/100.000 habitantes y 166,7/100.000 habitantes hombres y mujeres, respectivamente3.
La aterosclerosis, principal fuente de las enfermedades cardiovasculares, es una enfermedad sistémica y multifocal, que se origina a partir de la pérdida gradual de la función endotelial con lo cual se disparan mecanismos proinflamatorios y protrombóticos en la pared arterial. Estas alteraciones median la oxidación e internalización de partículas lipídicas, monocitos y linfocitos. El depósito celular continuo favorece la formación de la placa aterosclerótica, la cual estrecha la luz vascular, reduce el flujo sanguíneo y disminuye el suplemento de oxígeno a órganos blanco4. Los órganos afectados generalmente son el corazón, con el desarrollo de enfermedad arterial coronaria, el cerebro, con la presentación de accidente cerebrovascular, y los miembros inferiores, con la manifestación de enfermedad arterial periférica.
Estudios epidemiológicos han establecido como principales factores de riesgo para enfermedades cardiovasculares el tabaquismo, la diabetes mellitus, la dislipidemia, la hiperhomocisteinemia y la hipertensión arterial5. Sin embargo, estos factores de riesgo no explican la totalidad del riesgo atribuible, y por ende, son insuficientes para explicar el origen de estas. Es así como el uso de métodos de análisis genético como el escaneo global del genoma, los análisis de asociación genética y los estudios de ligamiento genético han contribuido a la identificación de polimorfismos de un solo nucleótido (SNPs) asociados con el riesgo de enfermedades cardiovasculares. A su vez, estos enfoques han permitido determinar nuevas posibles rutas patológicas de la enfermedad, contribuyendo a identificar poblaciones susceptibles al riesgo6. Por tanto, el objetivo de este artículo es revisar las investigaciones recientes en el tema, a fin de aportar al mejor entendimiento de los factores genéticos que modulan los mecanismos fisiopatológicos responsables del desarrollo de las enfermedades cardiovasculares.
Enfoques para el descubrimiento de genes asociados a enfermedades cardiovascularesLa asociación entre polimorfismos genéticos y las enfermedades cardiovasculares es compleja y sus interacciones con otros factores de riesgo influencian la aparición de las mismas7. Las variantes que contribuyen al riesgo de la enfermedad se han identificado a través de tres enfoques: el análisis de ligamiento en estudios familiares, los análisis de asociación genética y los estudios de asociación genómica (GWAS)8. Para las formas mendelianas de enfermedades cardiovasculares, los estudios familiares han sido exitosos en la identificación de la mutación y el gen causal asociado. Por su parte, los estudios de asociación genética han permitido la identificación de genes candidato asociados a susceptibilidad para enfermedades cardiovasculares en ciertas poblaciones9. Finalmente, los GWAS han cobrado recientemente una importancia significativa en la investigación de la genética de dichas enfermedades ya que estudian cientos de SNPs posibilitando la identificación de nuevas rutas genéticas asociadas a la enfermedad8.
Estudios de ligamiento de base familiarLas enfermedades con origen en una mutación simple usualmente se identifican mediante la conducción de estudios de ligamiento genético en familias con miembros afectados por varias generaciones. Estudios de agregación genética han demostrado que las enfermedades cardiovasculares presentan un importante componente de tipo familiar, evidenciado por la presentación de la enfermedad en pacientes jóvenes con historia familiar, considerándose hoy en día como un factor de riesgo independiente para la enfermedad10. Igualmente, estos estudios han identificado otros rasgos genéticos, como la hipercolesterolemia familiar, asociados a la etiología de las enfermedades cardiovasculares11.
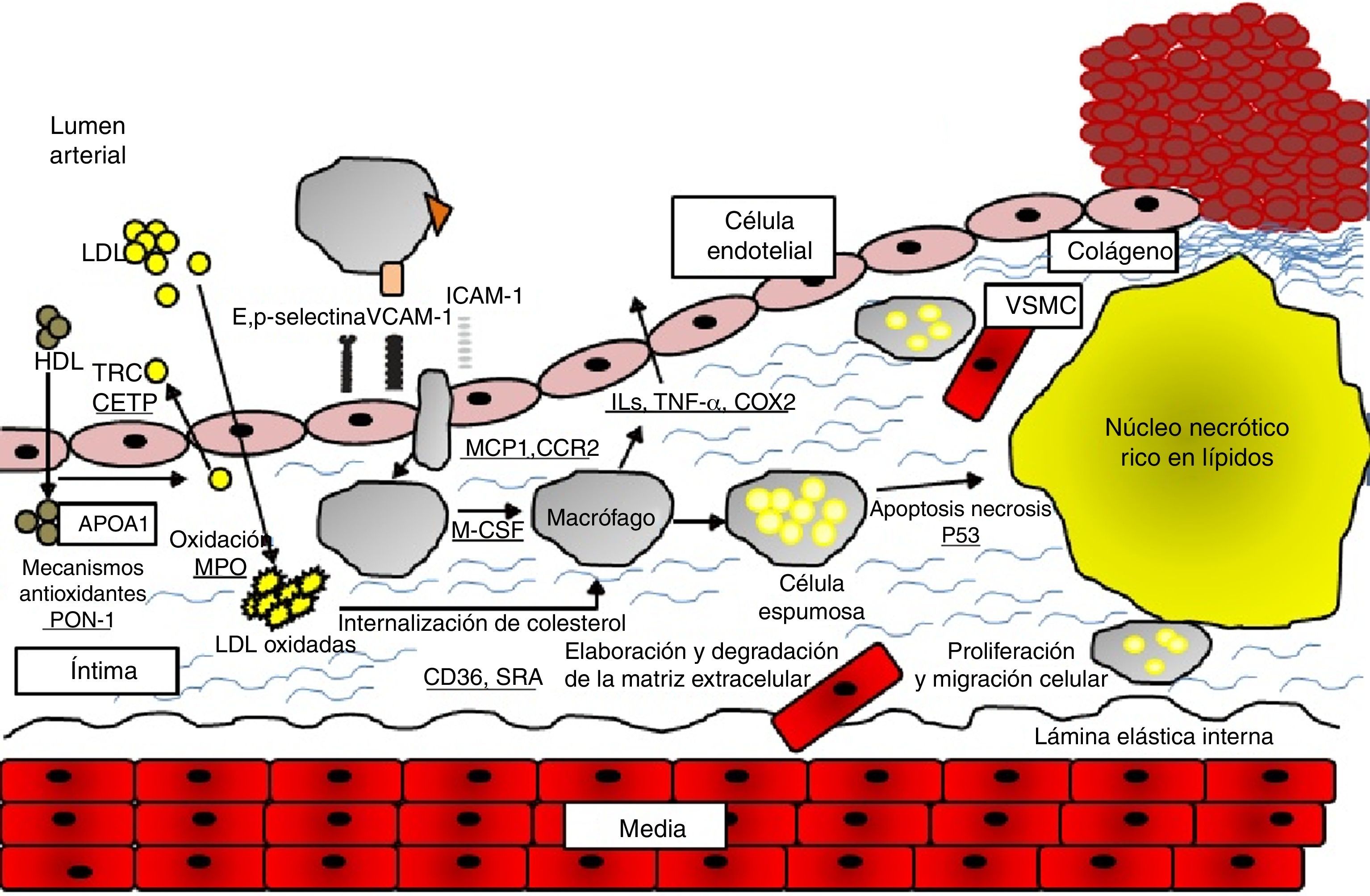
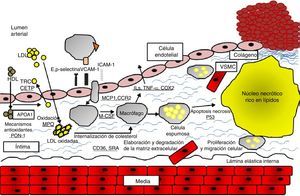
Estudios de asociación genéticaLa conducción de estudios de asociación genética requiere de un conocimiento a priori del papel crucial que cumple una SNP en una vía fisiopatológica de la enfermedad. Así, el uso de análisis moleculares de alto rendimiento en el estudio de genes candidato, ha permitido identificar algunos loci que se asocian con el inicio y desarrollo de la enfermedad arterial coronaria12. Las principales vías moleculares involucradas en la fisiopatología de las enfermedades cardiovasculares son: el estrés oxidativo, el metabolismo lipídico, el transporte lipídico, la inflamación y la coagulación13 (fig. 1).
Mecanismos moleculares involucrados en la aterosclerosis. La disfunción del endotelio arterial, la producción de especies reactivas de oxígeno, la oxidación de moléculas de LDL y la inflamación son procesos tempranos de la patogénesis de la aterosclerosis. La proliferación y migración de las células del músculo liso vascular, forman la capa fibrosa de la placa. La acumulación progresiva de lípidos, el incremento en la respuesta inflamatoria y la apoptosis y necrosis celular contribuyen a la formación y ruptura de la placa (13). APOA1: apoproteína A1, CCR2: receptor de quimiocina, CD36: grupo de diferenciación 36, COX2: ciclo-oxigenasa 2, HDL: lipoproteína de alta densidad, ICAM-1: molécula de adhesión intercelular-1, ILs: interleuquinas, LDL: lipoproteína de baja densidad, MCP1: proteína quimioatrayente de monocitos 1, M-CSF: factor estimulante de colonia de macrófagos, MPO: mieloperoxidasa, PON-1: paraoxanasa-1, SRA: receptor «scavenger» tipo A, TNF-α: factor de necrosis tumoral-α, TRC: transporte reverso del colesterol, VCAM-1: molécula de adhesión celular vascular-1, VSMC: células del músculo liso vascular.
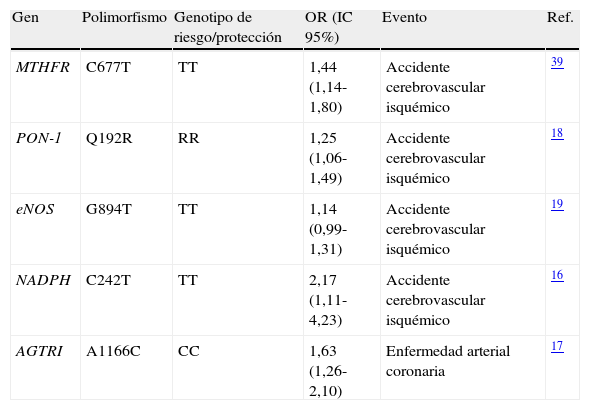
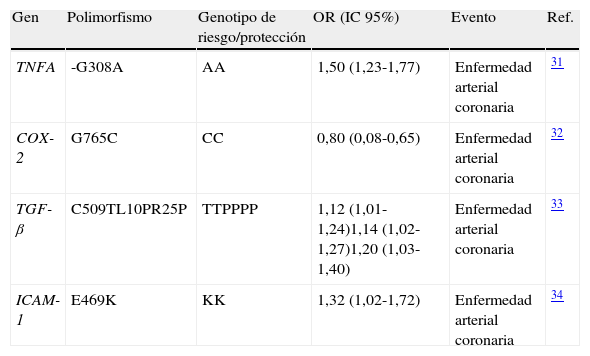
Las especies reactivas de oxígeno (EROs) se producen por la presencia de factores de riesgo cardiovascular que ocasionan la oxidación de LDL (ox-LDL) y contribuyen a un daño continuo en la pared arterial, así como a la progresión de la aterosclerosis. El estrés oxidativo media procesos de reducción en la biodisponibilidad del óxido nítrico (ON) y la disfunción subsecuente del endotelio arterial con la sobreexpresión de moléculas pro-inflamatorias y pro-trombóticas14. A la fecha se han identificado varios genes candidato que modulan la respuesta oxidativa y que confieren susceptibilidad para enfermedades cardiovasculares (tabla 1).
Polimorfismos de genes de la ruta del estrés oxidativo y su asociación con accidente cerebrovascular y enfermedad arterial coronaria
| Gen | Polimorfismo | Genotipo de riesgo/protección | OR (IC 95%) | Evento | Ref. |
| MTHFR | C677T | TT | 1,44 (1,14-1,80) | Accidente cerebrovascular isquémico | 39 |
| PON-1 | Q192R | RR | 1,25 (1,06-1,49) | Accidente cerebrovascular isquémico | 18 |
| eNOS | G894T | TT | 1,14 (0,99-1,31) | Accidente cerebrovascular isquémico | 19 |
| NADPH | C242T | TT | 2,17 (1,11-4,23) | Accidente cerebrovascular isquémico | 16 |
| AGTRI | A1166C | CC | 1,63 (1,26-2,10) | Enfermedad arterial coronaria | 17 |
El gen MTHFR codifica para la enzima metilentetrahidrofolato reductasa cuya variante polimórfica C677T se asocia con deficiencias en la enzima. Estas alteraciones provocan elevados niveles sanguíneos de homocisteína, cuya autoxidación genera radicales libres, moléculas involucradas en el estrés oxidativo15.
Por otra parte, la enzima nicotinamida-adenina dinucleótido fosfato oxidasa (NADPH) es una importante fuente de radicales libres de oxígeno en las células vasculares. El incremento extracelular de dichos radicales disminuye la biodisponibilidad del ON alterando la función endotelial. El polimorfismo C242T del gen NADPH se encuentra fuertemente asociado con el desarrollo de enfermedades cardiovasculares16.
La activación del receptor I de angiotensina II (AGTR1) lidera el incremento del estrés oxidativo a partir de la acción de NADPH con la subsecuente alteración de la capacidad vasodilatadora arterial. El polimorfismo A1166C en el gen AGTR1 incrementa la actividad del receptor y está relacionado con el riesgo de enfermedad arterial coronaria17.
La enzima paraoxanasa-1 (PON-1) es codificada por el gen PON-1 y se encuentra unida a moléculas de lipoproteína de alta densidad (HDL). Debido a sus propiedades antioxidantes, la enzima disminuye los efectos dañinos del estrés oxidativo. Se ha encontrado que el polimorfismo Q192R modula la acción de la enzima e influye en su capacidad antioxidante afectando el riesgo para enfermedades cardiovasculares18.
Genes asociados con la alteración en la homeostasis arterialLa disfunción endotelial se asocia con alteraciones en la acción de la enzima eNOS (óxido nítrico sintasa) codificada por el gen NOS3. La enzima es la encargada de la catálisis del sustrato L-arginina para la formación de ON. La variante polimórfica G894T produce una enzima disfuncional, que provoca baja disponibilidad de ON y alteraciones endoteliales19.
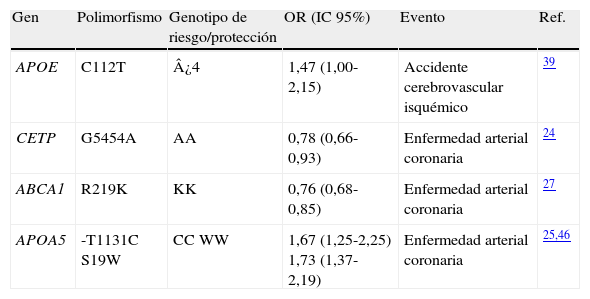
Metabolismo y transporte lipídicoLas principales moléculas que participan en el metabolismo y transporte de los lípidos en sangre han sido objeto de investigación en estudios epidemiológicos20,21. Los enfoques de investigación se han direccionado principalmente al papel protector de las HDL y la función de las ox-LDL en el riesgo de enfermedades cardiovasculares22. Las ox-LDL son reconocidas e internalizadas por monocitos para formar células espumosas al interior de la pared arterial23. Por su parte, las HDL contribuyen a inhibir la formación de ox-LDL. Numerosos estudios han analizado los SNPs en genes que modulan mecanismos del metabolismo y transporte de partículas lipídicas y su papel en el riesgo de enfermedades cardiovasculares (tabla 2).
Variantes alélicas de genes del metabolismo y transporte lipídico y su asociación con accidente cerebrovascular y enfermedad arterial coronaria
| Gen | Polimorfismo | Genotipo de riesgo/protección | OR (IC 95%) | Evento | Ref. |
| APOE | C112T | ¿4 | 1,47 (1,00-2,15) | Accidente cerebrovascular isquémico | 39 |
| CETP | G5454A | AA | 0,78 (0,66-0,93) | Enfermedad arterial coronaria | 24 |
| ABCA1 | R219K | KK | 0,76 (0,68-0,85) | Enfermedad arterial coronaria | 27 |
| APOA5 | -T1131C S19W | CC WW | 1,67 (1,25-2,25) 1,73 (1,37-2,19) | Enfermedad arterial coronaria | 25,46 |
La enzima CETP (proteína de transferencia de ésteres de colesterol) facilita el intercambio de ésteres de colesterol entre HDL y lipoproteínas ricas en triglicéridos y está involucrada en el transporte reverso del colesterol. La variante alélica TaqIB, se ha asociado con sobreproducción de la enzima, bajas concentraciones plasmáticas de HDL e incremento en el riesgo de enfermedad arterial coronaria24.
Genes asociados con el transporte lipídicoEl gen APOA5 codifica para la apoproteína APOA5, componente de varias fracciones de lipoproteínas incluyendo VLDL, HDL y quilomicrones, y es un determinante importante de los niveles plasmáticos de triglicéridos. Polimorfismos en el gen, principalmente -T1131C y C56G, se asocian con hipertrigliceridemia e incremento en el riesgo de enfermedad arterial coronaria25.
Por su parte, la apoproteína APOE desempeña un papel clave en la regulación del metabolismo de lípidos. De acuerdo con la presencia de polimorfismos en el gen APOE, la enzima puede presentar tres isoformas (E2, E3 y E4), donde las isoformas APOE2 y APOE4 frecuentemente se relacionan con estados de hiperlipoproteinemia, y consecuente incremento del riesgo para enfermedades cardiovasculares26.
El gen ABCA1 codifica para la proteína ABCA1 (transportador A1 unido a ATP) la cual participa en la biogénesis del HDL y en el transporte reverso del colesterol. El polimorfismo R219K del gen ABCA1 se coliga a incremento en el colesterol HDL y reducción en el riesgo de enfermedad arterial coronaria27.
De otro lado, la lipoproteína lipasa hidroliza triglicéridos de VLDL y quilomicrones y remueve remanentes de quilomicrón y VLDL de la circulación. El polimorfismo S447T en el gen LPL confiere protección para accidente cerebrovascular, ya que reduce los niveles de triglicéridos en plasma e incrementa los de colesterol HDL28.
InflamaciónLa aterosclerosis es una condición inflamatoria crónica, en la que citoquinas proinflamatorias median los mecanismos de la aterogénesis y las complicaciones finales de la enfermedad29. Con la disfunción del endotelio arterial se activan mecanismos inflamatorios que participan en la adhesión y transmigración leucocitaria al interior de la íntima arterial. La formación y el depósito continuo de células espumosas en la íntima arterial contribuye a un estado inflamatorio y a la formación de la placa30. Diversos estudios han determinado la asociación de SNPs en genes de inflamación y su relación con el desarrollo de enfermedad arterial coronaria (tabla 3).
Polimorfismos en genes de inflamación y su relación con riesgo para enfermedad arterial coronaria
| Gen | Polimorfismo | Genotipo de riesgo/protección | OR (IC 95%) | Evento | Ref. |
| TNFA | -G308A | AA | 1,50 (1,23-1,77) | Enfermedad arterial coronaria | 31 |
| COX-2 | G765C | CC | 0,80 (0,08-0,65) | Enfermedad arterial coronaria | 32 |
| TGF-β | C509TL10PR25P | TTPPPP | 1,12 (1,01-1,24)1,14 (1,02-1,27)1,20 (1,03-1,40) | Enfermedad arterial coronaria | 33 |
| ICAM-1 | E469K | KK | 1,32 (1,02-1,72) | Enfermedad arterial coronaria | 34 |
El gen TNFA codifica para la citoquina inflamatoria TNF-α (factor de necrosis tumoral) producida por leucocitos como parte de la respuesta inflamatoria. La sobreexpresión de TNF-α produce activación del endotelio vascular, aumento de la permeabilidad arterial y con ello riesgo para enfermedades cardiovasculares31.
La ciclo-oxigenasa 2 (COX-2) cataliza la formación de prostaglandinas que agudizan la respuesta inflamatoria en la placa aterosclerótica. El polimorfismo G765C en el gen COX-2 se ha identificado como factor protector para enfermedad arterial coronaria ya que reduce la expresión de la enzima y por ende la actividad de macrófagos dentro de la placa32.
El factor de crecimiento transformante beta (TGFB) modula la respuesta inflamatoria, reduciendo la expresión de moléculas de adhesión endotelial y la proliferación de linfocitos T CD4 y CD8. Los polimorfismos C509T, L10P y R25P en el gen TGFB se han asociado con la sobreproducción de la proteína y con un incremento consecuente en el riesgo de enfermedad arterial coronaria33.
La molécula de adhesión intercelular-1 (ICAM-1) se expresa en la pared arterial en respuesta a la disfunción del endotelio y está involucrada en la adhesión de leucocitos a las células endoteliales. El alelo K del polimorfismo E469K en el gen ICAM-1 se ha asociado con sobre-expresión de la proteína e incremento en el riesgo de enfermedad arterial coronaria34.
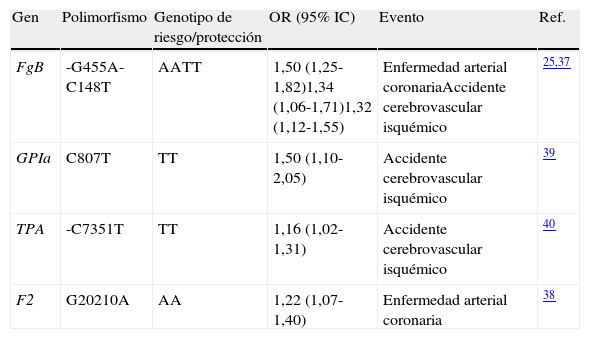
Coagulación, fibrinólisis y trombosis arterialLa hemostasia vascular está controlada por interacciones entre el sistema plaquetario, la coagulación y las vías anticoagulantes13, alterándose luego de la ruptura de la placa aterosclerótica. La exposición del colágeno, presente en el espacio subendotelial arterial y su interacción con receptores de glicoproteínas en la membrana plaquetaria, media los fenómenos de adhesión y agregación plaquetaria en el sitio de la lesión35. Adicionalmente, el factor tisular liberado de las células endoteliales en respuesta a la lesión, interacciona con los diversos factores de coagulación y contribuye a la producción de fibrina y la formación del retículo del trombo36. Estudios de asociación genética hechos en las últimas décadas, han arrojado evidencia clara de la asociación de variantes polimórficas de genes que participan en las vías de coagulación y fibrinólisis con las enfermedades cardiovasculares (tabla 4).
Genes y polimorfismos genéticos de vías trombóticas y fibrinolíticos y su asociación con accidente cerebrovascular y enfermedad arterial coronaria
| Gen | Polimorfismo | Genotipo de riesgo/protección | OR (95% IC) | Evento | Ref. |
| FgB | -G455A-C148T | AATT | 1,50 (1,25-1,82)1,34 (1,06-1,71)1,32 (1,12-1,55) | Enfermedad arterial coronariaAccidente cerebrovascular isquémico | 25,37 |
| GPIa | C807T | TT | 1,50 (1,10-2,05) | Accidente cerebrovascular isquémico | 39 |
| TPA | -C7351T | TT | 1,16 (1,02-1,31) | Accidente cerebrovascular isquémico | 40 |
| F2 | G20210A | AA | 1,22 (1,07-1,40) | Enfermedad arterial coronaria | 38 |
El fibrinógeno, codificado por el gen FGB, es una glicoproteína involucrada en la cascada de la coagulación. Luego de la ruptura de la placa aterosclerótica, el fibrinógeno se transforma en fibrina gracias a la actividad de la trombina, y con ello la formación del trombo. El polimorfismo -C148T del gen está asociado con niveles elevados de fibrinógeno y riesgo de accidente cerebrovascular37.
El factor II de la coagulación, codificado por el gen F2, participa en la cascada de coagulación y, al entrar en contacto con la enzima tromboplastina produce la trombina. El polimorfismo en el locus 20210ha sido asociado con estados de hipercoagulabilidad que favorecen la trombosis arterial y el desarrollo de enfermedad arterial coronaria38.
La glicoproteína plaquetaria Ia, receptor de colágeno en la membrana plaquetaria, está involucrada en los procesos de adhesión de las plaquetas en áreas de disrupción endotelial, a partir de su interacción con el colágeno del tejido conectivo subendotelial. El polimorfismo C807T en el gen GPIa puede influenciar la activación plaquetaria, modificar la trombogenicidad de las plaquetas y asociarse con riesgo de accidente cerebrovascular39.
Genes asociados con la fibrinólisisEl gen TPA codifica para el activador tisular del plasminógeno derivado del endotelio, mediador primario de la fibrinólisis intravascular. El polimorfismo –C7351T fue el primero identificado y se relacionó con tasas de liberación de TPA. El alelo -7351T se asocia con elevados niveles plasmáticos de TPA y riesgo de accidente cerebrovascular40.
Estudios de asociación genómicaLos proyectos Genoma Humano y HapMap, así como los estudios genómicos recientes han permitido la identificación de SNPs comunes en todas las poblaciones alrededor del mundo. El análisis de la asociación no aleatoria de alelos en las inmediaciones de un loci hace posible el diseño de GWAS en un número de genes en alto desequilibrio de ligamiento41. El uso de GWAS implica la implementación de plataformas de genotipificación de alto rendimiento, para analizar un amplio volumen de SNPs con efectos modestos en el fenotipo y localiza señales genotípicas en una escala genómica muy pequeña. Se han completado cerca de 1.200 GWAS e identificado varios miles de loci de 200 rasgos complejos42.
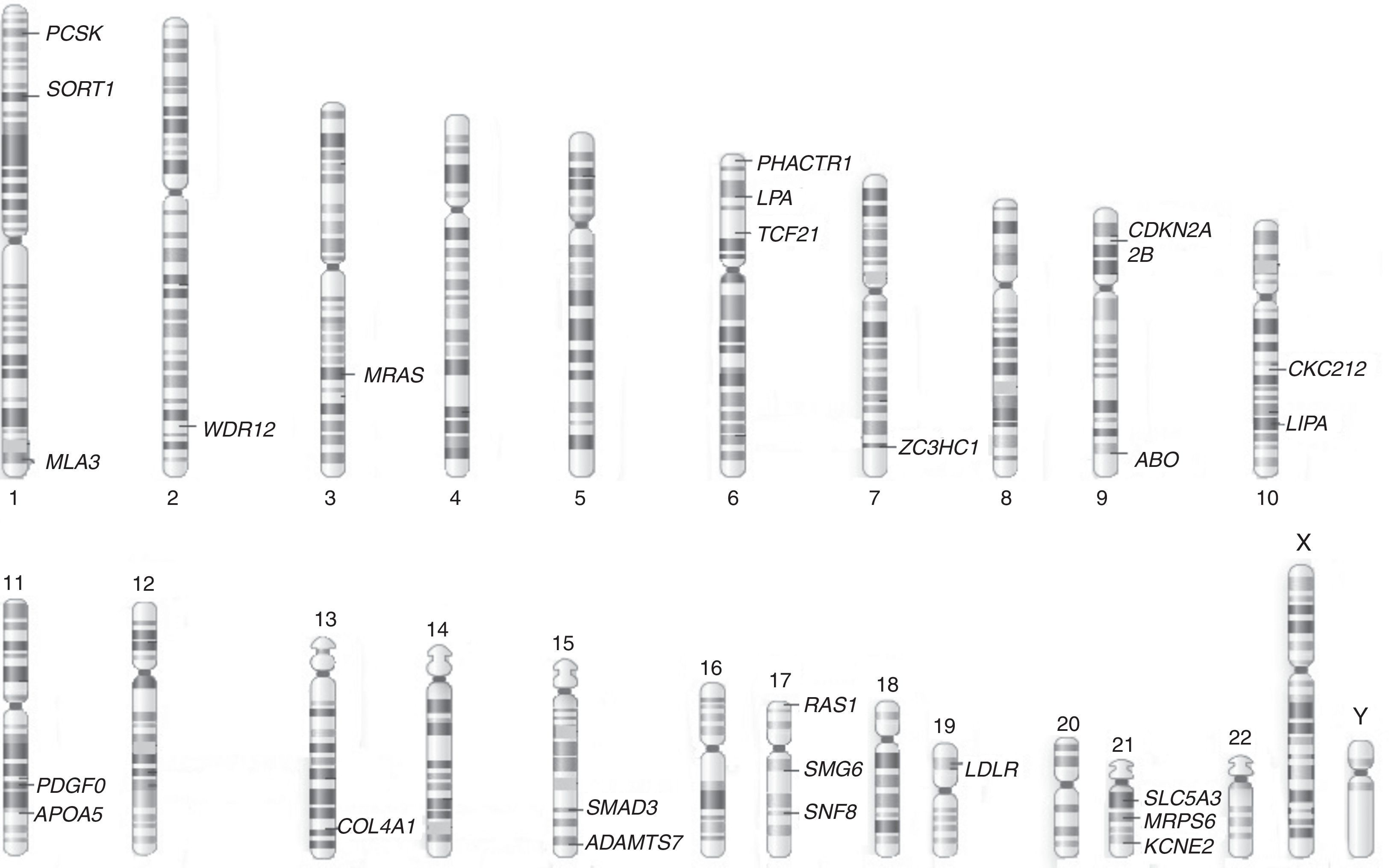
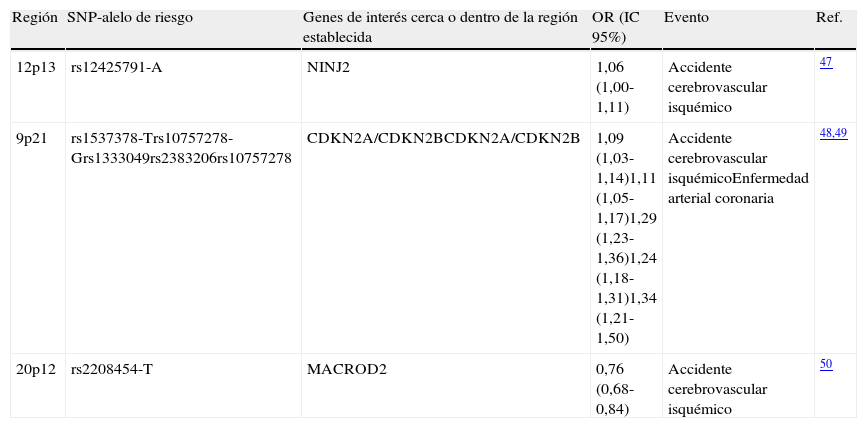
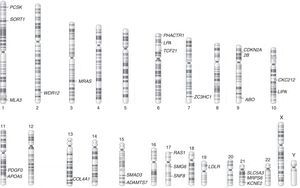
Con el advenimiento de tecnologías de microarreglos se ha posibilitado la ejecución de GWAS para enfermedades complejas como las cardiovasculares8 (tabla 5). Así, el enfoque de análisis genómico permite el descubrimiento de nuevos SNPs, genes y posibles vías moleculares asociadas con las enfermedades de origen aterosclerótico. Descubrimientos iniciales identificaron la relación de la región 9p21 con infarto agudo de miocardio, la cual contiene genes que regulan la expresión cardíaca de los genes CDKN2A/B e igualmente contiene 33 genes moduladores de vías inflamatorias43. Los GWAS han identificado loci asociados con infarto de miocardio y enfermedad arterial coronaria (fig. 2). Así, diversos SNPs se han involucrado con diferentes vías moleculares implicadas en la enfermedad. Se han identificado, de igual forma, 95 loci asociados con niveles de colesterol LDL, HDL y triglicéridos, los cuales están cercanos a 18 genes previamente asociados con desórdenes lipídicos de origen mendeliano44.
SNPs y loci de susceptibilidad para accidente cerebrovascular y enfermedad arterial coronaria identificados en meta-análisis de la literatura
| Región | SNP-alelo de riesgo | Genes de interés cerca o dentro de la región establecida | OR (IC 95%) | Evento | Ref. |
| 12p13 | rs12425791-A | NINJ2 | 1,06 (1,00-1,11) | Accidente cerebrovascular isquémico | 47 |
| 9p21 | rs1537378-Trs10757278-Grs1333049rs2383206rs10757278 | CDKN2A/CDKN2BCDKN2A/CDKN2B | 1,09 (1,03-1,14)1,11 (1,05-1,17)1,29 (1,23-1,36)1,24 (1,18-1,31)1,34 (1,21-1,50) | Accidente cerebrovascular isquémicoEnfermedad arterial coronaria | 48,49 |
| 20p12 | rs2208454-T | MACROD2 | 0,76 (0,68-0,84) | Accidente cerebrovascular isquémico | 50 |
Regiones cromosómicas de las variantes genéticas en genes asociados a riesgo para infarto agudo de miocardio. Tomado y modificado de O¿Donell et al45. ABO: histogrupo sanguíneo ABO sistema transferasa; ADAMTS7: metalopeptidasa ADAM con trombospondina tipo 1, motivo 7; APOA5: apoproteína A5; CDKN2A: Inhibidor de quinasa dependiente de ciclina 2A; COL4A1: colágeno tipo 4 alfa 1; KCNE2: canal de potasio activado por voltaje, miembro 2; LDLR: receptor de la lipoproteína de baja densidad; LIPA: lipasa A; LPA: lipoproteína A; MIA3: actividad inhibitoria del melanoma; MRAS: oncogen homólogo RAS; MRPS6: proteína ribosomal mitocondrial S6; PCSK: proproteína/convertasa subtilisina/kexina tipo 1; PDGF0: factor de crecimiento derivado de plaquetas; PHACTR1: regulador de actina y fosfatasa 1; SMAD3: miembro 3 de la familia SMAD; SLC5A3: solute carrier family 5, member 3 (su sigla en inglés); SMG6: SMG6 nonsense mediated mRNA decay factor (su sigla en inglés); SNF8: subunidad del complejo ESCRT-II, SNF8; SORT1: sortilina 1; RAS1: Ras tipo 1; TCF21: factor de transcripción 21; WDR12: proteína con repeticiones WD; ZC3HC1: dominio de zinc de tipo C3HC.
Uno de los principales objetivos de los estudios genéticos de las enfermedades cardiovasculares es identificar marcadores que permitan dilucidar los mecanismos moleculares asociados con la enfermedad. A su vez, la identificación de variantes genéticas ha contribuido al descubrimiento de nuevas dianas terapéuticas, modificando considerablemente el enfoque farmacológico de los desórdenes cardiovasculares a corto y largo plazo. A medida que los estudios de asociación genética arrojan nuevos genes candidato asociados con el riesgo de enfermedades cardiovasculares, se hace imperativa la replicación de dichos estudios para confirmar tales asociaciones y establecer la distribución de las variantes polimórficas en las diversas poblaciones humanas.
Investigaciones epidemiológicas han reportado gran número de genes candidato y cientos de SNPs involucrados en los mecanismos moleculares subyacentes a la fisiopatología de la enfermedad. Sin embargo, y en materia de genes candidato, los estudios de meta-análisis revelan que son pocos los que muestran, en efecto, una asociación con las enfermedades cardiovasculares. Acorde con la evidencia, se reconoce que los principales genes candidato aunados a las enfermedades cardiovasculares, están al menos involucrados en las siguientes vías moleculares:
- a)
Estrés oxidativo: MTHFR, PON-1, eNOS, NADPH, y AGTRI.
- b)
Metabolismo y transporte lipídico: APOE, APOA5, CETP, y ABCA1.
- c)
Inflamación: TNFA, COX-2, TGF-B e ICAM-1.
- d)
Coagulación y fibrinólisis: FgB, GPIa, F2, y TPA.
Así mismo, investigaciones en genes candidato como AGT (angiotensinógeno), IL-6 (interleuquina-6), VCAM-1 (molécula de adhesión celular vascular tipo 1), E- selectina, M-CSF (factor estimulante de colonia de macrófagos), CCR2 (receptor de quimiocina tipo 2), MMP9 (metaloproteinasa 9), SCARB1 (receptor «basurero» tipo 1), advierten un papel en el riesgo para enfermedades cardiovasculares, sin embargo, la evidencia actual no es concluyente.
Por su parte, los GWAS han permitido identificar numerosos loci y genes asociados con enfermedades cardiovasculares. Aunque, estos loci tienen efectos modestos en el riesgo de la enfermedad, los genes descubiertos revelan nuevas vías de la enfermedad y nuevas dianas terapéuticas. Sin embargo, existen aspectos por abordar en el futuro, como el establecimiento de los genes causales asociados a los loci de susceptibilidad, la caracterización de la función de dichos genes en la fisiopatología de la enfermedad y la extensión de la búsqueda a variantes genéticas raras.
Conflicto de interésLos autores declaran no tener conflicto de intereses.
Fuente de financiamientoEsta investigación fue financiada con recursos del Programa Nacional de Salud de COLCIENCIAS (Cod. 110351929119).
Los autores expresan su agradecimiento a la Universidad del Cauca, la Vicerrectoría de Investigaciones y los Departamentos de Ciencias Fisiológicas y Ciencias Quirúrgicas de la Facultad de Ciencias de la Salud por su apoyo en la ejecución de este proyecto.