Las miocardiopatías infiltrativas se caracterizan por un depósito de sustancias anormales dentro de la pared ventricular que generan rigidez y así disfunción diastólica progresiva, que típicamente precede la disfunción sistólica. Estas entidades pueden clasificarse en dos grandes grupos, según su fenotipo: las que simulan enfermedad isquémica cardiaca o miocardiopatía dilatada y las que simulan la miocardiopatía hipertrófica o hipertensiva. Dentro del primer grupo se encuentran la sarcoidosis, la hemocromatosis y la granulomatosis de Wegener, mientras que en el segundo grupo están la amiloidosis, la enfermedad de Anderson-Fabry, la enfermedad de Danon, la ataxia de Friedreich, la oxalosis miocárdica y las mucopolisacaridosis. En este capítulo se tratarán los aspectos más relevantes de la aproximación ecocardiográfica en las miocardiopatías infiltrativas más frecuentes, destacando los hallazgos más notables que deberán hacer sospechar cada una de estas enfermedades y plantear la necesidad de ampliar el estudio con otros métodos de diagnóstico.
Infiltrative cardiomyopathies are characterised by the deposit of abnormal substances within the ventricular wall that cause stiffness and thus progressive diastolic dysfunction, which typically precedes systolic dysfunction. These conditions can be classified into two large groups, depending on their phenotype: those that simulate ischaemic heart disease or dilated cardiomyopathy, and those that simulate hypertrophic or hypertensive cardiomyopathy. The first group includes, sarcoidosis, haemochromatosis, and Wegener's granulomatosis, while the second group includes, amyloidosis, Anderson-Fabry disease, Danon disease, Friedreich's ataxia, myocardial oxalosis, and mucopolysaccharidosis. In this chapter, a description will be made of the most relevant aspects of the echocardiography approach into the most common infiltrative cardiomyopathies, highlighting the most notable findings that should make one suspect each one these diseases, and to establish the need to widen the study with other diagnostic methods.
La amilodosis cardiaca es una forma de miocardiopatía infiltrativa que se caracteriza por la presencia de un depósito extracelular de proteínas fibrilares insolubles a nivel miocárdico. Su manifestación más frecuente es la insuficiencia cardiaca congestiva. La mortalidad puede llegar a ser mayor al 50% cuando no se diagnostica a tiempo y por ende, se alcanzan estadios avanzados1. Por esta razón, su diagnóstico precoz desempeña un papel importante que define el inicio del tratamiento e impacta el pronóstico de estos pacientes.
Las siguientes son las formas de amiloidosis que afectan al corazón2:
Amiloidosis de cadena ligeraSe asocia a discrasias de células plasmáticas, produciendo depósito de inmunoglobulinas de cadena ligera. El mieloma múltiple tiene una prevalencia del 12 al 15%, y hasta el 50% de éstos pueden presentar compromiso cardíaco3. Puede afectar a otros órganos como riñón, hígado, sistema nervioso periférico y tejidos blandos.
Amiloidosis asociada a la transtirretinaExisten dos tipos, la forma familiar con transmisión autosómica dominante y la sistémica senil que afecta principalmente a hombres. Es de progresión lenta4 y menor mortalidad respecto a otros tipos de amiloidosis cardiaca.
Amiloidosis secundariaSe asocia a enfermedades inflamatorias sistémicas como la artritis reumatoide juvenil, la espondilitis anquilosante y la enfermedad inflamatoria intestinal. Los principales órganos comprometidos son el riñón, el hígado y en menor proporción, el corazón.
La ecocardiografía ha sido desde hace varios años el método diagnóstico de primera línea en pacientes con sospecha de amiloidosis cardiaca.
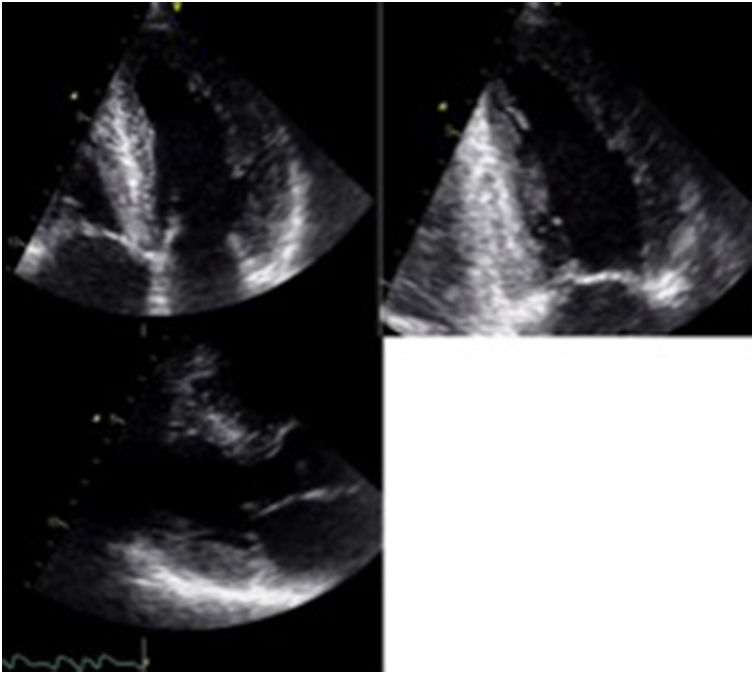
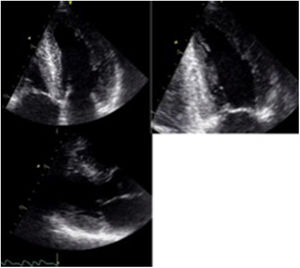
La primera descripción de amiloidosis cardiaca se hizo en 19755 mediante el modo M. Ya desde ese entonces, se documentó el aumento simétrico en el espesor de las paredes del miocardio, asociado a un ventrículo izquierdo con dimensiones normales o disminuidas en diástole, diámetros de fin de sístole aumentados, en algunos casos, y derrame pericárdico asociado. Posteriormente, en 19816, se describieron los primeros hallazgos mediante ecocardiografía 2D, que aún hoy en día continúan siendo características que deben hacer pensar en amiloidosis cardiaca, especialmente en presencia de “hipertrofia” ventricular no explicada (tabla 1). Uno de los principales hallazgos ecocardiográficos es el aumento difuso en el espesor de la pared del ventrículo izquierdo en ausencia de hipertensión arterial y/o estenosis aórtica, sin ser este un hallazgo específico, ya que este mismo fenotipo puede encontrarse en otro tipo de miocardiopatías infiltrativas, así como también en la miocardiopatía hipertrófica (fig. 1). Sin embargo, esta última entidad no cursa con engrosamiento de las válvulas aurículo-ventriculares, ni del septum interauricular, características que se han documentado en los pacientes con amiloidosis cardiaca. El aumento del espesor de la pared, en este caso, se debe al depósito de amiloide y no a hipertrofia de la fibra. Pese a que en la mayoría de los casos el engrosamiento de la pared es simétrico, hasta un 55% de los pacientes puede cursar con aumento asimétrico del septum, y simular así una miocardiopatía hipertrófica asimétrica7.
Características ecocardiográficas de la amiloidosis cardiaca
| - Aumento en el espesor de la pared del ventrículo izquierdo. |
| - Aspecto granular. |
| - Disminución en los VFD |
| - Fracción de eyección normal o ligeramente disminuida |
| - Disfunción diastólica progresiva. |
| - Dilatación biauricular. |
| - Engrosamiento de válvulas y septum interauricular. |
| - Aumento en el espesor del ventrículo derecho- TAPSE |
| - Derrame pericárdico. |
| - Alteración del strain longitudinal comprometiendo los segmentos basales y mediales de todas las paredes. Strain normal en los segmentos apicales. |
Adicionalmente, aunque inespecífico, es la apariencia “granular” del miocardio que se ha descrito en algunos estudios y que debe hacer pensar en la posibilidad de miocardiopatía infiltrativa8.
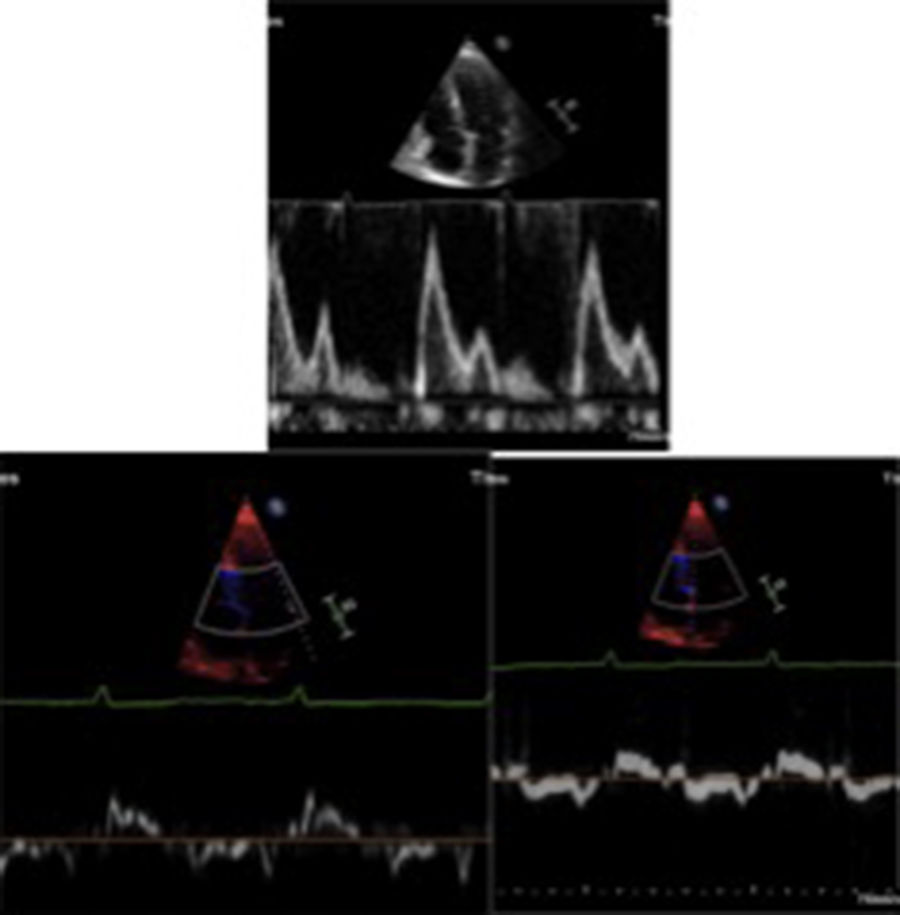
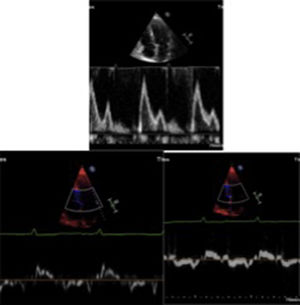
La disfunción diastólica es frecuente, con trastorno de la relajación en etapas iniciales, alteración progresiva de la compliance ventricular y finalmente un patrón restrictivo en etapas mucho más avanzadas (fig. 2). La fracción de eyección puede ser normal o ligeramente disminuida en la mayoría de pacientes. Sin embargo, en etapas terminales, se puede llegar a evidenciar severa disfunción sistólica. La dilatación biauricular es frecuente y refleja la alteración en el llenado ventricular. Otros hallazgos frecuentes aunque también inespecíficos son el engrosamiento de las paredes del ventrículo derecho, la disminución del TAPSE y la presencia de derrame pericárdico. El incremento concéntrico del grosor de la pared del ventrículo izquierdo, la dilatación biauricular y el derrame pericárdico son hallazgos que indican amiloidosis cardiaca en fase avanzada9.
Otro aspecto que está a favor del diagnóstico de amiloidosis cardiaca es la discrepancia entre los hallazgos electrocardiográficos y los hallazgos ecocardiográficos. El voltaje disminuido (QRS <0,1mV en derivaciones precordiales y <0,05mV en las derivaciones de las extremidades), en un ventrículo con aumento en el espesor de sus paredes, hará pensar en la posibilidad de amiloidosis cardiaca, especialmente en la forma de cadena ligera10.
Los pacientes con amiloidosis asociada a la transtirretina pueden no tener voltaje disminuido especialmente si cursan con hipertensión arterial. Esta disminución del voltaje aparentemente está relacionada con atrofia de los miocitos y disminución en las velocidades de conducción debido al depósito de amiloide11,12.
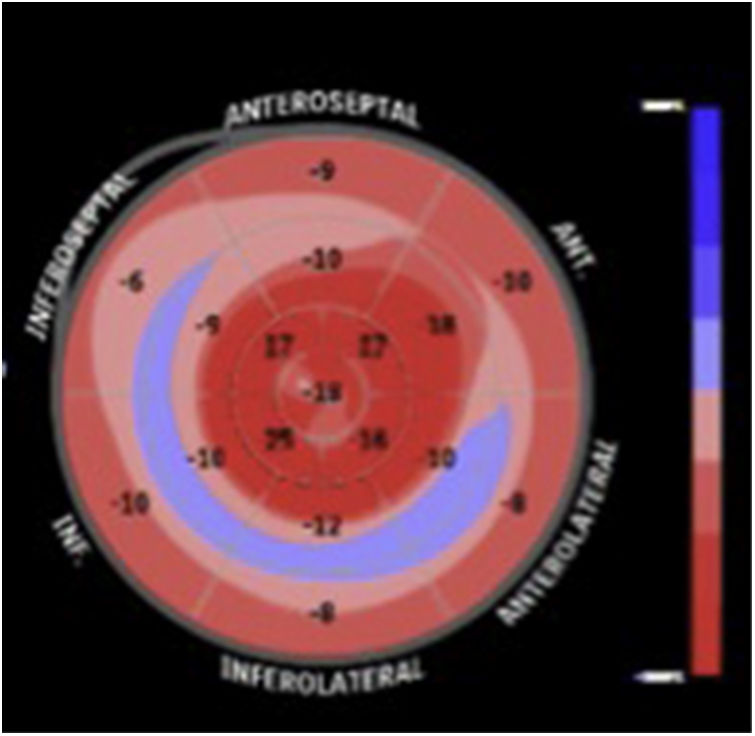
El advenimiento de técnicas de ecocardiografía avanzada, como el speckel tracking ha cobrado un papel importante en el estudio de la amiloidosis cardiaca, ya que permite hallar de manera característica, una alteración en el strain longitudinal de los segmentos basales y mediales de todas las paredes del ventrículo izquierdo, respetando los segmentos apicales, ayudando así a diferenciarla de otras enfermedades que también cursan con aumento en el espesor de las paredes, como la cardiopatía hipertensiva y la miocardipatía hipertrófica (fig. 3).
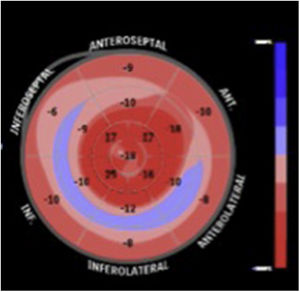
Un patrón de strain longitudinal regional llamado “patrón de ahorro apical” que puede cuantificarse mediante el ratio de strain regional relativo (RRSR: Strain longitudinal promedio apical/Strain longitudinal promedio basal+Strain longitudinal promedio medial), tiene una sensibilidad del 93% y una especificidad del 82% para el diagnóstico de amiloidosis cardiaca, cuando es mayor a 113. Este índice también se ha asociado con mayor mortalidad y mayor necesidad de trasplante cardiaco14.
La valoración cualitativa del mapa polar demostrando variaciones regionales del strain, también tiene utilidad en el diagnóstico diferencial con otras patologías15. Se ha documentado una diferencia exagerada entre el strain apical y el basal (> -8%), relacionado con el gradiente decremental de depósito de amiloide entre la base y el ápex del ventricular16.
El compromiso del strain logitudinal promedio global (menor a -11,78%) se ha descrito como un predictor independiente de menor sobrevida, especialmente en pacientes con amiloidosis de cadena ligera17.
Recientemente se ha descrito una disociación importante entre la fracción de eyección del ventrículo izquierdo y el strain longitudinal global en pacientes con amiloidosis cardiaca, que permite diferenciar esta patología de la miocardiopatía hipertrófica. Los autores proponen un índice que relaciona la fracción de eyección con el strain longitudinal global (fracción de eyección/strain longitudinal global), con un valor mayor a 4,1 en pacientes con amiloidosis cardiaca18.
Por último, la prevalencia de trombos intracardiacos es alta y varía entre un 27 a un 33% según los diferentes estudios19,20. Estos trombos están relacionados con la presencia de disfunción auricular izquierda, caracterizada por una onda A pequeña, así como disminución de la fracción de eyección auricular y del strain auricular21.
SarcoidosisEs una enfermedad granulomatosa multisistémica de etiología desconocida. Su principal caraterística histopatológica es la presencia de granulomas no caseificantes. El principal órgano afectado es el pulmón (hasta en un 90% de los casos), sin embargo, también puede comprometer otros órganos como corazón, hígado, piel, ojos y glándula parótida22.
Muchos pacientes con sarcoidosis sistémica y pulmonar tienen compromiso cardiaco asintomático. En estudios de autopsias de pacientes con antecedente de sarcoidosis, se encontró una prevalencia de compromiso cardiaco de al menos 25%23.
Las principales manifestaciones cardiacas de la enfermedad son alteraciones en la conducción, arritmias ventriculares, muerte súbita y falla cardiaca. Entre el 16 al 35% de los pacientes presentan bloqueo AV (menores de 60 años) o taquicardia ventricular de etiología desconocida22,24,25.
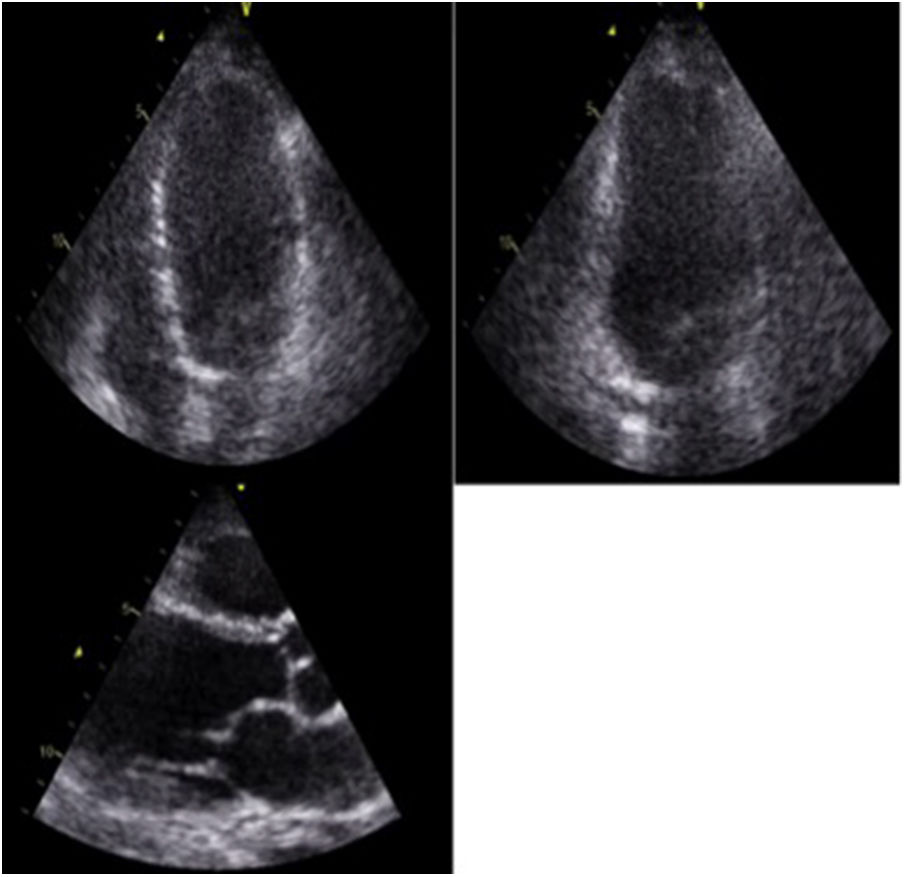
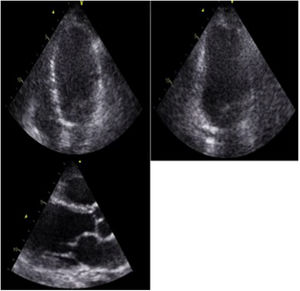
El ecocardiograma transtorácico es una de las herramientas utilizadas en el estudio inicial de estos pacientes, y es a menudo anormal en la enfermedad manifiesta, pero es usualmente normal en la enfermedad clínicamente silente. Las anormalidades son variables y usualmente inespecíficas. Dentro de los hallazgos relevantes se encuentra la dilatación ventricular izquierda con disfunción sistólica global o asociada a trastornos segmentarios de la contractilidad que no tienen una distribución coronaria22 (fig. 4), siendo este uno de los hallazgos que obliga profundizar el estudio mediante otros métodos diagnósticos de imagen, como la resonancia cardiaca. Estos pacientes pueden tener adelgazamiento de las paredes, que en algunos casos compromete el segmento basal del septum26, aunque éste también puede presentar engrosamiento durante la fase inflamatoria de la enfermedad, simulando una miocardiopatía hipertrófica22,27. Este engrosamiento se debe a la infiltración granulomatosa y al edema miocárdico. Hasta en un 10% de los casos se han documentado aneurismas ventriculares, particularmente en la pared anterior y el septum interventricular28 (tabla 2).
Características ecocardiográficas de la sarcoidosis cardiaca
| - Dilatación del ventrículo izquierdo. |
| - Disfunción sistólica. |
| - Hipoquinesia difusa o trastornos segmentarios de la contractilidad que no siguen una distribución coronaria. |
| - Adelgazamiento de las paredes (segmento basal del septum) |
| - Aneurismas ventriculares. |
| - Disfunción diastólica progresiva. |
| - Alteración inespecífica del strain longitudinal global. |
Aunque la especificidad para la detección de infiltración granulomatosa miocárdica es limitada, la ecocardiografía es útil en la detección de la disfunción sistólica severa, así como también de las alteraciones en el llenado diastólico, que pueden indicar enfermedad infiltrativa temprana26. En más del 30% de los casos se encuentra dilatación ventricular izquierda y alteración de la función sistólica, hallazgo que se ha asociado con resultados adversos y con el que se han demostrado algunos grados de disfunción valvular inespecífica28.
El strain longitudinal global del ventrículo izquierdo puede estar alterado, sin tener un patrón de distribución específico, que permita diferenciarla de otras patologías. La disminución del strain longitudinal promedio en la sarcoidosis cardiaca se ha asociado de manera independiente a eventos cardíacos adversos. Según un estudio publicado por Joyce et al., un strain longitudinal global de -17,3% o mayor se relaciona con menor probabilidad de alcanzar el punto final primario combinado de muerte por todas las causas, hospitalización por falla cardiaca, implante de dispositivos y aparición de nuevas arritmias29. Finalmente, se ha documentado disfunción ventricular derecha precoz mediante la técnica de speckel tracking, que también se ha relacionado con algunos eventos adversos30.
Enfermedad de FabryEn 1898, los dermatólogos europeos Johan Fabry (Alemania) y William Anderson (Inglaterra) describieron un grupo de pacientes con lesiones vasculares cutáneas y compromiso de la función renal, que denominaron angioqueratomas corporales difusos31,32. Por tal motivo la literatura médica, desde entonces, hace referencia a esta patología como enfermedad de Fabry o de Anderson-Fabry.
Se trata de una enfermedad metabólica ligada al sexo (cromosoma X) producida por el déficit total o parcial de la enzima lisosomal alfa galactosidasa que ocasiona el depósito intracelular de esfingolípidos, con predilección por el tejido renal, cardiaco, cutáneo, los vasos sanguíneos y el sistema nervioso central y periférico.
Es la segunda enfermedad de depósito más frecuente después de la enfermedad de Gaucher. Su prevalencia oscila entre 1:17.000 y 1:117.000 sin diferencia entre razas, aunque estos datos pueden estar ligeramente subestimados33. En pacientes adultos entre 35 a 40 años de edad, la prevalencia descrita se encuentra entre el 0,5 y el 1%34.
Palecek et al.35 realizaron un screening en 100 hombres con hipertrofia ventricular izquierda inexplicada, encontrando un diagnóstico definitivo de enfermedad de Fabry, hasta en un 4% de estos pacientes, por lo que recomiendan realizar la búsqueda de la entidad en estos grupos poblacionales aún en ausencia de manifestaciones extracardiacas.
La mayoría de pacientes con enfermedad de Fabry conocida, tiene algún grado de compromiso cardiaco. Existe la llamada variante cardiaca de enfermedad de Fabry en la que el corazón puede ser el único órgano o el principalmente afectado36.
Las manifestaciones cardiovasculares de la enfermedad de Fabry incluyen alteraciones en la conducción, arritmias supraventriculares y ventriculares, así como síntomas de falla cardiaca y estadios avanzados que progresan a disfunción sistólica severa del ventrículo izquierdo37,38.
Aunque el diagnóstico definitivo de esta patología requiere diferentes pruebas bioquímicas, estudio genético y en algunos casos biopsia endomiocárdica, las diferentes técnicas de imagen desempeñan un papel importante en el tamizaje y estudio inicial de estos pacientes
El aumento en el espesor del ventrículo izquierdo es la principal característica ecocardiográfica, que compromete todas las paredes, de manera concéntrica y progresiva según avanza la enfermedad. Este engrosamiento de pared obedece al depósito de glucoesfingolípidos que a la vez promueven hipertrofia de la fibra miocárdica y fibrosis intersticial. Se han descrito algunos casos de hipertrofia asimétrica del septum, que se han confundido con miocardiopatía hipertrófica septal asimétrica, incluso con obstrucción dinámica a nivel del tracto de salida del ventrículo izquierdo e insuficiencia mitral secundaria, aunque esta no es una situación muy frecuente en esta entidad39. También puede presentarse aumento en el espesor de los músculos papilares. En un interesante trabajo publicado por Niemann et al.40, se describe cómo el aumento absoluto del área de los músculos papilares, así como de la relación entre el área de los músculos papilares y el área ventricular izquierda trazadas por ecocardiografia 2D en un eje corto, tiene sensibilidad del 75% y especificidad del 86% para enfermedad de Fabry. De esta forma, la presencia de músculos papilares prominentes puede ser un marcador ecocardiográfico útil en el diagnóstico de esta patología (tabla 3).
Características ecocardiográficas de la enfermedad de Fabry
| - Aumento simétrico o asimétrico en el espesor de la pared del ventrículo izquierdo. |
| - Aumento en el espesor de los músculos papilares. |
| - Adelgazamiento del segmento basal de la pared inferolateral. |
| - Apariencia binaria del borde endocárdico |
| - Fracción de eyección normal o disminuida en etapas avanzadas. |
| - Disfunción diastólica. |
| - Aumento en el espesor de la pared del ventrículo derecho y dilatación en etapas avanzadas. |
Otra característica patológica encontrada en algunos pacientes es el adelgazamiento del segmento basal de la pared inferolateral, en relación con la presencia de fibrosis localizada a ese nivel41.
Se ha descrito una apariencia binaria inespecífica del borde endocárdico correspondiente probablemente a la compartimentalización del esfingolípido endomiocárdico generando una apariencia de dos capas42. Sin embargo, dicho hallazgo ha sido muy debatido por otros autores desde su publicación, y no es frecuente encontrarlo en todos los casos.
Estos pacientes pueden cursar con isquemia miocárdica secundaria a disfunción endotelial de las arterias coronarias y a un desequilibrio entre el aporte y la demanda de oxígeno en presencia de un miocardio engrosado, sin que exista una enfermedad aterosclerótica establecida43.
En el 70% de los pacientes con enfermedad de Fabry puede haber hipertrofia ventricular derecha, y en etapas avanzadas, dilatación de dicho ventrículo44.
La fracción de eyección usualmente está preservada y si bien hay evidencia de disfunción diastólica progresiva, el patrón restrictivo es infrecuente45. La caída de la función sistólica ventricular izquierda es un evento tardío.
Otros trabajos han empleado el strain y strain rate para tratar de evaluar tempranamente a estos pacientes en fase preclínica. Si bien no hay un punto de corte para la enfermedad de Fabry definido por las guías actuales de práctica clínica, iniciativas como la de Krämer et al.46 describen cómo valores de strain menores a -12,5% en los segmentos afectados, tienen alta sensibilidad y especificidad para detectar zonas de fibrosis, confirmadas mediante resonancia cardiaca, en comparación con valores superiores a -16,5% en segmentos no patológicos.
Por otra parte, pueden detectarse alteraciones valvulares no significativas. Los hallazgos más reportados han sido insuficienca valvular aórtica leve, mitral y tricúspidea47. Raramente cursan con estenosis valvular aórtica o grados de insuficiencia mayores (moderados a severos).
Respecto al diámetro aórtico, se ha encontrado alta prevalencia de dilatación de la aorta ascendente, especialmente en pacientes masculinos, en la quinta década de la vida48. Sin embargo, el aneurisma es un hallazgo muy infrecuente, así como también lo es el desarrollo de insuficiencia aórtica funcional moderada o severa. No hay reportes de disección aórtica o ruptura aórtica.
La dilatación auricular no es un signo frecuente en la enfermedad de Fabry como sí lo puede llegar a ser en otras entidades como la amiloidosis cardíaca. La dilatación auricular izquierda a menudo es leve o moderada. Tampoco hay referencias acerca de una marcada dilatación auricular derecha49.
En la enfermedad de Fabry, la ecocardiografía desempeña un papel fundamental en su diagnóstico y seguimiento. Es una herramienta fácil y reproducible que permite evaluar la gravedad de ésta enfermedad. Es importante estar familiarizados con los principales hallazgos imagenológicos descritos, para así definir de manera temprana la necesidad de otros métodos diagnósticos que apoyen o confirmen la enfermedad y puedan definir rapidamente la conducta terapéutica.
HemocromatosisSe caracteriza por un depósito excesivo de hierro que puede presentarse en diferentes órganos, y puede ser primaria o secundaria. La primaria o hereditaria es autosómica recesiva y se asocia con una mutación en el gen HFE localizado en el cromosoma 6. Esta mutación al parecer favorece el incremento de la absorción de hierro a nivel intestinal50. Hasta el 10% de la población caucácica en Estados Unidos es heterocigota, y un 0,3-1% homocigota, siendo esta la población en riesgo de manifestar la enfermedad51,52. Los pacientes con la forma hereditaria permanecen asintomáticos por largos periodos de tiempo hasta cuando la cantidad de hierro absorbido supera la capacidad de almacenamiento, y se da el depósito anormal de hierro intracelular en órganos como el hígado, las articulaciones, la tiroides, el páncreas y el corazón53,54.
La forma secundaria se relaciona con diferentes tipos de anemia, transfusiones a repetición y enfermedad hepática crónica.
El depósito de hierro inicialmente es subepicárdico y posteriormente mesial y subendocárdico55. Cuando se supera la capacidad de almacenamiento, el hierro es trasportado al interior de las células en forma de hemosiderina o hierro libre, activando procesos de peroxidación, alterando la permeabilidad de las membranas y finalmente produciendo muerte celular56.
El compromiso miocárdico ocurre hasta en un 15% de los casos y las manistestaciones principales son falla cardiaca, arritmias y trastornos de la conducción57. Estas manifestaciones suelen ocurrir tarde en la evolución de la enfermedad debido a que la acumulación de hierro es mucho más rápida a nivel hepático.
Dentro de los hallazgos ecocardiográficos más relevantes se encuentra la disfunción diastólica que puede ser progresiva hasta llegar a estadios avanzados de fisiología restrictiva. Posteriormente, la remodelación adversa produce adelgazamiento y dilatación del ventrículo izquierdo acompañada de compromiso severo de la función sistólica58–60. Algunos autores han descrito engrosamiento de los músculos papilares y miocardio de aspecto granular similar al que se describe en la amiloidosis cardiaca. El ventrículo derecho también se compromete, especialmente por aumento en el espesor de sus paredes.
El ecocardiograma no permite identificar el depósito de hierro pero es la herramienta de elección en el tamizaje inicial de los pacientes en riesgo, así como también es útil en el seguimiento de estos pacientes.
Disfunción diastólicaLas cardiopatías infiltrativas tienen en común la disfunción diastólica, cuya severidad puede progresar a lo largo del tiempo hasta llegar a presentar fisiología restrictiva en etapas avanzadas.
Se caracteriza por una alteración en el llenado ventricular, con volúmenes de fin de diástole normales o disminuidos. La función sistólica permanece normal en etapas tempranas y los ventrículos presentan un grosor de pared normal o disminuido. Diferentes mecanismos, según la patología, generan marcada rigidez del ventrículo izquierdo con lo cual se produce compromiso progresivo de la función diastólica, se impide el llenado ventricular adecuado y se favorece así el aumento de las presiones de llenado61. En estadios tempranos, puede evidenciarse disfunción diastólica leve, tipo retardo en la relajación. En la medida en que progresa el compromiso ventricular, la distensibilidad del ventrículo disminuye, aumentando las presiones de llenado y el volumen de la aurícula izquierda. En esta fase, la disfunción diastólica se considera moderada y se conoce como tipo II o pseudonormalización62. Finalmente, en estadios avanzados, las presiones de llenado se encuentran severamente aumentadas en presencia de un ventrículo izquierdo muy rígido y un gradiente alto entre la aurícula izquierda y el ventrículo izquierdo al comienzo de la diástole, lo que favorece un llenado temprano con velocidades elevadas (onda E del flujo transmitral), fase que rápidamente se interrumpe debido al aumento acelerado de la presión dentro del ventrículo izquierdo. Igualmente, la función sistólica de la aurícula izquierda se compromete y la contracción atrial se reduce por lo que la onda A del flujo transmitral presenta velocidades disminuidas; todo esto es característico de la disfunción diastólica severa, de tipo restrictivo63. La “fisiología restrictiva” compartida por este grupo de enfermedades en etapas avanzadas, presenta, entonces, las características ecocardiográficas descritas en la tabla 464.
La aurícula izquierda usualmente se encuentra severamente dilatada (> 48ml/m2); con una velocidad del jet de regurgitación tricuspídea que generalmente es> a 2,8 m/s. Cuando se encuentran los anteriores signos de fisiología restrictiva el pronóstico es muy pobre y la mortalidad a un año disminuye de manera significativa65.
FinanciaciónNinguna.
Conflicto de interesesNinguno.