El papel principal de la resonancia magnética en el estudio de las miocardiopatías infiltrativas, se basa en la capacidad que tiene dicha técnica de caracterizar el tejido. Existen secuencias de caracterización tisular que no requieren el uso de contraste, y otras como las secuencias de realce tardío, que mediante la administración de gadolinio han permitido clasificar las miocardiopatías en dos grandes grupos: isquémicas y no isquémicas.
El gadolinio es un agente extracelular, que una vez entra en el torrente sanguíneo, migra rápidamente al espacio extracelular. De esta forma, el aumento del espacio extracelular ocasionado por diferentes causas (fibrosis, muerte celular o depósito de alguna sustancia, proteína amiloide como en el caso de la amiloidosis cardiaca), favorecerá el depósito focal de gadolinio, que a su vez disminuirá el tiempo de T1 (tiempo en el que los protones recuperan su equilibrio, al ser estimulados) y permitirá identificar zonas de mayor intensidad de señal, que contrastan con la señal hipointensa del miocardio sano.
The main role of magnetic resonance in the study of infiltrative cardiomyopathies is based on the capacity that this technique has in characterising tissue. There are characterisation sequences that do not require the use of contrast, and others like delayed enhancement, which by means of administrating gadolinium, have enabled cardiomyopathies to be classified into two large groups: ischaemic and non-ischaemic.
Gadolinium is an extracellular agent that migrates into the extracellular space once it enters the blood stream. In this way, the increase in extracellular space due to different causes (fibrosis, cell death or deposit of any substance, amyloid protein, as in the case of cardiac amyloidosis), will favour the focal deposit of gadolinium, which in turn will decrease the T1 time (time in which the protons recover their equilibrium on being stimulated), and will enable the areas of greater intensity that contrast with the signal to be identified.
La resonancia magnética cardiaca desempeña un papel clave en el estudio de quienes se sospecha tienen amiloidosis, no sólo por su excelente resolución espacial, que facilita la evaluación morfológica (fig. 1), sino por la posibilidad de realizar secuencias de caracterización tisular que permiten identificar tres aspectos importantes: el depósito focal de gadolinio, la prolongación del tiempo de T1 nativo (pre-contraste) y el aumento del volumen extracelular secundario al depósito de la proteína amiloide1.
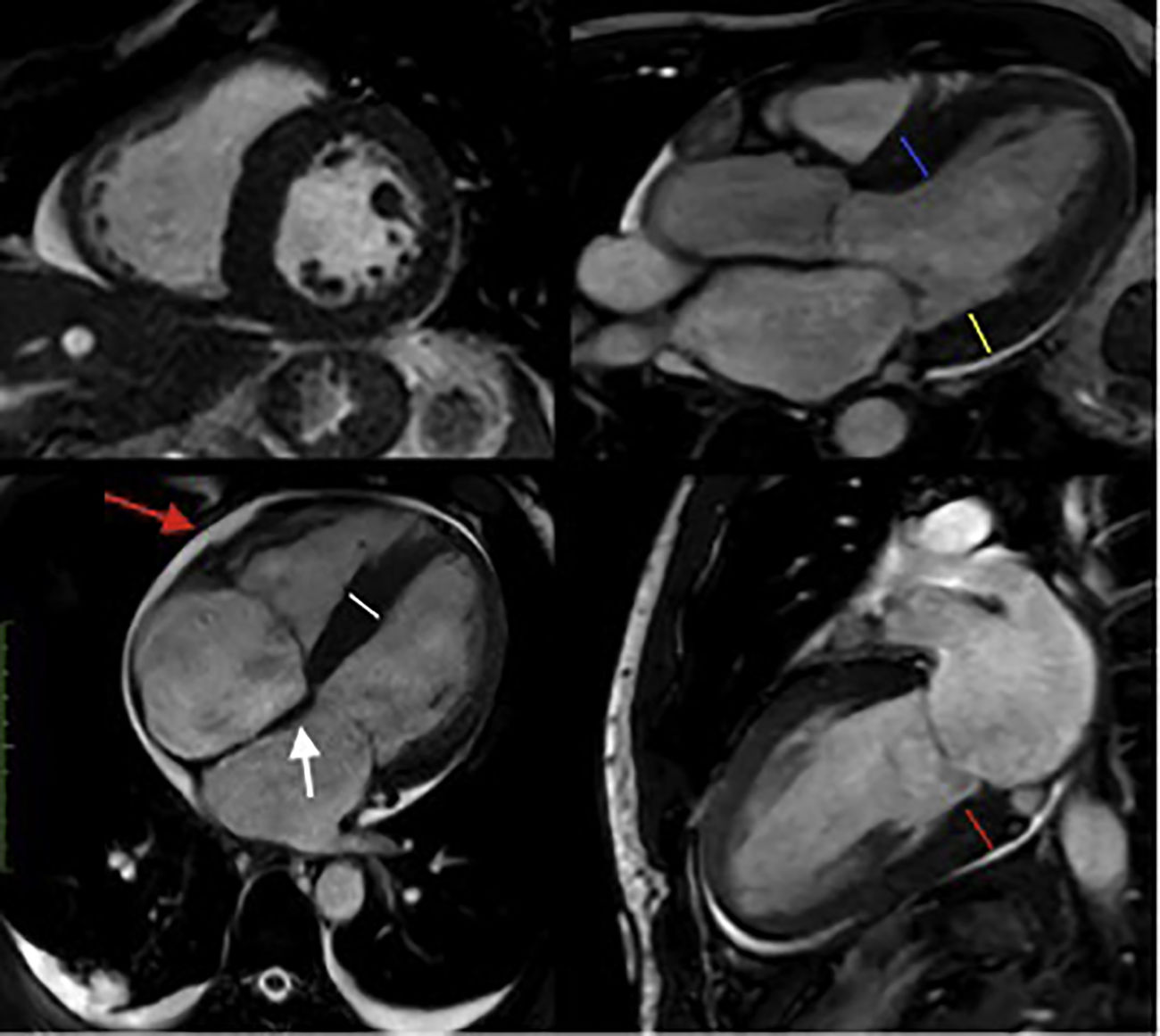
Resonancia magnética cardiaca – Secuencias cine: Aumento en el espesor de las paredes del ventrículo izquierdo (inferoseptal medial (línea blanca): 16mm; anteroseptal basal (línea azul): 15mm; inferolateral basal (línea amarilla): 15mm; inferior basal (línea roja):17mm). Función sistólica limítrofe. FE: 52%. Engrosamiento del septum interauricular (flecha blanca). Dilatación biauricular. Derrame pericárdico leve (flecha roja). FCI – IC.
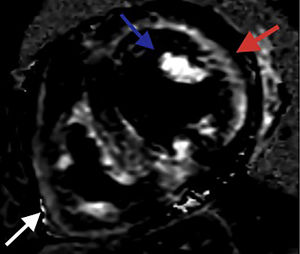
El depósito focal de gadolinio en esta enfermedad, es principalmente subendocárdico difuso, y compromete de manera global todas las paredes del ventrículo izquierdo2,3 (fig. 2), patrón que se ha documentado especialmente en la amiloidosis de cadena ligera. Este depósito de gadolinio ha permitido identificar el compromiso cardiaco hasta en un 47% de los pacientes con amiloidosis sistémica en etapas tempranas, cuando aún el espesor de pared es normal1. Hasta un 90% de los pacientes con amiloidosis por transtiretina (ATTR) presentan un patrón transmural, también global, que sólo se ha documentado en el 37% de los pacientes con amiloidosis AL4 (fig. 3). Este depósito de gadolinio cumple un rol trascendental como predictor de mortalidad a un año5. Se ha descrito depósito focal de gadolinio en el ventrículo derecho, en todos los pacientes con amiloidosis ATTR y en el 72% de los pacientes con amiloidosis AL4; también es frecuente el depósito de gadolinio en la pared auricular. Otro aspecto que caracteriza esta enfermedad y permite diferenciarla de otras que cursan con aumento en el espesor de las paredes, como la miocardiopatía hipertrófica, es la incapacidad de anular la señal del miocardio sano (tabla 1). El importante depósito de amiloide altera la cinética del gadolinio, el cual presenta un lavado muy rápido desde el espacio intravascular sanguíneo hacia el espacio extracelular, dificultando la adquisición e interpretación de las secuencias de realce tardío. La secuencia look locker (secuencia T1 con diferentes tiempos de inversión), 5 minutos posterior a la administración del contraste, permite documentar esta alteración, demostrando cómo la señal del miocardio se torna hiperintensa antes que la señal del pool sanguíneo, lo cual indica secuestro de gadolinio debido a la expansión del espacio extracelular. Adicionalmente, mediante las nuevas técnicas de mapeo T1 se ha logrado obtener el tiempo de T1 nativo que se encuentra prolongado en esta enfermedad, permitiendo diferenciarla de otras miocardiopatías6. Ya que es una técnica que no requiere la administración de gadolinio, tiene un campo muy prometedor en pacientes con contraindicación para recibir este medio de contraste. Por otra parte, los mapas de T1 posterior a la administración de gadolinio han facilitado el cálculo del volumen del espacio extracelular, cuya expansión ocurre incluso antes de evidenciar depósito de gadolinio. La expansión de este espacio extracelular se ha correlacionado directamente con los niveles de BNP, troponina y masa miocárdica, considerándose que puede llegar a ser un indicador de la carga de amiloide a nivel miocárdico7.
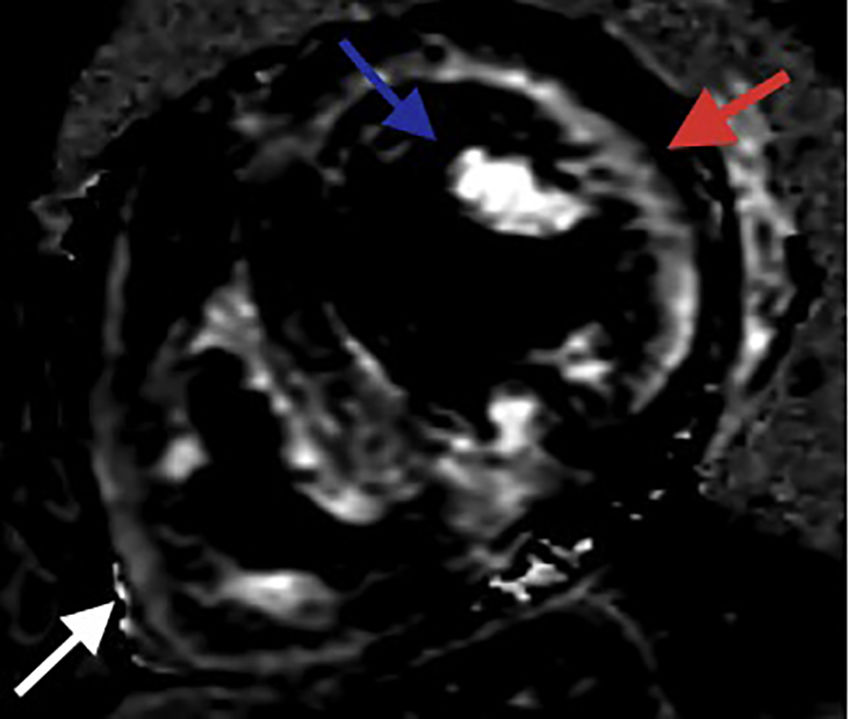
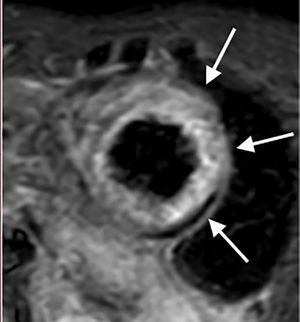
Resonancia magnética cardiaca – Secuencias de realce tardío: Depósito focal de gadolinio subendocárdico comprometiendo los segmentos medios de todas las paredes (flecha roja). Depósito focal de gadolinio comprometiendo los dos músculos papilares (flecha azul). Depósito focal de gadolinio comprometiendo la pared del ventrículo derecho (flecha blanca). FCI – IC.
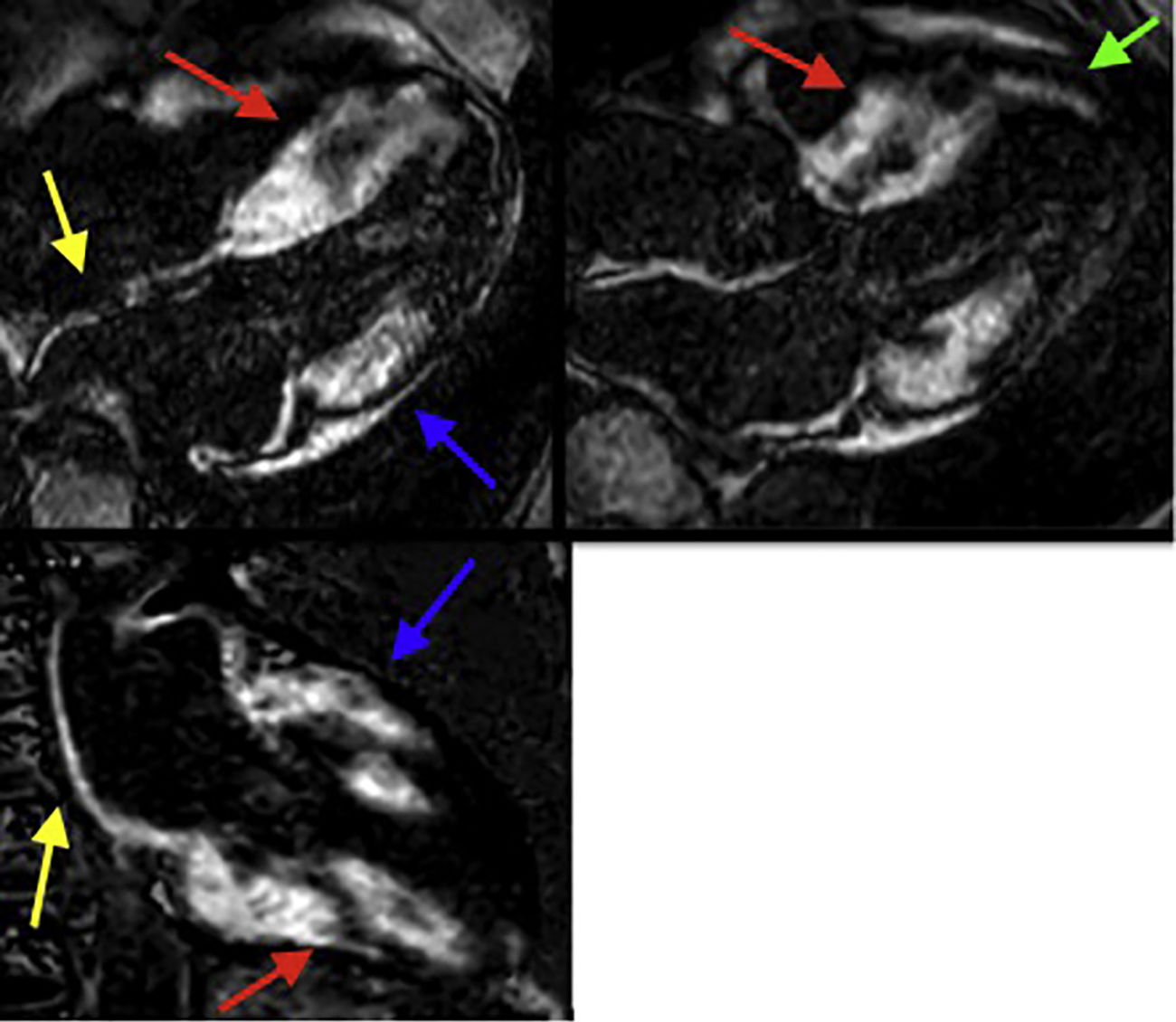
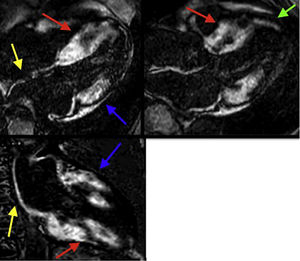
Resonancia magnética cardiaca – Secuencias de realce tardío: Importante depósito focal de gadolinio transmural comprometiendo los segmentos basales y medios del septum y de la pared inferior (flechas rojas), así como los segmentos basales de la pared anterolateral y anterior (flechas azules). Depósito focal de gadolinio subendocárdico a nivel del segmento apical del septum (flecha verde). Depósito focal de gadolinio comprometiendo la pared de la aurícula izquierda y el septum interauricular (flechas amarillas). FCI – IC.
Características de la amiloidosis cardiaca por resonancia magnética
| Alteración en la cinética de gadolinio. |
| Dificultad para anular la señal del miocardio sano. |
| Depósito focal de gadolinio subendocárdico difuso. |
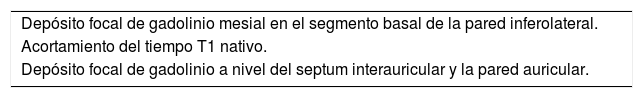
| Depósito focal de gadolinio a nivel del septum interauricular y la pared auricular. |
| Técnica T1 mapeo: aumento del tiempo T1 nativo. Aumento del volumen extracelular. |
Como se aprecia, la resonancia cardiaca debe ser un estudio de primera línea en pacientes con historia clínica o hallazgos ecocardiográficos que sugieran la posibilidad de amiloidosis cardiaca. Su capacidad de caracterizar el tejido e identificar la expansión del espacio extracelular secundario al depósito de amiloide, es su mayor ventaja. Sin embargo, ninguno de los hallazgos mencionados anteriormente es cien por ciento específico, de modo que deberá complementarse con un estudio histológico (biopsia endomiocárdica, de grasa subcutánea, recto, médula o cualquier otro órgano afectado).
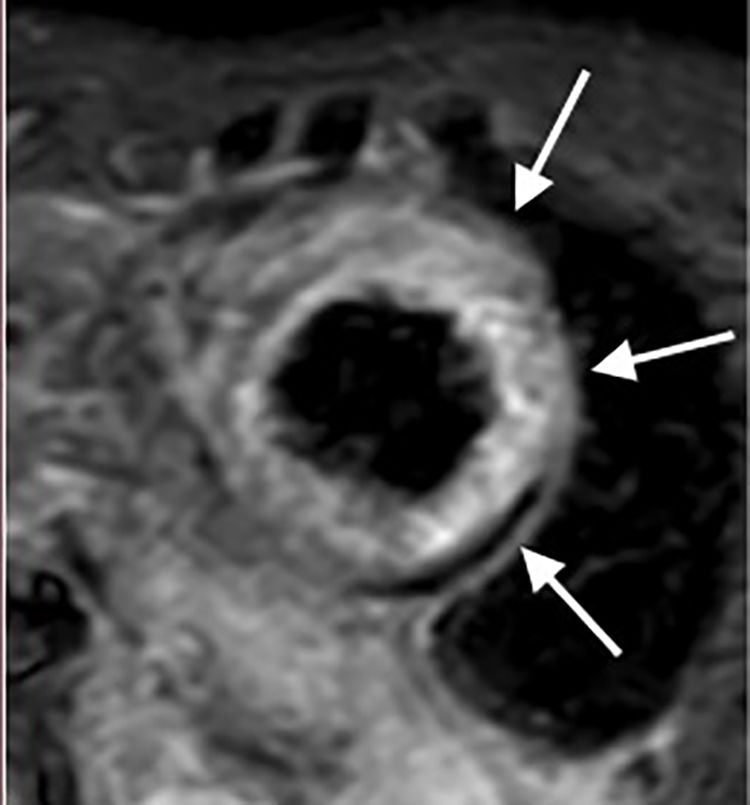
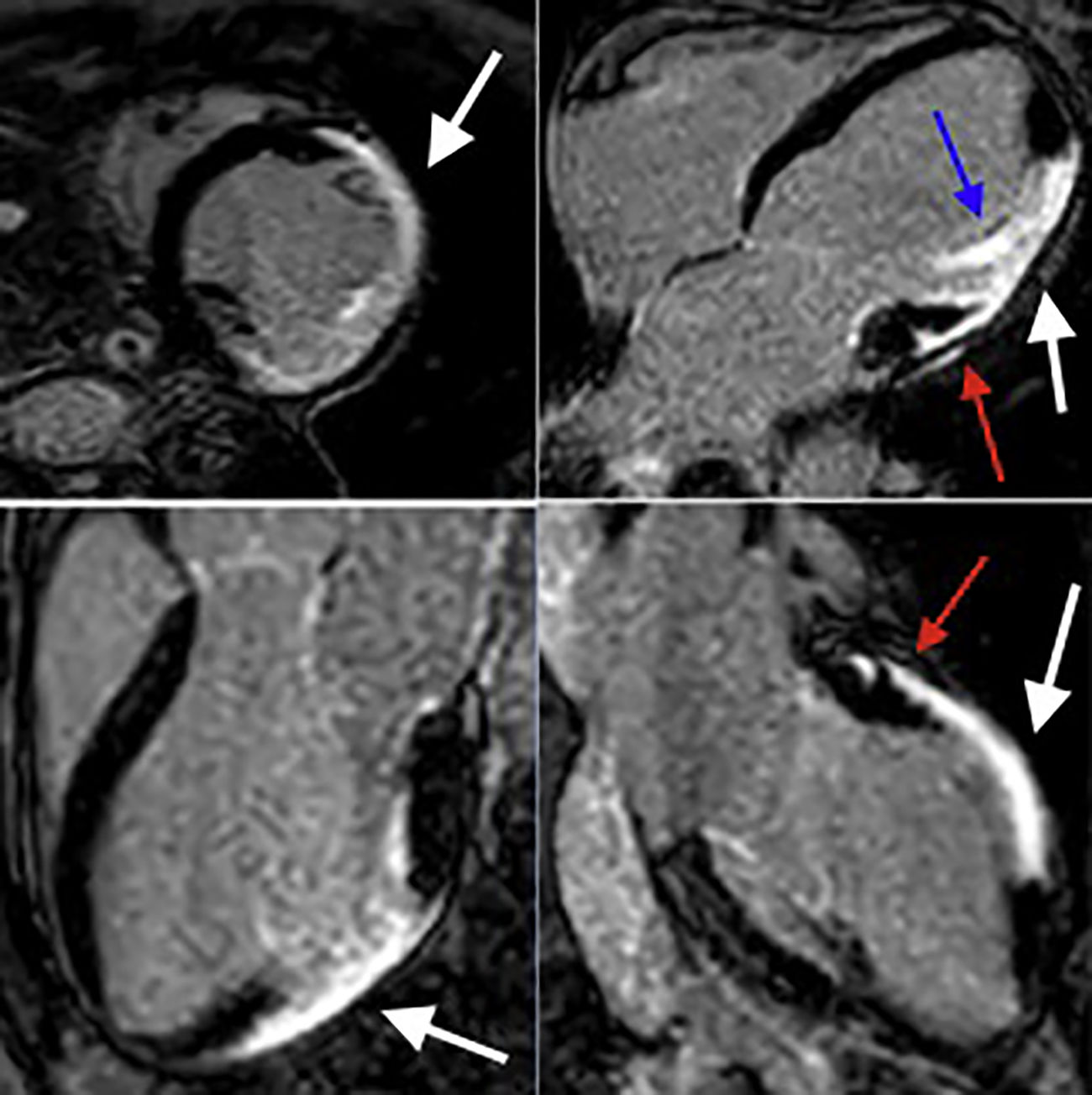
Sarcoidosis cardiacaEl principal atractivo de la resonancia cardiaca como herramienta diagnóstica en sarcoidosis cardiaca es la posibilidad de identificar fibrosis, sin olvidar otras ventajas importantes en esta enfermedad como la identificación de edema miocárdico y por supuesto la evaluación de la función biventricular (tabla 2) (fig. 4A, 4B, 4C, 5, 6). El depósito de gadolinio en pacientes con sarcoidosis puede tener diferentes patrones y no existe ninguno que sea cien por ciento específico; sin embargo, en la mayoría de los casos el compromiso es parcheado mesial o subepicárdico, localizado principalmente en los segmentos basales del septum y de la pared inferolateral8–12; también se ha documentado compromiso de los músculos papilares (fig. 6).
Características de la sarcoidosis cardiaca por resonancia magnética
| Depósito focal de gadolinio mesial o subepicárdico con compromiso de los segmentos basales del septum y la pared inferolateral. |
| Depósito focal de gadolinio en los músculos papilares. |
| Depósito focal de gadolinio con compromiso del ventrículo derecho. |
| Edema miocárdico. |
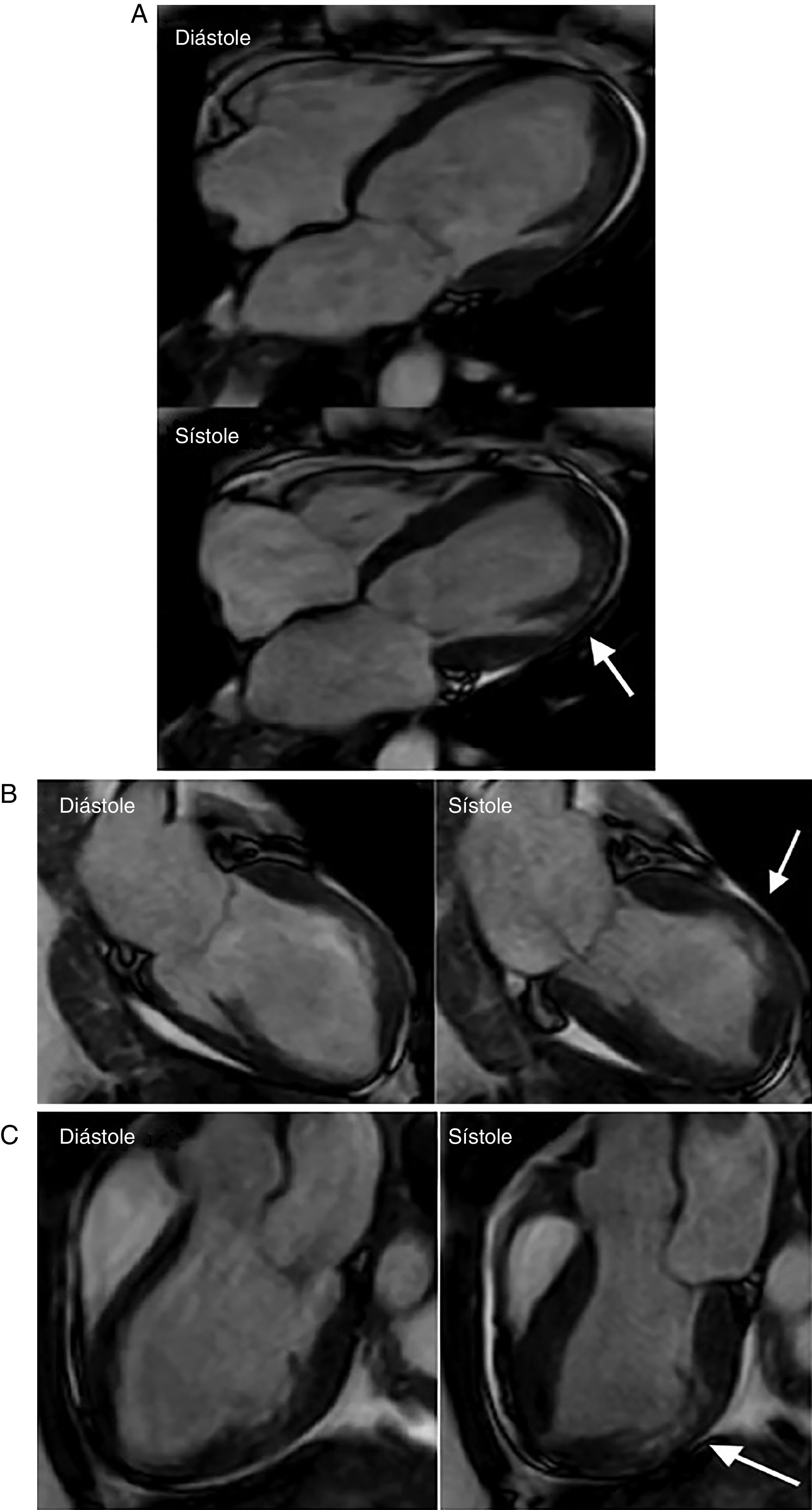
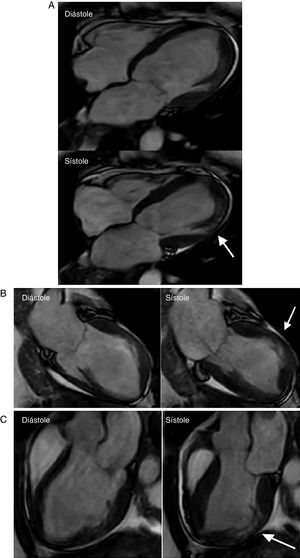
A Resonancia magnética cardiaca – secuencias cine (4 cámaras): Dilatación del ventrículo izquierdo con adelgazamiento y disquinesia del segmento medio de la pared anterolateral (flecha). Hipoquinesia del resto de los segmentos. FE: 25%. FCI – IC. Figura 4B Resonancia magnética cardiaca – secuencias cine (2 cámaras): Dilatación del ventrículo izquierdo con adelgazamiento y disquinesia del segmento medio de la pared anterior (Flecha). Hipoquinesia del resto de los segmentos. FCI – IC. Figura 4C Resonancia magnética cardiaca – secuencias cine (3 cámaras): Dilatación del ventrículo izquierdo con adelgazamiento y disquinesia del segmento medio de la pared inferolateral (flecha). Hipoquinesia del resto de los segmentos. FCI – IC.
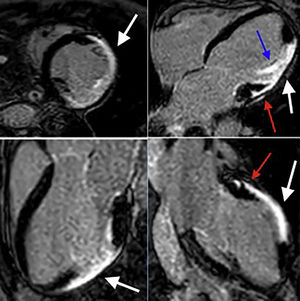
Resonancia magnética cardiaca – secuencias de realce tardío: Depósito focal de gadolinio transmural comprometiendo los segmentos medios de la pared anterior, anterolateral e inferolateral (flechas blancas). Depósito focal de gadolinio subepicárdico a nivel de los segmentos basales de la pared anterior y anterolateral (flechas rojas). Depósito focal de gadolinio comprometiendo el músculo papilar anterolateral (flecha azul). FCI – IC.
La sensibilidad y especificidad del depósito de gadolinio reportadas en los diferentes estudios es del 75 al 95% o más, y del 75 al 85%, respectivamente11,13–15.
Este depósito es secundario a edema miocárdico, infiltración granulomatosa y/o presencia de tejido cicatricial concomitante13,16. El depósito focal de gadolinio es un indicador pronóstico de severidad de la enfermedad y se ha asociado con arritmias ventriculares y mayor posibilidad de eventos adversos como muerte, descarga del cardiodesfibrilador y necesidad de marcapaso17–19.
El ventrículo derecho también puede verse comprometido hasta en un 42% de los pacientes, con evidencia de realce secundario a infiltración granulomatosa de éste20 o sin infiltración pero con disfunción sistólica en pacientes que cursan con sarcoidosis pulmonar.
Recientemente se publicó una revisión sistemática y metaanálisis de pacientes con sospecha o diagnóstico definitivo de sarcoidosis cardiaca en el que se demostró el poder pronóstico del realce tardío y su valor en la estratificación de riesgo. Pacientes con realce tardío tienen mayor riesgo de muerte por cualquier causa y eventos arritmogénicos21.
Estos depósitos de gadolinio han demostrado tener una alta sensibilidad, incluso superior a la sensibilidad de los criterios diagnósticos de la Japanese Ministry of Health and Welfare11,18,19. La identificación de estas zonas de cicatriz ha permitido guiar la biopsia endomiocárdica, que sigue siendo clave para el diagnóstico definitivo22.
Otra ventaja que ofrecen estas secuencias de realce tardío, es la posibilidad de identificar miocardio enfermo cuando aún la enfermedad se encuentra silente y no ha producido compromiso de la función ventricular12,17,23–25.
Otros hallazgos documentados en esta enfermedad son el adelgazamiento de la pared ventricular y la disfunción ventricular con trastornos segmentarios de la contractilidad, que en algunas ocasiones pueden simular una cardiopatía isquémica, con la diferencia que en esta enfermedad el depósito de gadolinio respeta, en la mayoría de los casos, el subendocardio, aunque algunas veces el realce pueda ser transmural. Durante la fase aguda o inflamatoria puede no documentarse adelgazamiento, sino, por el contrario, aumento focal del espesor de la pared. Por tratarse de una enfermedad inflamatoria, la presencia de edema miocárdico apoya el diagnóstico. Dicho edema se identifica mediante las secuencias potenciadas en T2 (STIR) (fig. 5); este expande el espacio extracelular favoreciendo también el depósito de gadolinio. La disminución del área de realce y de su intensidad se ha utilizado para monitorizar la respuesta al tratamiento antiinflamatorio13,26.
En un futuro cercano, las nuevas técnicas de resonancia, como el mapeo T2, tendrán un papel importante en la estimación objetiva de la respuesta al tratamiento, pudiendo equipararse a los estudios de medicina nuclear, con la ventaja adicional de poder evitar los efectos de la radiación ionizante en estos pacientes que usualmente requieren estudios seriados27.
Sin embargo, siempre que se considere realizar un nuevo estudio para el seguimiento de la enfermedad se deberá considerar el riesgo/beneficio del mismo, debido a que se deberán tener en cuenta las alertas recientemente expuestas por la Administración de Alimentos y Medicamentos (FDA) respecto al riesgo de aparición de depósitos de gadolinio intracerebrales en algunos pacientes que requieren múltiples estudios, sin que aún esto sea una razón para contraindicarlo en estos casos. Así mismo, deberán tenerse presentes las ventajas que ofrece el gadolinio macrocíclico para estos pacientes28,29.
Muchos de estos pacientes requerirán implante de marcapaso o cardiodesfibrilador en algún momento de su enfermedad, y aunque esto anteriormente era un inconveniente, el desarrollo de marcapasos y electrodos compatibles con el resonador, así como el desarrollo de protocolos de resonancia que disminuyen los artefactos producidos por estos dispositivos, ha permitido realizar estudios de seguimiento30–32.
Como se ilustra en esta líneas, la ecocardiografía y la resonancia cardiaca son estudios complementarios; sin embargo, un trabajo reciente de Vasileios et al. demostró la superioridad de la resonancia. Pese a que la ecocardiografía tiene un valor predictivo positivo alto (83,9%), su sensibilidad es baja (27,1%). La resonancia cardiaca demostró ser la herramienta diagnóstica más precisa (AUC: 0,984), con una sensibilidad del 96,9% y una especificidad del 100%33.
Enfermedad de FabryEl principal aporte de la resonancia cardiaca en el enfoque diagnóstico de la enfermedad de Fabry está dado por los hallazgos que se han descrito en las secuencias de realce tardío. El depósito de gadolinio que se ha descrito es mesial y compromete principalmente el segmento basal de la pared inferolateral34,35 (tabla 3).
Aunque hay muy pocos estudios de pacientes con Fabry estudiados con resonancia, uno de los más recientes es el publicado en el Journal of Cardiovascular Magnetic Resonance por el grupo de Deva et al.36, quienes documentaron cuatro fenotipos: ausencia de hipertrofia; hipertrofia concéntrica, hipertrofia septal asimétrica e hipertrofia apical. El fenotipo más frecuente fue la hipertrofia ventricular concéntrica asociada con el depósito focal de gadolinio inferolateral ya descrito previamente. Aquellos pacientes con hipertrofia septal asimétrica e hipertrofia apical, presentaron depósito focal de gadolinio a nivel septal y apical, respectivamente. Adicionalmente, demostraron que la severidad de la hipertrofia ventricular estaba asociada con una mayor posibilidad de presentar arritmia ventricular.
El tratamiento con la enzima alfa glucosidasa A recombinante ha logrado disminuir la hipertrofia ventricular y mejorar la función sistólica, de ahí la importancia de diferenciar esta enfermedad de otras causas de hipertrofia ventricular izquierda, especialmente en pacientes jóvenes con hipertrofia ventricular inexplicada37,38.
Finalmente, las nuevas secuencias de mapeo T1 han demostrado su utilidad en esta enfermedad logrando identificar acortamiento del tiempo T1 nativo (sin necesidad de gadolinio), en etapas tempranas de la enfermedad39.
HemocromatosisLa principal ventaja de la resonancia cardiaca en pacientes con sospecha de sobrecarga férrica en el miocardio, es la posibilidad de identificar el depósito de hierro mediante la medida del tiempo de T2*. El depósito de hierro altera la homogeneidad del campo magnético, disminuyendo el tiempo de T2*. En la medida en que el depósito de hierro aumenta, el tiempo de T2* disminuye40–42. Un T2* menor a 20ms, es compatible con un depósito de hierro intramiocárdico significativo. Anderson et al., fueron los primeros en reportar la utilidad de esta secuencia en esta enfermedad43.
El T2* está directamente relacionado con la fracción de eyección y se ha convertido en factor predictor de riesgo, ya que está directamente asociado con falla cardiaca y arritmias44,45. La disfunción sistólica ocurre tarde en la evolución de la enfermedad, pero usualmente es resistente al tratamiento, convirtiéndose en uno de los signos de mal pronóstico46,47.
Otra ventaja importante de la estimación del tiempo de T2*, es su papel en el seguimiento de la respuesta al tratamiento43,48,49.
La monitorización de la respuesta al tratamiento mediante los niveles de hierro hepático y los niveles de ferritina no son adecuados para el seguimiento de la sobrecarga férrica a nivel miocárdico. Si bien el tratamiento con quelantes férricos disminuye rápidamente los niveles séricos y hepáticos, no ocurre igual a nivel miocárdico, debido a que allí la depuración del mismo es mucho más lenta48,50.
La miocardiopatía por sobrecarga de hierro es potencialmente reversible con el tratamiento temprano, sobre todo si se inicia antes de la falla cardiaca manifiesta51. El uso de la resonancia cardiaca y más específicamente la cuantificación del tiempo de T2*, tiene un papel crucial en el diagnóstico temprano y de esa forma en la disminución de la mortalidad asociada al depósito de hierro44,45,49.