La enfermedad de Erdheim-Chester es una histiocitosis celular diferente a la histiocitosis de Langerhans, de origen incierto. Se caracteriza por una implicación multi-orgánica debida a la infiltración de los histiocitos CD68+/CD1a-, en forma de xantogranulomas, que afectan principal y comúnmente a la metáfisis y diáfisis de huesos largos. El diagnóstico se realiza mediante biopsia, donde se revelan histiocitos CD68+/CD1a-, carencia de proteína S, y presencia de gránulos de Birbeck. Se ha subestimado la implicación cardiovascular. Reportamos un caso de un varón de 67 años con la enfermedad de Erdheim-Chester e infarto de miocardio agudo, debido a implicación coronaria, además de enfermedad ósea, vascular, pituitaria y retroperitoneal. Revisamos la literatura relevante y describimos el tratamiento clínico de estos pacientes.
Erdheim-Chester disease is a non-Langerhans cell histiocytosis of uncertain origin. It is characterized by multiorgan involvement due to infiltration of CD68+/CD1a- histiocytes, in the form of xantogranulomas, most commonly affecting the metaphysis and diaphysis of long bones. The diagnosis is made by biopsy showing CD68+/CD1ahistiocytes, lack of S protein and Birbeck granules. Cardiovascular involvement is underestimated. We report a case of a 67 year-old man with Erdheim-Chester disease and acute myocardial infarction due to coronary involvement, in addition to bone, vascular, pituitary and retroperitoneal disease. We review relevant literature and describe the clinical management of these patients.
La enfermedad de Erdheim-Chester (EECh) o histiocitosis de células no Langerhans es un desorden minoritario de etiopatogenia desconocida que se caracteriza por la infiltración xantogranulomatosa por histiocitos espumosos a nivel multisistémico, dando lugar a una gran heterogeneidad clínica. Entre los múltiples órganos afectados se encuentran: el corazón y los vasos sanguíneos, incluyendo las arterias coronarias que irrigan el músculo cardiaco, cuya infiltración puede ser una causa extremadamente rara de infarto agudo de miocardio (IAM)1. Se presenta el caso de un paciente con EECh que sufre un IAM y se realiza una revisión de la literatura que sustenta una discusión posterior sobre los mecanismos etiopatogénicos así como las peculiaridades que se presentan en el manejo terapéutico. Para la búsqueda bibliográfica se utilizó la base de datos Pubmed, seleccionando entre la literatura publicada los artículos más recientes y relevantes con las siguientes palabras: Erdheim Chester, afectación coronaria, afectación cardiaca y vascular, infarto agudo de miocardio, tratamiento, interferón y enfermedad de Erdheim-Chester.
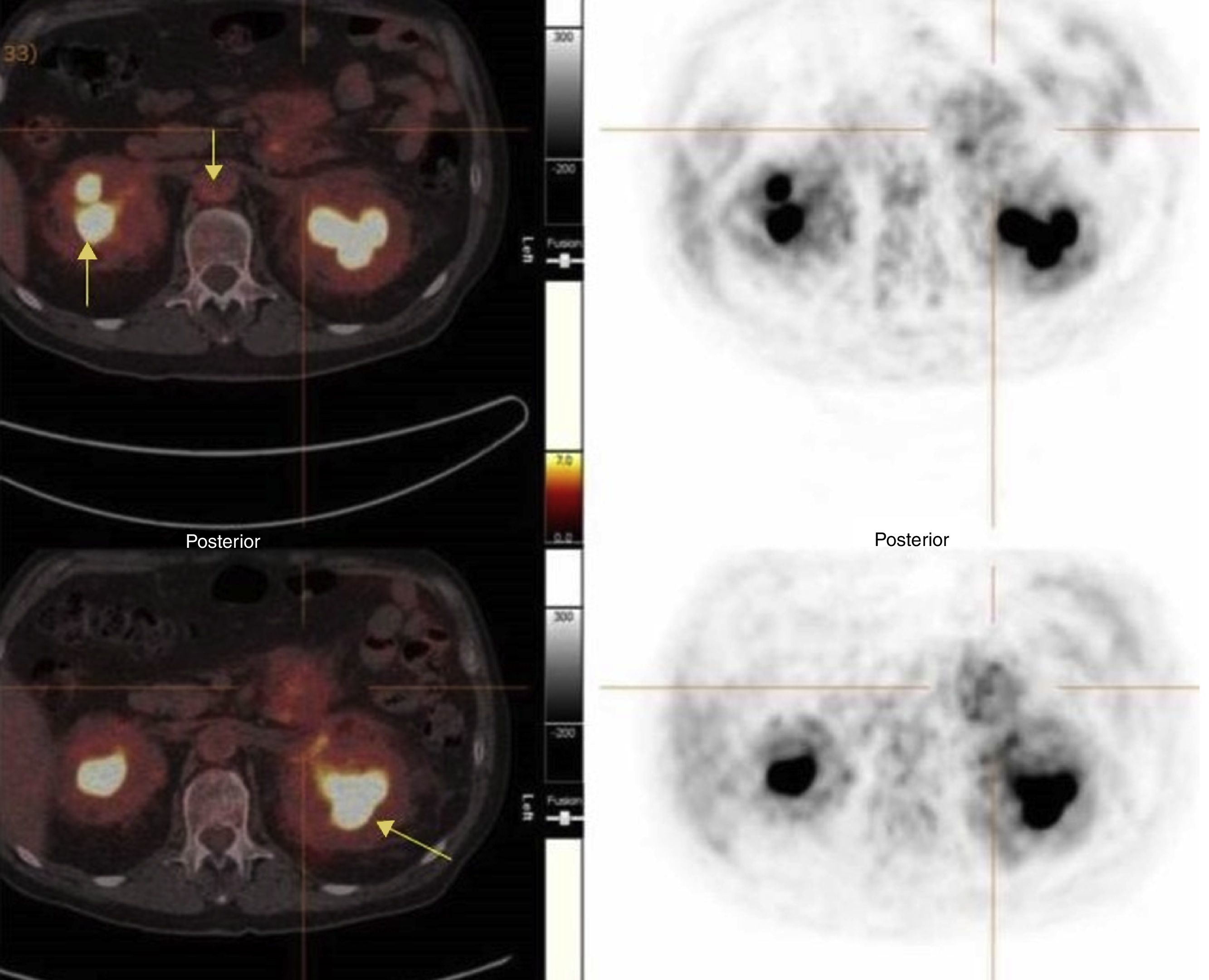
Caso clínicoPresentamos el caso de un varón de 67 años de edad, sin factores de riesgo cardiovascular conocidos con diagnóstico de: EECh con afectación retroperitoneal (fibrosis retroperitoneal y periaortitis), infiltración de los parénquimas renales (“hairy kidney”), estenosis bilateral de las arterias renales, afectación osteoblástica de la diáfisis proximal de huesos largos y diabetes insípida. El diagnóstico se confirmó mediante la anatomía patológica, demostrándose por inmunohistoquímica la clásica positividad para CD68 y la negatividad para CD1a junto con la ausencia de la proteína S100 y los gránulos de Birbeck característicos de la enfermedad. Se documentó la presencia del gen BRAF mutado. En tratamiento, desde hace 16 meses, con el interferón pegilado semanal 180 mcg (dosis acumulada 11,5g), la desmopresina 120 mcg y la prednisona 15mg al día, con dificultad para reducción de la dosis por persistencia de síntomas. A pesar del tratamiento, el paciente continuaba presentado signos de actividad. El último PET-TC de control puso de manifiesto persistencia de afectación perivascular a nivel de la aorta toracoabdominal y el cayado aórtico, la actividad metabólica perirrenal y la lesión mesentérica estables, afectación ósea con discreta respuesta metabólica y aumento de actividad en la hipófisis (fig. 1.
El paciente acudió al servicio de urgencias por dolor centro torácico opresivo, con cortejo vegetativo asociado y disnea a mínimos esfuerzos, habiendo presentado episodios similares de menor intensidad durante los meses previos. En la exploración presentaba: facies cushingoide, TA 170/70mmHg, FC 70 lpm. Se encontraba afebril. Ausencia de disnea. SatO2 99% aire ambiente. Auscultación cardiopulmonar normal, con tonos rítmicos y sin soplos. Ausencia de estertores. El abdomen no mostró hallazgos y no presentaba edemas ni datos de trombosis venosa profunda en miembros inferiores. El electrocardiograma realizado mostró descenso del segmento ST de 1,5mm en las derivaciones V4 a V6, con niveles máximos de troponina T ultrasensible en 147ng/L. La radiografía de tórax realizada no mostró hallazgos. Ante el diagnóstico de SCASEST de riesgo intermedio (TIMI score 4) se realizó una ecocardiografía transtorácica, sin hallazgos patológicos tanto a nivel de las cavidades como de las vávulas cardiacas, presentando una fracción de eyección del ventrículo izquierdo conservada. El cateterismo cardiaco demostró la existencia de un tronco común izquierdo con estenosis del 53% ostial y proximal, la arteria descendente anterior con oclusión de aspecto crónico distal con buen calibre y desarrollo, visible por circulación colateral heterocoronaria, la arteria circunfleja (ACx) con estenosis severa de aspecto agudo proximal y distal, con buen vaso distal y la arteria coronaria derecha (ACD) dominante sin lesiones significativas. Se realizó intervencionismo coronario percutáneo sobre la ACx y el tronco común izquierdo, mediante angioplastia e implante de stents farmacoactivos (2 y 1, respectivamente) y se propuso abordaje de la ADA en segundo tiempo mediante estrategias de abordaje para la oclusión crónica. Al alta estaba asintomático. Se suspendió el tratamiento con el interferón pegilado (180 mcg semanales) por los efectos secundarios a nivel cardiovascular, se mantuvo con la prednisona 15mg al día y la desmopresina 120 mcg al día y se planteó la opción de un nuevo tratamiento. Actualmente el paciente se encuentra a la espera para la aprobación del tratamiento con el vemurafenib.
DiscusiónLa enfermedad de Erdheim Chester (EECh) presenta un espectro clínico muy heterogéneo. Entre las múltiples manifestaciones se destaca la afectación ósea (96%), sobre todo a nivel diafisometafisario de los huesos largos, siendo un rasgo prácticamente patognomónico y un criterio diagnóstico establecido por Haroche y Cols.1. Alrededor de la mitad de los pacientes tiene manifestaciones extraesqueléticas que incluyen: hipotálamo-hipofisarias (diabetes insípida), exoftalmos, fibrosis retroperitoneal, afectación neurológica y/o cardiovascular, siendo la PET-TC una de las pruebas más útiles tanto para el diagnóstico como para el seguimiento2. La afectación del aparato cardiovascular está infraestimada. Cursa en un elevado número de casos de forma asintomática, detectándose mediante TC o RMN de manera incidental. No obstante, junto a la afectación neurológica, es uno de los principales determinantes de la mortalidad en estos pacientes3. En una serie de 178 pacientes descrita por Haroche y Cols., el 40% presentaba afectación cardiaca. Mientras que la fibrosis periaórtica (“coated aorta”) supone la afección vascular más frecuente, el derrame pericárdico es la forma más común de la presentación cardiaca, llegando en ocasiones a condicionar un taponamiento cardiaco. Además, se han descrito formaciones pseudotumorales a nivel de la aurícula derecha, hipertensión renovascular por afectación de las arterias renales y eventos arrítmicos e isquémicos por la infiltración del árbol coronario por la enfermedad4. A pesar de la descripción en la literatura de infiltración coronaria, si revisamos los estudios publicados, los casos descritos de la afectación coronaria en los pacientes con EECh son escasos y algunos se han documentado al realizar la autopsia5. En la serie descrita por Haroche y Cols., se reportaron seis casos (3,37%) de infarto agudo del miocardio (IAM). De éstos, 2 pacientes fallecieron a consecuencia de éste y 5 tenían infiltración coronaria, siendo la edad media de presentación de 60,8 años4. Aunque hay casos descritos de ateroesclerosis temprana en pacientes con EECh, la afectación cardiaca se considera tardía dentro de las manifestaciones clínicas de la enfermedad. Esto hace que se sumen factores de confusión para discernir la etiología de un evento coronario en un paciente con EECh, desde la edad y la mayor tendencia a padecer factores de riesgo cardiovascular conocidos como: la hipertensión arterial o la hiperlipidemia, a la propia infiltración por la enfermedad. El paciente no tenía factores de riesgo cardiovascular pero sí un control subóptimo de la actividad de la enfermedad evidenciado por pruebas de imagen. Si se considera la EECh como una patología inflamatoria y extrapolamos la información presente actualmente acerca del riesgo cardiovascular en otras enfermedades inflamatorias, como el lupus eritematoso sistémico o la artritis reumatoide, vemos una mayor incidencia de la enfermedad cardiovascular en estos pacientes aun en ausencia de FRCV clásicos. Además, se describe una relación entre la cardiopatía isquémica y el uso del interferón, en base a sus conocidos efectos adversos sobre el sistema cardiovascular, así como su papel en el desarrollo de la disfunción endotelial6. No obstante, además, de lo planteado, nosotros proponemos que la causa protagonista a la que atribuimos el desarrollo del evento isquémico es la infiltración coronaria por la enfermedad, en base a la ausencia de FRCV y por tratarse de un paciente con mal control de la actividad inflamatoria. Una de las cuestiones que suscita el caso presentado es el siguiente paso a dar desde el punto de vista del tratamiento, en un paciente al que se le ha retirado el interferón por lo expuesto anteriormente. El interferón es el principal fármaco para combatir la enfermedad. Sin una estimación de tiempo de tratamiento conocida y a unas dosis variables, (entre 3 a 9 millones de unidades tres veces en semana para el inteferón alfa y entre 135-200μg por semana para el interferón pegilado), ha quedado demostrada su función en la regresión sintomática y la mejoría en la supervivencia7. De hecho, una de las indicaciones con el interferón a dosis máximas (≥ 180 mcg/semana del interferón pegilado) es la ausencia de respuesta a las dosis leves en los pacientes con afectación cardiaca y neurológica en contraposición a lo expuesto anteriormente8. Si tenemos en cuenta el posible papel del interferón en favorecer la disfunción endotelial, su actividad como factor proinflamatorio para el desarrollo de la ateroesclerosis y los múltiples efectos secundarios a nivel cardiaco que puede provocar, tales como: arritmias, muerte súbita o acentuación de una cardiopatía isquémica subyacente, nos vemos obligados a plantearnos prescindir de uno de los principales fármacos que poseemos para abordar la enfermedad, decidiéndose la suspensión y búsqueda de una alternativa con garantías.
En la guía de consenso para el manejo de los pacientes con EECh, el interferón sigue siendo el fármaco de primera elección, siendo el resto de tratamientos como la anakinra, alternativas a este9. Se propone el uso del infliximab junto a la cladribina o el imatinib como tratamiento de segunda línea9. A pesar de encontrarse aún en terapia de ensayo, uno de los fármacos más prometedores para el tratamiento de EECh es el vemurafenib. Un inhibidor del gen BRAF en los pacientes con mutación V600E, describiéndose su uso con éxito en la literatura y provocando desde la disminución de la infiltración periaórtica, la resolución de hidronefrosis o la disminución de las lesiones cutáneas10. No obstante, aún quedan por discernir la dosis óptima, el tiempo de tratamiento o los efectos a la larga que puede tener este.
ConclusiónLa enfermedad de EECh es una patología minoritaria con afectación multisistémica y gran heterogeneidad clínica. La afectación cardiaca es uno de los principales condicionantes del pronóstico de estos pacientes, por lo que debemos estar atentos ante cualquier síntoma que oriente a ésta de cara a un manejo diagnóstico-terapéutico precoz, ya que aunque poco frecuente, resulta muy grave. Entre las zonas afectadas se encuentra la vasculatura coronaria, siendo una causa poco frecuente de IAM. El interferón es el fármaco de primera elección, no obstante, existen limitaciones importantes para su uso en este perfil de pacientes con afectación cardiovascular. El vemurafenib se plantea como una opción prometedora en estos casos. A pesar de todo, se necesitan más estudios para el mejor conocimiento de la enfermedad y un abordaje correcto de estos pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.