El síndrome de Kounis es la asociación de síndrome coronario agudo secundario a una reacción de anafilaxis, la cual es producida por mediadores inflamatorios y vasoactivos liberados principalmente por activación y degranulación de mastocitos que actúan en el sistema cardiovascular. Es una patología subdiagnosticada por cuanto no es considerada en los servicios de urgencias y cuidado coronario pues son pocos los registros en la literatura médica. El síndrome de Kounis es producido por diferentes mediadores como medicamentos, medios de contraste, enfermedades alérgicas, mastocitosis, venenos de insectos, etc.; en sí todo lo que conlleve a la activación de mastocitos puede producir el síndrome. Se puede presentar en cualquier grupo etáreo dado que ha sido descrito en niños y adultos. Debido a la falta de estudios clínicos, hasta el momento no hay un consenso acerca del tratamiento de esta patología.
Kounis syndrome is the concurrence of acute coronary syndromes with conditions associated to an anaphylaxis reaction, which is produced by vasoactive and inflammatory mediators, released mostly by activation and degranulation of mast cells that act in the cardiovascular system. It is an underdiagnosed condition, not included in the emergency room services or coronary care, as there are only few registers in medical literature. Kounis syndrome is produced by different mediators, such as drugs, contrast agents, allergic diseases, mastocytosis, insect stings, etc.; anything that could activate mast cells may trigger the syndrome. It can appear in any age group, in fact it has been described in children and adults. Due to the lack of clinical studies, until today there is no consensus on the treatment for this condition.
El síndrome de Kounis se define como un síndrome coronario agudo (que puede ser angina inestable, infarto agudo de miocardio y trombosis del stent), en un contexto de hipersensibilidad, el cual es causado por la liberación de mediadores inflamatorios durante la activación de mastocitos y posterior degranulación de los mismos. Interactúan células inflamatorias en el escenario de alergias, reacción anafiláctica y anafilactoide. Es causado por mediadores inflamatorios tales como histamina, triptasa, productos del ácido araquidónico, factor activador de plaquetas y una variedad de citoquinas y quimiocinas liberadas durante el proceso de activación y degranulación1–4.
La prevalencia de reacciones alérgicas a lo largo de la vida es cercana al 1,6% o mayor. Cualquier medicamento o condición pueden desencadenar una reacción alérgica y esta desencadenar el síndrome de Kounis, si bien son más propensos los pacientes con atopia. El compromiso cardiovascular es poco usual pero cuando se presenta se da en forma de síndrome coronario, arritmias, defectos de conducción y anormalidades no específicas en el electrocardiograma5. En la actualidad la prevalencia mundial del síndrome es desconocida dado que es una patología que poco se sospecha, de ahí que en la mayoría de casos no se diagnostique. La incidencia de anafilaxis con síntomas cardiovasculares asociados es de 8 por 100.000 habitantes en Estados Unidos y Europa6.
Fue descubierto inicialmente por Pfister en los años 50, pero en 1991 Kounis y Zavras lo describieron como un síndrome de angina alérgica que podía llegar a producir infarto de miocardio secundario a una reacción alérgica por penicilina. En 1995, mientras estudiaba especímenes de arterias coronarias de pacientes fallecidos por infarto de miocardio, Kovanen evidenció que en las áreas de erosión o ruptura en la placa aterosclerótica había mayor degranulación del contenido de los mastocitos (200:1) al compararlas con áreas más adyacentes. Hacia 1998 Braunwald demostró que la histamina y los leucotrienos pueden inducir angina vasoespástica. Se conoce además, que este tipo de síndrome coronario puede afectar cualquier grupo etáreo1,7,8. En 2009 Biteker publicó los primeros casos de infarto de miocardio de causa alérgica en niños9.
Conceptos fisiopatológicosLas células inflamatorias principales son los mastocitos; son la piedra angular para que se produzcan reacciones alérgicas. Se derivan de células madre que expresan el marcador CD 34 en la médula ósea, posteriormente gracias al factor de crecimiento de mastocitos se convierten en células maduras para producir reacciones alérgicas inmediatas, mediadas por inmunoglobulina E; pero no es esta única molécula la que puede activar los mastocitos, también las anafilotoxinas (C3a-C5a) conducen a la liberación y degranulación de los mastocitos con la consiguiente salida de mediadores inflamatorios y vasoactivos tanto locales como sistémicos, los cuales al interactuar con otras células como macrófagos y linfocitos T producen el síndrome5,6,10–12.
Se sabe que para que se produzca degranulación debe haber por lo menos 2.000 anticuerpos ligados a receptores en la superficie del mastocito que pueden ser de diferentes especificidades13,14. Cabe tener en cuenta que la activación mediada por IgE, es la que activa estas células. Los macrófagos activan a más macrófagos y pueden intensificar la respuesta para la activación de linfocitos T; la proteína 1ª que es inducible en los macrófagos, puede activar más mastocitos, mientras CD 169 de los macrófagos activa linfocitos CD 8; estas células T median la activación y proliferación de mastocitos y a su vez regulan la actividad de los macrófagos15. Durante los episodios de hipersensibilidad, la degranulación de los mastocitos tiene lugar, y asociado a esto, se da la activación de las plaquetas.
Gran variedad de mediadores inflamatorios almacenados son liberados en forma local y sistémica; estos incluyen la histamina, la cual activa receptores H1 y H2 (los H1 producen vasoconstricción coronaria e incrementan la permeabilidad vascular, en tanto que los H2 incrementan la cronotropía y la inotropía auricular y ventricular y producen vasodilatación coronaria). La interacción de estos dos receptores media la disminución de la presión diastólica, hecho que aumenta la presión de pulso. Igualmente, induce la expresión de factor tisular16 y taquicardia mediada por barorreceptores al disminuir la presión aórtica media. Otra célula relacionada con reacciones de hipersensibilidad e inflamación es el eosinófilo a través de su proteína catiónica eosinofílica17,18. Se ha demostrado que la activación de estas células al igual que la de las plaquetas, induce trombosis del stent19,20.
El factor activador de plaquetas disminuye el flujo coronario, retrasa la conducción atrio-ventricular y produce efectos depresores en el miocardio. En casos de isquemia aguda actúa como señal para la activación de leucocitos y plaquetas, liberación de leucotrienos o como directo vasoconstrictor. Puede contribuir a inestabilidad y ruptura de la placa porque induce agregación plaquetaria y liberación de enzimas líticas por los macrófagos, y tiene una correlación significante con la severidad de la anafilaxis, la cual es mejor que la histamina o la triptasa21–23.
La betatriptasa, que es la enzima activa, es una proteasa que se encuentra en los gránulos de los mastocitos y se libera cuando estas células se degranulan, activan el complemento y las vías de coagulación. Se sabe que la triptasa se encuentra elevada (constituye aproximadamente el 20% de las proteínas almacenadas), al igual que otros mediadores inflamatorios, tanto en síndromes coronarios por hipersensibilidad, como en aquellos causados por los factores de riesgo tradicionales, es decir, de causa no alérgica. En un estudio en Japón se evidenció que los pacientes con angina inestable e infarto de miocardio tenían mayores niveles de triptasa que aquellos con placas de menos del 50%, y que este marcador asociado a las quinasas son predictores de vulnerabilidad de la placa24. El sistema kinina-kalicreína, que produce hipotensión y coagulación intravascular diseminada en casos severos de anafilaxia, ejerce una acción dual en la cascada de coagulación dado que tiene propiedades tanto fibrinolíticas como trombóticas. Como se observa, muchos de estos mediadores poseen una actividad cardiovascular importante; las tres proteasas de los neutrófilos pueden activar metaloproteinasas que degradan la capa de colágeno e inducen erosión de la placa y ruptura.
La quinasa y catepsina D actúan como enzimas para convertir la angiotensina I en angiotensina II como principal sustancia vasoconstrictora25. Los leucotrienos también producen vasoconstricción y su biosíntesis aumenta en la fase aguda de la angina inestable. El tromboxano es un potente mediador de agregación plaquetaria al igual que posee propiedades que producen vasoconstricción.
El corazón puede ser el sitio primario de la reacción anafiláctica, dado que cuando esta ocurre hay vasoconstricción coronaria, fenómeno que conlleva isquemia del miocardio y finalmente disfunción ventricular26,27, reducción del retorno venoso, salida de plasma al espacio intersticial y pérdida de volumen por permeabilidad capilar por lo cual cae el gasto cardiaco y se produce hipoperfusión coronaria y daño miocárdico consecuente. Se ha demostrado que en el corazón de los mamíferos hay gran cantidad de mastocitos en los vasos coronarios, en la capa íntima y en las placas de ateroma. Cada vez hay mayor evidencia a favor que los mastocitos intervienen en la iniciación y progresión de la placa a través de sus mediadores como la histamina. Igualmente desempeñan un papel preponderante en la vulnerabilidad de la placa.
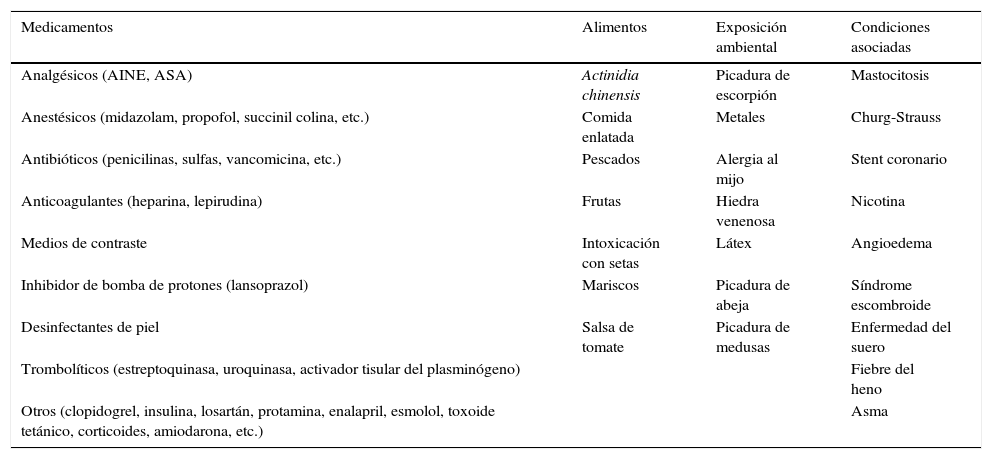
Causas28–31En cuanto a la etiología de la entidad, se ha visto que puede ser multifactorial, e incluir reacciones alérgicas a medicamentos, a stent coronario tanto medicado como no medicado (alergia al níquel), alimentos, sobre todo de mar, anafilaxis inducida por ejercicio, nicotina, enfermedades alérgicas como asma, angioedema, mastocitosis, medios de contraste, etc. En la tabla 1 se enumeran algunas causas del síndrome en mención.
Principales causas del síndrome de Kounis
| Medicamentos | Alimentos | Exposición ambiental | Condiciones asociadas |
|---|---|---|---|
| Analgésicos (AINE, ASA) | Actinidia chinensis | Picadura de escorpión | Mastocitosis |
| Anestésicos (midazolam, propofol, succinil colina, etc.) | Comida enlatada | Metales | Churg-Strauss |
| Antibióticos (penicilinas, sulfas, vancomicina, etc.) | Pescados | Alergia al mijo | Stent coronario |
| Anticoagulantes (heparina, lepirudina) | Frutas | Hiedra venenosa | Nicotina |
| Medios de contraste | Intoxicación con setas | Látex | Angioedema |
| Inhibidor de bomba de protones (lansoprazol) | Mariscos | Picadura de abeja | Síndrome escombroide |
| Desinfectantes de piel | Salsa de tomate | Picadura de medusas | Enfermedad del suero |
| Trombolíticos (estreptoquinasa, uroquinasa, activador tisular del plasminógeno) | Fiebre del heno | ||
| Otros (clopidogrel, insulina, losartán, protamina, enalapril, esmolol, toxoide tetánico, corticoides, amiodarona, etc.) | Asma |
En el estudio de fármaco-vigilancia realizado por Renda, se evidencia que los antibióticos y los antiinflamatorios no esteroides son los principales causantes del síndrome32.
Abordaje diagnósticoLos principales síntomas son dolor torácico (el cual puede ser atípico en comparación con el que ocurre en el síndrome coronario de causa no alérgica), disnea, palpitaciones y síntomas disautonómicos. Se pueden observar manifestaciones de alergia como urticaria, rash, broncoespasmo, y en casos severos hipotensión y alteración en el estado de alerta33. Se debe sospechar en todo paciente que presente clínica de angina asociada a síntomas alérgicos.
Se pueden evidenciar diferentes patrones en el electrocardiograma. En la mayoría de casos reportados se evidencia supradesnivel del ST en la cara anterior e inferior; igualmente puede ser normal o presentar cambios inespecíficos del segmento ST-T34,35, siendo por consiguiente la descendente anterior y la coronaria derecha las arterias más comprometidas. Otras anormalidades incluyen cualquier grado de bloqueo cardiaco y arritmias cardiacas, principalmente fibrilación auricular, ritmo nodal y ectopias ventriculares.
Se han observado tres variantes del síndrome:
Tipo I: arterias coronarias normales, sin factores de riesgo cardiovascular. En la fase aguda se liberan mediadores inflamatorios que pueden inducir espasmo coronario con consecuente cuadro de angina o infarto según se eleven o no los biomarcadores. Se considera que debe presentarse disfunción endotelial y angina microvascular para explicar estos episodios.
Tipo II: enfermedad aterosclerótica preexistente, en la cual la liberación de mediadores inflamatorios en la fase aguda conlleva vasoespasmo coronario, seguido de cuadro de angina o infarto según haya elevación o no de biomarcadores.
Tipo III: trombosis del stent coronario, en el cual al hacerse tinción de Giemsa o hematoxilina-eosina los trombos extraídos demuestran la presencia de eosinófilos y mastocitos1–37.
En todo paciente que presente coronarias sanas en el cateterismo se debe reinterrogar en busca de signos o síntomas de alergia.
En general, los estudios iniciales que se solicitan son los mismos que para cualquier síndrome coronario. Pueden agregarse estudios para confirmar una reacción alérgica: niveles séricos de triptasa (vida media menor a 90 minutos), histamina (vida media menor a 10 minutos), inmunoglobulina E, proteínas del complemento y conteo de eosinófilos. En quienes se sospecha síndrome de Kounis tipo II se debería hacer un ecocardiograma intracoronario para identificar enfermedad coronaria oculta38.
En el estudio de Song Cha, llevado a cabo en Korea del norte, se mostró cómo la medición de troponina I y la ecocardiografía evidenciaban elevación de la primera en el 7,3% de los pacientes, aunque no en un rango al cual generalmente se eleva con síndromes coronarios de causa no alérgica, y por la imagen se observaron trastornos de contractilidad o hipoquinesia generalizada en un pequeño grupo de pacientes. Por tanto, la lesión miocárdica puede expresarse por elevación aislada de troponinas o por la combinación de esta con los cambios en el ecocardiograma transtorácico descritos39. Hoy en día se han iniciado estudios con resonancia cardiaca pero aún no se encuentran estandarizados31. La angiografía coronaria sirve para diferenciar entre el tipo I y el II, y guiar la terapia.
TratamientoNo existen guías de tratamiento para los pacientes con síndrome de Kounis. La mayoría de la información al respecto proviene de reportes o series de casos; sin embargo, la literatura parece estar de acuerdo en que el manejo del síndrome de Kounis en su fase aguda, debe involucrar el tratamiento del síndrome coronario agudo y la supresión de la reacción alérgica.
Esta situación puede tornarse difícil para el médico, ya que los fármacos cuya indicación es clara para cada una de estas entidades por separado, pueden presentar contraindicaciones cuando se usan de manera concomitante, en especial en lo que respecta a la adrenalina40.
OxígenoSe usa de acuerdo con las mismas indicaciones de las guías de práctica clínica para síndrome coronario agudo. Los pacientes en choque anafiláctico requerirán oxígeno al 100% y probable asistencia respiratoria. Su indicación, por tanto, es clara.
NitratosSon vasodilatadores coronarios y periféricos. En pacientes con síndrome de Kounis, no hipotensos, puede ser adecuado su uso debido a que el vasoespasmo coronario es el proceso fisiopatológico de base41.
Antagonistas de los canales de calcioPueden ser considerados como terapia de primera línea en el tratamiento antiisquémico de los pacientes con síndrome de Kounis. Su beneficio está ligado precisamente al proceso fisiopatológico del vasoespasmo comentado anteriormente.
Ácido acetilsalicílicoLas guías de práctica clínica para síndrome coronario agudo, recomiendan su uso en todos los pacientes tan pronto como sea posible en ausencia de contraindicaciones. Sin embargo, este fármaco puede causar reacciones alérgicas, incluidas reacciones anafilactoides o agravar una anafilaxia preexistente. Por tanto, no es claro su empleo en este síndrome. Conviene hacer una evaluación cuidadosa del riesgo-beneficio y sería recomendable ingresar al paciente a una unidad de cuidado coronario para monitorización y detección precoz de síntomas asociados con anafilaxis. En pacientes con el tipo II y alergia a este fármaco, puede emplearse terapia de desensibilización o clopidogrel como alternativa.
Los esteroides y antihistamínicos deben ser la primera línea de manejo para tratar de suprimir la reacción alérgica.
BetabloqueadoresA pesar de los beneficios demostrados en el manejo del síndrome coronario agudo, estos fármacos pueden disminuir los efectos benéficos de la adrenalina (tratamiento de elección en anafilaxia). En pacientes con anafilaxia e hipotensión, que venían tomando betabloqueadores previamente o los recibieron para el síndrome coronario agudo, puede ser útil el empleo de glucagón para antagonizar los efectos del betabloqueador29. Se recomiendan dosis de 1-5mg en adultos o 20-30 mcg/kg en niños, en bolo durante 5 minutos.
OpiáceosMedicamentos como la morfina o la meperidina tienen efecto analgésico y ansiolítico potente. No obstante se requiere precaución ya que pueden agravar la reacción alérgica al generar degranulación inespecífica de mastocitos.
AdrenalinaTratamiento de elección en anafilaxia. La vía de administración recomendada por las guías es la intramuscular en dosis de 0,3-0,5ml de adrenalina 1:1.000 en adultos, pudiendo repetirse a los veinte minutos. Sin embargo, en presencia de síndrome coronario agudo puede agravar la isquemia, prolongar el intervalo QT, inducir vasoespasmo coronario y arritmias, sobre todo en pacientes mayores e hipertensos. No sebe usarse en pacientes con historia de alergia a sulfitos ya que muchos de los preparados de adrenalina contienen metabisulfito sódico42. Así mismo, su uso debe individualizarse de acuerdo con la condición clínica del paciente.
Bloqueantes H1Alternativa en el manejo de anafilaxia. Pueden mejorar síntomas como prurito, rash, urticaria y angioedema. Se administran con precaución y de forma lenta ya que el bolo puede causar hipotensión y compromiso del flujo coronario, por lo que se recomiendan solo en pacientes estables29.
Bloqueantes H2Pueden prevenir el sangrado gastrointestinal. Se recomienda su uso ya que parece ser que la administración conjunta de bloqueantes H1 y H2 tiene mejores resultados que solo el uso de bloqueantes H129.
CorticoidesSon potentes antiinflamatorios e inmunosupresores. Se emplean para las reacciones alérgicas moderadas a severas. Su inicio de acción es de 4 a 6 horas luego de la aplicación intravenosa. En pacientes con angina vasoespástica y evidencia de alergia o síntomas refractarios a dosis elevadas de vasodilatadores han demostrado su eficacia en la resolución de síntomas. Se ha considerado que incrementan el riesgo de ruptura de la pared ventricular en el infarto de miocardio, pero hasta el momento no hay pruebas contundentes que lo demuestren, así que parece seguro su uso. Son más útiles para tratar episodios recurrentes o prolongados que para episodios agudos de anafilaxis43. Sin embargo se necesitan más estudios44,45.
Reposición de volumen intravascularLa expansión de volumen en un cuadro de anafilaxia es importante, toda vez que en esta entidad hay un gran porcentaje de desplazamiento del volumen intravascular hacia el intersticio, que causa hipovolemia y hemoconcentración. Sin embargo, ante síndrome de Kounis, su uso puede desencadenar disfunción ventricular izquierda y aumentar rápidamente la presión de fin de diástole, de modo que en casos en los que se administren grandes cantidades de líquidos, se podría llegar a producir edema pulmonar y falla ventilatoria. Por consiguiente, estos pacientes deben ser trasladados a una unidad de cuidado intensivo para monitorización29.
Estabilizadores de mastocitos (cromoglicato sódico, ketotifeno)Debido a que la activación de los mastocitos es el mecanismo primario del síndrome de Kounis, estos fármacos podrían aliviar las reacciones alérgicas y disminuir los fenómenos trombóticos. Sin embargo, su eficacia y potencia son cuestionables46.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.