Al sistema serotoninérgico se lo ha implicado en la regulación del estado de ánimo y en la conducta alimentaria, por lo que el gen del transportador de serotonina (SLC6A4) es un buen candidato para el desarrollo de los trastornos de la conducta alimentaria (TCA). La mayoría de los estudios genéticos en los TCA se han centrado principalmente en un polimorfismo, el denominado 5-HTTLPR del gen SLC6A4.
ObjetivoRealizar una revisión de los estudios de asociación entre el 5-HTTLPR y los TCA, como anorexia nerviosa, bulimia nerviosa y trastornos alimentarios no especificados.
MétodoSe realizó una búsqueda en MEDLINE, ISI y PubMed de las palabras clave «transportador de serotonina» y «TCA».
ConclusionesSegún la revisión de 37 artículos originales, la variante S del 5-HTTLPR es un factor de riesgo de anorexia nerviosa. Además, se encontró asociación entre el alelo S y el índice de masa corporal, impulsividad, ansiedad, depresión y el tiempo de evolución en TCA. Sin embargo, en bulimia nerviosa no se reporta asociación con las variantes del 5-HTTLPR.
The serotoninergic system has been implicated in mood and appetite regulation, and the serotonin transporter gene (SLC6A4) is a commonly studied candidate gene for eating disorders. However, most studies have focused on a single polymorphism (5-HTTLPR) in SLC6A4.
ObjectiveWe present the studies published on the association between eating disorders (ED) and 5-HTTLPR polymorphism in anorexia nervosa (AN), bulimia nervosa (BN), and eating disorders not otherwise specified (EDNOS).
MethodSearch of databases: MEDLINE, ISI, and PubMed for SLC6A4 and ED.
ConclusionsFrom a review of 37 original articles, it was suggested that carriers of S allele is a risk factor for eating disorders, especially for AN. However, BN did not show any association. Also, BMI, impulsivity, anxiety, depression, and age of onset have been associated with S allele in ED patients.
Los trastornos de la ingesta y los trastornos de la conducta alimentaria (TCA) se definen como afecciones en que los patrones de consumo de alimentos se ven muy alterados y frecuentemente tienen consecuencias graves en el estado de salud física y mental de quienes los padecen. Los TCA se dividen principalmente en: anorexia nerviosa (AN), bulimia nerviosa (BN) y trastorno por atracón (TA). Cuando los elementos sintomáticos no son suficientes para integrar los diagnósticos mencionados, se incluyen como trastornos de la conducta alimentaria no especificados (TANE). La AN se caracteriza por el miedo intenso de los pacientes a ganar peso o a convertirse en obesos y la alteración de la percepción del peso o la silueta corporales; se dividen en dos subtipos: el restrictivo (ANR) y el compulsivo/purgativo (ANCP). La BN se caracteriza por episodios de atracones en que se ingieren cantidades abundantes de comida y se experimenta paralelamente la sensación de pérdida del control; estos episodios se siguen de conductas compensatorias, a diferencia del TA, en el que se producen atracones en ausencia de conductas compensatorias1.
Según la encuesta nacional de epidemiología psiquiátrica en México, la población mayor de 18 años mostró una prevalencia de BN del 0,6% de los varones y el 1,8% de las mujeres2. Estudios en Estados Unidos y Europa reportan que el riesgo de sufrir AN es de un 0,5-1%; el de BN, de un 1-2% en poblaciones jóvenes, y el de TANE, de un 4,1-5,17%3–5. En la ciudad de México, se ha observado que las mujeres presentan un riesgo del 2,8% y que ha habido un incremento de este padecimiento en los últimos años6. Hasta la fecha, se desconoce la causa etiológica de estos trastornos; sin embargo, se ha propuesto que son multifactoriales, y en su desarrollo participan factores sociales, psicológicos y biológicos. Entre los factores biológicos, se han descrito alteraciones de las funciones fisiológicas y mecanismos encargados de la ingesta alimentaria, tales como el sistema serotoninérgico.
Serotonina y los TCALa serotonina es una amina aromática7, la cual en humanos se sintetiza básicamente en dos zonas: central, en los núcleos localizados en el tallo cerebral, y periférica, en el sistema gastrointestinal. En el sistema nervioso central, la serotonina regula procesos de los ciclos sueño-vigilia, el apetito y la saciedad, la manifestación de náusea, la ansiedad, las emociones y los estados depresivos y de agresividad8. En áreas periféricas participa en procesos fisiológicos como el control de la motilidad, la secreción y la absorción epitelial intestinal9. Según los estudios realizados en modelos animales, la serotonina, inyectada tanto periférica como centralmente en el núcleo paraventricular, suprime la ingesta de alimentos10, por lo cual se ha señalado que se encuentra involucrado en los trastornos alimentarios. Del mismo modo, los estudios clínicos también han respaldado la hipótesis sobre una disfunción en el sistema serotoninérgico, a partir de datos que muestran la eficacia de los inhibidores selectivos de la recaptación de serotonina (ISRS) en el tratamiento de los TCA11–15, los datos que reportan alteraciones en la concentración plasmática de serotonina que podría estar relacionada con la sensación de saciedad, el control de los impulsos y el estado de ánimo de los pacientes con TCA. La disponibilidad de serotonina es clave en la regulación de la respuesta serotoninérgica en cualquier órgano; esta respuesta culmina cuando el 5-HT es extraído del espacio intersticial gracias a su recaptación por un transportador selectivo expresado en neuronas o en las plaquetas, llamado transportador de serotonina. El papel fundamental del transportador de serotonina en la actividad serotoninérgica ha causado que sea una molécula muy estudiada.
El transportador de serotonina (5-HTT)Se encarga del trasporte activo de serotonina al interior de la neurona; en el cerebro está situado en la membrana presináptica de las terminales nerviosas como las dendríticas y los núcleos de rafe en la base del cerebro. Esta molécula produce la eliminación y el reciclaje de la serotonina liberada tras la estimulación neuronal, por lo que tiene un papel principal en la regulación homeostática de la magnitud, la duración y la distribución espacial de las señales que alcanzan los receptores serotoninérgicos16.
El transportador de serotonina es codificado por el gen SLC6A4, el cual se localiza en el cromosoma 17q11.1-q1217. El gen consta de 14 exones que se extienden a lo largo de 31 kb y codifica una proteína de 630 aminoácidos18,19. Se han identificado diversos polimorfismos, de los cuales el más estudiado es uno funcional situado en la región promotora, una región rica en guanina y citocina denominada 5-HTTLPR (serotonin transporter linked polymorphic region). Esta se caracteriza por la inserción/deleción de un fragmento de 44 pb que presenta dos variantes alélicas, una larga (large [L]) y una corta (short [S])20. Estudios de transfección en células linfoblastoides han reportado que portadores de la variante L presentan un aumento de la actividad transcripcional y captación basal de 5-HT in vitro, en comparación con las células portadoras de la variante S del 5-HTTLPR21,22. Por lo anterior, se ha indicado que dicho polimorfismo tiene la propiedad de modular la capacidad de recaptar serotonina, por lo que podría estar asociada con las alteraciones reportadas en pacientes con TCA.
Estudios de asociación en TCALos estudios de asociación genética se utilizan ampliamente al abordar el estudio de las enfermedades complejas. Entre otras ventajas que tiene esta metodología, son menos costosos, es más fácil obtener las muestras de comparación y se puede detectar genes con un efecto pequeño en la enfermedad. En los estudios de asociación se eligen genes con base en su posible papel dentro de la enfermedad y se los denomina «genes candidatos». En los estudios de asociación existen dos principales tipos de diseño: de casos y controles y estudios basados en familias (tríos: padres y paciente)23,24. En los estudios de casos y controles, se comparan las frecuencias alélicas entre el grupo de pacientes y el grupo de controles sanos. En los estudios de asociación basada en familias, es una prueba del desequilibrio de la transmisión (TDT), y se analiza la transmisión del alelo de riesgo de los padres al sujeto afectado, lo que elimina la posibilidad de falsas asociaciones por problemas de estratificación poblacional.
Dado el papel que desempeña el transportador de serotonina en la modulación de la conducta alimentaria, en este trabajo se realizó una revisión de los estudios genéticos sobre el 5-HTTLPR y los TCA reportados hasta la fecha.
MétodosSe realizó una revisión sistemática de los estudios de asociación entre el gen SLC6A4 y los TCA durante el periodo 1997-2012 de las páginas oficiales de MEDLINE, ISI y PubMed, usando la combinación de las palabras: eating disorders, 5-HTTLPR, EDNOS, AN, BN, SLC6A4, association, case-control, family association study, short allele, long allele, serotonin, trait, phenotypes.
La revisión de los artículos se hizo de acuerdo con los siguientes criterios de inclusión: a) artículos que utilizaran como metodología estudios de asociación; b) que tuvieran el diagnóstico principal de TCA según el DMS vigente; c) que contaran con resultados genéticos del 5-HTTLPR; d) que fueran artículos originales, y e) artículos escritos en inglés y español publicados en revistas indexadas.
Los criterios de exclusión fueron: a) que no tuviera el diagnóstico principal de TCA, y b) no presentara resultados del 5-HTTLPR.
Los autores de esta revisión leyeron y seleccionaron todos los artículos, tomando en cuenta el impacto de sus contribuciones al campo de estudio y su accesibilidad. Se seleccionó un total de 61 artículos, correspondientes a 20 artículos de revisión, 4 capítulos de libros y 37 reportes de investigación original.
ResultadosUna vez recopilada la información, se muestran los resultados según el tipo de metodología utilizada en los estudios. Principalmente se presentan los de asociación basada en familias y de casos y controles en TCA; se incluyó en menor relevancia los estudios farmacogenéticos y metanálisis.
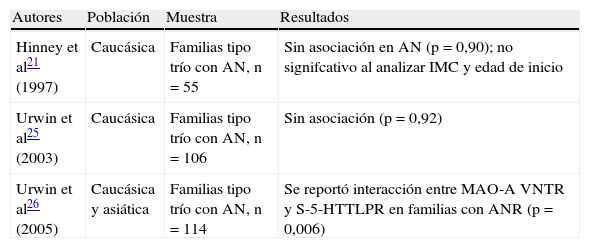
Se encontraron tres estudios realizados en AN que utilizaron la metodología de asociación basada en familias21,25,26 y solo un trabajo reportó mayor transmisión del alelo S en familias con ANR (tabla 1). No se encontraron artículos de investigación en estudios de asociación en BN y el 5-HTTLPR.
Estudios de asociación basados en familias entre el 5-HTTLPR y los trastornos de la conducta alimentaria
| Autores | Población | Muestra | Resultados |
| Hinney et al21 (1997) | Caucásica | Familias tipo trío con AN, n=55 | Sin asociación en AN (p=0,90); no signifcativo al analizar IMC y edad de inicio |
| Urwin et al25 (2003) | Caucásica | Familias tipo trío con AN, n=106 | Sin asociación (p=0,92) |
| Urwin et al26 (2005) | Caucásica y asiática | Familias tipo trío con AN, n=114 | Se reportó interacción entre MAO-A VNTR y S-5-HTTLPR en familias con ANR (p=0,006) |
AN: anorexia nervisa; ANR: AN restrictiva; IMC: índice de masa corporal.
Con respecto a los estudios de casos y controles realizados entre 5-HTTLPR y AN, se ha reportado asociación positiva con el polimorfismo 5-HTTLPR; estos estudios indican que el gen SLC6A4 podría estar asociado con la etiología de la AN27,28; otros hallazgos no reportan asociación entre las variantes del 5-HTTLPR y la AN29,30. Por lo anterior, se ha señalado que otros genes del sistema serotoninérgico podrían ejercer influencia en los síntomas de los pacientes con TCA31.
El primer estudio que observó asociación significativa entre la variante S y la BN fue en población caucásica, y halló que los pacientes portadores de dos copias del alelo corto presentan un riesgo de BN 7 veces mayor32. En otro estudio, además del 5-HTTLPR, se analizó el variable number tandem repeat (VNTR) del intrón 2 en pacientes con BN y antecedentes de AN33. Sin embargo, otros encontraron asociación con la variante L en el subtipo BNP y TCA34,35, y en otros estudios realizados en población asiática y caucásica, no se reportó asociación con ninguna de las variantes del 5-HTTLPR y BN28,36,37 (tabla 2).
Estudios de asociación de casos y controles entre el 5-HTTLPR y los trastornos de la conducta alimentaria
| Autores | Población | Muestra | Resultados |
| Fumeron et al27 (2001) | Caucásicos | AN, n=67; controles, n=148 | Asociación del S por genotipos (p=0,027) y alelos (p=0,024) |
| Mashuita et al28 (2004) | Asiática | AN, n=77; BN, n=118; controles, n=290 | Asociación por genotipos y alelos (p=0,02 y p=0,005) |
| Sundaramurthy et al29 (2000) | Caucásica | AN, n=138; controles, n=90 | Mayor frecuencia de S (p=0,128) |
| Rybakowski et al30 (2006) | Caucásica | AN, n=132; controles, n=93 | Sin asociación con 5HTTLPR |
| Kiezebrink et al31 (2010) | Caucásica | AN, n=226; controles, n=678 | No se encontró diferencia signficativa (p>0,05) |
| Di Bella et al32 (2000) | Caucásica | AN, n=112; BN, n=50; controles, n=120 | Asociación por genotipos y alelos con S en BN (p=0,0001 y p=0,001); no se encontraron en equilibrio HW |
| Lauzurica et al33 (2003) | Caucásica | BN, n=102; controles, n=99 | Asociación con el haplotipo SS-10/12 (p=0,02) |
| Monteleone et al34 (2006) | Caucásica | BN, n=125; controles, n=94 | Asociación con el alelo L (p=0,01) |
| Steiger et al35 (2009) | Caucásica | AN, n=17; BN, n=108; TANE, n=60 | Asociación entre genotipo LL (p=0,028) y síndrome bulímico |
| De Luca et al36 (2003) | Caucásica | BN, n=127; controles, n=127 | Sin significación (p>0,05) en ambas poblaciones |
| Akkermann et al37 (2010) | Caucásica | BN, n=8; BED, n=10; TANE, n=21 | Sin significación por diagnóstico; los portadores de S presentaban mayor calificación en la subescala bulimia del EDI-2 (p=0,03) |
AN: anorexia nerviosa; BN: bulimia nervisa; EDI-2: inventario de trastornos alimentarios versión 2; HW: Hardy-Weinberg; TANE: trastornos alimentarios no especificados.
Estudios farmacogenéticos en TCA han mostrado que los portadores del alelo S en BN tienen mayor probabilidad de no obtener buena respuesta al tratamiento con los inhibidores selectivos de la recaptación de serotonina (ISRS)38; otro estudio reportó que los portadores de la variante S-5HTTLPR presentaban bajas concentracioanes de paroxetina medida en sangre de pacientes con BN39. Asimismo se reportó que los sujetos con BN y TANE 3 y 4 y portadores del alelo S presentaban una reducción de la frecuencia de purgas y episodios de atracones a los 8 meses de tratamiento con ISRS40. Sin embargo, otro grupo no reporta asociación entre las variantes del 5-HTTLPR y la respuesta al tratamiento con cuatro tipos de ISRS41. Los autores de una revisión indican que los pacientes con AN no respondedores al tratamiento con ISRS están asociados con la variante S del 5HTTLPR42.
El 5-HTTLPR se ha asociado con algunas características clínicas de pacientes con AN y BN; por ejemplo, se ha mostrado asociación entre tener la variante S, el índice de masa corporal (IMC)27,34,38 y la edad de inicio del trastorno28; respecto a características psicopatológicas y de personalidad, se reportó una mayor calificación en evitación del daño del Inventario de Temperamento y Carácter (ITC) de Cloninger, abuso de sustancias34,43,47, pulsión por la delgadez, bulimia, perfeccionismo e insatisfacción corporal del Inventario de Trastornos Alimentarios (EDI-2)35,46,49, historia de abuso sexual35,44,45,48, ansiedad y depresión33,34,40,53, apego inseguro y rasgos de trastorno límite de personalidad (TLP)39, conductas de atracón y purgas38 y conductas impulsivas40,50–52.
Los estudios de interacción gen-ambiente, como el que se realizó en gemelos dicigóticos con AN y la interacción del polimorfismo 5-HTTLPR, han reportado asociación entre la interacción de un medio ambiente no compartido (problemas personales) y la variante S-HTTLPR54; otro estudio reportó interacción entre la variante S y un apego inseguro en pacientes con BN que presentaban antecedentes de abuso físico y sexual durante la infancia55. En otro estudio se reportó asociación de interacción en pacientes con TCA entre conductas de automutilación e intentos suicidas y la variante L-5HTTLPR56. En dos estudios se reportó asociación entre la variante S y una mayor gravedad de síntomas depresivos y conductas bulímicas en adolescentes evaluados durante un periodo de 6 meses57,58.
Recientemente se han realizado tres metanálisis de los estudios de asociación entre el 5-HTTLPR y los TCA, y ha hallado asociación entre la variante S y la AN59–61. El tercer metanálisis fue entre el 5-HTTLPR y la BN, pero reportó incongruencias en los resultados con BN; el autor señala que falta realizar más estudios de BN con muestras de mayor tamaño para obtener resultados coherentes.
ConclusionesLa literatura revisada indica que el polimorfismo 5-HTTLPR tiene la propiedad de modular la capacidad de recaptar serotonina, por lo que podría estar asociado con las alteraciones en pacientes con TCA.
Cinco estudios de asociación indican que la variante S-5HTTLPR se encuentra asociada con la etiología de la AN. Sin embargo, hay incongruencias entre los estudios realizados en BN: un estudio reportó asociación con la variante S y dos estudios encontraron asociación con la variante L. Según estos resultados, se señala que el 5-HTTLPR no se encuentra asociado a BN; pero resulta importante analizarlo en otras poblaciones con BN para llegar a alguna conclusión. Además, resulta importante que se analicen otras variantes del gen para tener un panorama más completo sobre el papel del SLC6A4 en el desarrollo de los TCA.
Con respecto a los estudios de asociación entre rasgos psicopatológicos y la variante S, son más firmes los resultados relacionados con impulsividad, bulimia, pulsión por la delgadez, depresión, ansiedad y evitación del daño en pacientes con BN, lo cual indicaría que dicha variante podría estar participando como un gen modulador de esos tipos de síntomas y no directamente en la etiología del trastorno.
Implicaciones de los estudios de asociaciónEste tipo de estudios proporciona información sobre marcadores genéticos relacionados con el riesgo de padecer la enfermedad, que explica un pequeño porcentaje de la hererabilidad atribuida a los TCA. Lo anterior no quiere decir que sus hallazgos no puedan ser útiles, ya que proporcionan información para comprender los mecanismos presentes en el desarrollo de la enfermedad o generar nuevas hipótesis sobre su origen.
Con el avance en las tecnologías de genotipificación a gran escala y el aumento en el número de polimorfismos analizados, los estudios del genoma completo (genome-wide association studies [GWAS]) que permiten analizar sistemáticamente la mayor parte de la variabilidad común de cada muestra resultan particularmente útiles para el estudio genético de las enfermedades psiquiátricas, cuya fisiopatología todavía no se conoce.
Identificando genes de riesgo asociados a endofenotipos en los TCA, se podrá encontrar información sobre sistemas neurales específicos, asociados con los diversos patrones de comportamiento de los pacientes dentro del espectro patológico de los TCA.
Direcciones futurasExiste una estrategia complementaria a los estudios de asociación, la identificación de variantes raras de susceptibilidad a enfermedades comunes62,63. En este tipo de estrategia se propone identificar mutaciones o variantes poco comunes (frecuencia<1%), identificadas en familias o casos concretos, que podrían ser origen de la susceptibilidad a enfermedades complejas como los TCA. Este tipo de estrategia permitirá identificar variantes raras que pudieran estar interactuando con las variantes comunes como el 5-HTTLPR y tener efecto en la manifestación de los TCA.
En los próximos estudios de asociación se deberá obtener tamaños muestrales más grandes, evitar problemas de estratificación poblacional e incluir diversos polimorfismos de cada gen con el propósito de evitar falsos positivos y que los resultados sean más consistentes. Con tamaños de muestra más grandes, participando en consorcios multicéntricos en TCA, se podrá identificar marcadores genéticos de riesgo de TCA que sean informativos en diferentes etnias.
Estos hallazgos no solo permitirían establecer un diagnóstico genético más adecuado, sino que pueden proporcionar un mejor asesoramiento genético y también abren prometedoras perspectivas para un tratamiento más individualizado de los TCA.
FinanciaciónEl presente estudio fue financiado por el Instituto Científico Pfizer 2006, México; CONACyT Proyecto 52272; financiamiento a proyectos de investigación del INPRF, y ICyTDF Proyecto DGC-279-2008.
Conflicto de interesesLos autores del presente trabajo declaramos no tener conflictos de intereses.