Determinar cuándo está indicado emplear un antipsicótico de depósito, y cuál es el más efectivo y seguro, en pacientes con esquizofrenia en la fase de mantenimiento del tratamiento.
MétodoSe elaboró una guía de práctica clínica bajo los lineamientos de la Guía Metodológica del Ministerio de Salud y Protección Social para identificar, sintetizar, evaluar la evidencia y formular recomendaciones respecto al manejo y seguimiento de los pacientes adultos con diagnóstico de esquizofrenia. Se adoptó y actualizó la evidencia de la guía NICE 82, que contestaba la pregunta acá planteada. Se presentó la evidencia y su graduación al grupo desarrollador de la guía (GDG) para la formulación de las recomendaciones siguiendo la metodología propuesta por el abordaje GRADE.
ResultadosLa revisión de la literatura muestra que la calidad evidencia es moderada a baja y que en muchos casos los hallazgos no son concluyentes. Se utilizaron 8 artículos de los resultados de las búsquedas. El riesgo de recaídas fue menor con risperidona de depósito y palmitato de paliperidona al compararlos frente a placebo. Para el riesgo de hospitalizaciones, la comparación de Antipsicóticos de depósito (APD) frente a AP orales, el resultado no es concluyente. De forma global los AP de segunda generación de depósito tuvieron menor riesgo de descontinuación al compararlos con placebo. Los AP de segunda generación presentan mayor riesgo de Síndromes extrapiramidales frente a placebo, lo mismo que con el uso de antiparkinsonianos. La comparación de AP de segunda generación IM frente a placebo mostró un aumento de riesgo de los primeros a ganar peso.
ConclusiónSe recomienda el uso de antipsicóticos de depósito en la fase de mantenimiento del paciente adulto con diagnóstico de esquizofrenia si no hay adherencia al tratamiento con antipsicóticos orales y cuando el paciente los prefiera. No se recomienda usar antipsicóticos de depósito en la fase aguda de la esquizofrenia en adultos.
To determine the indications of long-acting antipsychotic injection and what its effectiveness and safety in adult patients with schizophrenia during the treatment maintenance phase.
MethodsA clinical practice guideline was elaborated under the parameters of the Methodological Guide of the Ministerio de Salud y Protección Social to identify, synthesize and evaluate the evidence and make recommendations about the treatment and follow-up of adult patients with schizophrenia. The evidence of NICE guide 82 was adopted and updated. The evidence was presented to the Guideline Developing Group and recommendations, employing the GRADE system, were produced.
ResultsThe literature review shows that the evidence has moderate to low quality. 8 articles were used. The risk of relapse was lower with depot risperidone and paliperidone palmitate when compared with placebo. For the risk of hospitalizations comparing depot antipsychotics (APD) versus oral AP, the result is inconclusive. Globally the second-generation APD had a lower risk of discontinuation when compared with placebo. The second generation AP had higher risk of extrapyramidal syndromes than placebo, as in the use of antiparkinsonian. The comparison of second-generation AP injections versus placebo showed an increased risk of early weight gain.
ConclusionThe use of depot antipsychotics in the maintenance phase of adult patients diagnosed with schizophrenia is recommended if there is no adherence to oral antipsychotics as the patient's preference. It is not recommended depot antipsychotics in the acute phase of schizophrenia in adults.
La esquizofrenia es una enfermedad crónica caracterizada por períodos de exacerbación y remisión que se inicia generalmente en la adolescencia. Uno de los pilares del tratamiento son los antipsicóticos (AP), que se usan a largo plazo para evitar las recaídas y re hospitalizaciones. Sin embargo, uno de los mayores problemas en el tratamiento de estos pacientes es la escasa adherencia a los AP orales que en la mayoría de los casos no alcanzan el 50%1–3. Para superar esta dificultad se han utilizado técnicas de psicoeducación4 y acompañamiento. En la década de 1960 se empezaron a producir formulaciones de larga acción conocidas como Antipsicóticos de depósito (APD).
Los APD son una forma farmacéutica de algunos de los AP conocidos para uso por vía IM, que se aplican cada dos a cuatro semanas. Los APD de primera generación son esteres formados a partir de ácidos grasos de cadena larga (palmitato, decanoato, pamoato); en esta forma el compuesto es suspendido en aceite vegetal, generalmente de sésamo. Los APD de segunda generación son suspensiones acuosas y utilizan sistemas farmacéuticos diferentes, por ejemplo, encapsulado del medicamento en un polímero biodegradable, uso de microesferas de liberación extendida o tecnología de nanocristales5.
El uso de los APD varía bastante de acuerdo con los países y pueden estar entre un 20% y un 30%6. La evidencia de si los APD aumentan la adherencia y disminuyen las recaídas y rehospitalizaciones no es consistente3,7–9. Hay estudios que muestran que los APD pueden aumentar la tasa de adherencia en pacientes con esquizofrenia7,10, pero el aumento de adherencia no necesariamente se refleja en una disminución significativa de las tasas de recaída o rehospitalización en el largo plazo9. Por otra parte, es importante tener en cuenta que los APD pueden tener efectos secundarios tales como complicaciones en el sitio de inyección: dolor, sangrado, hematoma, nódulos transitorios, y efectos extrapiramidales más prolongados, especialmente disquinesia tardía. A lo anterior debemos agregarle, que el manejo de algunos efectos secundarios puede ser un reto, dado que después de aplicado el AP, no es posible ni disminuir la dosis ni suspender su acción.
Al comparar los APD de primera y segunda generación, no hay diferencias en términos de eficacia, pero sí al parecer, en menores efectos secundarios con los de segunda generación7.
Actualmente, aunque los APD se recomiendan para el tratamiento de pacientes con pobre adherencia al tratamiento3,8, y en una menor proporción de casos por preferencia del paciente o su familia, no hay una tendencia o preferencia clara por parte de los pacientes y personal de salud a usar APD en vez de los AP por vía oral o como primera línea de tratamiento11.
Ante las controversias planteadas sobre su efectividad e indicaciones, es relevante evaluar cuál es la evidencia que soportaría una recomendación sobre el uso particular de los APD para el tratamiento de los adultos con esquizofrenia en la fase de mantenimiento. Para tal fin se formularon las siguientes preguntas para el desarrollo de las recomendaciones: ¿Para los pacientes con esquizofrenia en la fase de mantenimiento (poscrisis o estabilización y estable) cuándo está indicado emplear un antipsicótico de depósito? ¿Para los pacientes con esquizofrenia en la fase de mantenimiento (poscrisis o estabilización y estable) cuál es el antipsicótico de depósito más efectivo y seguro?
MetodologíaPara la realización de la GPC se utilizaron los pasos propuestos en el documento Guía Metodológica para la elaboración de Guías de Práctica Clínica en el Sistema General de Seguridad Social en Salud colombiano. La metodología detallada de la elaboración de la guía se encuentra en el documento completo disponible la página web del Ministerio de Salud y Protección Social (http://www.minsalud.gov.co)12.
Para el desarrollo de las recomendaciones basadas en la evidencia sobre el Manejo de pacientes adultos con esquizofrenia en fase de mantenimiento con antipsicóticos de depósito se elaboró un protocolo de revisión sistemática de la literatura que se detalla a continuación.
Búsqueda y selección de la literaturaSe realizó un proceso general de búsqueda de guías de práctica clínica sobre la evaluación y el tratamiento del adulto con diagnóstico de esquizofrenia. El proceso incluyó una búsqueda exhaustiva en diferentes fuentes de guías, una tamización y una evaluación de calidad. Para el desarrollo de la guía completa se tomó como base la guías NICE 8213. Para esta pregunta clínica se realizó una búsqueda sistemática de la literatura para identificar estudios que actualizaran la búsqueda de evidencia realizada por la guía fuente y que identificó las publicaciones relevantes hasta agosto de 2013.
Se consultaron las bases de datos de PubMed, EMBASE, Cochrane y LILACS. Se buscaron revisiones sistemáticas y metaanálisis, pero no se realizaron búsquedas posteriores de ECA, porque las revisiones sistemáticas estaban actualizadas y se realizó una selección pareada de los títulos para apreciar críticamente. Se incluyeron revisiones sistemáticas y metaanálisis en inglés, español, francés.
Los criterios de inclusión fueron estudios de pacientes mayores de 18 años con diagnóstico de esquizofrenia y otros trastornos psicóticos (esquizoafectivo o esquizofreniforme) combinados. Pacientes que recibieron tratamiento con los siguientes APD: Haloperidol decanoato, flufenazina decanoato, palmitato de pipotiazina, risperidona de liberación prolongada, palmitato de paliperidona. Se compararon los APD frente a AP orales o placebo y entre ellos.
Los desenlaces críticos fueron: Recurrencias o recaídas, Recuperación, Hospitalizaciones, Funcionamiento social, Estatus ocupacional, Suicidio, Efectos adversos.
No se incluyeron estudios de pacientes tratados con APD para Trastorno afectivo bipolar, delirium, demencia, trastornos amnésicos cognitivos o trastornos mentales secundarios, mujeres embarazadas, Esquizofrenia de inicio muy tardío (mayores de 65 años). Igualmente se descartaron artículos que trataran específicamente sobre esquizofrenia y consumo de sustancias.
Evaluación y selección de estudios individualesUna vez seleccionados los estudios relevantes, teniendo en cuenta los criterios de inclusión descritos anteriormente, cada documento fue sometido a una evaluación del riesgo de sesgo utilizando el instrumento SIGN de apreciación crítica14. Dicha evaluación fue realizada por dos evaluadores de manera independiente, y los desacuerdos fueron resueltos por consenso o por un tercer revisor. Solamente fueron incluidos los estudios con calificaciones de “aceptable” o “alta calidad”.
Evaluación de la calidad de la evidencia y formulación de recomendacionesUna vez se seleccionaron los artículos que deberían ser incluidos para basar la formulación de las recomendaciones, se dio paso a la síntesis de la información y a la consolidación del cuerpo de la evidencia disponible para cada uno de los desenlaces considerados como críticos por el grupo desarrollador (GDG); posteriormente, se pasó a evaluar la calidad de la evidencia para cada desenlace utilizando para esto el abordaje GRADE, y teniendo en cuenta los siguientes criterios: Diseño del estudio y riesgo de sesgo, inconsistencia, presencia de evidencia indirecta, imprecisión en los estimativos y sesgo de publicación15.
La evidencia fue presentada en una reunión al GDG, en conjunto con un borrador de las recomendaciones. Las cuales fueron definidas y graduadas en fortaleza a partir de las siguientes consideraciones: calidad de la evidencia, balance entre beneficios y riesgos, consumo de recursos y valores y preferencias de los pacientes (el grupo contaba con delegados de Asociación Colombiana de Personas con Esquizofrenia y sus Familiares). En caso de no contar con evidencia se establecieron las recomendaciones y su fortaleza por consenso.
Para facilitar la lectura del artículo e interpretación de las recomendaciones, se utilizarán las siguientes convenciones:
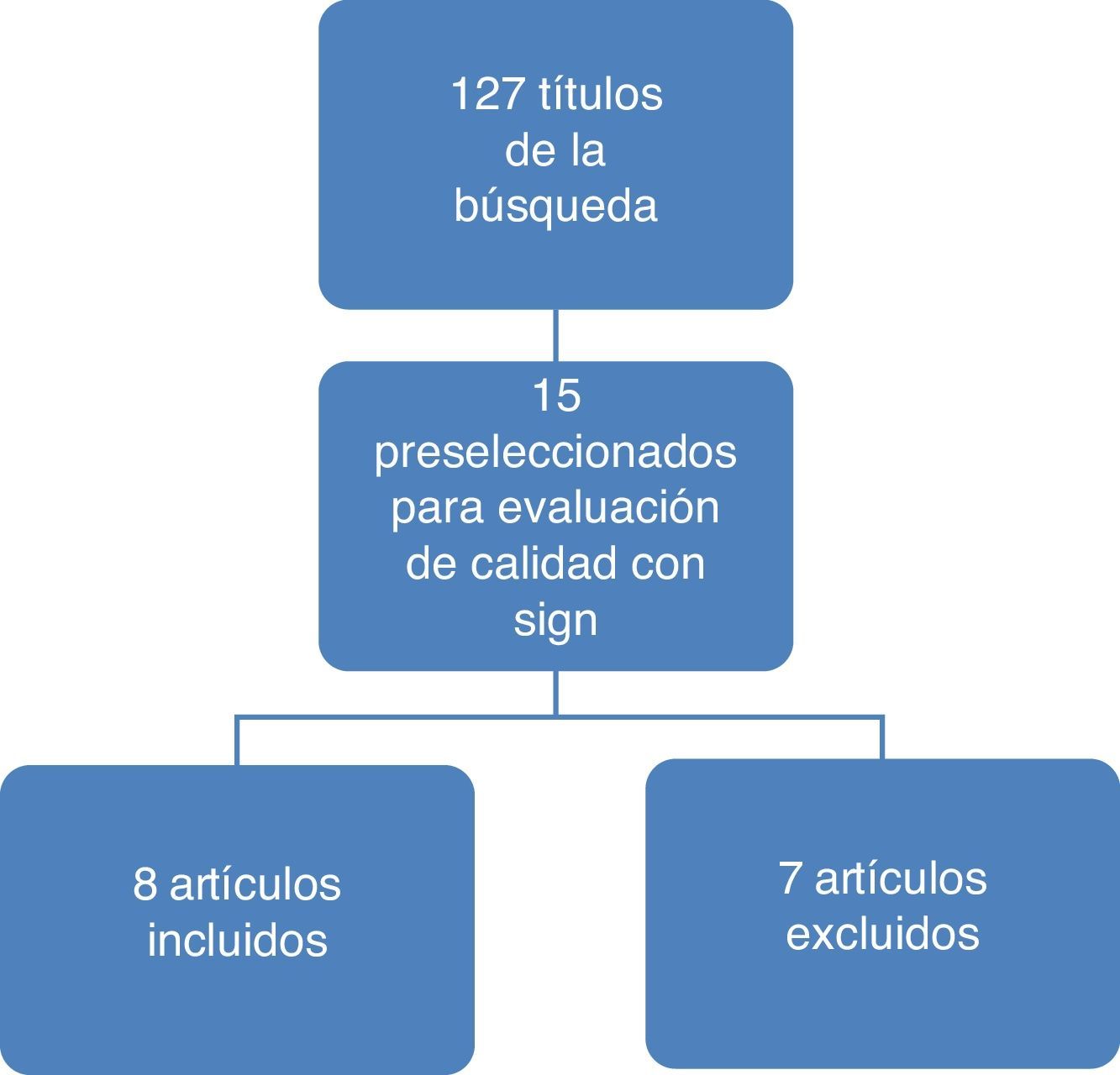
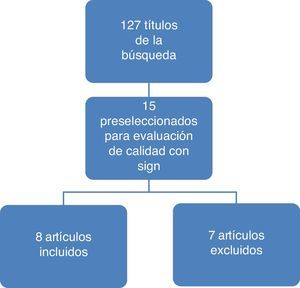
ResultadosEn la figura 1 se ilustran los resultados del proceso de búsqueda y selección de los estudios para actualizar el cuerpo de la evidencia que sirvió de base para la formulación de recomendaciones. El detalle de los artículos incluidos y excluidos puede ser consultado en el documento completo de la guía en la página del Ministerio de Salud y Protección Social (gpc.minsalud.gov.co)16.
Se muestran los hallazgos de la evidencia encontrada posterior a las búsquedas de los desenlaces incluidos en las alternativas. Las tablas de resúmenes de la evidencia se presentarán para las comparaciones de los APD frente a placebo, frente a los AP frente y entre ellos.
No se encontró evidencia para los desenlaces de funcionamiento social y estatus ocupacional con estas intervenciones.
RecaídasEste desenlace presentaba diferentes tipos de mediciones para definir “recaída”: exacerbación de alucinaciones17, reaparición de síntomas18, recurrencia de síntomas psicóticos19 y empeoramiento de los síntomas20.
El tiempo de seguimiento fue variable según los estudios, pero en general se tomaba como recaída a mediano plazo aquella que ocurriera entre seis meses y un año posterior al inicio de tratamiento y a largo plazo aquellas por encima de doce meses17,18.
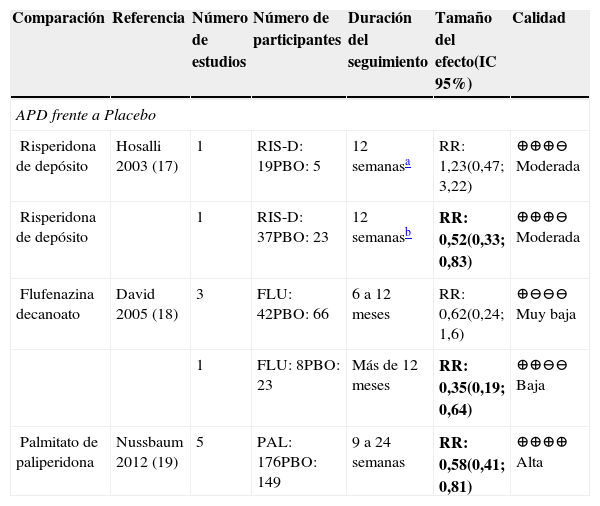
APD frente a placeboEl riesgo de recaídas fue menor con risperidona de depósito y palmitato de paliperidona al compararlos frente a placebo17,19. La calidad de la evidencia para estas comparaciones fue moderada y alta, respectivamente. Con una baja calidad de la evidencia se encontró que la flufenazina era mejor que el placebo a largo plazo para la prevención de recaídas, pero a mediano plazo el resultado no fue concluyente18. En la tabla 1 se presentan las comparaciones de los APD frente a placebo para el desenlace recaídas.
Resumen de la evidencia sobre recaídas en las comparaciones contra placebo
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| APD frente a Placebo | ||||||
| Risperidona de depósito | Hosalli 2003 (17) | 1 | RIS-D: 19PBO: 5 | 12 semanasa | RR: 1,23(0,47; 3,22) | ⊕⊕⊕⊖ Moderada |
| Risperidona de depósito | 1 | RIS-D: 37PBO: 23 | 12 semanasb | RR: 0,52(0,33; 0,83) | ⊕⊕⊕⊖ Moderada | |
| Flufenazina decanoato | David 2005 (18) | 3 | FLU: 42PBO: 66 | 6 a 12 meses | RR: 0,62(0,24; 1,6) | ⊕⊖⊖⊖ Muy baja |
| 1 | FLU: 8PBO: 23 | Más de 12 meses | RR: 0,35(0,19; 0,64) | ⊕⊕⊖⊖ Baja | ||
| Palmitato de paliperidona | Nussbaum 2012 (19) | 5 | PAL: 176PBO: 149 | 9 a 24 semanas | RR: 0,58(0,41; 0,81) | ⊕⊕⊕⊕ Alta |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. RIS-D: risperidona depósito; PBO: placebo; FLU: flufenazina; PAL: paliperidona.
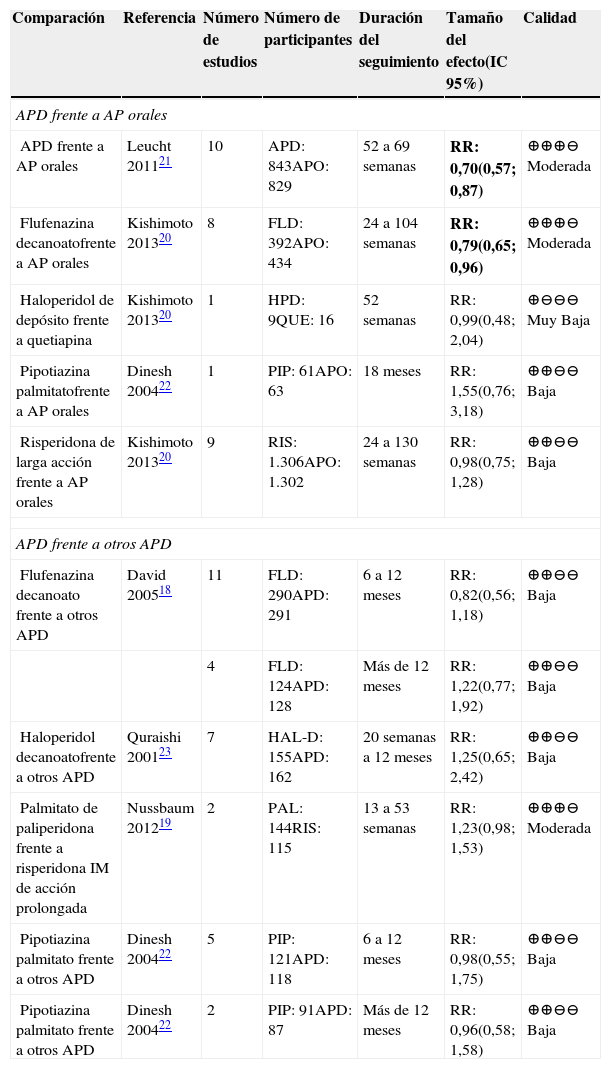
En la tabla 2 se presentan los resultados de las comparaciones de APD frente a otros AP para el desenlace de recaídas.
Resumen de la evidencia sobre recaídas en comparaciones entre AP
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| APD frente a AP orales | ||||||
| APD frente a AP orales | Leucht 201121 | 10 | APD: 843APO: 829 | 52 a 69 semanas | RR: 0,70(0,57; 0,87) | ⊕⊕⊕⊖ Moderada |
| Flufenazina decanoatofrente a AP orales | Kishimoto 201320 | 8 | FLD: 392APO: 434 | 24 a 104 semanas | RR: 0,79(0,65; 0,96) | ⊕⊕⊕⊖ Moderada |
| Haloperidol de depósito frente a quetiapina | Kishimoto 201320 | 1 | HPD: 9QUE: 16 | 52 semanas | RR: 0,99(0,48; 2,04) | ⊕⊖⊖⊖ Muy Baja |
| Pipotiazina palmitatofrente a AP orales | Dinesh 200422 | 1 | PIP: 61APO: 63 | 18 meses | RR: 1,55(0,76; 3,18) | ⊕⊕⊖⊖ Baja |
| Risperidona de larga acción frente a AP orales | Kishimoto 201320 | 9 | RIS: 1.306APO: 1.302 | 24 a 130 semanas | RR: 0,98(0,75; 1,28) | ⊕⊕⊖⊖ Baja |
| APD frente a otros APD | ||||||
| Flufenazina decanoato frente a otros APD | David 200518 | 11 | FLD: 290APD: 291 | 6 a 12 meses | RR: 0,82(0,56; 1,18) | ⊕⊕⊖⊖ Baja |
| 4 | FLD: 124APD: 128 | Más de 12 meses | RR: 1,22(0,77; 1,92) | ⊕⊕⊖⊖ Baja | ||
| Haloperidol decanoatofrente a otros APD | Quraishi 200123 | 7 | HAL-D: 155APD: 162 | 20 semanas a 12 meses | RR: 1,25(0,65; 2,42) | ⊕⊕⊖⊖ Baja |
| Palmitato de paliperidona frente a risperidona IM de acción prolongada | Nussbaum 201219 | 2 | PAL: 144RIS: 115 | 13 a 53 semanas | RR: 1,23(0,98; 1,53) | ⊕⊕⊕⊖ Moderada |
| Pipotiazina palmitato frente a otros APD | Dinesh 200422 | 5 | PIP: 121APD: 118 | 6 a 12 meses | RR: 0,98(0,55; 1,75) | ⊕⊕⊖⊖ Baja |
| Pipotiazina palmitato frente a otros APD | Dinesh 200422 | 2 | PIP: 91APD: 87 | Más de 12 meses | RR: 0,96(0,58; 1,58) | ⊕⊕⊖⊖ Baja |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. AP: antipsicóticos o neurolépticos; APO: antipsicóticos orales; PAL: palmitato de paliperidona; PIP: pipotiazina; FLD: flufenazina decanoato; PAL: paliperidona; RIS: risperidona; HAL-D: haloperidol decanoato; QUE: quetiapina; HPD: haloperidol de depósito.
Resultados en negrilla son significativos.
La evidencia de la comparación de APD frente a AP orales fue de calidad moderada a baja, los resultados no siempre fueron consistentes, por ejemplo al compararlos globalmente o al comparar flufenazina de depósito con los AP orales en general el resultado fue concluyente: demostraron un menor riesgo de recaídas con los APD frente a los AP orales20,21. Pero al comparar haloperidol decanoato con quetiapina, o la pipotizina o risperidona frente AP orales en general los hallazgos no fueron concluyentes20,22.
Las comparaciones entre APD presentan calidad de la evidencia moderada o baja y sus resultados no fueron concluyentes.
HospitalizacionesPara este desenlace se encontró la comparación de APD frente a AP orales. La calidad de la evidencia fue moderada y el resultado, un riesgo relativo de 0,78 con intervalo de confianza del 95% de 0,57 a 1,05. Este resultado no es concluyente para esta comparación21.
Abandono del tratamientoEste desenlace fue evaluado en varias de las comparaciones encontradas entre los diferentes metaanálisis18,19,24, incluyendo las comparaciones entre AP y algunas comparaciones entre algunos de estos contra placebo. Los seguimientos se realizaron entre ocho semanas y más de doce meses.
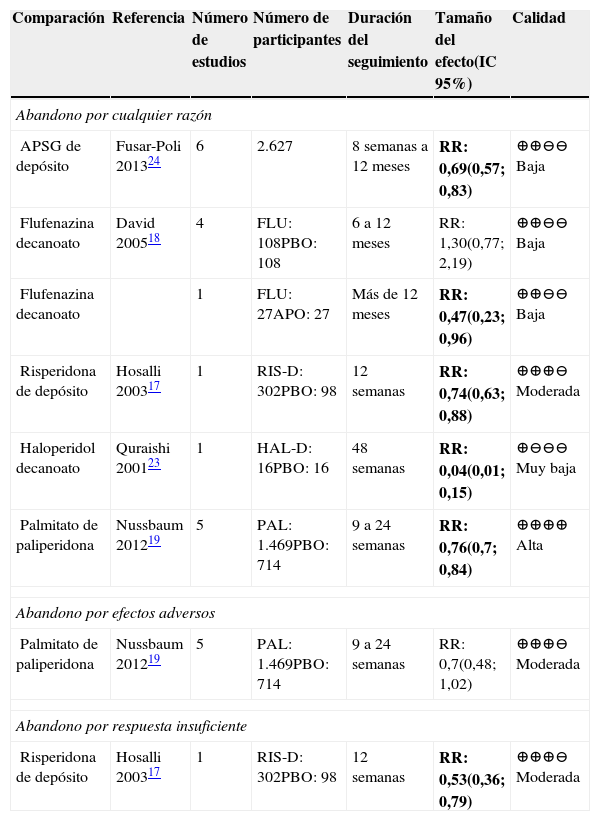
APD frente a placeboEn la tabla 3 se muestran los resultados de las comparaciones de los AP frente a placebo. Se encontró que la calidad de la evidencia fue moderada para la risperidona, alta para la paliperidona, baja para la flufenazina y muy baja para el haloperidol. De forma global los AP de segunda generación de depósito tuvieron menor riesgo de descontinuación al compararlos con placebo, aunque con un relativo pequeño tamaño del efecto24.
Resumen de la evidencia de abandono del tratamiento en las comparaciones de APD contra placebo
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| Abandono por cualquier razón | ||||||
| APSG de depósito | Fusar-Poli 201324 | 6 | 2.627 | 8 semanas a 12 meses | RR: 0,69(0,57; 0,83) | ⊕⊕⊖⊖ Baja |
| Flufenazina decanoato | David 200518 | 4 | FLU: 108PBO: 108 | 6 a 12 meses | RR: 1,30(0,77; 2,19) | ⊕⊕⊖⊖ Baja |
| Flufenazina decanoato | 1 | FLU: 27APO: 27 | Más de 12 meses | RR: 0,47(0,23; 0,96) | ⊕⊕⊖⊖ Baja | |
| Risperidona de depósito | Hosalli 200317 | 1 | RIS-D: 302PBO: 98 | 12 semanas | RR: 0,74(0,63; 0,88) | ⊕⊕⊕⊖ Moderada |
| Haloperidol decanoato | Quraishi 200123 | 1 | HAL-D: 16PBO: 16 | 48 semanas | RR: 0,04(0,01; 0,15) | ⊕⊖⊖⊖ Muy baja |
| Palmitato de paliperidona | Nussbaum 201219 | 5 | PAL: 1.469PBO: 714 | 9 a 24 semanas | RR: 0,76(0,7; 0,84) | ⊕⊕⊕⊕ Alta |
| Abandono por efectos adversos | ||||||
| Palmitato de paliperidona | Nussbaum 201219 | 5 | PAL: 1.469PBO: 714 | 9 a 24 semanas | RR: 0,7(0,48; 1,02) | ⊕⊕⊕⊖ Moderada |
| Abandono por respuesta insuficiente | ||||||
| Risperidona de depósito | Hosalli 200317 | 1 | RIS-D: 302PBO: 98 | 12 semanas | RR: 0,53(0,36; 0,79) | ⊕⊕⊕⊖ Moderada |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. APSG: AP de segunda generación; PBO: placebo; APO: antipsicóticos orales; PAL: palmitato de paliperidona; FLU: flufenazina decanoato; RIS: risperidona; HAL-D: haloperidol decanoato.
Resultados en negrilla son significativos.
En comparaciones cabeza a cabeza la risperidona tiene el menor riesgo de abandono de tratamiento por cualquier razón17 frente al placebo, seguido por el palmitato de paliperidona19. El haloperidol decanoato y la flufenazina a largo plazo también tuvieron menor riesgo de descontinuación del tratamiento por cualquier causa18,23.
La risperidona, por su parte, tuvo el menor riesgo de abandono del tratamiento por respuesta insuficiente de este frente al placebo17.
En aquellas comparaciones donde los resultados no fueron concluyentes, la calidad de la evidencia fue baja. En el desenlace abandono por efectos adversos, la calidad fue moderada, pero los resultados no fueron concluyentes.
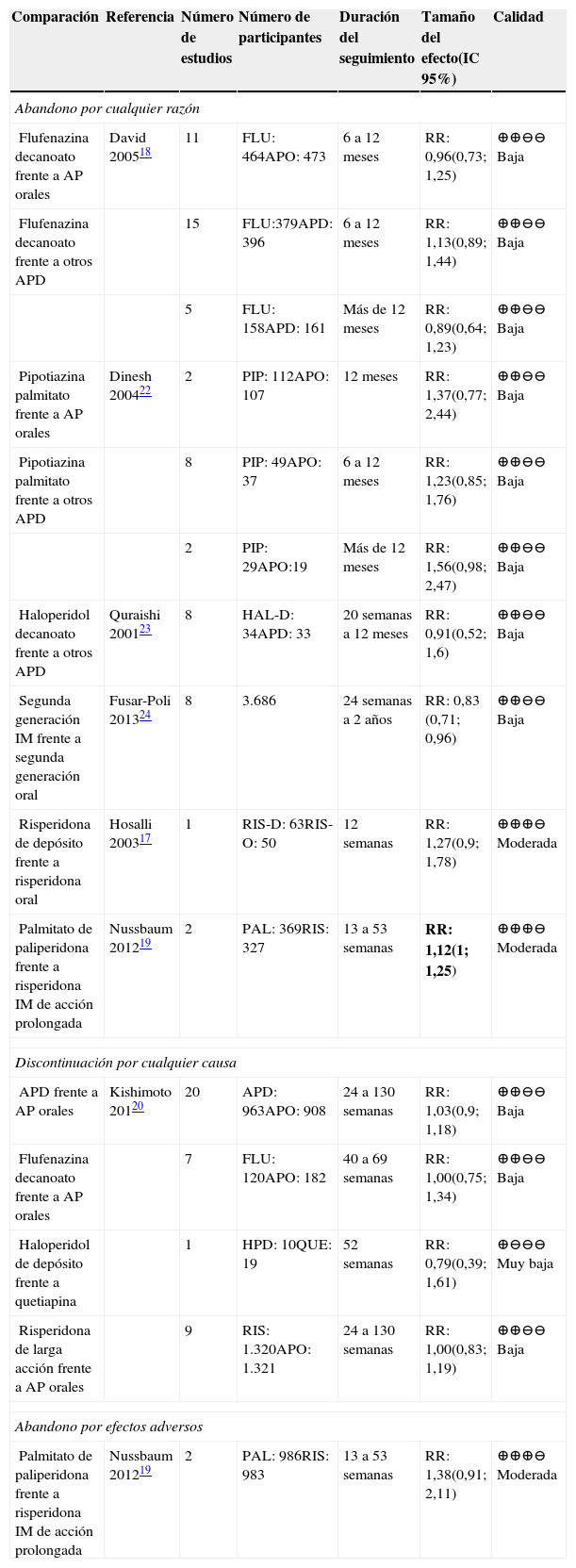
APD frente a otros APEn la tabla 4 se muestran los resultados de las comparaciones de los AP frente a otros AP (orales o depósito). En general, los estudios fueron de baja calidad en la evaluación con GRADE.
Resumen de la evidencia de abandono del tratamiento en las comparaciones entre AP
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| Abandono por cualquier razón | ||||||
| Flufenazina decanoato frente a AP orales | David 200518 | 11 | FLU: 464APO: 473 | 6 a 12 meses | RR: 0,96(0,73; 1,25) | ⊕⊕⊖⊖ Baja |
| Flufenazina decanoato frente a otros APD | 15 | FLU:379APD: 396 | 6 a 12 meses | RR: 1,13(0,89; 1,44) | ⊕⊕⊖⊖ Baja | |
| 5 | FLU: 158APD: 161 | Más de 12 meses | RR: 0,89(0,64; 1,23) | ⊕⊕⊖⊖ Baja | ||
| Pipotiazina palmitato frente a AP orales | Dinesh 200422 | 2 | PIP: 112APO: 107 | 12 meses | RR: 1,37(0,77; 2,44) | ⊕⊕⊖⊖ Baja |
| Pipotiazina palmitato frente a otros APD | 8 | PIP: 49APO: 37 | 6 a 12 meses | RR: 1,23(0,85; 1,76) | ⊕⊕⊖⊖ Baja | |
| 2 | PIP: 29APO:19 | Más de 12 meses | RR: 1,56(0,98; 2,47) | ⊕⊕⊖⊖ Baja | ||
| Haloperidol decanoato frente a otros APD | Quraishi 200123 | 8 | HAL-D: 34APD: 33 | 20 semanas a 12 meses | RR: 0,91(0,52; 1,6) | ⊕⊕⊖⊖ Baja |
| Segunda generación IM frente a segunda generación oral | Fusar-Poli 201324 | 8 | 3.686 | 24 semanas a 2 años | RR: 0,83 (0,71; 0,96) | ⊕⊕⊖⊖ Baja |
| Risperidona de depósito frente a risperidona oral | Hosalli 200317 | 1 | RIS-D: 63RIS-O: 50 | 12 semanas | RR: 1,27(0,9; 1,78) | ⊕⊕⊕⊖ Moderada |
| Palmitato de paliperidona frente a risperidona IM de acción prolongada | Nussbaum 201219 | 2 | PAL: 369RIS: 327 | 13 a 53 semanas | RR: 1,12(1; 1,25) | ⊕⊕⊕⊖ Moderada |
| Discontinuación por cualquier causa | ||||||
| APD frente a AP orales | Kishimoto 20120 | 20 | APD: 963APO: 908 | 24 a 130 semanas | RR: 1,03(0,9; 1,18) | ⊕⊕⊖⊖ Baja |
| Flufenazina decanoato frente a AP orales | 7 | FLU: 120APO: 182 | 40 a 69 semanas | RR: 1,00(0,75; 1,34) | ⊕⊕⊖⊖ Baja | |
| Haloperidol de depósito frente a quetiapina | 1 | HPD: 10QUE: 19 | 52 semanas | RR: 0,79(0,39; 1,61) | ⊕⊖⊖⊖ Muy baja | |
| Risperidona de larga acción frente a AP orales | 9 | RIS: 1.320APO: 1.321 | 24 a 130 semanas | RR: 1,00(0,83; 1,19) | ⊕⊕⊖⊖ Baja | |
| Abandono por efectos adversos | ||||||
| Palmitato de paliperidona frente a risperidona IM de acción prolongada | Nussbaum 201219 | 2 | PAL: 986RIS: 983 | 13 a 53 semanas | RR: 1,38(0,91; 2,11) | ⊕⊕⊕⊖ Moderada |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. APO: antipsicóticos orales; PAL: palmitato de paliperidona; PIP: pipotiazina palmitato; FLU: flufenazina decanoato; RIS: risperidona de larga acción; HAL-D: haloperidol decanoato, QUE: quetiapina; RIS-D: risperidona de depósito; RIS-O: risperidona oral; HPD: haloperidol de depósito.
Resultados en negrilla son significativos.
Se encontraron resultados con calidad moderada para las comparaciones de palmitato de paliperidona frente a risperidona IM de acción prolongada; aquel presenta menor abandono por cualquier tipo de efectos adversos19.
Para abandono del tratamiento por efectos adversos se encontró una comparación, palmitato de paliperidona frente a risperidona IM de acción prolongada, cuyos resultados no son concluyentes.
Para las otras comparaciones se evidenciaron riesgo de sesgos en los estudios individuales o resultados no concluyentes, lo que les disminuyó la calidad.
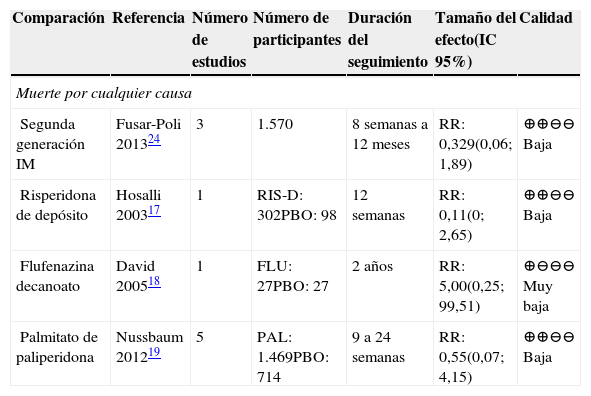
Muerte por cualquier causaSe incluyeron los reportes de mortalidad por cualquier causa o por causas naturales, no se incluyeron las relacionadas con suicidio. Los resultados suministrados para las comparaciones de AP de segunda generación IM, risperidona de depósito, flufenazina decanoato, palmitato de paliperidona frente a placebo en los metaanálisis incluidos17,24 no fueron concluyentes.
En general, los estudios individuales presentan riesgo de sesgos dado que no se reportaba un adecuado proceso de cegamiento para los evaluadores.
AP frente a placeboEn la tabla 5 se presentan los resultados de las comparaciones frente a placebo. Este desenlace se reportó para risperidona, flufenazina y paliperidona; los resultados no fueron concluyentes. La calidad de la evidencia fue baja o muy baja, principalmente por la imprecisión de los resultados, por los pocos eventos presentados, así como por el riesgo de sesgo que presentaban algunos de los estudios individuales.
Resumen de la evidencia sobre muerte por cualquier causa en las comparaciones de APD contra placebo
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| Muerte por cualquier causa | ||||||
| Segunda generación IM | Fusar-Poli 201324 | 3 | 1.570 | 8 semanas a 12 meses | RR: 0,329(0,06; 1,89) | ⊕⊕⊖⊖ Baja |
| Risperidona de depósito | Hosalli 200317 | 1 | RIS-D: 302PBO: 98 | 12 semanas | RR: 0,11(0; 2,65) | ⊕⊕⊖⊖ Baja |
| Flufenazina decanoato | David 200518 | 1 | FLU: 27PBO: 27 | 2 años | RR: 5,00(0,25; 99,51) | ⊕⊖⊖⊖ Muy baja |
| Palmitato de paliperidona | Nussbaum 201219 | 5 | PAL: 1.469PBO: 714 | 9 a 24 semanas | RR: 0,55(0,07; 4,15) | ⊕⊕⊖⊖ Baja |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. PAL: palmitato de paliperidona; PBO: placebo; RIS-D: risperidona de depósito; FLU: flufenazina decanoato.
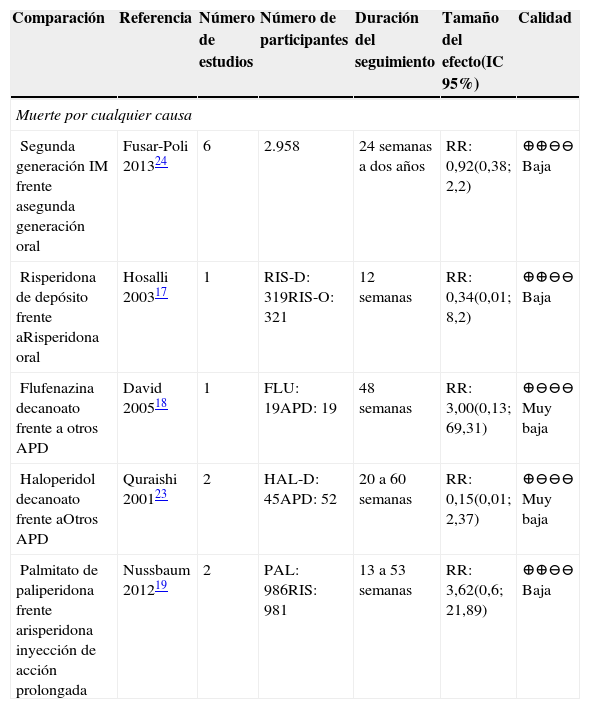
En la tabla 6 se presentan los resultados de las comparaciones de APD frente a otros AP (orales o depósito). Este desenlace se reportó para risperidona, flufenazina, paliperidona y haloperidol17–19. En general, la calidad de los estudios fue baja o muy baja. Adicionalmente, los resultados de las comparaciones no fueron concluyentes.
Resumen de la evidencia sobre muerte por cualquier causa en las comparaciones de APD entre ellos y con otros AP
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| Muerte por cualquier causa | ||||||
| Segunda generación IM frente asegunda generación oral | Fusar-Poli 201324 | 6 | 2.958 | 24 semanas a dos años | RR: 0,92(0,38; 2,2) | ⊕⊕⊖⊖ Baja |
| Risperidona de depósito frente aRisperidona oral | Hosalli 200317 | 1 | RIS-D: 319RIS-O: 321 | 12 semanas | RR: 0,34(0,01; 8,2) | ⊕⊕⊖⊖ Baja |
| Flufenazina decanoato frente a otros APD | David 200518 | 1 | FLU: 19APD: 19 | 48 semanas | RR: 3,00(0,13; 69,31) | ⊕⊖⊖⊖ Muy baja |
| Haloperidol decanoato frente aOtros APD | Quraishi 200123 | 2 | HAL-D: 45APD: 52 | 20 a 60 semanas | RR: 0,15(0,01; 2,37) | ⊕⊖⊖⊖ Muy baja |
| Palmitato de paliperidona frente arisperidona inyección de acción prolongada | Nussbaum 201219 | 2 | PAL: 986RIS: 981 | 13 a 53 semanas | RR: 3,62(0,6; 21,89) | ⊕⊕⊖⊖ Baja |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. PAL: palmitato de paliperidona; RIS-D: risperidona de depósito; RIS-O: risperidona oral; RIS: risperidona inyección de acción prolongada; FLU: flufenazina decanoato; HAL-D: haloperidol decanoato.
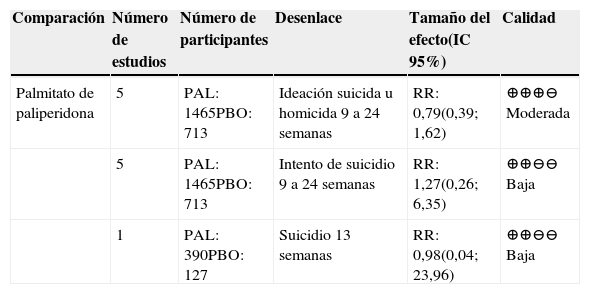
En la tabla 7 se presentan los resultados para el desenlace de conducta suicida para las comparaciones de AP frente a placebo
Resumen de la evidencia sobre conducta suicida en las comparaciones con placebo
| Comparación | Número de estudios | Número de participantes | Desenlace | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|
| Palmitato de paliperidona | 5 | PAL: 1465PBO: 713 | Ideación suicida u homicida 9 a 24 semanas | RR: 0,79(0,39; 1,62) | ⊕⊕⊕⊖ Moderada |
| 5 | PAL: 1465PBO: 713 | Intento de suicidio 9 a 24 semanas | RR: 1,27(0,26; 6,35) | ⊕⊕⊖⊖ Baja | |
| 1 | PAL: 390PBO: 127 | Suicidio 13 semanas | RR: 0,98(0,04; 23,96) | ⊕⊕⊖⊖ Baja |
Fuente: Nussbaum 201219.
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. PAL: palmitato de paliperidona; PBO: placebo.
La presencia de ideación suicida u homicida, intento de suicidio y suicidio se reportó solo en la comparación entre palmitato de paliperidona y placebo19, con calidad de la evidencia moderada para la ideación suicida u homicida y baja para el intento de suicidio y suicidio. No se encontraron resultados concluyentes para ninguno de estos desenlaces.
En general, los estudios individuales presentan riesgo de sesgos y un inadecuado reporte del proceso de cegamiento para los evaluadores.
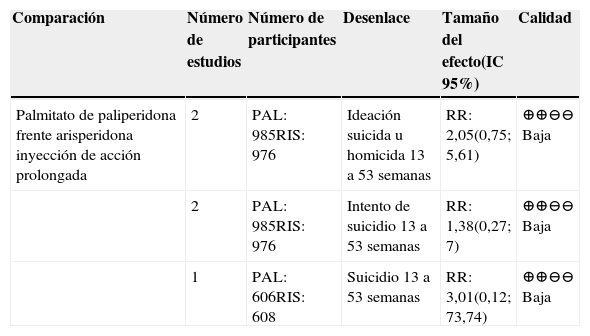
APD frente a otros APEn la tabla 8 se presentan los resultados del desenlace conducta suicida para las comparaciones entre APD y otros AP19.
Resumen de la evidencia sobre conducta suicida en comparaciones entre AP
| Comparación | Número de estudios | Número de participantes | Desenlace | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|
| Palmitato de paliperidona frente arisperidona inyección de acción prolongada | 2 | PAL: 985RIS: 976 | Ideación suicida u homicida 13 a 53 semanas | RR: 2,05(0,75; 5,61) | ⊕⊕⊖⊖ Baja |
| 2 | PAL: 985RIS: 976 | Intento de suicidio 13 a 53 semanas | RR: 1,38(0,27; 7) | ⊕⊕⊖⊖ Baja | |
| 1 | PAL: 606RIS: 608 | Suicidio 13 a 53 semanas | RR: 3,01(0,12; 73,74) | ⊕⊕⊖⊖ Baja |
IC: intervalo de confianza, RR: Riesgo relativo.
Fuente: Nussbaum 201219.
La calidad general de la evidencia fue baja y ninguna de las comparaciones mostró resultados concluyentes. En general, los estudios individuales presentaron riesgo de sesgos y un inadecuado reporte del proceso de cegamiento para los evaluadores.
Efectos adversosEn este desenlace de efectos secundarios se incluyen la presencia de distonía aguda, acatisia, parkinsonismo o SEP no discriminados. El uso de medicamentos antiparkinsonianos o anticolinérgicos se consideró como una medida indirecta que representa estos desenlaces, ya que varios estudios reportaron este desenlace18,19,22–24.
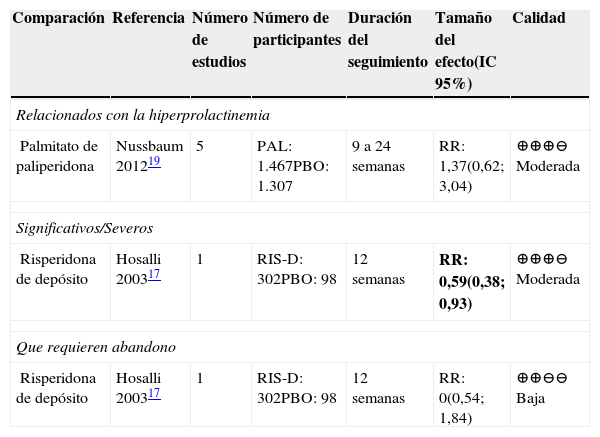
Frecuencia de eventos adversosADP frente a placeboEn la tabla 9 se presentan los resultados del desenlace de frecuencia de eventos adversos para las comparaciones frente a placebo. Se reportaron solo en las comparaciones entre paliperidona y placebo y entre risperidona y placebo17,19.
Resumen de la evidencia sobre eventos adversos no discriminados en las comparaciones frente a placebo
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| Relacionados con la hiperprolactinemia | ||||||
| Palmitato de paliperidona | Nussbaum 201219 | 5 | PAL: 1.467PBO: 1.307 | 9 a 24 semanas | RR: 1,37(0,62; 3,04) | ⊕⊕⊕⊖ Moderada |
| Significativos/Severos | ||||||
| Risperidona de depósito | Hosalli 200317 | 1 | RIS-D: 302PBO: 98 | 12 semanas | RR: 0,59(0,38; 0,93) | ⊕⊕⊕⊖ Moderada |
| Que requieren abandono | ||||||
| Risperidona de depósito | Hosalli 200317 | 1 | RIS-D: 302PBO: 98 | 12 semanas | RR: 0(0,54; 1,84) | ⊕⊕⊖⊖ Baja |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. PAL: palmitato de paliperidona; RIS-D: risperidona de depósito; PBO: placebo. Resultados en negrilla son significativos.
Con la utilización de risperidona de observó una disminución en el riesgo de presentar eventos adversos significativos frente al placebo. La calidad de la evidencia fue moderada.
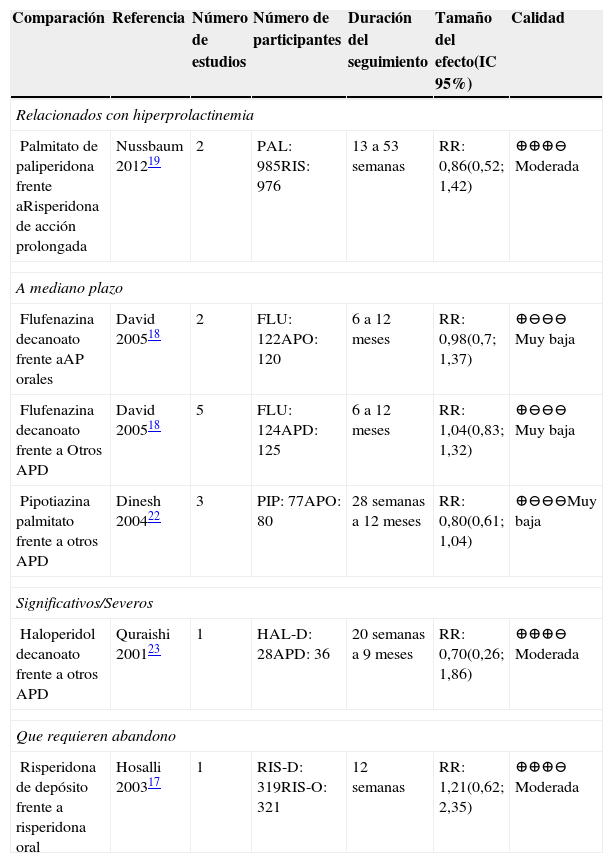
ADP frente a otros APEn la tabla 10 se presentan los resultados del desenlace eventos adversos para las comparaciones de APD frente a otros AP17,22,23.
Resumen de la evidencia sobre eventos adversos en comparaciones entre AP
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| Relacionados con hiperprolactinemia | ||||||
| Palmitato de paliperidona frente aRisperidona de acción prolongada | Nussbaum 201219 | 2 | PAL: 985RIS: 976 | 13 a 53 semanas | RR: 0,86(0,52; 1,42) | ⊕⊕⊕⊖ Moderada |
| A mediano plazo | ||||||
| Flufenazina decanoato frente aAP orales | David 200518 | 2 | FLU: 122APO: 120 | 6 a 12 meses | RR: 0,98(0,7; 1,37) | ⊕⊖⊖⊖ Muy baja |
| Flufenazina decanoato frente a Otros APD | David 200518 | 5 | FLU: 124APD: 125 | 6 a 12 meses | RR: 1,04(0,83; 1,32) | ⊕⊖⊖⊖ Muy baja |
| Pipotiazina palmitato frente a otros APD | Dinesh 200422 | 3 | PIP: 77APO: 80 | 28 semanas a 12 meses | RR: 0,80(0,61; 1,04) | ⊕⊖⊖⊖Muy baja |
| Significativos/Severos | ||||||
| Haloperidol decanoato frente a otros APD | Quraishi 200123 | 1 | HAL-D: 28APD: 36 | 20 semanas a 9 meses | RR: 0,70(0,26; 1,86) | ⊕⊕⊕⊖ Moderada |
| Que requieren abandono | ||||||
| Risperidona de depósito frente a risperidona oral | Hosalli 200317 | 1 | RIS-D: 319RIS-O: 321 | 12 semanas | RR: 1,21(0,62; 2,35) | ⊕⊕⊕⊖ Moderada |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. FLU: flufenazina decanoato; PAL: palmitato de paliperidona; APO: antipsicóticos orales; RIS-D: risperidona de depósito; RIS-O: risperidona oral; PIP: pipotiazina palmitato; HAL-D: haloperidol decanoato; RIS: risperidona de acción prolongada.
La calidad de la evidencia fue moderada para las comparaciones palmitato de paliperidona frente a risperidona de acción prolongada, haloperidol frente a otros APD y risperidona depósito frente a risperidona oral. Sin embargo, a pesar de la calidad de la evidencia ninguno de ellos presentó resultados concluyentes.
Las demás comparaciones presentan baja o muy baja calidad de la evidencia y resultados no concluyentes.
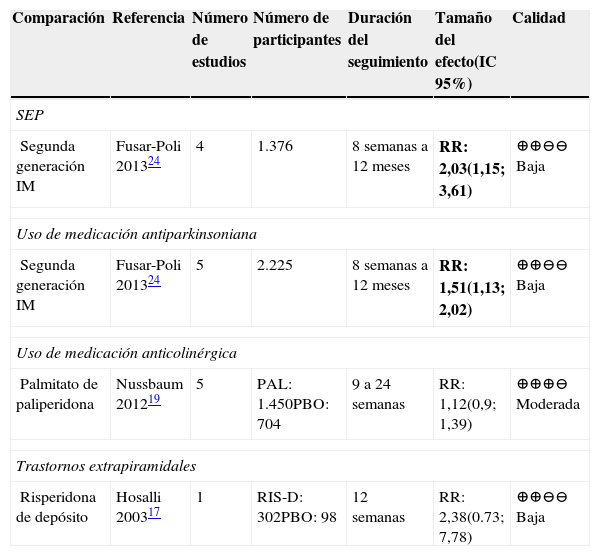
SEP (Síndromes Extrapiramidales)APD frente a placebo para SEP de forma globalEn la tabla 11 se presentan los resultados de las comparaciones de APD frente a placebo para SEP de forma global.
Resumen de la evidencia sobre SEP en las comparaciones con placebo
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| SEP | ||||||
| Segunda generación IM | Fusar-Poli 201324 | 4 | 1.376 | 8 semanas a 12 meses | RR: 2,03(1,15; 3,61) | ⊕⊕⊖⊖ Baja |
| Uso de medicación antiparkinsoniana | ||||||
| Segunda generación IM | Fusar-Poli 201324 | 5 | 2.225 | 8 semanas a 12 meses | RR: 1,51(1,13; 2,02) | ⊕⊕⊖⊖ Baja |
| Uso de medicación anticolinérgica | ||||||
| Palmitato de paliperidona | Nussbaum 201219 | 5 | PAL: 1.450PBO: 704 | 9 a 24 semanas | RR: 1,12(0,9; 1,39) | ⊕⊕⊕⊖ Moderada |
| Trastornos extrapiramidales | ||||||
| Risperidona de depósito | Hosalli 200317 | 1 | RIS-D: 302PBO: 98 | 12 semanas | RR: 2,38(0.73; 7,78) | ⊕⊕⊖⊖ Baja |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. PBO: placebo; PAL: palmitato de paliperidona; RIS-D: risperidona de depósito. Resultados en negrilla son significativos.
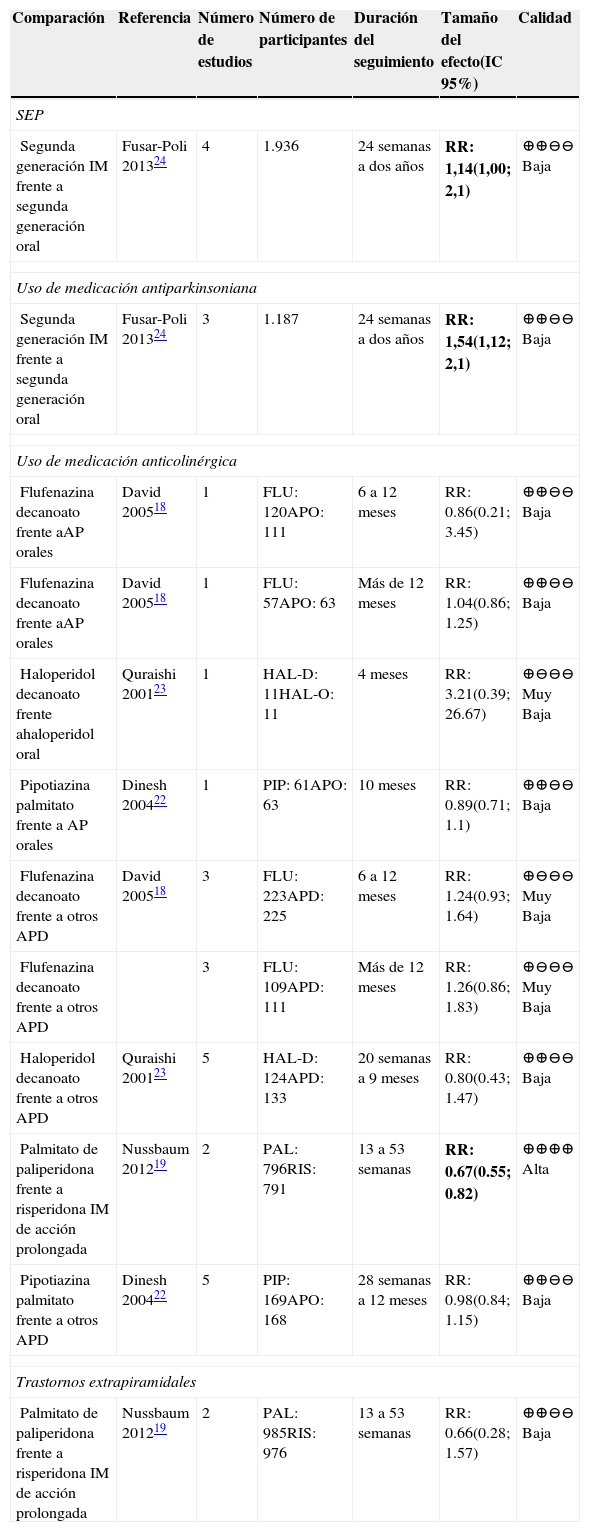
La calidad de la evidencia en general fue baja; sin embargo, se encontraron resultados concluyentes en las comparaciones de AP de segunda generación frente a placebo para el desenlace de SEP, siendo los primeros los que presentan mayor riesgo24.
La calidad de la evidencia para la comparación de palmitato de paliperidona frente a placebo fue moderada; sin embargo, los resultados no fueron concluyentes.
APD frente a otros antipsicóticos para SEP de forma globalEn la tabla 12 se presentan los resultados de las comparaciones para SEP de forma global.
Resumen de la evidencia sobre SEP en comparaciones entre AP
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| SEP | ||||||
| Segunda generación IM frente a segunda generación oral | Fusar-Poli 201324 | 4 | 1.936 | 24 semanas a dos años | RR: 1,14(1,00; 2,1) | ⊕⊕⊖⊖ Baja |
| Uso de medicación antiparkinsoniana | ||||||
| Segunda generación IM frente a segunda generación oral | Fusar-Poli 201324 | 3 | 1.187 | 24 semanas a dos años | RR: 1,54(1,12; 2,1) | ⊕⊕⊖⊖ Baja |
| Uso de medicación anticolinérgica | ||||||
| Flufenazina decanoato frente aAP orales | David 200518 | 1 | FLU: 120APO: 111 | 6 a 12 meses | RR: 0.86(0.21; 3.45) | ⊕⊕⊖⊖ Baja |
| Flufenazina decanoato frente aAP orales | David 200518 | 1 | FLU: 57APO: 63 | Más de 12 meses | RR: 1.04(0.86; 1.25) | ⊕⊕⊖⊖ Baja |
| Haloperidol decanoato frente ahaloperidol oral | Quraishi 200123 | 1 | HAL-D: 11HAL-O: 11 | 4 meses | RR: 3.21(0.39; 26.67) | ⊕⊖⊖⊖ Muy Baja |
| Pipotiazina palmitato frente a AP orales | Dinesh 200422 | 1 | PIP: 61APO: 63 | 10 meses | RR: 0.89(0.71; 1.1) | ⊕⊕⊖⊖ Baja |
| Flufenazina decanoato frente a otros APD | David 200518 | 3 | FLU: 223APD: 225 | 6 a 12 meses | RR: 1.24(0.93; 1.64) | ⊕⊖⊖⊖ Muy Baja |
| Flufenazina decanoato frente a otros APD | 3 | FLU: 109APD: 111 | Más de 12 meses | RR: 1.26(0.86; 1.83) | ⊕⊖⊖⊖ Muy Baja | |
| Haloperidol decanoato frente a otros APD | Quraishi 200123 | 5 | HAL-D: 124APD: 133 | 20 semanas a 9 meses | RR: 0.80(0.43; 1.47) | ⊕⊕⊖⊖ Baja |
| Palmitato de paliperidona frente a risperidona IM de acción prolongada | Nussbaum 201219 | 2 | PAL: 796RIS: 791 | 13 a 53 semanas | RR: 0.67(0.55; 0.82) | ⊕⊕⊕⊕ Alta |
| Pipotiazina palmitato frente a otros APD | Dinesh 200422 | 5 | PIP: 169APO: 168 | 28 semanas a 12 meses | RR: 0.98(0.84; 1.15) | ⊕⊕⊖⊖ Baja |
| Trastornos extrapiramidales | ||||||
| Palmitato de paliperidona frente a risperidona IM de acción prolongada | Nussbaum 201219 | 2 | PAL: 985RIS: 976 | 13 a 53 semanas | RR: 0.66(0.28; 1.57) | ⊕⊕⊖⊖ Baja |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. FLU: flufenazina decanoato; PAL: palmitato de paliperidona; APO: antipsicóticos orales; RIS: risperidona IM de acción prolongada; PIP: pipotiazina palmitato; HAL-D: haloperidol decanoato; HAL-O: haloperidol oral. Resultados en negrilla son significativos.
En general, para todos los desenlaces la calidad de la evidencia fue baja o muy baja para todas las comparaciones. Sin embargo, en las comparaciones de AP de segunda generación IM frente a AP de segunda generación por vía oral, los primeros demostraron mayor riesgo de SEP24. Para el desenlace uso de medicación antiparkinsoniana, la comparación AP de segunda generación IM frente a AP de segunda generación por vía oral muestra que los primeros presentan mayor riesgo de uso de antiparkinsonianos24.
En el desenlace uso de medicación anticolinérgica hubo una comparación con alta calidad y resultados concluyentes. La comparación palmitato de paliperidona frente a risperidona IM de acción prolongada demostró un menor riesgo de la primera en uso de antiparkinsonianos19.
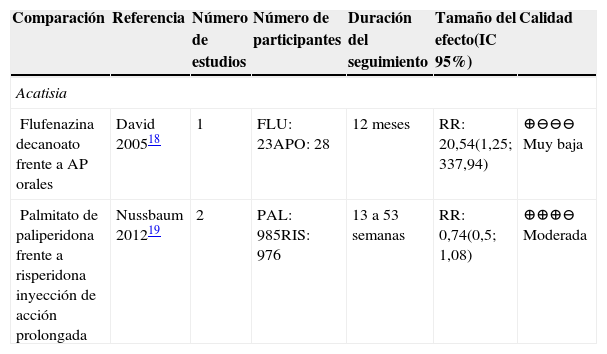
APD frente a placebo para acatisiaFue reportado para una sola comparación: palmitato de paliperidona frente a placebo. En el metaanálisis de cuatro estudios de nueve a 24 semanas de seguimiento se encontró un riesgo relativo de 0,89 IC 95% (0,49; 1,61)19. La calidad de los estudios fue moderada; sin embargo, los resultados no fueron concluyentes.
APD frente a otros AP para acatisiaEn la tabla 13 se presenta el resumen de los hallazgos del desenlace específico de acatisia.
Resumen de la evidencia sobre acatisia en comparaciones entre AP
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| Acatisia | ||||||
| Flufenazina decanoato frente a AP orales | David 200518 | 1 | FLU: 23APO: 28 | 12 meses | RR: 20,54(1,25; 337,94) | ⊕⊖⊖⊖ Muy baja |
| Palmitato de paliperidona frente a risperidona inyección de acción prolongada | Nussbaum 201219 | 2 | PAL: 985RIS: 976 | 13 a 53 semanas | RR: 0,74(0,5; 1,08) | ⊕⊕⊕⊖ Moderada |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. PAL: palmitato de paliperidona, RIS: risperidona inyección de acción prolongada; APO: antipsicóticos orales, FLU: flufenazina decanoato.
La comparación palmitato de paliperidona frente a risperidona inyección de acción prolongada fue de moderada calidad; sin embargo, los resultados no fueron concluyentes19.
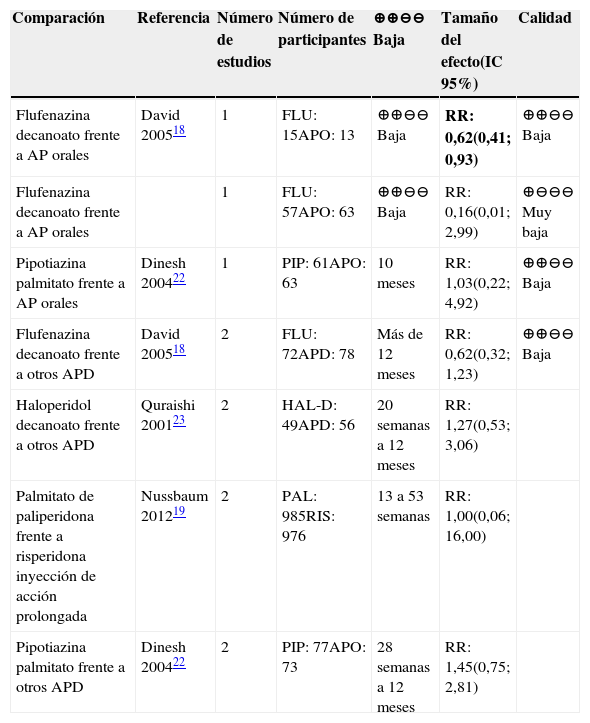
Disquinesia tardíaAPD frente a placeboEste desenlace fue reportado únicamente en la comparación entre paliperidona y placebo, que evaluó a 2.178 individuos entre nueve y 24 semanas en cinco estudios; sus resultados no fueron concluyentes (RR: 1,84 IC 95% [0,08; 44,79])19. La calidad de la evidencia fue baja porque varios estudios presentaban riesgo de sesgos dado por problemas de aleatorización y cegamiento y el intervalo de confianza era impreciso.
APD frente a otros APLa comparación de flufenazina frente a neurolépticos orales presentó resultados significativos, con menor riesgo de presentar disquinesia tardía para el grupo tratado con flufenazina18. Para las demás comparaciones, los resultados no fueron concluyentes (véase tabla 14). La evidencia en general fue de calidad baja o muy baja.
Resumen de la evidencia sobre disquinesia tardía en comparaciones entre APD y otros AP
| Comparación | Referencia | Número de estudios | Número de participantes | ⊕⊕⊖⊖ Baja | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| Flufenazina decanoato frente a AP orales | David 200518 | 1 | FLU: 15APO: 13 | ⊕⊕⊖⊖ Baja | RR: 0,62(0,41; 0,93) | ⊕⊕⊖⊖ Baja |
| Flufenazina decanoato frente a AP orales | 1 | FLU: 57APO: 63 | ⊕⊕⊖⊖ Baja | RR: 0,16(0,01; 2,99) | ⊕⊖⊖⊖ Muy baja | |
| Pipotiazina palmitato frente a AP orales | Dinesh 200422 | 1 | PIP: 61APO: 63 | 10 meses | RR: 1,03(0,22; 4,92) | ⊕⊕⊖⊖ Baja |
| Flufenazina decanoato frente a otros APD | David 200518 | 2 | FLU: 72APD: 78 | Más de 12 meses | RR: 0,62(0,32; 1,23) | ⊕⊕⊖⊖ Baja |
| Haloperidol decanoato frente a otros APD | Quraishi 200123 | 2 | HAL-D: 49APD: 56 | 20 semanas a 12 meses | RR: 1,27(0,53; 3,06) | |
| Palmitato de paliperidona frente a risperidona inyección de acción prolongada | Nussbaum 201219 | 2 | PAL: 985RIS: 976 | 13 a 53 semanas | RR: 1,00(0,06; 16,00) | |
| Pipotiazina palmitato frente a otros APD | Dinesh 200422 | 2 | PIP: 77APO: 73 | 28 semanas a 12 meses | RR: 1,45(0,75; 2,81) |
Abreviaturas: IC: intervalo de confianza, DM: diferencia de medias, RR: Riesgo relativo. FLU: flufenazina decanoato; PAL: palmitato de paliperidona; APO: antipsicóticos orales; RIS: risperidona inyección de acción prolongada; PIP: pipotiazina palmitato; HAL-D: haloperidol decanoato. Resultados en negrilla son significativos.
En la tabla 15 se encuentran resumidos los resultados de los desenlaces correspondientes a los efectos secundarios metabólicos, cardiovasculares, dolor y somnolencia de las comparaciones de APD frente a placebo.
Resumen de la evidencia sobre otros efectos secundarios en las comparaciones contra placebo
| Comparación | Referencia | Número de estudios | Número de participantes | Duración del seguimiento | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
| Ganancia de peso | ||||||
| Segunda generación IM | Fusar-Poli 201324 | 4 | 2.111 | 8 semanas a 12 meses | RR: 2,75(1,87; 4,03) | ⊕⊕⊕⊖ Moderada |
| Palmitato de paliperidona | Nussbaum 201219 | 5 | PAL: 1.386PBO: 666 | 9 a 24 semanas | DM: 1,34(0,97; 1,7) | ⊕⊕⊕⊕ Alta |
| Risperidona de depósito | Hosalli 201317 | 1 | RIS-D: 302PBO: 98 | 12 semanas | RR: 0(0,48; 9,18) | ⊕⊕⊖⊖ Baja |
| Prolongación del intervalo QT | ||||||
| Palmitato de paliperidona | Nussbaum 201219 | 2 | PAL: 368PBO: 287 | 9 a 24 semanas | RR: 1,03(0,09; 11,2) | ⊕⊕⊖⊖ Baja |
| Dolor en el sitio de la inyección | ||||||
| Palmitato de paliperidona | Nussbaum 201219 | 5 | PAL: 1.460PBO: 706 | 9 a 24 semanas | RR: 1,39(0,97; 1,99) | ⊕⊕⊕⊖ Moderada |
| Segunda generación IM | Fusar-Poli 201324 | 6 | 1713 | 8 semanas a 12 meses | RR: 1,13(0,95; 1,35) | ⊕⊕⊖⊖ Baja |
| Infarto del Miocardio | ||||||
| Palmitato de paliperidona | Nussbaum 201219 | 4 | PAL: 1.304PBO: 629 | 9 a 24 semanas | RR: 0,33(0,01; 8,06) | ⊕⊕⊖⊖ Baja |
| Somnolencia | ||||||
| Palmitato de paliperidona | Nussbaum 201219 | 5 | PAL: 1.467PBO: 713 | 9 a 24 semanas | RR: 1,34(0,71; 2,53) | ⊕⊕⊕⊖ Moderada |
| Risperidona de depósito | Hosalli 201317 | 1 | RIS-D: 302PBO: 98 | 12 semanas | RR: 2,27(0,69; 7,45) | ⊕⊕⊖⊖ Baja |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. PBO: placebo; PAL: palmitato de paliperidona; RIS-D: risperidona de depósito. Resultados en negrilla son significativos.
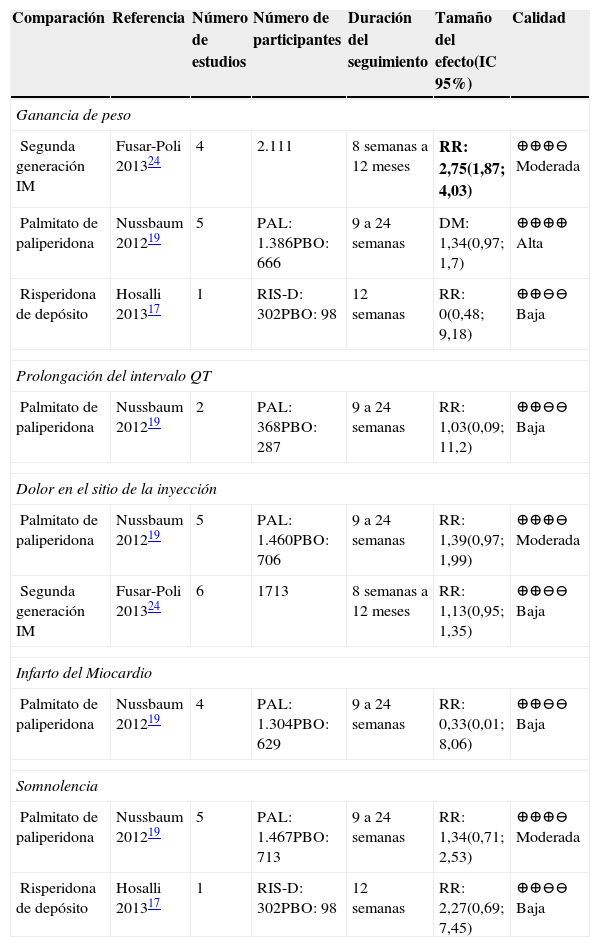
La comparación de AP de segunda generación IM frente a placebo presentaba un aumento de riesgo de los primeros a ganar peso. La calidad de la evidencia fue moderada. En la comparación del palmitato de paliperidona presentó un aumento de peso de 1,34kg más frente al placebo. La calidad de esta evidencia fue alta19. El resto de comparaciones presentaba calidad baja de la evidencia y resultados no concluyentes.
Efectos secundarios cardiovascularesSolo se reportaron efectos secundarios cardiovasculares en la comparación entre paliperidona y placebo. Los resultados arrojados no fueron concluyentes y la calidad de la evidencia fue baja por la imprecisión de los resultados.
Dolor en el sitio de la inyecciónEn la comparación palmitato de paliperidona frente a placebo, la calidad de la evidencia fue moderada; sin embargo, los resultados no eran concluyentes. Las demás comparaciones presentaban calidad baja de la evidencia sin resultados concluyentes.
SomnolenciaNo se reportaron resultados concluyentes en las comparaciones entre paliperidona frente a placebo y risperidona frente a placebo. En el caso de la paliperidona, la calidad de la evidencia reportada fue moderada; mientras que en el caso de la risperidona la evidencia tuvo una calidad baja.
ADP frente a otros APEn la tabla 16 se presentan los resultados de los desenlaces correspondientes a los efectos secundarios metabólicos, cardiovasculares, dolor y somnolencia de las comparaciones de APD frente a otros AP. Para los desenlaces infarto de miocardio y somnolencia, la calidad de la evidencia fue baja para las comparaciones y ninguna de ellas presentaba resultados concluyentes.
Resumen de la evidencia sobre otros efectos secundarios en comparaciones entre AP
| Comparación | Referencia | Número de estudios | Número de participantes | Desenlace | Tamaño del efecto(IC 95%) | Calidad |
|---|---|---|---|---|---|---|
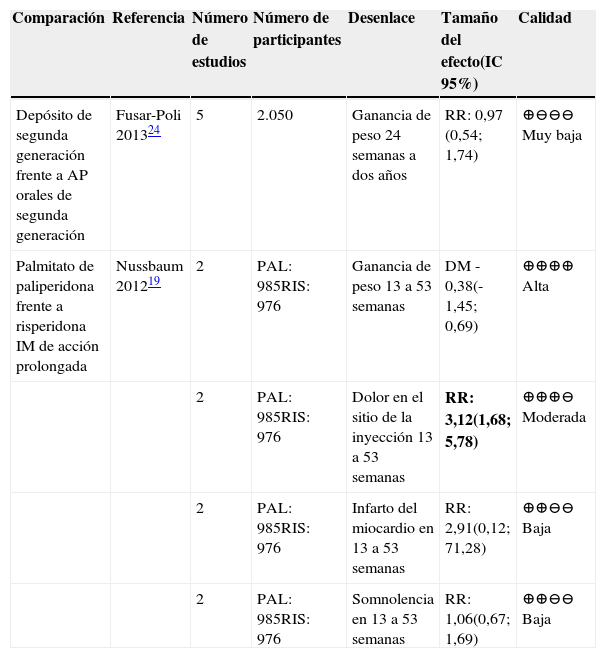
| Depósito de segunda generación frente a AP orales de segunda generación | Fusar-Poli 201324 | 5 | 2.050 | Ganancia de peso 24 semanas a dos años | RR: 0,97 (0,54; 1,74) | ⊕⊖⊖⊖ Muy baja |
| Palmitato de paliperidona frente a risperidona IM de acción prolongada | Nussbaum 201219 | 2 | PAL: 985RIS: 976 | Ganancia de peso 13 a 53 semanas | DM -0,38(-1,45; 0,69) | ⊕⊕⊕⊕ Alta |
| 2 | PAL: 985RIS: 976 | Dolor en el sitio de la inyección 13 a 53 semanas | RR: 3,12(1,68; 5,78) | ⊕⊕⊕⊖ Moderada | ||
| 2 | PAL: 985RIS: 976 | Infarto del miocardio en 13 a 53 semanas | RR: 2,91(0,12; 71,28) | ⊕⊕⊖⊖ Baja | ||
| 2 | PAL: 985RIS: 976 | Somnolencia en 13 a 53 semanas | RR: 1,06(0,67; 1,69) | ⊕⊕⊖⊖ Baja |
Abreviaturas: IC: intervalo de confianza, RR: Riesgo relativo. PAL: palmitato de paliperidona; RIS: risperidona IM de acción prolongada. Resultados en negrilla son significativos.
La comparación de paliperidona frente a risperidona IM de acción prolongada mostró disminución del peso de los pacientes en tratamiento con el primero24. La calidad de esta evidencia fue alta.
Dolor en el sitio de la inyecciónPara la comparación de palmitato de paliperidona frente a risperidona IM de acción prolongada hubo un aumento del riesgo de presentar este desenlace para el primer antipsicótico. La calidad de la evidencia fue moderada19.
DiscusiónLa revisión de la literatura para la realización de esta guía muestra en general que la calidad evidencia es moderada a baja y que en muchos casos los hallazgos no son concluyentes. Además, existen pocas comparaciones cabeza a cabeza entre los APD.
Se utilizaron ocho artículos de los resultados de las búsquedas. Adicional a la evidencia encontrada, se tuvieron en consideración las experiencias profesionales del grupo de expertos.
Durante las reuniones de formulación de recomendaciones se discutió ampliamente sobre la decisión de poner líneas de tratamiento para los APD; sin embargo, dadas la evidencia y las experiencias de los expertos, se decidió dejar el uso de estos según criterio clínico dentro de la lista de los que se encuentran disponibles. Se discutieron los posibles eventos adversos que los APD pueden presentar frente a su contraparte por vía oral. Dado lo anterior y los hallazgos en la literatura científica, se reafirmó que sea el psiquiatra quién considere cuándo se le puede ofrecer al paciente el manejo con este tipo de medicamentos.
El grupo de expertos evaluó el problema de los costos de estos para el uso en mantenimiento. Sin embargo, aunque no se cuenta con un estudio de costo-efectividad en este momento, se tomó la decisión de seguir estrictamente la evidencia disponible en la literatura médica para hacer las recomendaciones.
Las intervenciones de los pacientes y sus representantes durante la discusión sobre el uso de estos como posible terapia en la fase aguda llevaron al GDG a formular recomendaciones para no emplearlos en fase aguda por la falta de evidencia que se presentaba. Sin embargo, se consideró la opción de la preferencia de los pacientes para su uso, por lo que se incluyó este ítem en las recomendaciones.
Los expertos, los pacientes y sus representantes enfatizaron la necesidad del uso de APD como una medida a la que se llega mediante común acuerdo de todas las partes involucradas en el tratamiento.
Se determinaron por consenso las recomendaciones 1 y 2 debido a la ausencia de evidencia sobre indicaciones para el uso de los APD en la fase de mantenimiento.
Los representantes de la ACPEF (Asociación Colombiana de Pacientes con Esquizofrenia) asistieron a todas las reuniones del grupo para el desarrollo de las recomendaciones finales. Para estás recomendaciones en particular, su aporte fue crítico dado que consideraron la posibilidad de iniciar el suministro de APD en la fase aguda, argumentando la baja adherencia inicial de los pacientes al tratamiento por falta de conocimiento de la enfermedad. Esta observación fue tenida en cuenta para la formulación de las recomendaciones, así como para el análisis de la literatura encontrada.
Recomendaciones pertinentes para la preguntaEl GDG formuló las siguientes recomendacionesRecomendación 1. Se recomienda el uso de antipsicóticos de depósito en la fase de mantenimiento del paciente adulto con diagnóstico de esquizofrenia si no hay adherencia al tratamiento con antipsicóticos orales. ↑↑
Recomendación 2. Se sugiere el uso de los antipsicóticos de depósito para el manejo de mantenimiento del paciente adulto con diagnóstico de esquizofrenia cuando el paciente los prefiera. ↑
Recomendación 3. No se recomienda usar antipsicóticos de depósito en la fase aguda de la esquizofrenia en adultos. ↑↑
Recomendación 4. Si el médico y el paciente adulto con diagnóstico de esquizofrenia han optado por el uso de antipsicóticos de depósito para la fase de mantenimiento, se sugiere escoger entre los siguientes antipsicóticos de depósito: Paliperidona, Risperidona, Flufenazina, Haloperidol, Pipotiazina. ↑
Punto de buena práctica 1. Las primeras prescripciones de un antipsicótico de depósito deben ser realizadas por un médico psiquiatra. Ver cuadro para la prescripción en el Apéndice 1. √
Requisitos estructuralesPara que el paciente con esquizofrenia en fase de mantenimiento de la enfermedad reciba la intervención farmacológica adecuada, se debe garantizar la disponibilidad de los siguientes recursos:
- •
Equipo de salud mental entrenado que incluya la participación de psiquiatría y enfermería.
- •
Personal capacitado para brindar entrenamiento a MD generales en el uso de APD.
- •
Personal capacitado para brindar entrenamiento a familiares o acudientes sobre las precauciones que se debe tener con el paciente que recibe APD.
- •
Red de referencia y contrarreferencia para tratamiento del paciente en caso de ser necesario.
- •
APD recomendados (su prescripción inicial debe ser por MD psiquiatras).
Para esta pregunta no se realizó análisis económico específico alguno por parte del GDG para APD; sin embargo, dada la variación de precios en el mercado nacional, se hace necesaria una evaluación de este tipo para una mejor caracterización de los medicamentos aquí mencionados y poder profundizar aún más los hallazgos que se presentan.
Por otra parte, existe la necesidad de estudios cabeza a cabeza entre los neurolépticos de depósito.
Conflictos de interésLa declaración de intereses y evaluación de los mismos se presenta en el anexo 3 de la guía completa que se puede consultar en la página web (gpc.minsalud.gov.co). Los autores no tienen conflictos de interés relacionados con el tópico de artículo.
Al Ministerio de Salud y Protección Social y al Departamento Administrativo de Ciencia, Tecnología e Innovación (COLCIENCIAS), por la financiación para el desarrollo de la guía mediante Contrato 467 de 2012 suscrito con la Pontificia Universidad Javeriana.
Al personal de soporte administrativo para el desarrollo de la guía.
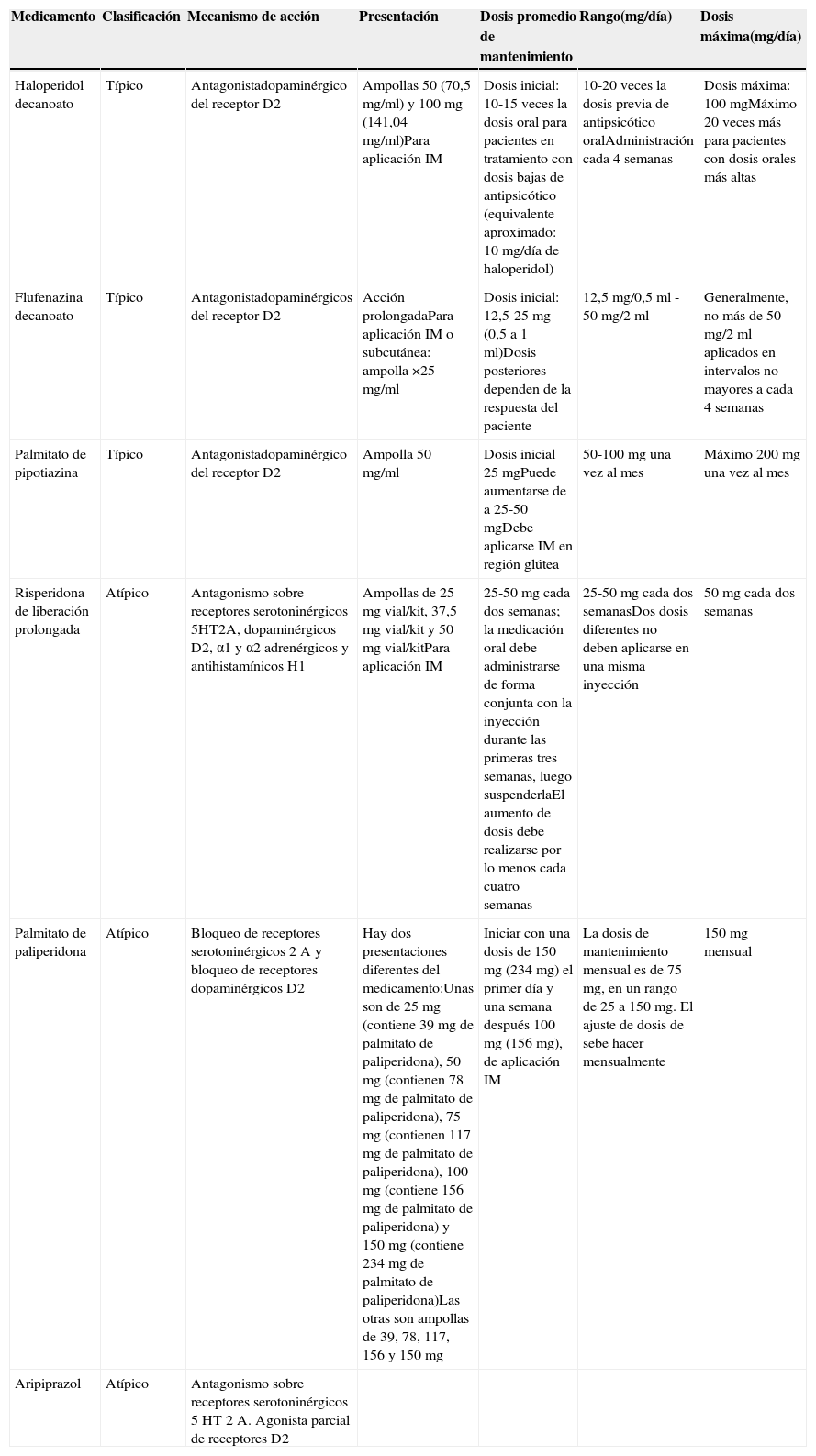
| Medicamento | Clasificación | Mecanismo de acción | Presentación | Dosis promedio de mantenimiento | Rango(mg/día) | Dosis máxima(mg/día) |
|---|---|---|---|---|---|---|
| Haloperidol decanoato | Típico | Antagonistadopaminérgico del receptor D2 | Ampollas 50 (70,5 mg/ml) y 100 mg (141,04 mg/ml)Para aplicación IM | Dosis inicial: 10-15 veces la dosis oral para pacientes en tratamiento con dosis bajas de antipsicótico (equivalente aproximado: 10 mg/día de haloperidol) | 10-20 veces la dosis previa de antipsicótico oralAdministración cada 4 semanas | Dosis máxima: 100 mgMáximo 20 veces más para pacientes con dosis orales más altas |
| Flufenazina decanoato | Típico | Antagonistadopaminérgicos del receptor D2 | Acción prolongadaPara aplicación IM o subcutánea: ampolla ×25 mg/ml | Dosis inicial: 12,5-25 mg (0,5 a 1 ml)Dosis posteriores dependen de la respuesta del paciente | 12,5 mg/0,5 ml - 50 mg/2 ml | Generalmente, no más de 50 mg/2 ml aplicados en intervalos no mayores a cada 4 semanas |
| Palmitato de pipotiazina | Típico | Antagonistadopaminérgico del receptor D2 | Ampolla 50 mg/ml | Dosis inicial 25 mgPuede aumentarse de a 25-50 mgDebe aplicarse IM en región glútea | 50-100 mg una vez al mes | Máximo 200 mg una vez al mes |
| Risperidona de liberación prolongada | Atípico | Antagonismo sobre receptores serotoninérgicos 5HT2A, dopaminérgicos D2, α1 y α2 adrenérgicos y antihistamínicos H1 | Ampollas de 25 mg vial/kit, 37,5 mg vial/kit y 50 mg vial/kitPara aplicación IM | 25-50 mg cada dos semanas; la medicación oral debe administrarse de forma conjunta con la inyección durante las primeras tres semanas, luego suspenderlaEl aumento de dosis debe realizarse por lo menos cada cuatro semanas | 25-50 mg cada dos semanasDos dosis diferentes no deben aplicarse en una misma inyección | 50 mg cada dos semanas |
| Palmitato de paliperidona | Atípico | Bloqueo de receptores serotoninérgicos 2A y bloqueo de receptores dopaminérgicos D2 | Hay dos presentaciones diferentes del medicamento:Unas son de 25 mg (contiene 39 mg de palmitato de paliperidona), 50 mg (contienen 78 mg de palmitato de paliperidona), 75 mg (contienen 117 mg de palmitato de paliperidona), 100 mg (contiene 156 mg de palmitato de paliperidona) y 150 mg (contiene 234 mg de palmitato de paliperidona)Las otras son ampollas de 39, 78, 117, 156 y 150 mg | Iniciar con una dosis de 150 mg (234 mg) el primer día y una semana después 100 mg (156 mg), de aplicación IM | La dosis de mantenimiento mensual es de 75 mg, en un rango de 25 a 150 mg. El ajuste de dosis de sebe hacer mensualmente | 150 mg mensual |
| Aripiprazol | Atípico | Antagonismo sobre receptores serotoninérgicos 5HT 2A. Agonista parcial de receptores D2 |
Fuente: Adaptado de Stahl25.
Dirección y coordinación
Carlos Gómez Restrepo
Adriana Patricia Bohórquez Peñaranda
Equipo Metodológico
Jenny García Valencia
Ana María De la Hoz Bradford
Álvaro Enrique Arenas Borrero
Asistentes de investigación
Mauricio José Avila Guerra
Nathalie Tamayo Martínez
Maria Luisa Arenas González
Carolina Vélez Fernández
Sergio Mario Castro Díaz
Equipo Temático
Luis Eduardo Jaramillo
Gabriel Fernando Oviedo Lugo
Angela Vélez Traslaviña
Luisa Fernanda Ahunca
Equipo de Evaluación Económica
Hoover Quitian
Jair Arciniegas
Natalia Castaño
Equipo de Implementación
Natalia Sánchez Díaz
Andrés Duarte Osorio
Expertos de la Fuerza de Tarea Ampliada
Ana Lindy Moreno López
Edwin Yair Oliveros Ariza
Maribel Pinilla Alarcón
Usuarios
Gloria Nieto de Cano
Marisol Gómez
Gloria Pinto Moreno
Equipo de soporte administrativo
Carlos Gómez Restrepo
Jenny Severiche Báez
Marisol Machetá Rico
Equipo de coordinación metodológica y editorial
Ana María De la Hoz Bradford
Carlos Gómez Restrepo
Equipo de comunicaciones
Mauricio Ocampo Flórez
Pedro Mejía Salazar
Carlos Prieto Acevedo
Marisol Machetá Rico
Jenny Severiche Báez
Paola Andrea Velasco Escobar
Equipo de coordinación general alianza CINETS
Carlos Gómez Restrepo
Rodrigo Pardo Turriago
Luz Helena Lugo Agudelo
Otros Colaboradores
Dr. Carlos Alberto Palacio Acosta, Dr. Alexander Pinzón, Dr. Omar Felipe Umaña
La Guía de práctica clínica para el diagnóstico, tratamiento e inicio de la rehabilitación psicosocial de los adultos con esquizofrenia completa fue desarrollada por el grupo que aparece en el anexo de este artículo. Este artículo-resumen fue redactado por los integrantes del grupo que se mencionan bajo el título. La fuente principal del documento es la guía, aclaramos que algunos apartes fueron tomados textualmente del texto de la guía pues no requerían ajustes o modificaciones. Financiación: El desarrollo de la Guía de Atención Integral fue financiado por el Ministerio de Salud y Protección Social y por el Departamento Administrativo de Ciencia, Tecnología e Innovación (Colciencias), mediante Contrato 467 de 2012 suscrito con la Pontificia Universidad Javeriana. Convocatoria 563 de 2012 de Colciencias (Conformación de un banco de proyectos para el desarrollo de Guías de Atención Integral (GAI) Basadas en Evidencia), fue elegido por el Consejo del Programa Nacional de Ciencia y Tecnología de la Salud, el proyecto fue liderado por la Pontificia Universidad Javeriana, en alianza con la Universidad de Antioquia y la Universidad Nacional de Colombia (Alianza CINETS).