El diagnóstico del síndrome antifosfolípido requiere resultados anormales de anticoagulante lúpico y títulos elevados de anticuerpos anticardiolipina (aCL) y β2glicoproteína I (anti-β2GPI). Las últimas pruebas inmunológicas carecen de un umbral estándar en la práctica clínica.
ObjetivoDeterminar el punto de referencia (percentil 99) para los aCL y anti-β2GPI en voluntarios sanos.
Materiales y métodosSe llevó a cabo un estudio transversal descriptivo en el que se realizó una medición de los títulos de anticuerpos anticardiolipina y β2glicoproteína I (IgG e IgM por ensayo inmunoabsorbente ligado a enzimas) en 49 donantes de sangre sanos en Medellín, Colombia. Se excluyeron aquellos sujetos que tuvieran antecedentes de trombosis, morbilidad del embarazo, tumores, infecciones o enfermedades autoinmunes y también se evaluaron las variables sociodemográficas e inmunológicas. Los títulos de los anticuerpos se describen en mediana y rango intercuartílico. Se estimó el percentil 99.
ResultadosSe analizaron aCL y anti-β2GPI en 16 hombres y 33 mujeres. Los valores del límite superior del rango de referencia (percentil 99) de aCL y anti-β2GPI fueron: aCL IgM: 18,0, aCL IgG: 16,1, anti-β2GPI IgM: 16,4 y anti-β2GPI IgG: 6,9.
ConclusionesLos límites superiores obtenidos difieren en gran medida de los valores arbitrarios de clasificación sugeridos en las pautas internacionales, teniendo en cuenta que usualmente se requieren valores superiores a 40 unidades internacionales (UI) y los valores identificados en este estudio están entre 6,9 y 18 de estas unidades. Se sugiere hacer estudios adicionales que validen puntos de corte según los percentiles explorados en este estudio.
Antiphospholipid syndrome diagnosis requires abnormal results of lupus anticoagulant and high titles of anticardiolipin (aCL) and β2glycoprotein I (anti-β2GPI) antibodies. The latter immunological tests lack a standard threshold in clinical practice.
ObjectiveTo determine the 99th percentile of aCL and anti-β2GPI in healthy volunteers.
Materials and methodsThis cross-sectional study reviewed antibody titles of anticardiolipin and β2glycoprotein I (IgG and IgM by enzyme-linked immunosorbent assay) in forty-nine healthy blood donors in Medellin, Colombia. Sociodemographic and immunological variables are also assessed. Antibody titles are described in median and interquartile range and the 99th percentile was estimated.
ResultsWe analysed samples from 16 men and 33 women. We found that the upper limits of the reference range (99th percentile) of aCL and anti-β2GPI were: aCL IgM: 18.0, aCL IgG: 16.1, anti-β2GPI IgM: 16.4, and anti- β2GPI IgG: 6.9.
ConclusionsThe upper limits obtained differ greatly from the arbitrary classification values suggested in the international guidelines, taking into account that values greater than 40 international units are usually required, and the values identified in this study are between 6.9 and 18 international units. We suggest conducting additional studies that validate cut-off points according to the percentiles explored in this work.
El síndrome antifosfolípido (SAF) es una enfermedad autoinmune caracterizada por la presencia de dos grupos de manifestaciones clínicas (trombosis y morbilidad gestacional) y de anticuerpos antifosfolípidos (AAF) persistentemente positivos. Su incidencia se calcula en cerca de 5 casos nuevos por 100.000 individuos por año y su prevalencia oscila entre 40 y 50 casos por 100.000 individuos1. El SAF tiene una alta carga de enfermedad: desde la perspectiva trombótica, se calcula que el 13% de los sujetos con ataque cerebrovascular (ACV), el 11% de los individuos con infarto agudo de miocardio y el 9,5% de los pacientes con trombosis venosa profunda tienen SAF2. Las mujeres menores de 50 años con ACV y SAF tienen un riesgo elevado de un nuevo evento isquémico hasta de 201 veces2. Con respecto a morbilidad gestacional relevante (definida como pérdida gestacional recurrente, parto pretérmino, preeclampsia y retardo del crecimiento intrauterino), el SAF es responsable hasta del 6% de estas manifestaciones en la población obstétrica general; además, el 11% de los mortinatos es secundario a esta patología3.
El diagnóstico de esta entidad se establece al cumplir al menos un criterio clínico y un criterio de laboratorio (AAF); este último debe estar positivo al menos en dos mediciones separadas, como mínimo 12 semanas4. Con respecto al criterio de laboratorio, los AAF son fundamentalmente 3: anticoagulante lúpico (AL), anticuerpos anticardiolipina (aCL) y anti-β2 glicoproteína I (anti-β2GPI). La primera prueba es funcional, ampliamente estandarizada, en cambio, los aCL tienen dos opciones de positividad: tener más de 40 UI (considerados títulos moderados o altos) por la técnica de Elisa o que su valor sea igual o superior al percentil 99. Por otro lado, los anti-β2GPI deben ser mayores al percentil 99 y se expresan en unidades arbitrarias4. La definición de estos valores de aCL y anti-β2GPI tiene problemas: los criterios de Sidney del 2006 sugieren que este percentil 99 sea tomado de los puntos de corte del fabricante de la prueba; el percentil 99 de este punto de corte oscila, por ejemplo, para los aCL entre 15 y 39 UI, lo cual lleva a imprecisión diagnóstica5. Se han propuesto varias razones que explican esta variabilidad en el percentil 99 de los AAF: se han empleado diferentes equipos de ejecución, existen múltiples técnicas de ejecución, falta uniformidad en el material de referencia para la calibración y la validación de este percentil se ha hecho en personas sanas, pero no en pacientes con SAF.
Desde el punto de vista clínico, se ha descrito en estudios observacionales (principalmente cohortes) que los títulos bajos de aCL (entre 20 y 40 UI) parecen ser clínicamente significativos cuando son mayores de 20 UI (presentes entre el 17 y el 23%) en pacientes tanto con SAF trombótico como obstétrico6,7. Los títulos bajos también se han considerado para los pacientes con alta sospecha de SAF, con el agravante de que, especialmente los aCL tipo IgM, tienden a dar resultados falsos positivos en este rango, en particular en presencia de crioglobulinas, factor reumatoide positivo o infecciones8.
En relación con los anticuerpos anti-β2GPI, estos no se reportan en unidades internacionales como los aCL, sino que se rotulan en unidades arbitrarias, además, se desconoce con precisión su percentil 99, hecho que va en contravía de las recomendaciones del Subcomité Científico y de Estandarización de la Sociedad Internacional de Trombosis y Hemostasis5.
Desde el punto de vista técnico, se recomienda que el punto de corte no paramétrico (es decir, aquel que se emplea cuando se desconoce la distribución que siguen los datos y el resultado estadístico proviene de un orden) del percentil 99 es más específico que la presencia de títulos moderados o altos de AAF en el diagnóstico de SAF9. Adicionalmente, estos puntos de corte deben determinarse en una población de voluntarios sanos10–12. Después de una exhaustiva revisión de la literatura, es claro que en nuestro medio se desconoce el percentil 99 de los AAF, o bien estudios que hayan intentado definirlo, lo que sería de gran utilidad ya que permitiría tener una mayor precisión diagnóstica de esta entidad, la cual tiene una carga alta de morbimortalidad y cuyo diagnóstico adecuado permite el inicio y el mantenimiento de una terapia antitrombótica o anticoagulante no exenta de riesgos, sobre todo sangrado, pero que se instaure en la población indicada.
Es fundamental considerar que el hecho de conocer con más claridad el percentil 99 en nuestro medio podría aumentar tanto la precisión como la validez diagnóstica, pues de esta forma se puede favorecer la exactitud y la reproducibilidad en el abordaje diagnóstico de los pacientes, además de aumentar el potencial de la prueba para discriminar entre las personas enfermas y sanas para condiciones específicas como el SAF.
El objetivo del presente estudio fue determinar el punto de referencia (percentil 99) para los aCL y anti-β2GPI, según características sociodemográficas e isotipos de anticuerpos en voluntarios sanos en una institución en la ciudad de Medellín.
Pacientes y métodosDiseño del estudio y selección de los pacientesSe llevó a cabo un estudio transversal descriptivo en personas sanas que fueron donantes de sangre en una institución del noroccidente colombiano, que asimismo cumplieran con los criterios de elegibilidad y aceptaran participar en el estudio entre diciembre del 2019 y enero del 2020.
Los criterios de elegibilidad específicos fueron:
Población sanaHombres y mujeres no embarazadas mayores de 18 años colombianos.
Sin signos clínicos de trombosis, tumores o enfermedades autoinmunes.
Sin signos de infección actual (respiratoria, piel y tejidos blandos, gastrointestinal, genitourinaria, sistema nervioso o cualquier otro órgano o sistema).
Pacientes con resultados negativos para exámenes usuales de tamización de enfermedades infecciosas (anticuerpos contra el VIH I y II, antígeno de superficie de la hepatitis B, core de la hepatitis B, anticuerpos contra hepatitis C, sífilis, anticuerpos contra enfermedad de Chagas y anticuerpos contra HTLV I y II), realizados por protocolo en el banco de sangre.
El número de participantes en el estudio fue determinado por conveniencia, debido a cuestiones de costos de las pruebas de laboratorio que era preciso realizar, por lo cual se decidió seleccionar una población de 49 sujetos que acudieron a un centro como donantes de sangre voluntarios. Se consideró que este número era suficiente, teniendo en cuenta que para cumplir con el objetivo general del estudio se recomienda utilizar entre 30 y 50 sueros de individuos sanos (13). Es fundamental resaltar que en la literatura no se han documentado cálculos de tamaño de muestra, sino que esta es la forma analítica y preanalítica de realizar este tipo de estudios.
Proceso de recolección de datosUna vez se obtuvo el aval del comité de ética en investigación en salud de la institución participante, a todos los participantes se les solicitó autorización mediante un consentimiento informado por escrito que fue diligenciado antes de responder el formulario usual que se emplea para donantes de sangre y la toma de muestra de sangre. Este formulario tenía como objetivo identificar los antecedentes personales, familiares y los hábitos de vida del paciente. La persona encargada de revisar dicho formulario, además de hacer una valoración de los signos clínicos, fue un especialista en medicina interna. Dicha valoración fue clínica, por medio de anamnesis y examen físico completo. En el cuestionario se interrogó sobre la fecha de la última menstruación y el uso de métodos de planificación, a fin de determinar el estado de embarazo en las mujeres. Aquellos sujetos en los cuales no se detectaron condiciones de riesgo en la encuesta se consideraron población sana. De igual forma, según los protocolos internacionales para ser donantes de sangre, era necesario verificar los resultados negativos de las múltiples pruebas infecciosas.
A cada participante se le efectuó una medición de aCL y anti-β2GPI IgM e IgG en plasma utilizando un ensayo por inmunoabsorción ligado a enzimas (Elisa), empleado en el laboratorio de referencia. Dicho método es el que usan los laboratorios la mayoría de las veces13,14. Los Elisa detectan todos los anticuerpos reactivos con β2GPI y antígeno de cardiolipina, incluidos los anticuerpos no patógenos, los fosfolípidos independientes y el anti-β2GPI de baja afinidad. Para imitar la unión del β2GPI a los fosfolípidos cargados negativamente, se utilizan placas con carga negativa (alta unión o irradiadas con rayos gamma), en tanto que para aumentar la densidad del antígeno tras el proceso de incubación en pocillos y lavado de forma secuencial se logra obtener un resultado cuantitativo del AAF15.
Para la medición de aCL se utilizó Quanta Lite® ACA IgM III e IgG III (Inova Diagnostics, San Diego CA, EE. UU.), que tiene como rango de referencia normal valores inferiores a 12,5 MPL (unidades estándar de inmunoglobulina M) y 15 GPL (unidades estándar de inmunoglobulina G), respectivamente. En lo referente a la medición de anti-β2GPI, se utilizó QUANTA Lite® β2 GPI IgM e IgG (Inova Diagnostics), que tiene como rango de referencia normal valores inferiores a 20 unidades/mL para las 2 pruebas. La muestra de sangre utilizada correspondía a la misma en la cual se tomó muestra para la donación de sangre; en consecuencia, no se requería un volumen de sangre mayor que el habitual utilizado en este procedimiento. Una vez tomada la muestra, esta fue procesada en el laboratorio.
Se recolectaron variables sociodemográficas (sexo y edad) e inmunológicas (valores de anticuerpos aCL y de anti-β2GPI IgG e IgM en plasma). Una vez finalizado el procesamiento de las muestras y la recolección de la información, esta se exportó a una hoja de cálculo electrónica en Microsoft Excel® 2016, en la cual se recodificaron las variables que lo requirieron y se exploró la consistencia de los datos antes de su posterior análisis.
Para controlar los posibles sesgos en los que se podía incurrir, se aplicaron las siguientes estrategias: se organizó una discusión entre los investigadores del protocolo y del proceso de recolección de la información; el sesgo de información se intentó controlar mediante estandarización al momento de ingresar la información a la base de datos, la cual asimismo contaba con campos validados para evitar errores en la digitación de los datos y así aumentar su confiabilidad; además, se evaluó la calidad de la información mediante la exploración de valores (detección de datos extremos, valores inconsistentes, entre otros) y en caso de duda se confrontó la información con las fuentes primarias.
Análisis estadísticoLas variables cualitativas se expresaron mediante frecuencias absolutas y relativas y las cuantitativas empleando media con desviación estándar (DE) o mediana con rango intercuartílico, según la distribución de los datos evaluada mediante la prueba Shapiro-Wilk, indicada para una n menor a 50 observaciones. A efectos de determinar el punto de corte de referencia o de positividad, se estimó el percentil 99 de la distribución de los valores de los aCL y de los anti-β2GPI IgG e IgM. También se describieron estos valores según las variables sociodemográficas y los isotipos de los anticuerpos, en tanto que los puntos de corte obtenidos se compararon con los propuestos por el fabricante en la técnica de Elisa. Los análisis se realizaron en el programa IBM SPSS versión 24 (IBM Corp., Armonk, NY, EE. UU.).
Consideraciones éticasEsta investigación se clasificó como de riesgo mínimo, según la Resolución 8430 de 1993 del Ministerio de Salud y Protección Social, y fue aprobada por el comité de ética de investigación en salud de las instituciones participantes. Todos los pacientes aceptaron de forma voluntaria la participación en el estudio y firmaron el consentimiento informado.
ResultadosSe recolectaron muestras de sangre de 49 sujetos, 16 hombres y 33 mujeres, de raza mestiza, ningún afrocolombiano ni sujetos de otras razas. Todos los sujetos se encontraban asintomáticos. Las características generales de la muestra se presentan en la tabla 1.
Características generales de 49 sujetos sanos donantes de sangre
| Características | 49 pacientes |
|---|---|
| Edad-años (media ± DE) | 34,1 ± 12,6 |
| Sexo femenino - número (%) | 33 (67,3) |
| Índice de masa corporal - kg/m2 (media ± DE) | 25,8 ± 4,2 |
| Resultado de pruebas de infecciones - número (%)Negativo | 49 (100) |
Fuente: Elaboración propia.
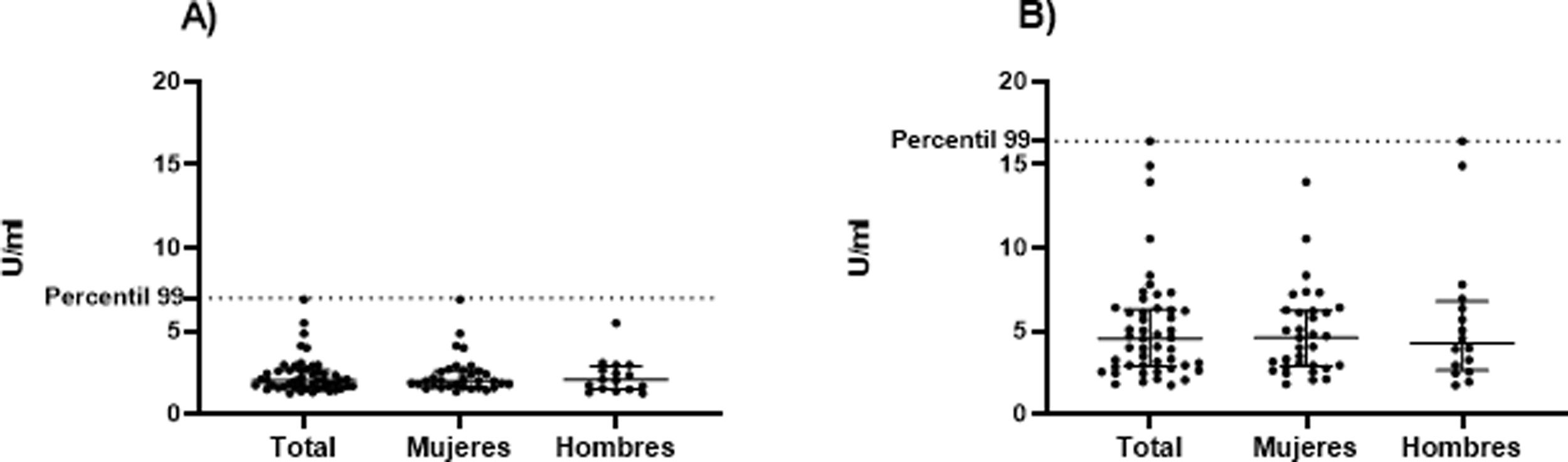
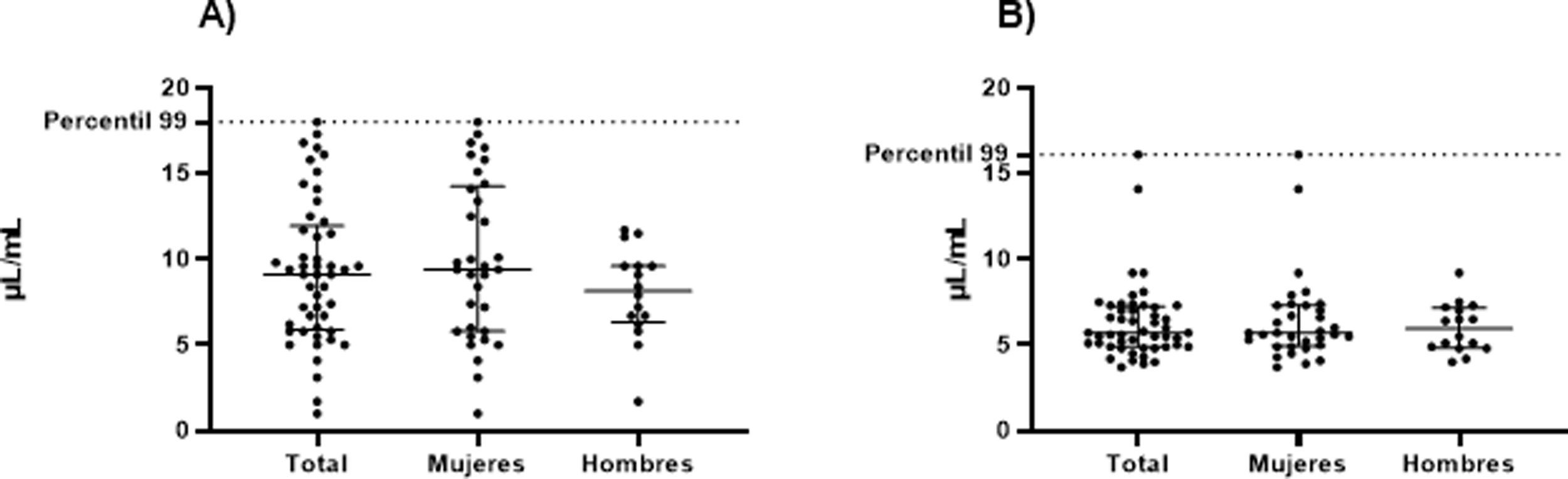
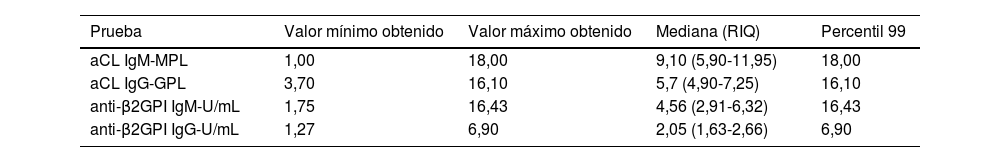
Los valores del límite superior del rango de referencia (percentil 99) de aCL y anti-β2GPI en 49 sujetos sanos fueron: aCL IgM: 18,0, aCL IgG: 16,1, anti-β2GPI IgM: 16,4 y anti-β2GPI IgG: 6,9. Dicha información se muestra con mayor detalle en la tabla 2 y en las figuras 1 y 2.
Percentil 99 de las diferentes pruebas de anticuerpos antifosfolípidos realizadas en 49 donantes voluntarios sanos de un banco de sangre
| Prueba | Valor mínimo obtenido | Valor máximo obtenido | Mediana (RIQ) | Percentil 99 |
|---|---|---|---|---|
| aCL IgM-MPL | 1,00 | 18,00 | 9,10 (5,90-11,95) | 18,00 |
| aCL IgG-GPL | 3,70 | 16,10 | 5,7 (4,90-7,25) | 16,10 |
| anti-β2GPI IgM-U/mL | 1,75 | 16,43 | 4,56 (2,91-6,32) | 16,43 |
| anti-β2GPI IgG-U/mL | 1,27 | 6,90 | 2,05 (1,63-2,66) | 6,90 |
aCL: anticuerpos anticardiolipina; anti-β2GPI: anti-β2 glicoproteína I; DE: desviación estándar; RIQ: rango intercuartílico.
GPL: 1 mL/mL de IgG aCL; MPL: 1 mL/mL de IgM.
Fuente: Elaboración propia.
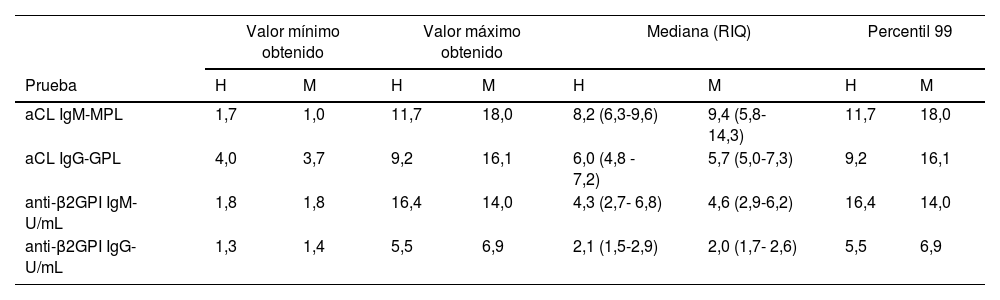
En la tabla 3 se presentan los resultados de aCL y anti-β2GPI, según el sexo del participante. Se observan valores más altos del percentil 99 de aCL, tanto IgG como IgM, en mujeres.
Percentil 99 de las diferentes pruebas de anticuerpos antifosfolípidos según el sexo de los participantes
| Valor mínimo obtenido | Valor máximo obtenido | Mediana (RIQ) | Percentil 99 | |||||
|---|---|---|---|---|---|---|---|---|
| Prueba | H | M | H | M | H | M | H | M |
| aCL IgM-MPL | 1,7 | 1,0 | 11,7 | 18,0 | 8,2 (6,3-9,6) | 9,4 (5,8-14,3) | 11,7 | 18,0 |
| aCL IgG-GPL | 4,0 | 3,7 | 9,2 | 16,1 | 6,0 (4,8 - 7,2) | 5,7 (5,0-7,3) | 9,2 | 16,1 |
| anti-β2GPI IgM-U/mL | 1,8 | 1,8 | 16,4 | 14,0 | 4,3 (2,7- 6,8) | 4,6 (2,9-6,2) | 16,4 | 14,0 |
| anti-β2GPI IgG-U/mL | 1,3 | 1,4 | 5,5 | 6,9 | 2,1 (1,5-2,9) | 2,0 (1,7- 2,6) | 5,5 | 6,9 |
H: hombres, M: mujeres; aCL: anticuerpos anticardiolipina; anti-β2GPI: anti-β2 glicoproteína I; DE: desviación estándar; RIQ: rango intercuartílico.
GPL: 1 mL/mL de IgG aCL; MPL: 1 mL/mL de IgM.
Fuente: Elaboración propia.
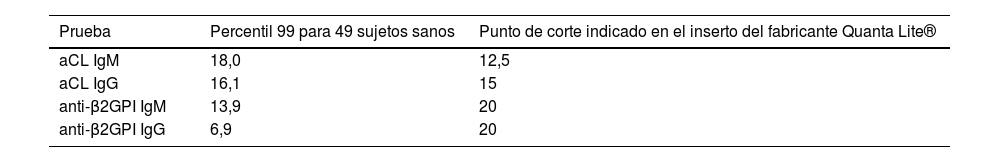
En la tabla 4 se describen los resultados de aCL y anti-β2GPI en 49 sujetos sanos, así como los valores de referencia del fabricante de las pruebas.
Percentil 99 de las diferentes pruebas de anticuerpos antifosfolípidos en 49 sujetos sanos y los valores de referencia para del fabricante de las pruebas
| Prueba | Percentil 99 para 49 sujetos sanos | Punto de corte indicado en el inserto del fabricante Quanta Lite® |
|---|---|---|
| aCL IgM | 18,0 | 12,5 |
| aCL IgG | 16,1 | 15 |
| anti-β2GPI IgM | 13,9 | 20 |
| anti-β2GPI IgG | 6,9 | 20 |
aCL: anticuerpos anticardiolipina; anti-β2GPI: anti-β2 glicoproteína I.
Fuente: Elaboración propia.
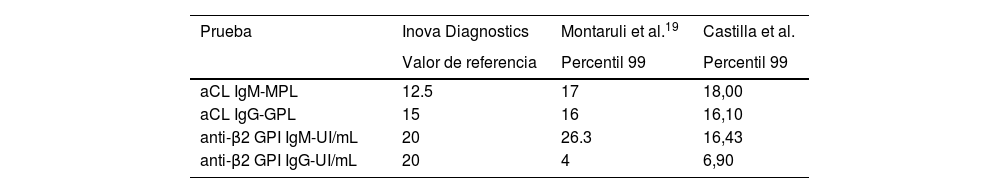
En la tabla 5 se comparan los diferentes valores del percentil 99 para el fabricante Inova Diagnostics.
Comparación de diferentes valores del percentil 99 para el fabricante Inova Diagnostics
| Prueba | Inova Diagnostics | Montaruli et al.19 | Castilla et al. |
|---|---|---|---|
| Valor de referencia | Percentil 99 | Percentil 99 | |
| aCL IgM-MPL | 12.5 | 17 | 18,00 |
| aCL IgG-GPL | 15 | 16 | 16,10 |
| anti-β2 GPI IgM-UI/mL | 20 | 26.3 | 16,43 |
| anti-β2 GPI IgG-UI/mL | 20 | 4 | 6,90 |
GPL: 1 mL/mL de IgG aCL; MPL: 1 mL/mL de IgM.
Fuente: Elaboración propia.
Hasta donde se sabe, este es el primer estudio en nuestro medio que evalúa el valor del percentil 99 para aCL y anti-β2GPI en población sana. Es fundamental resaltar que los límites superiores del rango de referencia normal de AAF encontrados en este estudio difieren de los valores de corte de clasificación seleccionados arbitrariamente por las directrices del consenso internacional sobre las pruebas de aCL y anti-β2GPI15,16, los cuales se obtuvieron a partir de estudios observacionales y del punto de corte de Elisa reportado por el fabricante. Es esencial recordar que si no se conocen con claridad los valores clínicamente significativos de AAF, se puede obtener una falla diagnóstica entre 9,5-29,4% de los casos17. De los cuatro AAF a los cuales se les identificó el percentil 99 en los sujetos evaluados, únicamente el aCL IgG cuenta con un valor realmente cerca al punto de corte indicado en el inserto del fabricante, los demás difieren en mayor medida.
Es llamativo además que el percentil 99 identificado en la muestra de pacientes del presente estudio también es diferente al momento de comparar dicho resultado entre hombres y mujeres, sin embargo, como se sabe, el estándar de referencia no hace distinciones entre sexo. En la literatura se han reportado diferentes problemas técnicos en los Elisa utilizados para la determinación de AAF, tanto pre como postanalíticos, además de una importante variabilidad interlaboratorio con respecto al rendimiento para aCL y anti-β2GPI, la cual obedece a la falta de uniformidad en el material de referencia para la calibración18.
El problema científico principal radica en que el criterio de laboratorio basado en aCL y anti-β2GPI para el diagnóstico del SAF es poco preciso, además, se ha visto variación en diferentes poblaciones, tanto en los rangos de referencia obtenidos con los kits comerciales como en los valores pautados por los criterios clasificatorios19. Esta puede ser una explicación para los resultados discordantes encontrados.
La variación en los resultados de la prueba se origina en problemas metodológicos en la realización de los ensayos, diferencias en la calibración y ausencia de consenso en la interpretación de los resultados con respecto a la clasificación como positiva o negativa15. La falta de uniformidad en el material de referencia utilizado para la calibración, como también la variedad en los calibradores, es uno de los problemas principales, ya que esto genera diferencias en los títulos entre los ensayos15. Hoy es claro que el método de detección más común de aCL y anti-β2GPI es mediante Elisa, no obstante, a medida que pasa el tiempo, se han introducido en el mercado más plataformas automatizadas que requerirán proporcionar detalles y especificaciones adicionales para la detección y la interpretación de sus resultados20.
En lo referente a la información disponible sobre el fabricante Quanta Lite® (Inova Diagnostics), se sabe que los puntos de referencia para estas pruebas de laboratorio se obtuvieron a partir de muestras aleatorias de donantes normales, en las que se analizaron 489 y 488 muestras para obtener el rango de referencia en las aCL IgM e IgG, respectivamente. Por otro lado, para las anti-β2GPI IgM, este fabricante informa que se sometieron a ensayo un total de 313 muestras normales de un grupo formado por una cantidad similar de hombres y mujeres de edades comprendidas entre los 18 y los 58 años. Asimismo, se utilizaron 256 muestras de donantes normales para obtener el valor de las anti-β2GPI IgG.
En la literatura se han hecho varios intentos para determinar este percentil 99 en voluntarios sanos, con diferentes resultados.
Montaruli et al. definieron este percentil en una población del noroccidente italiano en 104 sujetos sanos, se compararon tres diferentes técnicas de Elisa disponibles y se encontraron diferencias sustanciales entre los puntos de corte reportados por el fabricante (entre 7 y 18 UI), que en su mayoría correspondieron a títulos bajos, lejanos del valor de referencia arbitrario de los criterios de Sidney19. Cabe resaltar que una de las técnicas de Elisa empleada en dicho estudio corresponde al mismo fabricante utilizado en el presente trabajo (Inova Diagnostics). Al comparar los resultados reportados por estos autores con este fabricante en especial (tabla 5), podría concluirse que las aCL IgG e IgM y la anti-β2GPI IgG tienen valores de percentil 99 similares a lo documentado en el presente estudio; sin embargo, el valor correspondiente a las anti-β2GPI IgM si es sustancialmente diferente.
Ruffatti et al. quisieron validar los títulos moderados y altos de AAF en 90 sujetos con SAF, partiendo de un percentil 99 en sujetos sanos de 17,4 UI, obtenido en 100 voluntarios sanos, y encontraron que solo 64 sujetos tenían títulos moderados o altos. Asimismo, hasta un 74% de las pacientes con morbilidad gestacional y el 16,4% de los pacientes con trombosis tenían títulos bajos de AAF, resultado que reitera la mayor especificidad del percentil 99 obtenido en población sana cuando se compara con los títulos moderados o altos de AAF9.
Es llamativo que en el actual estudio, de manera similar a los descritos con anterioridad, se encuentran valores de percentil 99 para anti-β2GPI en población sana realmente bajos. Un aspecto crucial en la identificación de AAF son sus implicaciones diagnósticas y pronósticas, debido a la frecuencia de retrombosis y morbilidad gestacional recurrente, además de la morbimortalidad inherente a estas complicaciones clínicas. Otro hecho claro es que es más específico obtener el percentil 99 en voluntarios sanos, porque subsanaría en parte los errores preanalíticos, analíticos y postanalíticos de las pruebas de laboratorio disponibles para el diagnóstico de SAF.
Nuestro estudio tiene varias debilidades, como el hecho de que fue realizado únicamente con un tipo de ensayo comercial, la población se seleccionó de una sola institución y la inclusión de un número pequeño de pacientes, todos mestizos, razón por la cual impide extrapolar los resultados a pacientes de otras etnias y países. Por ello, no es representativo del total de la población.
Es muy importante recordar que los criterios de clasificación y los de diagnóstico son diferentes, por lo cual es probable que este tipo de estudios no altere los criterios de clasificación, pues estos tienen fines investigativos y, por tanto, siempre propenderán por dar valor a la especificidad. Sin embargo, resultados de estas características sí brindan información fundamental para enfocar pacientes que están precriterios y en quienes el clínico considera el diagnóstico y no la clasificación debido a que dicho dato de distribución poblacional hace que el peso de los resultados encontrados cambie.
Las fortalezas del estudio consisten en que es la primera aproximación en lo relacionado con este tema en nuestro medio. Obtener un valor de referencia de percentil 99 para AAF es sumamente importante, ya que este, de alguna forma, puede aumentar el rendimiento diagnóstico de las pruebas, brindando así un manejo adecuado y ajustado, además de buscar impactar en complicaciones asociadas con la enfermedad, tanto clínicas como las relacionadas con sangrado secundario al tratamiento. El siguiente paso después de haber obtenido estos resultados será comparar los valores de percentil 99 de AAF con otros tipos de ensayos comerciales, además, con una población que ya tenga el diagnóstico de SAF, esto con el objetivo de validar dichos resultados.
Finalmente, es necesario mencionar que este es un estudio que abre un campo para la investigación, puesto que si estos resultados no son tomados con cautela podríamos incurrir en un sobrediagnóstico. Para ello, será necesario profundizar en el tema y buscar que otros grupos de investigadores corroboren la información en otra población.
ConclusionesPara el diagnóstico del síndrome antifosfolípido se deben cumplir al menos un criterio clínico y uno de laboratorio, razón por la cual se hace tan importante tener información clara relacionada con el valor de los anticuerpos antifosfolípidos. En el presente estudio se encontraron diferencias al determinar el punto de referencia (percentil 99) para los aCL y anti-β2GPI con respecto a los puntos de corte internacionales y, en menor medida, para los valores de referencia del laboratorio, principalmente según el isotipo del anticuerpo, teniendo en cuenta que usualmente se requieren valores mayores de 40 UI y los valores identificados en este estudio están entre 6,9 y 18 de estas unidades. Este tipo de estudios es importante porque ayuda a caracterizar la población y permite afianzar en mayor medida la información conocida con respecto al diagnóstico del síndrome antifosfolípido.
FinanciaciónLa presente investigación utilizó fondos derivados de la Asociación Colombiana de Reumatología; dichos fondos no tenían una asociación específica con el sector comercial y eran sin fines de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses para la elaboración de este artículo.
A la doctora María Fernanda Álvarez Barreneche por la revisión del manuscrito y al banco de sangre y al servicio del laboratorio del hospital Pablo Tobón Uribe.