Los pacientes con artritis reumatoide tienen un riesgo cardiovascular elevado por la alta prevalencia de factores de riesgo cardiovascular y de alteraciones metabólicas derivadas de la actividad inflamatoria y del tratamiento de su enfermedad. No se ha realizado una evaluación sistemática del efecto de las estatinas en las fracciones lipídicas y desenlaces cardiovasculares específicamente en pacientes con artritis reumatoide.
MétodosSe realizó una búsqueda de la literatura en Medline (PubMed), Embase, Lilacs, Scielo y Cochrane. Se seleccionaron experimentos clínicos aleatorizados y no aleatorizados (estudios de cohortes) que evaluaran el impacto de las estatinas en mortalidad, eventos cardiovasculares, fracciones lipídicas y actividad de la enfermedad en pacientes con artritis reumatoide. Se realizó la selección, evaluación del riesgo de sesgos de forma pareada y un metaanálisis con RevMan 5.3®.
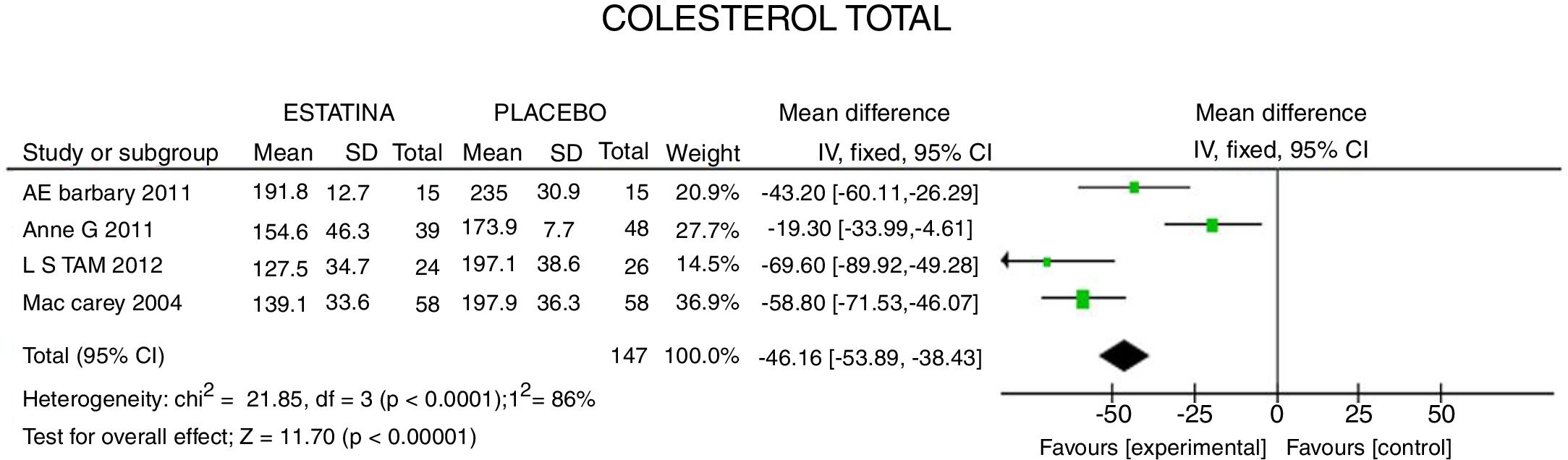
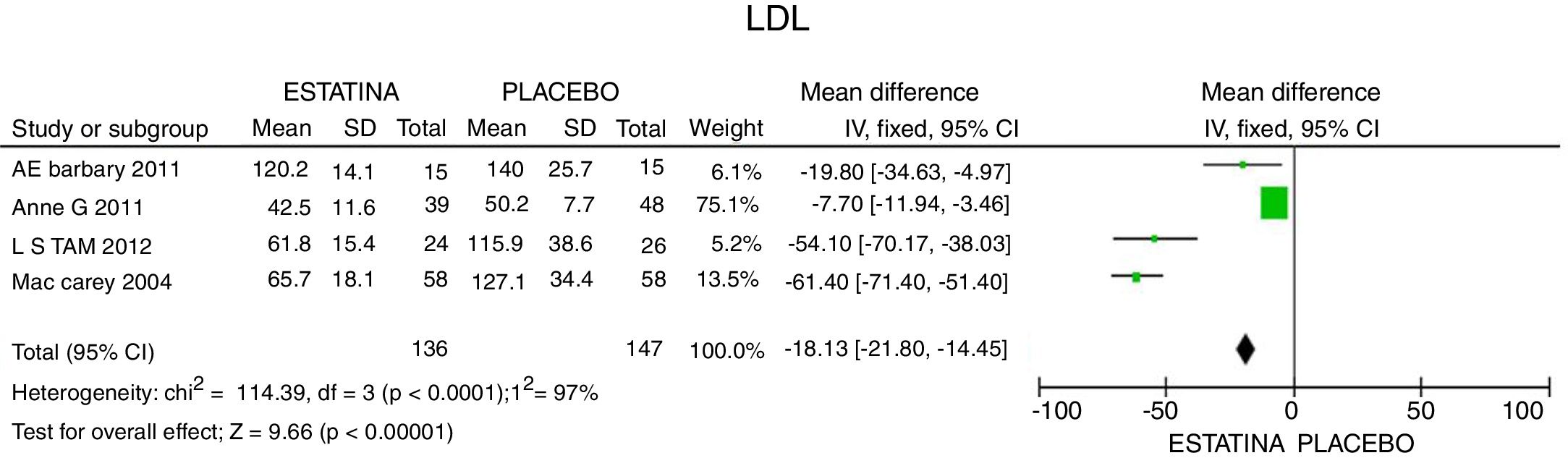
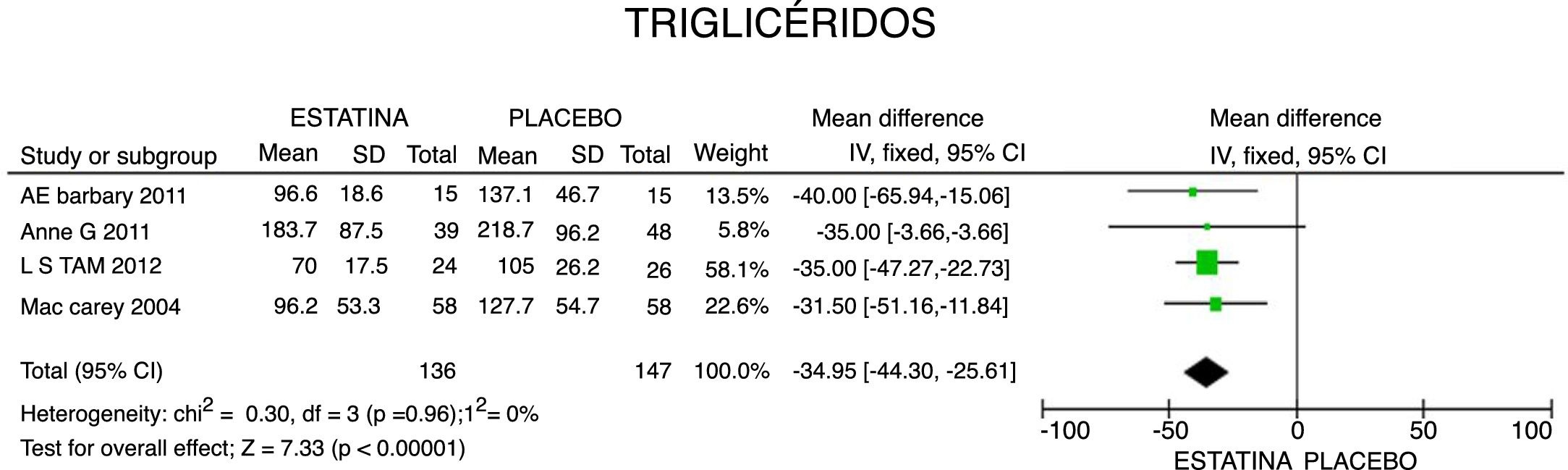
ResultadosUn total de 5 estudios y 383 pacientes fueron incluidos en el análisis. El uso de estatinas en pacientes con artritis reumatoide reduce significativamente los niveles de colesterol total: −46,16mg/dL (IC 95%: [−53,89; −38,46]; I2: 86%), LDLc: −18,13mg/dL (IC 95%: [−21,8; −14,4]; I2: 97%) y triglicéridos de −34,95mg/dL (IC 95%: [−44,3; −25,6]; I2: 0%), sin cambios significativos del HDLc. Además, reduce la actividad de la enfermedad (DAS28) en 0,73 (IC 95%: [−0,94; −0,53]; I2: 96%). No se encontró ningún estudio que reportara mortalidad ni desenlaces cardiovasculares.
ConclusiónEl efecto hipolipidemiante de las estatinas en pacientes con artritis reumatoide es consistente con lo encontrado en otras poblaciones. Existe un discreto impacto en la reducción de actividad de la enfermedad; sin embargo, la reducción del riesgo de eventos cardiovasculares en esta población específica no ha sido estudiada.
Patients with rheumatoid arthritis have a higher cardiovascular risk due to the prevalence of cardiovascular risk factors and metabolic alterations derived from the inflammatory activity and the treatment of their disease. A systematic evaluation of the effect of statins on lipid fractions and cardiovascular outcomes has not been carried out specifically in patients with rheumatoid arthritis.
MethodsA literature search was conducted in Medline (PubMed), Embase, Lilacs, Scielo, and Cochrane. Randomized and non-randomized clinical trials were selected that evaluated the impact of statins on mortality, cardiovascular events, lipid fractions and disease activity in patients with rheumatoid arthritis. A paired evaluation of risk of bias was carried out, along with a meta-analysis using RevMan 5.3®.
ResultsA total of 5 studies and 383 patients were included in the analysis. The use of statins among patients with rheumatoid arthritis significantly reduced total cholesterol levels: −46.16mg/dL (95% CI: [−53.89, −38.46]; I2: 86%), LDLc: −18.13mg/dL (95% CI: [−21.8, −14.4], I2: 97%) and TG of −34.95mg/dL (95% CI: [−44.3, −25.6], I2: 0%), without significant changes in HDLc. It also reduced the activity of the disease (DAS28) by 0.73 (95% CI: [−0.94, −0.53], I2: 96%). No study was found that reported mortality or cardiovascular outcomes.
ConclusionThe lipid-lowering effect of statins in patients with rheumatoid arthritis is consistent with that found in other populations. There is a slight impact in reducing the activity of the disease, but reducing the risk of cardiovascular events in this specific population has not been studied.
La artritis reumatoide (AR) es un factor de riesgo independiente de morbimortalidad cardiovascular1-3 e incluso se ha descrito que los eventos cardiovasculares son la principal causa de muerte en pacientes con AR4,5. La AR es una enfermedad sistémica autoinmune que cursa con un proceso inflamatorio significativo6. Existen múltiples mecanismos fisiopatológicos que favorecen el proceso aterogénico originados por la inflamación que elevan el riesgo cardiovascular y, en especial, el riesgo de enfermedad coronaria en comparación con población sin AR7-10.
Las causas específicas de este proceso en AR no están totalmente establecidas. Se considera que, además de factores de riesgo cardiovascular clásicos, existe una compleja interacción entre un componente genético y la presencia de inflamación crónica11. En los pacientes con AR, especialmente en aquellos con enfermedad activa, se encuentra un descenso marcado del colesterol de alta densidad (HDLc) y una consecuente elevación del índice aterogénico con pérdida de su función antiaterogénica y antioxidante, con lo que pasa a tener un perfil prooxidativo y proaterogénico1,12. Además, hay aumento de mediadores inflamatorios, lo que promueve el incremento del proceso ateromatoso y el daño endotelial13.
Se ha descrito un efecto paradójico en la reducción del colesterol total (CT) y del colesterol de baja densidad (LDLc) en pacientes con AR, usualmente asociado a estados de enfermedad activa, con incremento del riesgo de complicaciones cardiovasculares y muerte1,10,14. Otros estudios han documentado elevaciones del CT, LDLc y triglicéridos (TG) en pacientes con AR característicamente durante la fase temprana13,15,16. Dichas discrepancias pueden estar relacionadas con la población estudiada, el estadio de la enfermedad o la presencia de actividad17 y hacen más difícil evaluar adecuadamente la indicación e impacto del tratamiento.
Las estatinas forman parte del manejo habitual de pacientes con AR en la práctica clínica9 junto a la terapia DMARD (del inglés: disease-modifying antirheumatic drugs), no solo por su potencial impacto en la reducción de eventos cardiovasculares al modificar y mejorar el perfil lipídico8 sino, además, porque aparentemente podrían controlar la actividad de la enfermedad.
Dada la importancia de establecer el efecto en el riesgo cardiovascular y el perfil lipídico de las estatinas en pacientes con AR y teniendo en cuenta la escasa información de su efectividad en pacientes con esta enfermedad, se decidió realizar una revisión sistemática y metaanálisis para evaluar el impacto de las estatinas y determinar hasta qué punto podrían indicarse junto con la terapia antirreumática como parte del manejo estándar de esta enfermedad.
Materiales y métodosLa búsqueda de la literatura se llevó a cabo en las bases de datos Medline (PubMed), Embase, Lilacs, Scielo y la base de datos de la colaboración Cochrane (Cochrane Central Register of Controlled trials), desde su inicio hasta septiembre de 2016. Los términos de búsqueda utilizados fueron: artritis reumatoide, hiperlipidemia, dislipidemia, hipercolesterolemia, inhibidores de la hidroximetilglutaril CoA reductasa, atorvastatina, pravastatina, simvastatina, lovastatina y rosuvastatina, tanto en texto libre como en términos MeSH. Se limitó la búsqueda a publicaciones en inglés o español.
Como criterios de inclusión se consideraron estudios que evaluaran pacientes mayores de 18 años, con diagnóstico definido de AR según los criterios de clasificación de AR publicados por el Colegio Americano de Reumatología (ACR) en 198718 o según los criterios definidos por el ACR y la Liga Europea Contra el Reumatismo en 20106, tratados con al menos una estatina, con un tiempo mínimo de seguimiento de 26 semanas y que como grupo control viniesen recibiendo placebo, otra estatina de menor potencia o ningún medicamento. Los desenlaces evaluados fueron muerte por cualquier causa, muerte de origen cardiovascular, eventos cardiovasculares (infarto agudo de miocardio [IAM], accidente cerebrovascular) y como desenlaces secundarios, cambios en los valores del perfil lipídico (CT, LDLc, HDLc y TG), reducción de actividad de la enfermedad medida con DAS28 (Disease Activity Score) y cambios en la proteína C reactiva6. Conociendo a priori la escasez de información proveniente de estudios clínicos aleatorizados (ECA), se decidió adicionalmente buscar e incluir estudios no aleatorizados, bien fuesen estudios de cohortes, o estudios de casos y controles19,20.
Se excluyeron estudios que no proporcionaron datos originales (cartas, comentarios, perspectivas o editoriales), estudios que incluyeran pacientes con otro tipo de enfermedades inflamatorias articulares concomitantes a la AR y aquellos que no presentaban datos sobre los desenlaces de interés o no estuviesen disponibles a pesar de contactar a los autores.
La selección de estudios se realizó de forma pareada por parte de 2 autores (SC y OR) y las discrepancias se resolvieron por consenso, contando con la opinión de un tercer revisor (OM). La extracción de los datos fue realizada por 2 investigadores de manera independiente utilizando un formato estandarizado que incluía la información referente al tamaño de la muestra, características basales de la población, comparativo o control usado, presencia de comorbilidades, medicamentos adicionales utilizados, duración del seguimiento y resultados en los desenlaces de interés4,18. Las divergencias en la información fueron resueltas por un tercer investigador. El riesgo de sesgos de ensayos clínicos se evaluó de forma independiente por 2 revisores utilizando la herramienta propuesta por el Scottish Intercollegiate Guidelines Network21 y la evaluación del riesgo de sesgos de los estudios no aleatorizados, con la herramienta ROBINS-I22 recomendada por la colaboración Cochrane. Los desacuerdos fueron resueltos por discusión y participación de un tercer revisor. La digitalización, análisis y procesamiento de datos se realizaron con la herramienta Revman 5.3®, utilizando para el metaanálisis de los experimentos clínicos aleatorios un modelo de efectos aleatorios. Se planeó a priori analizar y presentar de forma independiente la información proveniente de los estudios clínicos no aleatorizados buscando identificar las causas de resultados divergentes19,23,24.
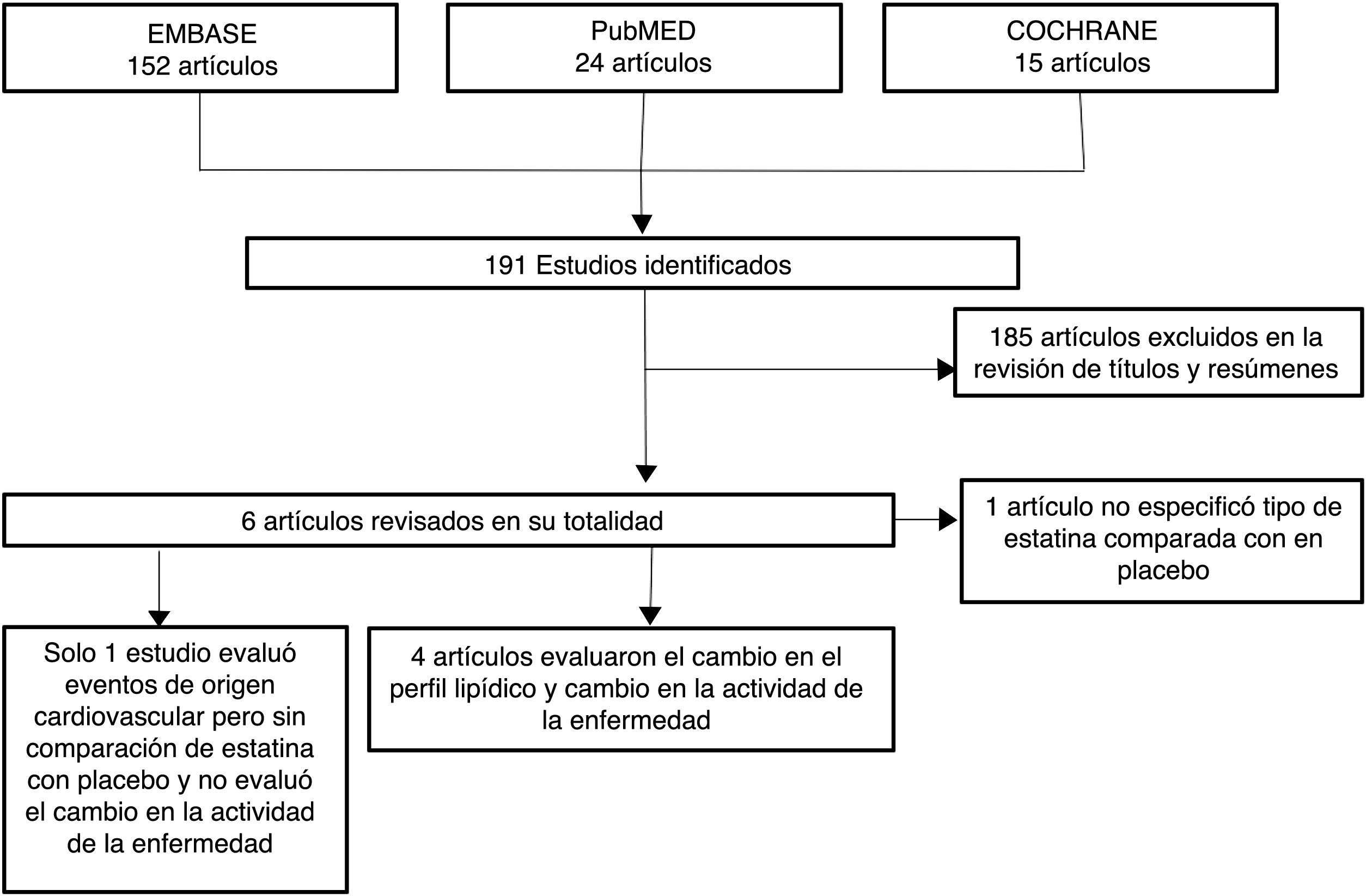
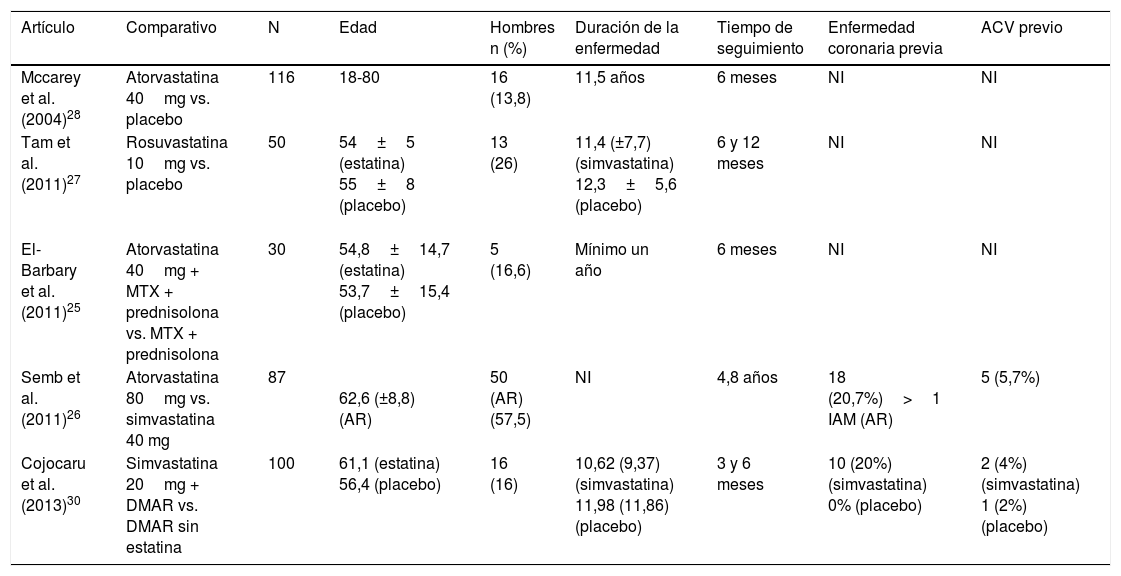
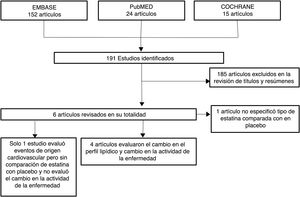
ResultadosDe 191 estudios encontrados en la búsqueda, 185 fueron excluidos después de una evaluación de los títulos y resúmenes. Fueron seleccionados 6 artículos25-30 para evaluación en texto completo. Uno de ellos29, correspondiente a un estudio de cohortes, fue excluido porque no se especificaba el tipo de estatina evaluada. De los 5 artículos finalmente incluidos, 4 correspondían a ECA25-28 y uno a estudio de cohortes30; en conjunto, los estudios evaluados incluyeron una población total de 383 pacientes. En la figura 1 se presentan los resultados de la búsqueda y selección de los estudios. La estatina evaluada en 3 estudios fue atorvastatina25,26,28; en un estudio, simvastatina30 y en otro, rosuvastatina27. Las características de los pacientes incluidos en cada uno de estos estudios se presentan en la tabla 1.
Características basales de los pacientes incluidos en los estudios seleccionados
| Artículo | Comparativo | N | Edad | Hombres n (%) | Duración de la enfermedad | Tiempo de seguimiento | Enfermedad coronaria previa | ACV previo |
|---|---|---|---|---|---|---|---|---|
| Mccarey et al. (2004)28 | Atorvastatina 40mg vs. placebo | 116 | 18-80 | 16 (13,8) | 11,5 años | 6 meses | NI | NI |
| Tam et al. (2011)27 | Rosuvastatina 10mg vs. placebo | 50 | 54±5 (estatina) 55±8 (placebo) | 13 (26) | 11,4 (±7,7) (simvastatina) 12,3±5,6 (placebo) | 6 y 12 meses | NI | NI |
| El-Barbary et al. (2011)25 | Atorvastatina 40mg + MTX + prednisolona vs. MTX + prednisolona | 30 | 54,8±14,7 (estatina) 53,7±15,4 (placebo) | 5 (16,6) | Mínimo un año | 6 meses | NI | NI |
| Semb et al. (2011)26 | Atorvastatina 80mg vs. simvastatina 40 mg | 87 | 62,6 (±8,8) (AR) | 50 (AR) (57,5) | NI | 4,8 años | 18 (20,7%)>1 IAM (AR) | 5 (5,7%) |
| Cojocaru et al. (2013)30 | Simvastatina 20mg + DMAR vs. DMAR sin estatina | 100 | 61,1 (estatina) 56,4 (placebo) | 16 (16) | 10,62 (9,37) (simvastatina) 11,98 (11,86) (placebo) | 3 y 6 meses | 10 (20%) (simvastatina) 0% (placebo) | 2 (4%) (simvastatina) 1 (2%) (placebo) |
ACV: accidente cardiovascular: AR: artritis reumatoide; DMAR: medicamentos modificadores de la enfermedad; IAM: infarto agudo de miocardio; MTX: metotrexato; NI: No hay información.
No se rencontró ningún estudio que evaluara estatinas contra placebo o sin tratamiento en lo referente a la presentación de eventos cardiovasculares, sin embargo, un estudio26 comparó la incidencia de eventos cardiovasculares —definidos como un desenlace final compuesto de IAM, accidente cerebrovascular, insuficiencia cardiaca y angina inestable, comparando estatina de alta potencia y estatina de moderada potencia— y reportó que la tasa de eventos cardiovasculares no fue significativamente diferente en pacientes con AR que recibieron atorvastatina (14/39, 35,9%) en comparación con la simvastatina (9/48; 18,8%; p=0,24). No fue posible individualizar cada uno de los diferentes eventos.
Fracciones lipídicas y actividad de la enfermedadEl CT tuvo una reducción media de 46,16mg/dL (IC 95%: [−53,89; −38,46]; I2: 86%). En el metaanálisis de los 4 ECA (fig. 2), la heterogeneidad en el resultado puede ser explicada porque en un estudio26 se evaluó estatina de alta potencia contra otra estatina de más baja potencia, con un menor efecto estimado (CT: −19,30mg/dL; IC 95%: [−33,9; −4,6]).
La reducción del LDLc media fue de 18,13mg/dL (IC 95%: [−21,8; −14,45]; I2: 97%). En los estudios de Tam et al.27 y McCarey et al.28 se evidenció una mayor eficacia en la reducción de LDL (54,10mg/dl; IC 95%: [−70,17; −38,03]) con el uso de rosuvastatina y de 61,4mg/dl (IC 95%: [−71,4; −51,4]) con el uso de atorvastatina, respectivamente (fig. 3).
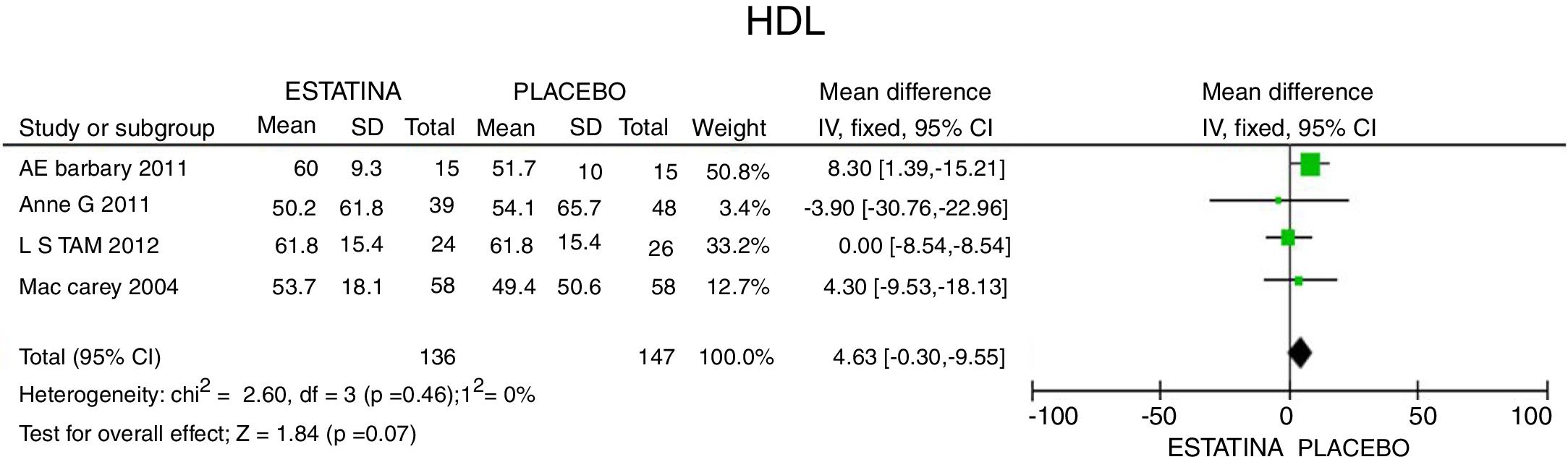
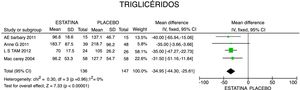
En cuanto a la reducción del nivel de TG, los resultados muestran disminución de 34,95mg/dL (IC 95%: [−44,3; −25,6]; I2: 0%) posterior a la terapia con estatinas (fig. 4) y para el HDLc hubo una elevación estadísticamente no significativa de 4,63mg/dL (IC 95%: [−0,30; 9,55] I2: 0) (fig. 5).
En contraste con los resultados de los ECA, en el estudio de cohortes de Cojocaru30 se evidenció un aparente aumento de las fracciones lipídicas posterior al tratamiento con estatinas. Esto fue dado por un sesgo de selección, como se explicará más adelante. Sin embargo, los valores de descenso neto del CT correspondían a −27,9mg/dl (IC 95%: [19,311; 44,243]; p<0,001) y del LDL una reducción de −21,66mg/dl (IC 95%: [21,109; 43,972]; p<0,001), sin cambios significativos en los niveles de HDL y TG.
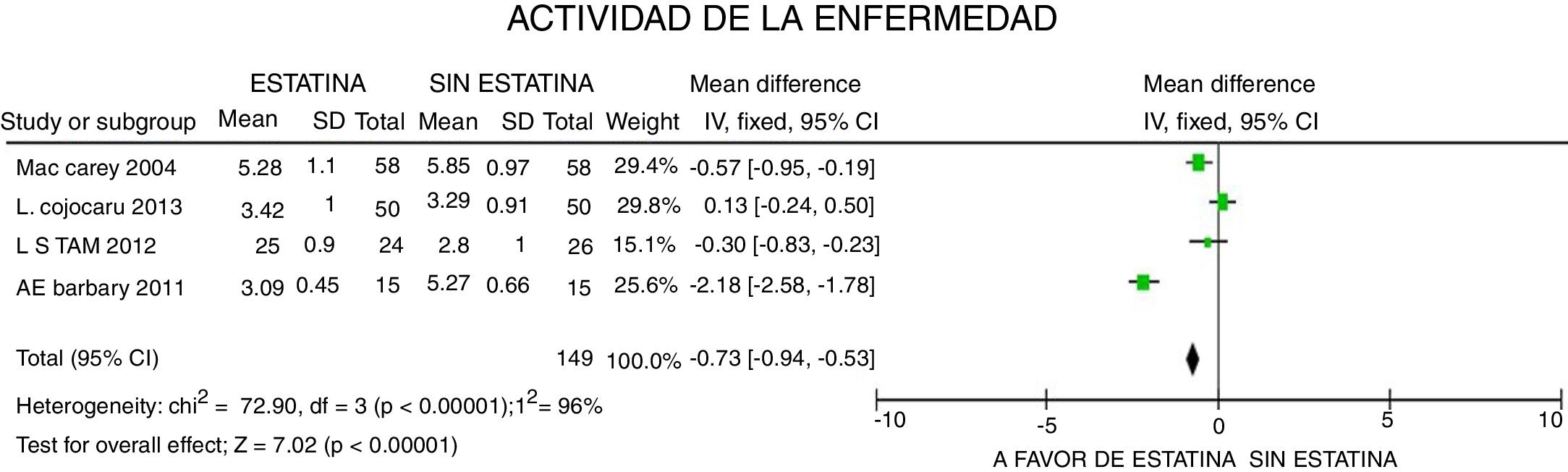
En cuanto a la actividad de la enfermedad, evaluada con la escala DAS28, se reportó una disminución de 0,73 puntos (IC 95%: [−0,94; −0,53]; I2: 96%), con gran heterogeneidad del estimativo, sin lograrse determinar características clínicas que la expliquen y sin lograr tampoco significación desde el punto de vista de la relevancia clínica, a pesar de la significación estadística del dato (fig. 6).
Calidad de los estudiosLos resultados de la evaluación de la calidad de los estudios incluidos se presentan en la tabla 2. Al revisar la calidad de los ECA para evaluar el impacto de las estatinas y nivel de actividad de la enfermedad, se encontró que, aunque todos realizaron una aleatorización de los pacientes, solo en 3 se realizó un adecuado cegamiento26-28. En todos los estudios incluidos la asignación fue aleatorizada. En la evaluación de calidad del estudio de cohorte26, se encontró inadecuado manejo de los factores de confusión, con características basales significativamente diferentes entre los grupos de intervención y control, y sin un análisis estadístico que buscara controlar estas diferencias.
Evaluación de calidad de los estudios seleccionados
| Mccarey et al. 200428 | Tam et al. 201127 | Semb et al. 201126 | El-Barbary et al. 201125 | |
|---|---|---|---|---|
| La asignación de los sujetos fue aleatoria | ||||
| Adecuado método de ocultamiento | ||||
| Cegamiento de los participantes | ||||
| El grupo control y el intervenido son similares | ||||
| La única diferencia entre los grupos era el tratamiento estudiado | ||||
| Sujetos analizados en grupos que fueron asignados al azar | ||||
| Sí | No |
La presente revisión sistemática incluyó información proveniente de estudios aleatorizados y no aleatorizados, demostrando el efecto hipolipidemiante de las estatinas ya conocido y un impacto positivo en la reducción de la puntuación de la actividad de la enfermedad (DAS28). El efecto beneficioso de las estatinas, al reducir los niveles de CT, LDLc, TG, con un discreto ascenso en HDLc, es consistente en los estudios incluidos y se comporta de manera similar a otras poblaciones estudiadas31,32. Aunque la mayoría de los estudios evaluados mostraron datos en cuanto al cambio del perfil lipídico y actividad de la enfermedad, al comparar pacientes expuestos y no expuestos a estatinas, no se encontraron datos suficientes para evaluar el efecto sobre desenlaces cardiovasculares. El único estudio encontrado con dicha especificación fue el estudio IDEAL26, que comparó grupos de pacientes con AR y sin AR expuestos a estatinas de alta y baja potencia, que demostró una mejoría significativa en el descenso de CT, LDLc y TG a favor de la estatina de alta potencia y elevación del HDLc con ambas estatinas. Sin embargo, no hubo diferencias significativas en eventos cardiovasculares, lo cual podría explicarse por el tiempo de seguimiento relativamente corto.
Considerando la escasa evidencia disponible para evaluar el impacto de las estatinas en el riesgo de mortalidad de pacientes con AR, vale la pena considerar algunos estudios adicionales publicados. De Vera et al.33 reportaron un estudio longitudinal basado en datos administrativos de más de 16.000 pacientes, y señalaban que, al suspender la terapia con estatina en pacientes con AR, se aumenta la incidencia tanto de muertes de origen cardiovascular como de muertes por todas las causas. De igual forma, en un estudio poblacional realizado por Sheng et al.29 se evaluó el impacto de las estatinas en disminuir el CT, mortalidad cardiovascular y muerte por cualquier causa, y señalaban un efecto benéfico de la estatina en estos 3 desenlaces en los pacientes con AR. Dichos estudios tienen importantes limitaciones metodológicas, asociadas al riesgo de sesgo de mala clasificación por las limitaciones inherentes a la calidad de la codificación para identificar a los pacientes con AR a partir de los datos administrativos y a la imposibilidad de evaluar exactamente cuáles estatinas recibieron, como es el caso del estudio mencionado de Sheng et al. Tampoco es posible evaluar si los pacientes realmente recibieron los medicamentos o las causas de suspenderlos; sin embargo, deja abierta la posibilidad de que realmente exista impacto en la mortalidad, que no pudo ser adecuadamente evaluado en los ECA y estudios de cohortes incluidos en la presente revisión. Nuevos ECA con un mayor tamaño de muestra y con tiempos de seguimiento suficientemente largos para detectar este impacto deberán desarrollarse a futuro.
Una fortaleza de la presente revisión fue la inclusión de estudios no aleatorizados, considerando que estos estudios tienen con frecuencia periodos de seguimiento más largos y mejor evaluación de los eventos adversos. A pesar de dicho esfuerzo, solo se identificó un estudio de cohortes realizado por Cojocaru et al.30, en el que aparentemente hubo una tendencia al aumento de las fracciones lipídicas con el uso de la estatina, a diferencia de lo evidenciado en los ECA incluidos25-28. Dicho hallazgo puede ser explicado por un sesgo de selección asociado a las diferencias sistemáticas entre los pacientes que recibieron estatinas con aquellos que no tuvieron dicho tratamiento, con niveles basales de CT, TG y LDLc, llamativamente más altos en el grupo de pacientes expuestos a la estatina. La baja calidad de este estudio no aporta de forma significativa a la evaluación del impacto del manejo con estatinas en pacientes con AR.
En cuanto al componente de actividad de la enfermedad, sí hubo reducción de las puntuaciones de actividad de la enfermedad a 3 meses, sin embargo, no existen diferencias significativas a los 6 meses de seguimiento. Dentro de los otros 3 estudios que evaluaron la actividad de la enfermedad, uno de ellos, correspondiente a Tam et al.27, tampoco alcanzó adecuada significación estadística al comparar la intervención con estatinas y placebo, aunque llamativamente dentro de los criterios de inclusión de este estudio se estipulaba un nivel basal de actividad baja o sin actividad, lo cual también podría explicar dicho fenómeno. Otro factor potencial de sesgo es la terapia DMARD usada de forma concomitante con la estatina, la cual pudo variar entre los pacientes, tanto en tipo como en dosis, lo que genera, a su vez, niveles de actividad basales diferenciales y tiempos de control diferentes.
Como principales limitaciones del estudio se encuentra el tiempo de seguimiento relativamente corto de todos los estudios incluidos, que es apropiado para evaluar el impacto sobre las fracciones lipídicas, pero es corto para la evaluación de desenlaces cardiovasculares. Además, los estudios incluidos presentaban alta variabilidad y heterogeneidad de los pacientes, lo que impide una correcta combinación de datos y análisis. La presente revisión sistemática genera un valioso aporte dada la escasa información disponible y motiva la realización de futuras investigaciones en este campo.
ConclusionesExiste un impacto significativo en el uso de las estatinas como terapia hipolipidemiante en pacientes con AR, al lograr una reducción de los niveles de CT, LDLc y TG, sin evidencia de aumento significativo de los niveles de HDLc. Se observó un discreto impacto sobre la actividad de la enfermedad medida con DAS28 a corto plazo (3 meses), que no se mantiene a 6 meses y que no alcanza relevancia clínica. La información sobre el impacto en la reducción de desenlaces cardiovasculares es limitada y no permite elaborar conclusiones sobre su potencial beneficio ni su uso sistemático como parte de la terapia antirreumática en los pacientes sin las indicaciones habituales para el manejo con estatinas.
Conflicto de interesesNo.