Los programas para cribado neonatal utilizan muestras de sangre impregnada en papel, en ellas se determinan los marcadores de las patologías incluidas. La presencia de anticoagulantes en las muestras puede producir interferencias en los métodos de medida y se recomienda su no utilización. No es posible reconocer las muestras recogidas con anticoagulante.
Material y métodosSe desarrolló y optimizó un procedimiento por espectrometría de masas en tándem con electrospray (ESI-MS/MS) para la determinación de EDTA (ácido etilendiaminotetraacético) en las muestras de sangre en papel y se valoró su inclusión en el perfil de aminoácidos y acilcarnitinas utilizado para la detección precoz neonatal de enfermedades metabólicas. Se estudió su influencia sobre las medidas de tirotropina (TSH), realizadas para el cribado neonatal de hipotiroidismo congénito.
ResultadosSe optimizaron los parámetros que permiten la medida de EDTA en el eluato de sangre. Se ha determinado TSH en sangre en papel, suero y plasma de un grupo de 110 muestras y EDTA en otro grupo de 2.300 muestras provenientes del programa de cribado neonatal detectando su presencia en un 0,74% de las mismas.
ConclusionesEl método desarrollado es válido para la determinación de este anticoagulante y se puede incluir en el perfil de aminoácidos y acilcarnitinas por MS/MS para detectar aquellas muestras que se extrajeron inadecuadamente.
Se ha confirmado la influencia negativa del EDTA en la determinación de TSH mediante un fluoroinmunoensayo (AutoDELFIA®). Esto podría provocar un falso negativo en el cribado neonatal de hipotiroidismo congénito.
Newborn screening programs use blood impregnated paper to analyze disease markers. The presence of EDTA in samples may interfere in the analytical methods used to measure these markers. For this reason, it is recommended not use anticoagulants in these samples. Moreover, it is not possible to recognize samples that have been collected into EDTA.
Material and MethodsWe developed and optimized an electrospray tandem mass spectrometry (ES-MS/MS) method to determine EDTA (ethylenediaminetetraacetic acid) in dried blood spots (DBS) on paper. We also included the method in the amino acids and acylcarnitines profile used for metabolic diseases neonatal screening. We also studied the EDTA influence on thyrotropin (TSH) neonatal screening analysis.
ResultsOptimized parameters for EDTA analysis in the blood eluate were found. TSH analysis was performed on DBS, serum and plasma samples from 110 patients. EDTA analysis on 2000 neonatal screening samples detected 0.74% of cases with EDTA contamination.
ConclusionsThe developed method is valid for the determination of this blood anticoagulant and can be included in the profile of amino acids and acylcarnitines by MS / MS to detect those samples that were taken improperly.
The negative influence of EDTA in the determination of TSH by fluoroimmunoassay (AutoDELFIA®) has been confirmed. This could cause a false negative in neonatal screening for congenital hypothyroidism.
Los programas de cribado neonatal para alteraciones metabólicas utilizan las muestras de sangre impregnada en papel de los recién nacidos tomadas del talón en los primeros días de vida. En ellas se determinan los diferentes analitos que son marcadores de las patologías incluidas en cada programa de cribado1. Muchos de los laboratorios donde se desarrollan estos programas de cribado han introducido la espectrometría de masas en tándem con electrospray (ESI-MS/MS) a lo largo de los últimos 10 años y en España son varios los que ya acumulan una importante experiencia con ella2–4.
La toma de muestra se realiza con sangre capilar o venosa que es recogida directamente en papel absorbente en forma de manchas que típicamente contienen de 50 a 80μL. El hecho de que sea muy elevado el número de personas, personal sanitario o no, involucradas en el proceso de toma de muestra hace que potencialmente sea elevado el número de posibles errores preanalíticos. El examen visual de las manchas de sangre solo detecta los errores más graves y todo ello ha conducido a la existencia de recomendaciones específicas por parte del Clinical and Laboratory Standards Institute (CLSI)5.
Es conocido que la presencia de anticoagulantes como el ácido etilendiaminotetraacético (EDTA) y el citrato sódico en la muestra de sangre puede producir interferencias en algunos métodos de medida6 como los fluorimétricos (FIA) e inmunofluorimétricos (IFMA). En el caso de inmunoensayos que utilizan anticuerpos marcados con europio, caso del sistema AutoDELFIA® (técnica utilizada en los laboratorios de cribado neonatal en España), la unión se realiza con derivados del EDTA y cuando la muestra misma lo contiene se produce una liberación de europio como consecuencia de la reacción de equilibrio que se produce durante la etapa de incubación7.
La presencia de EDTA en las muestras puede originar elevaciones de la 17-hidroxi-progesterona que provocan resultados falsamente positivos en los programas endocrinológicos de cribado neonatal que emplean este tipo de ensayos y podrían igualmente afectar a las medidas de tirotropina (TSH)8. El EDTA permite una mejor recuperación de algunos analitos como el plomo sanguíneo9 a partir de las muestras de sangre seca pero se recomienda, de forma general, su no utilización a la hora de la toma de muestra. No existe forma visual para reconocer aquellas muestras que han sido recogidas con anticoagulante y así poder descartarlas evitando la posibilidad de que se produzcan interferencias que den lugar a resultados falsamente negativos o positivos.
Teniendo presente que el EDTA es el anticoagulante mayoritariamente empleado en la práctica clínica, este trabajo tiene por objetivo el desarrollo y optimización de un método por espectrometría de masas en tándem (MS/MS) para la determinación de EDTA en la muestra de sangre impregnada en papel y posteriormente el análisis de la influencia de este anticoagulante sobre la medida de la hormona TSH, marcador empleado en el cribado neonatal del hipotiroidismo congénito, cuando es medida con el sistema AutoDELFIA®.
Se valoró su posterior inclusión en el perfil de aminoácidos y acilcarnitinas que se utiliza para la detección precoz neonatal de enfermedades metabólicas.
Material y métodosReactivos y aparatosSe utilizó agua obtenida con un sistema Milli-Q (Merck Millipore, MA EE. UU.) y EDTA Merk ref. 8418 (Darmstadt, Alemania).
Mezcla de isótopos estables de aminoácidos y acilcarnitinas de Cambridge Isotope Laboratories (CIL, Andover, MA, EE. UU.) (12 aminoácidos, incluyendo 13C6-Fenilalanina, y 8 acilcarnitinas).
Espectrómetro de masas en tándem API 2000 ESI-MSMS (AB SCIEX, Toronto, Canadá) acoplado a un HPLC Perkin-Elmer Series 200 para la medida del EDTA. La fase móvil empleada estuvo compuesta de acetonitrilo LiChrosolv Merck ref. 30 (Darmstadt, Alemania) y agua, proporción (70:30) con ácido fórmico al 0,05%. Merck, ref. 264 (Darmstadt, Alemania).
Los resultados fueron adquiridos con el software Analyst versión 1.4 y procesados por el software Chemoview 1.4 (ambos de AB SCIEX).
Para la butilación de los aminoácidos a los correspondientes ésteres se empleó butanol clorhídrico 3N Sigma-Aldrich-Fluka ref. 87472 (St. Louis, MO, EE. UU.).
Se empleó un equipo de fluorescencia para inmunoensayos automatizado AutoDELFIA® mod. 1235 (Wallac Oy, Perkin-Elmer Turku Finlandia), otro de quimioluminiscencia ADVIA Centaur® (Siemens Healthcare, Alemania) y un analizador de hematología ADVIA® mod. 2120 (Siemens Healthcare, Alemania).
MuestrasSe recogieron muestras de sangre con y sin EDTA cedidas voluntariamente por un grupo de pacientes que acudían a controles de salud al laboratorio central del hospital. Fueron elegidos de forma aleatoria y las muestras anonimizadas. Se impregnaron papeles con las muestras de sangre con EDTA y se les realizó la medida del hematocrito.
Igualmente se recogieron muestras anónimas de sangre impregnada en papel Whatman 903 semejantes a las empleadas en los programas de cribado neonatal.
Patrones y calibrado de ácido etilendiaminotetraacéticoLa optimización de los parámetros del espectrómetro de masas fue realizada mediante infusión a un flujo constante de 60μL/min de una disolución del butil éster del EDTA. Este compuesto fue obtenido a partir de una disolución acuosa de EDTA de concentración 7 mmol/L derivatizada con butanol clorhídrico 3N, para bloquear el grupo ácido de esta molécula mediante la introducción de un grupo butilo y formar un butil éster que favorece la ionización positiva, que a continuación se lleva a residuo seco con corriente de nitrógeno y se redisuelve en la fase móvil.
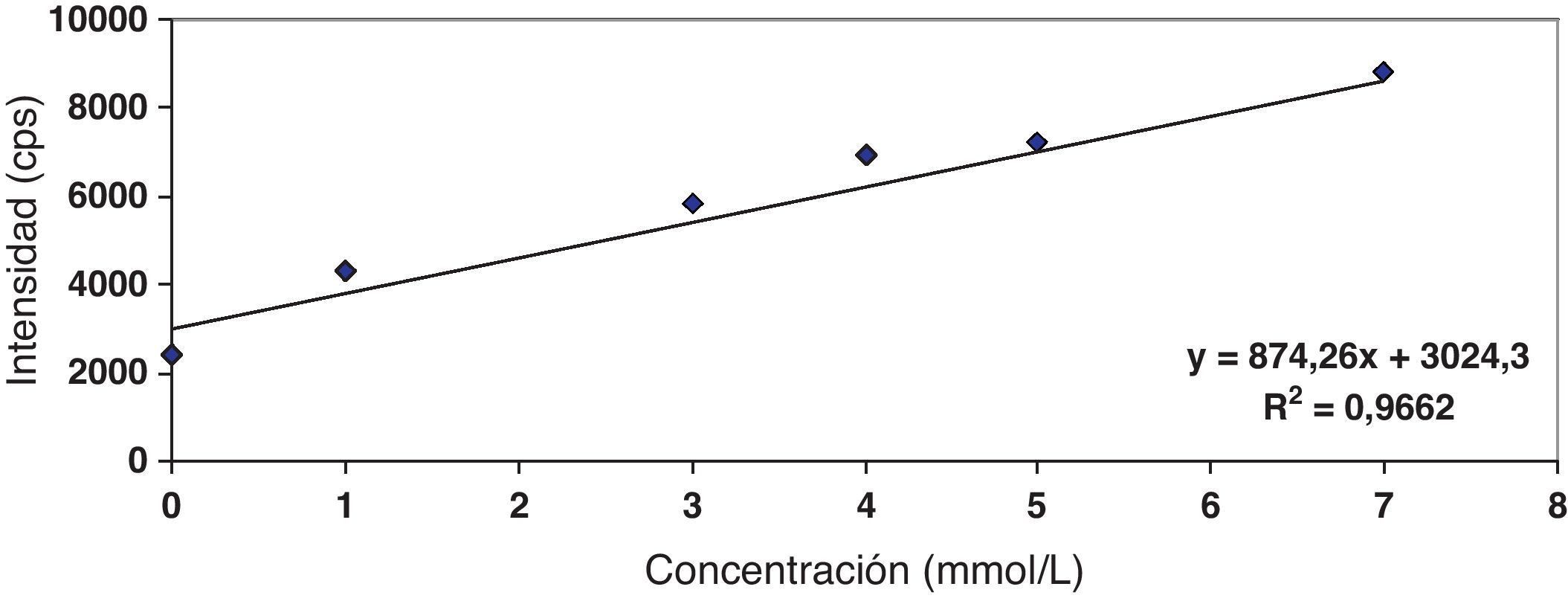
Para el cálculo de la curva de calibración del EDTA se prepararon disoluciones acuosas, a partir de una de 100 mmol/L, conteniendo 1, 3, 4, 5 y 7 mmol/L. Para el estudio de recuperación se realizaron adiciones de 1, 3, 4, 5 y 7 mmol/L a una muestra de sangre anticoagulada previamente con EDTA (fig. 1). El método es lineal en el rango objeto de estudio y la recuperación analítica en un rango entre el 91-108% (aceptado habitualmente entre 90-110%).
Con el fin de estudiar la sensibilidad del método se midieron 10 réplicas de la sangre. El límite de detección fue de 43μmol/L y el límite de cuantificación fue de 84μmol/L10.
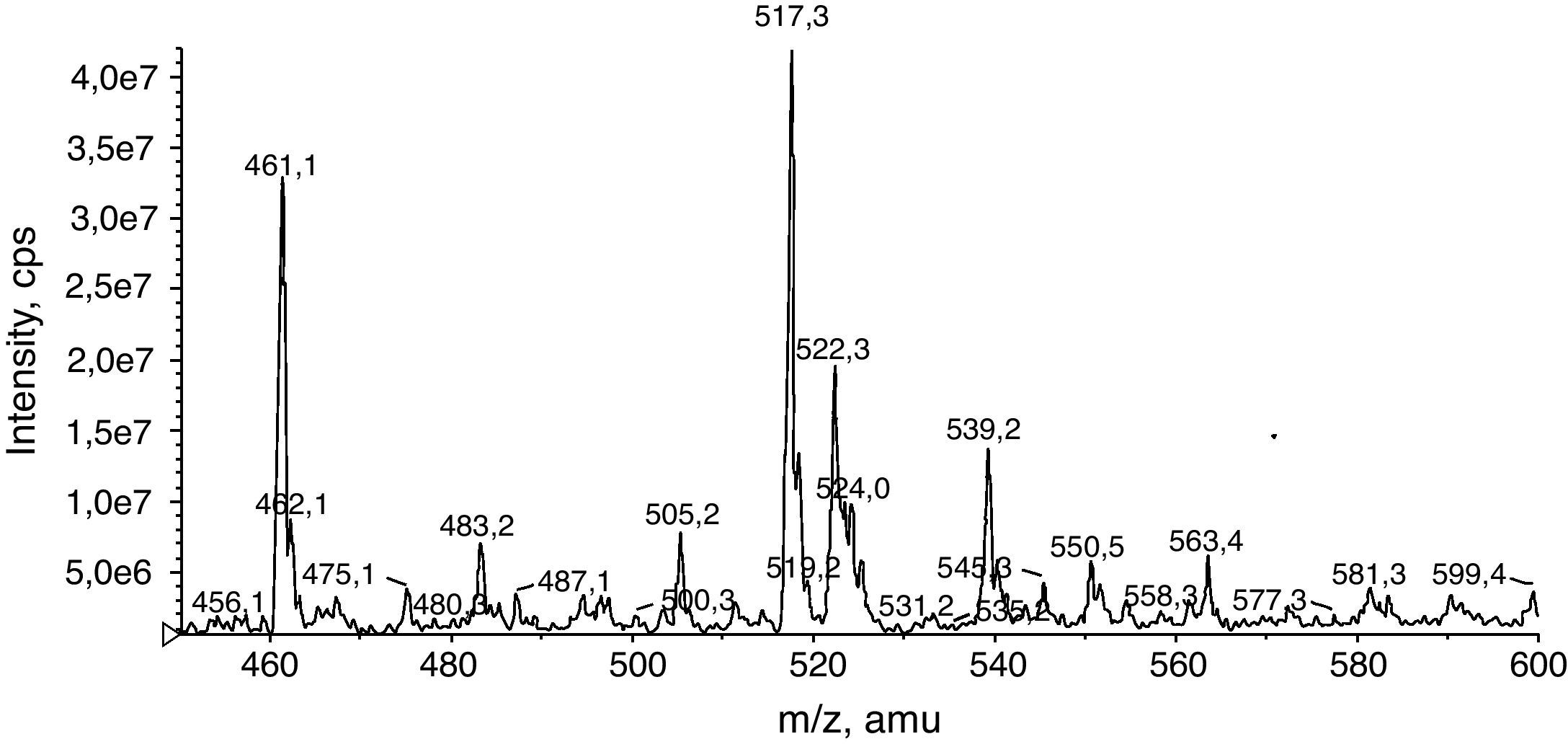
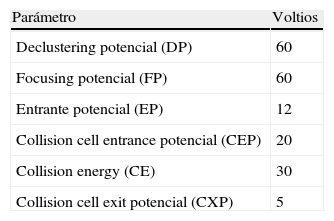
Optimización del método por MS/MS para la determinación de EDTASe trabaja con ionización en modo positivo. Se determina el ión precursor en el primer cuadropolo (Q1) y una vez establecida la relación masa/carga (m/z) exacta de la molécula protonada se optimizan los parámetros del espectrómetro que permiten que el Q1 detecte el ión precursor con la máxima sensibilidad posible. Los parámetros optimizados son: DP (Declustering Potencial), FP (Focusing Potencial) y EP (Entrance Potencial). El DP aplicado en la interfase es específico para cada ión precursor, mientras que los valores de FP y de EP pueden ser fijados en valores de compromiso para todos los iones precursores que se midan conjuntamente.
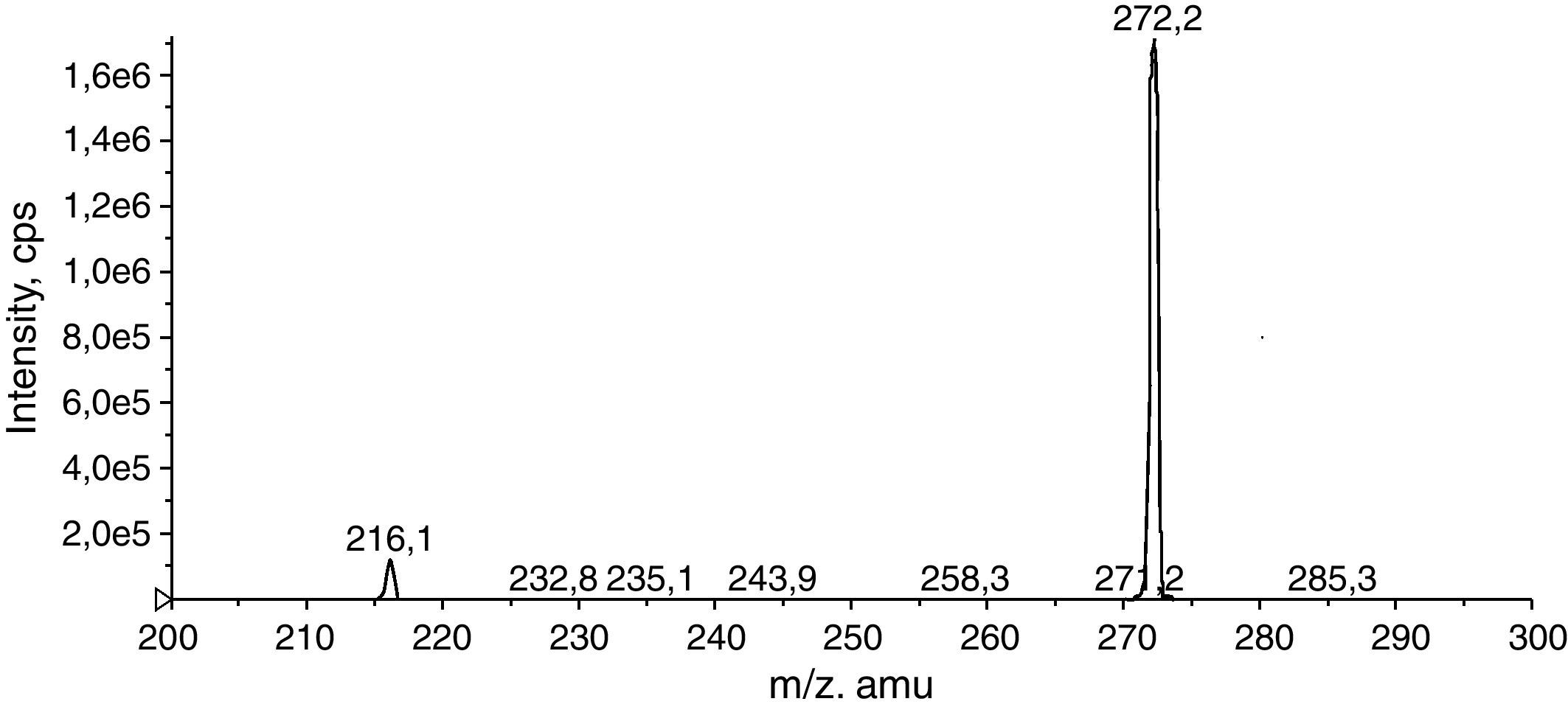
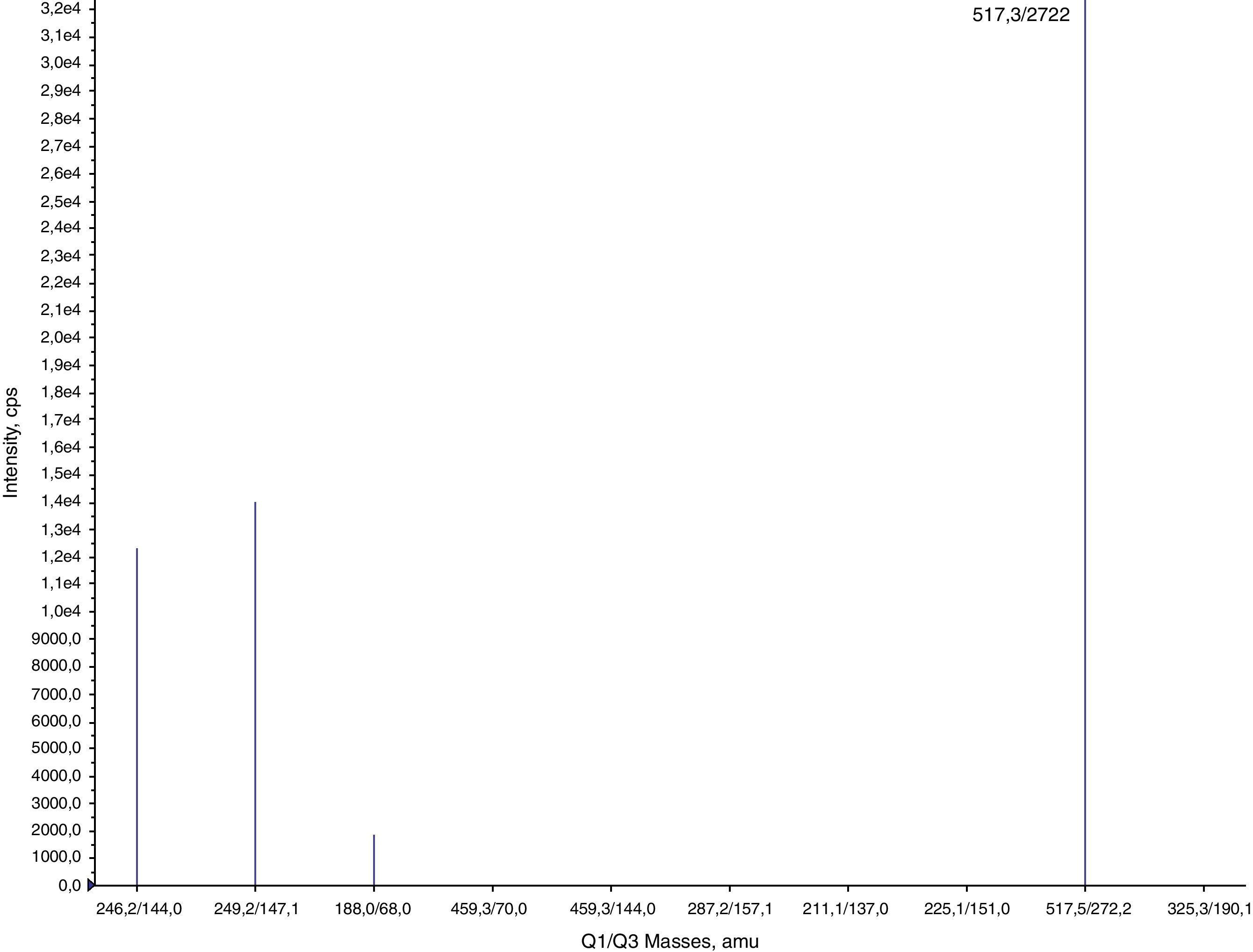
Una vez fragmentado el compuesto en la célula de colisión (Q2) se selecciona el ión producto mayoritario o específico del compuesto y se optimizan los parámetros del tercer cuadrupolo (Q3). Los parámetros CE (Collision Energy) y CXP (Collision Cell Exit Potencial) son específicos para cada ión producto. De esta forma la transición optimizada es: (m/z 517,3→ 272,2) (figs. 2 y 3).
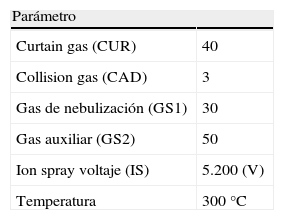
A continuación utilizando la misma disolución se optimizaron los parámetros de la fuente: CUR (Curtain Gas), CAD (Collision Gas), GS1, GS2 y TEM (Temperatura).
En las tablas 1 y 2 aparecen recogidos los valores obtenidos para todos ellos.
Se realizaron las determinaciones de la TSH sérica y plasmática mediante la técnica de quimioluminiscencia en el equipo ADVIA Centaur®, también se determina el hematocrito en el analizador ADVIA 2120. A las muestras de sangre impregnada en papel, con EDTA o sin él, se les mide TSH utilizando un ensayo fluoroinmunométrico con AutoDELFIA®.
Preparación de muestras para medida de aminoácidos y acilcarnitinasA partir de las muestras de sangre en papel son extraídos selectivamente estos metabolitos mediante agitación en metanol en el que previamente se han incluido patrones internos marcados isotópicamente. Este eluato en el que se ha realizado la dilución isotópica es sometido al mismo protocolo de derivatización descrito previamente para los patrones de EDTA y finalmente introducido en el equipo de MS/MS con la fase móvil descrita.
Resultados y discusiónUna vez el método fue desarrollado y optimizado (figs. 2 y 3, Tablas 1 y 2) añadimos esta transición como un MRM (multiple reaction monitoring) (fig. 6) al perfil de aminoácidos y acilcarnitinas que se utiliza para la detección precoz neonatal por ESI-MS/MS. Como patrón interno para la cuantificación del EDTA se utiliza la [13C6] fenilalanina de Cambrigde Isotopes Laboratories ya incluida en el grupo de patrones internos del ensayo.
Se ha observado que el fragmento de m/z 272,2, que produce el EDTA butilado, es el mismo que el de la acrililcarnitina en el ensayo de precursores de m/z 85,1 empleado para medir acilcarnitinas. Es decir, si en el perfil de acilcarnitinas se incluye este MRM, también podríamos de una forma indirecta detectar la presencia de este anticoagulante en las muestras de sangre empleadas para cribado neonatal.
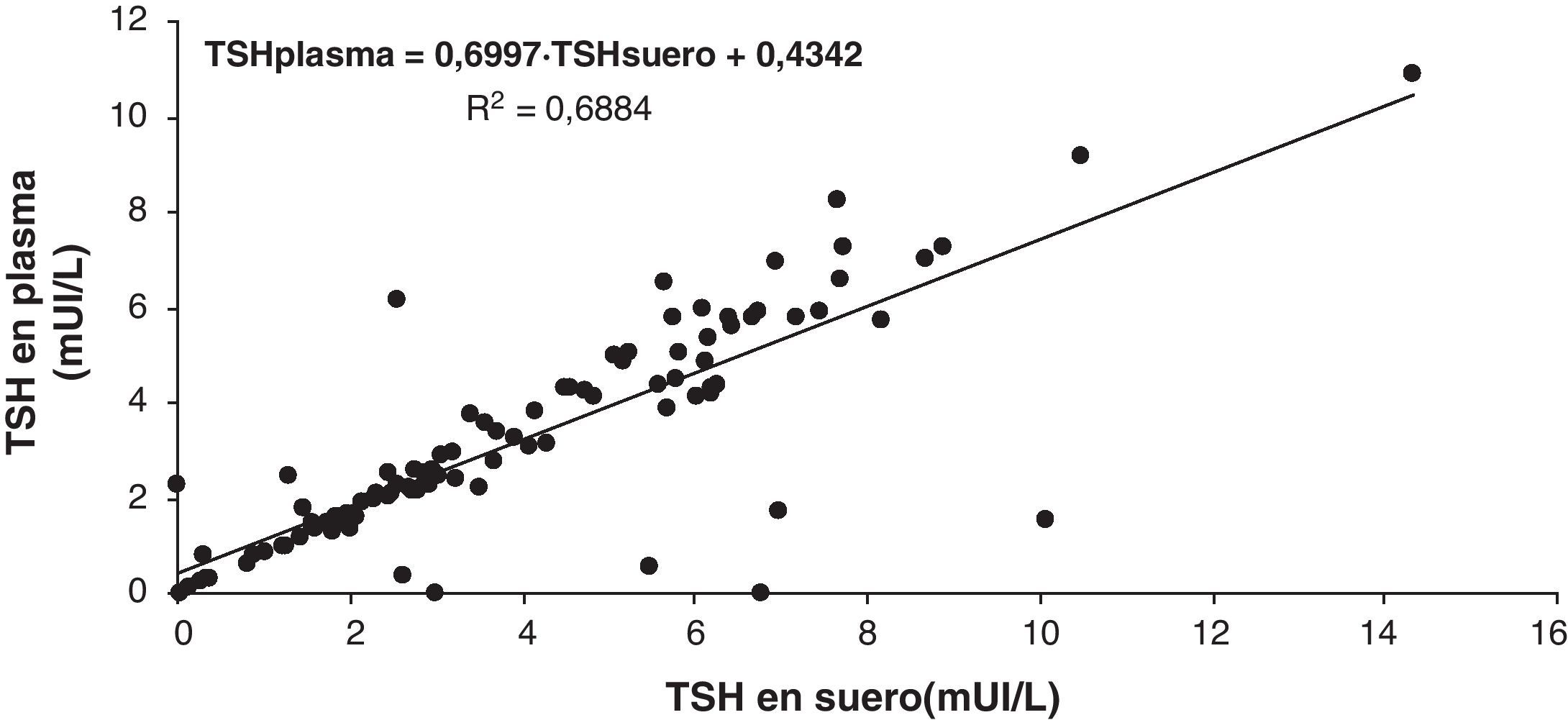
Se realiza el estudio de correlación entre las medidas de TSH en suero, plasma y sangre en papel en un grupo de 97 pacientes y utilizamos el hematocrito para corregir los valores de TSH medidos sobre la muestra de sangre total con EDTA impregnada en papel puesto que la hormona no se distribuye en eritrocitos11. Del grupo inicial de 110 muestras se descartaron aquellas con hematocrito menor del 30% y las que el valor de TSH estaba fuera del intervalo de interés para este estudio.
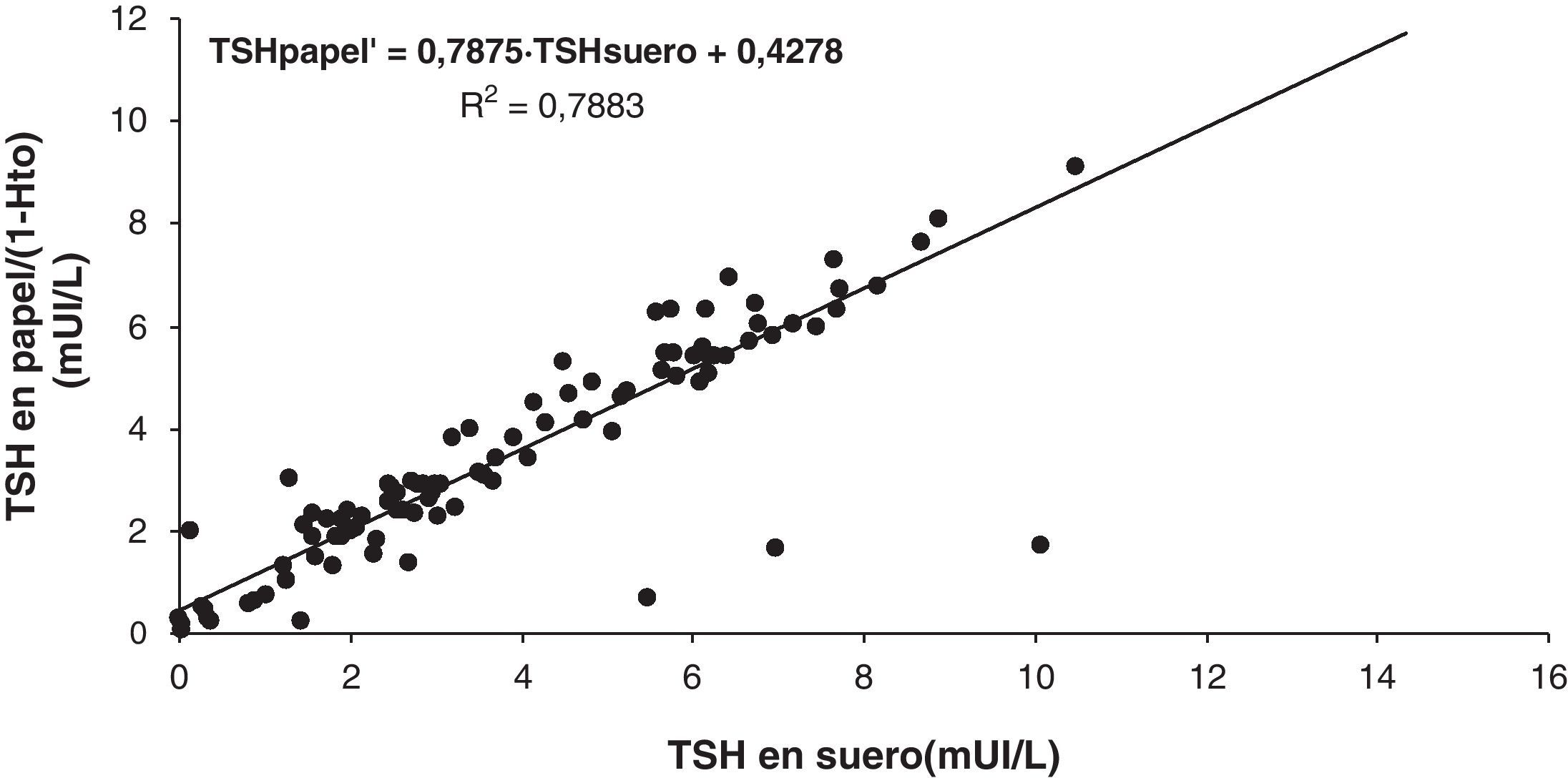
Se observa una disminución de los valores de TSH en las muestras plasmáticas que aparecen representadas en la figura 4 frente a las correspondientes en suero (pendiente 0,6997). Esto corrobora el efecto del EDTA sobre la medida de esta hormona. El mismo efecto se observa en las muestras de sangre con EDTA impregnadas en papel, corregida por el hematocrito, con una pendiente de 0,7875 (fig. 5). La explicación de esta disminución está en que se trata de un inmunoensayo directo, a diferencia de los empleados para la medida de 17-hidroxi-progesterona que son competitivos con 2 anticuerpos y lo que provoca es una elevación7,12.
En la representación de las figuras 4 y 5 observamos que 6 muestras de plasma y 4 de sangre impregnada en papel tienen una concentración de TSH menor de la esperada según la recta de regresión calculada. Esto podría justificarse si en la extracción de la muestra los tubos, que contienen una concentración de EDTA de 4,4 mmol/L cuando se llenan adecuadamente (hasta la señal indicada en el tubo), no se llenan completamente siendo mayor la concentración del anticoagulante y por lo tanto la interferencia que este produce en la medida de la hormona TSH12.
Otra práctica que debe descartarse es la de utilizar tubos capilares con EDTA5 y reutilizarlos varias veces para impregnar las manchas del papel de cribado ya que sería la causa de que las manchas presenten distintas concentraciones de TSH en función de si fue la primera vez que se utilizó el capilar ó las siguientes en las que el capilar ya no poseía EDTA.
Una vez estudiado el método y la influencia del EDTA sobre los valores de TSH se incluyó la transición MRM de este parámetro en el perfil de acilcarnitinas y aminoácidos. De esta forma se puede determinar en todas las muestras del cribado sin coste adicional alguno.
Se midió la concentración de EDTA presente en 2.300 muestras de sangre en papel de recién nacidos por ESI-MS/MS. En 17 de ellas se comprobó que contenían EDTA en una concentración entre 1 y 6 mmol/L. Esto representa un 0,74% de las muestras estudiadas y por tanto en riesgo de producirse un resultado falsamente negativo en caso de concurrencia con un valor próximo al punto de corte de TSH. En un estudio previo Fingerhurt et al. habían encontrado un 0,06%12. En nuestra experiencia, de más de 30 años de cribado neonatal de hipotiroidismo congénito, aproximadamente un 8% de los casos detectados presentaban al diagnóstico valores solo ligeramente superiores al punto de corte.
Conclusiones- 1.
El método puesto a punto es válido para la determinación de este anticoagulante y se puede incluir en el perfil de aminoácidos y acilcarnitinas por ESI-MS/MS para detectar y descartar aquellas muestras que se extrajeron inadecuadamente con EDTA.
- 2.
Se confirma la influencia del EDTA en la determinación de TSH disminuyendo los valores de esta hormona. Esto podría provocar un falso negativo en el cribado neonatal de hipotiroidismo congénito cuando se determina la TSH por el método de DELFIA.
- 3.
El hecho de que el EDTA y la acrililcarnitina produzcan el mismo fragmento molecular es útil para conocer qué muestras se han extraído con el anticoagulante permitiendo no validar el ensayo de TSH analizadas por este método.
- 4.
Un 0,74% de las muestras de sangre impregnadas en papel de los recién nacidos estudiados han sido tomadas con EDTA y por ello no serían válidas para el cribado neonatal de hipotiroidismo congénito. El protocolo de cribado debe modificarse incluyendo la solicitud de una nueva muestra en estos casos.
El presente trabajo ha sido financiado en parte con una ayuda de la Fundación José Luís Castaño para el desarrollo de la Bioquímica Clínica.
NotasEste trabajo corresponde a una comunicación científica presentada y premiada en el V Congreso Nacional del Laboratorio Clínico, celebrado en Málaga del 9-11 de noviembre de 2011.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo corresponde a una comunicación científica presentada y premiada con el segundo premio en el V Congreso Nacional del Laboratorio Clínico celebrado en Málaga del 9 al 11 de noviembre de 2011.