La enfermedad por hígado graso no alcohólico (EHGNA) afecta aproximadamente a entre el 20% y el 30% de la población general, y su relevancia clínica es debida a que una parte de estos sujetos desarrolla esteatohepatitis no alcohólica que puede progresar a cirrosis y carcinoma hepatocelular. Actualmente la biopsia hepática es el estándar de referencia para el diagnóstico y la estratificación de la EHGNA, pero sin embargo, los riesgos y limitaciones asociados a este procedimiento, junto con la alta y creciente prevalencia de la EHGNA han desencadenado una búsqueda intensiva de métodos alternativos no invasivos para la evaluación de esta enfermedad. Dentro de estos métodos destacan los biomarcadores de laboratorio, que se han convertido en una opción prometedora por su carácter no invasivo y su reproducibilidad. Esta revisión pretende exponer los conocimientos actuales sobre el papel de los biomarcadores en el manejo de la EHGNA.
Non-Alcoholic Fatty Liver Disease (NAFLD) affects approximately 20% to 30% of the general population, and its clinical relevance is due to the fact that a percentage of these subjects develop non-alcoholic steatohepatitis that can progress to cirrhosis and hepatocellular carcinoma. Currently the liver biopsy is the reference standard for the diagnosis and stratification of NAFLD, but the risks and limitations associated with this procedure, together with the high and increasing prevalence of NAFLD, have triggered an intensive search for alternative non-invasive methods for the evaluation of this disease. Among these methods are the laboratory biomarkers, which have become a promising option due to their non-invasive nature and reproducibility in their measurement. This review aims to present current knowledge on the role of biomarkers in the management of non-alcoholic steatohepatitis.
La enfermedad hepática grasa no alcohólica (EHGNA) es un término genérico que se refiere a un amplio espectro de lesiones hepáticas que aparecen en ausencia de ingesta de alcohol, y que van desde la esteatosis simple sin lesiones necroinflamatorias significativas, hasta un patrón complejo denominado esteatohepatitis, que incluye lesiones activas de daño hepatocitario, apoptosis, muerte celular e inflamación. La esteatohepatitis es una enfermedad hepática crónica que puede evolucionar a fibrosis, cirrosis y enfermedad hepática terminal.
En la EHGNA tienen lugar una serie de alteraciones de factores locales y sistémicos, que controlan el equilibrio entre el aflujo, la oxidación y la exportación de lípidos, lo que conduce a la acumulación hepática de triglicéridos. Es un proceso complejo, y solo parcialmente conocido, pero en el que sabe que desempeñan un papel fundamental la inflamación y la resistencia a la insulina.
La EHGNA es el trastorno hepático más frecuente en los países industrializados occidentales, y tiene una prevalencia del 6% al 35% en todo el mundo. En Europa, la prevalencia media es del 25-26% con amplias variaciones en diferentes poblaciones. La incidencia de la enfermedad ha aumentado de manera significativa en los últimos años, en paralelo con el aumento de la prevalencia de la obesidad1,2.
EpidemiologíaLos estudios de población han demostrado que la EHGNA está fuertemente asociada con la obesidad central, la diabetes mellitus tipo 2 (DM2), la dislipidemia y la resistencia a la insulina. Es frecuente la asociación de diversos de estos factores y, dentro de estos, los predictores más importantes de fibrosis son la edad, la obesidad y la DM. Como tal, la EHGNA puede ser considerada como la manifestación hepática del síndrome metabólico3.
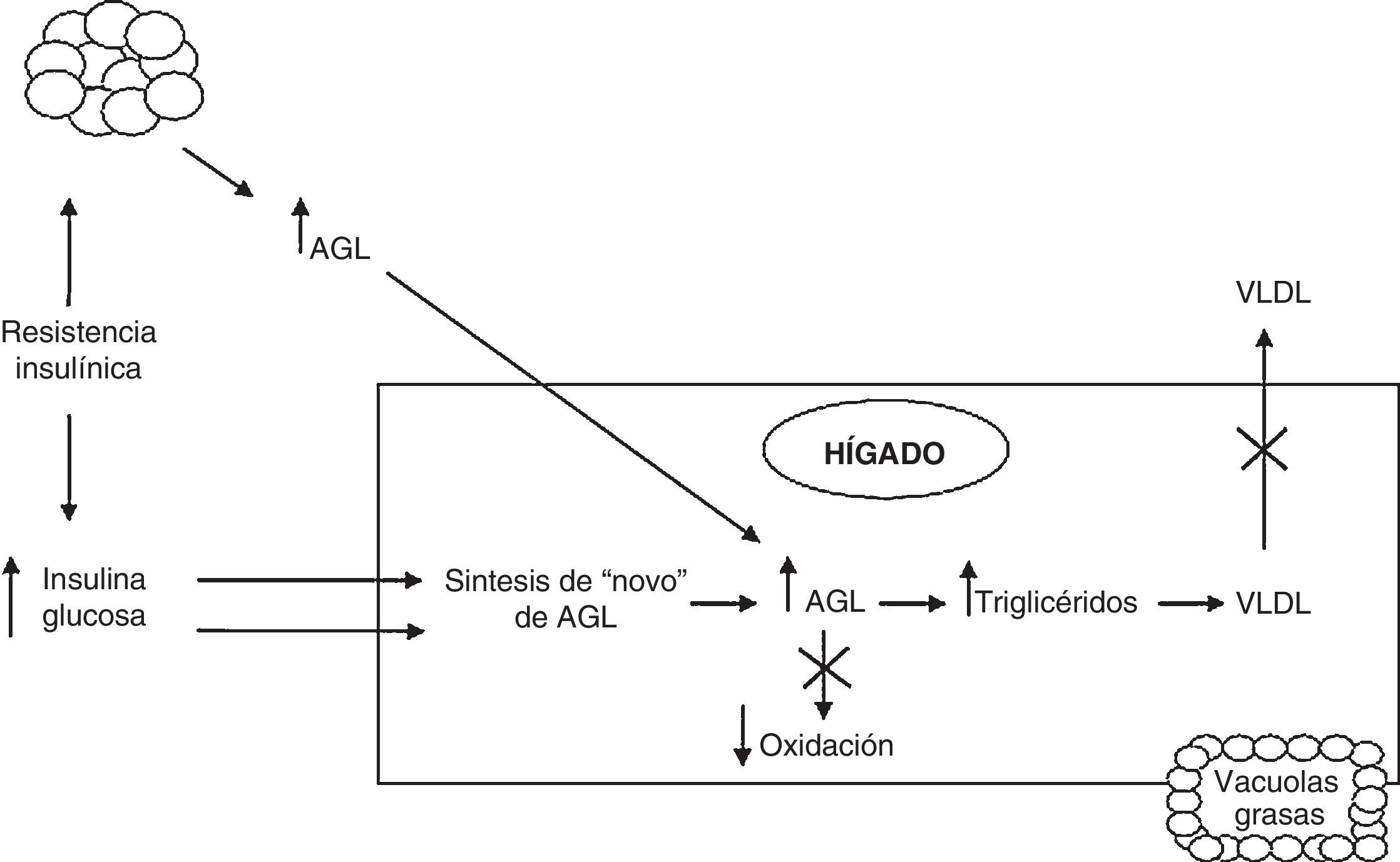
FisiopatologíaDesde el punto de vista fisiopatogénico la teoría más aceptada como causante de la enfermedad es la del «doble impacto» propuesta por Day y James4. Según este modelo, el primer golpe implica la acumulación de lípidos en los hepatocitos debido a un desequilibrio en la homeostasis de los triglicéridos, lo cual conduce al desarrollo de esteatosis hepática, considerado el marcador patognomónico de la enfermedad. Posteriormente, el segundo golpe equivale al desarrollo de estrés metabólico-oxidativo y a la producción descontrolada de citoquinas como intento de compensar la alteración de la homeostasis lipídica, que provocan inflamación, necrosis y activación de la cascada fibrogénica, promoviendo por tanto progresión de la lesión hepática.
En la EHGNA la acumulación de grasa en el hígado es el resultado de una mayor liberación de ácidos grasos libres (AGL) al hígado, del aumento de la síntesis y disminución de la exportación de triglicéridos a través de lipoproteínas de muy baja densidad y de la reducción de la beta-oxidación. Generalmente, los pacientes con EHGNA tienen resistencia a la insulina, lo que provoca un aumento de la lipólisis del tejido adiposo. Los AGL resultantes serán absorbidos por el hígado, pudiendo causar peroxidación lipídica, que aumentará la producción de citoquinas pro-inflamatorias5.
La lipogénesis de novo, debida a la hiperinsulinemia asociada a la resistencia a la insulina, también contribuye a la esteatosis aumentando la producción y almacenamiento de triglicéridos. La hiperinsulinemia además puede causar una reducción de la secreción de lipoproteínas de muy baja densidad, lo que conduce a la acumulación hepática de triglicéridos.
La presencia de inflamación o esteatohepatitis depende de una serie de factores tales como la presencia de AGL, citoquinas proinflamatorias y adipoquinas, estrés oxidativo y disfunción mitocondrial. En la figura 1 se puede apreciar esquemáticamente la fisiopatogenia de la EHGNA.
El hallazgo anatomopatológico más común descrito en la enfermedad es la presencia de esteatosis hepática, que se presenta con diferentes grados de gravedad casi en el 100% de los casos. Además, el amplio espectro de esta enfermedad incluye la presencia de esteatohepatitis y fibrosis en el caso de enfermedad avanzada.
En la EHGNA la progresión de la lesión hepática depende del daño histológico en el momento del diagnóstico, así la esteatosis hepática generalmente presenta un curso clínico benigno y carácter reversible, mientras que la presencia de esteatohepatitis o fibrosis están vinculadas con un peor pronóstico de la enfermedad relacionado con el desarrollo de cirrosis hepática y carcinoma hepatocelular. De entre los pacientes con esteatohepatitis un 25-35% desarrollan fibrosis progresiva, entre el 65-75% permanecen estables o presentan regresión de la fibrosis y entre el 9-20% progresan a cirrosis6,7.
Estos datos sugieren la importancia y la necesidad de establecer un seguimiento protocolizado de los pacientes con EHGNA, para detectar de manera precoz la presencia de esteatohepatitis y/o fibrosis, estableciendo por tanto una población de riesgo con mayor probabilidad de evolucionar a cirrosis y hepatocarcinoma.
DiagnósticoLos sujetos con EHGNA están en su mayoría asintomáticos, aunque pueden mostrar manifestaciones clínicas inespecíficas como fatiga, malestar general o dolor en el hipocondrio derecho. En ocasiones existe solo hepatomegalia, sin ictericia, y los datos de esplenomegalia o signos clínicos de hipertensión portal son muy raros. De ahí que casi siempre se sospeche el diagnóstico por la presencia de alteraciones ecográficas o de los resultados de laboratorio descubiertos de manera accidental.
Deben excluirse otras causas de hepatopatía, especialmente las hepatitis virales y el alcoholismo, por ser las más prevalentes en nuestro medio. La ausencia de consumo de alcohol es una de las características definitorias de esta entidad, pero es difícil de establecer con seguridad, motivo por el que se usan con frecuencia cuestionarios específicos o, incluso, combinaciones de datos analíticos.
En la actualidad, para el diagnóstico de la EHGNA se dispone básicamente de la biopsia hepática, técnica de referencia y de métodos no invasivos representados por las técnicas de imagen y los biomarcadores de laboratorio.
Biopsia hepáticaLa biopsia hepática es el estándar de referencia para el diagnóstico de la EHGNA, ya que confirma los hallazgos histológicos típicamente descritos en la enfermedad y permite su estratificación. Sin embargo, es un procedimiento invasivo, que implica por tanto un riesgo bajo pero real de morbimortalidad. Además del riesgo de eventos adversos la biopsia hepática presenta ciertas limitaciones inherentes al procedimiento, tales como el error de muestreo y la variabilidad intra e interobservador. Otras limitaciones no menos importantes son su elevado coste y una baja aceptación por parte de los pacientes, que en ocasiones conlleva demoras terapéuticas8.
Estas razones justifican que la biopsia no pueda utilizarse como procedimiento de cribado en el gran número de pacientes con sospecha de EHGNA, ni tampoco para realizar el seguimiento de los pacientes ya diagnosticados, quedando su uso limitado a pacientes muy seleccionados9,10. Es por ello que en los últimos años se ha potenciado el desarrollo de técnicas no invasivas, fundamentalmente biomarcadores y estudios de imagen.
Técnicas de imagenDe entre las técnicas de imagen la ecografía es la técnica de cribado más comúnmente utilizada en la práctica clínica rutinaria cuando existe sospecha de EHGNA, debido especialmente a su bajo coste y a su accesibilidad. Sin embargo, la sensibilidad de la técnica es baja en estadios leves de la enfermedad y para diferenciar estadios intermedios11.
Han cobrado especial relevancia en los últimos años técnicas de imagen como el Fibroscan® o el ARFI (Acustic Radiation Force Impulse; técnica de radiación acústica de la fuerza del impulso), basadas en la medición de la rigidez hepática mediante ultrasonidos. Estas técnicas, aunque con sus limitaciones, han mostrado buenos resultados en la evaluación de la EHGNA9,12.
Otras técnicas de imagen, aunque por el momento apenas utilizadas en la práctica clínica para el diagnóstico de la EGHNA, son la tomografía computarizada o la resonancia magnética (RM). Aunque la tomografía computarizada se considera una técnica fiable para evaluar la esteatosis su uso es limitado por la exposición a la radiación. Dentro de la RM existe una modalidad llamada «elastografía de resonancia magnética» (elasto-RM), que produce imágenes codificadas a color que indican la elasticidad de los tejidos. Esta técnica aporta buenos resultados, pero las principales limitaciones son su elevado coste, su poca disponibilidad y que, en ocasiones, es mal tolerada por los pacientes13,14.
BiomarcadoresLos biomarcadores se muestran como una opción muy prometedora para la valoración de la EHGNA, fundamentalmente por su naturaleza no invasiva, así como por la posibilidad de automatización y su reproducibilidad. A continuación se exponen algunos de los principales biomarcadores que se han evaluado en el contexto de esta enfermedad.
Pruebas de función hepáticaAunque un porcentaje bastante elevado de los pacientes con EHGNA pueden tener las pruebas de función hepática normales, dentro del patrón característico del laboratorio se encuentran la elevación moderada de la aspartato aminotransferasa (AST; EC 2.6.1.1.) y la alanino aminotransferasa (ALT; EC 2.6.1.2), que refleja un daño hepatocelular inespecífico. En la EHGNA, y más específicamente en la esteatohepatitis no alcohólica, los niveles de aminotransferasas pueden elevarse de 2 a 4 veces sobre el límite superior de normalidad, siendo la ALT más alta que la AST, en contraste con la esteatohepatitis alcohólica15,16.
Los niveles altos de fosfatasa alcalina (EC 3.1.3.1.) y γ-glutamiltransferasa (GGT; EC 2.3.2.2.) también son comunes, detectándose en el 25-75% de los pacientes, situándose los niveles entre 1,5 y 3 veces el límite superior de la normalidad. La bilirrubina y la albúmina suelen permanecer normales hasta etapas avanzadas de la hepatopatía17.
Los trastornos en la hemostasia, debidos a la disminución de la capacidad sintética del hígado de los factores de la coagulación, no se manifiestan generalmente hasta alcanzar el estadio de cirrosis hepática. En las etapas previas de la enfermedad no se observan alteraciones hemostásicas debido a la gran reserva funcional de las proteínas de la coagulación existente en el hígado.
Si bien todas estas alteraciones no son específicas, ni tampoco suficientemente sensibles para detectar la enfermedad en estadios iniciales, sí ayudan a excluir otras causas potenciales de enfermedad hepática después de descartar alcoholismo y marcadores virales positivos.
Biomarcadores de fibrosisLa fibrosis hepática es la formación y acumulación patológica de matriz extracelular por las células estrelladas en respuesta a una lesión hepática crónica. El grado y la tasa de progresión de la fibrosis hepática se consideran actualmente los determinantes más importantes de la evolución y el pronóstico de los pacientes con EHGNA. Esta es la razón por la cual los primeros biomarcadores que se utilizaron en la EHGNA fueron los que estimaban el grado de fibrosis hepática y que, generalmente, se habían evaluado inicialmente en pacientes con hepatitis virales (particularmente con hepatitis por virus C). Existe una amplia variedad de este tipo de biomarcadores, utilizados de manera aislada, o más frecuentemente combinados mediante algoritmos matemáticos. A continuación se describen algunos de los más relevantes.
En 2007 se desarrolló el algoritmo NAFLD Fibrosis Score (NFS) en un estudio llevado a cabo en una población de pacientes con EHGNA diagnosticada mediante biopsia, con el objetivo de identificar a aquellos con fibrosis avanzada18. El índice incluye los parámetros edad, índice de masa corporal, presencia de DM o alteración de la glucosa en ayunas, relación AST/ALT, recuento de plaquetas y albúmina. Una puntuación por debajo de –1,455 tiene un valor predictivo negativo alto para excluir fibrosis avanzada, mientras que una puntuación por encima de 0,676 predice fibrosis avanzada. Los autores recomiendan que únicamente los pacientes cuya puntuación se sitúe en el rango intermedio deben someterse a biopsia hepática, evitando así alrededor del 75% de las biopsias. En un metaanálisis de 2011 que evaluó diversos estudios llevados a cabo en pacientes con EHGNA19 se reflejó un área bajo la curva ROC (receiver operation characteristics; AUROC) y una sensibilidad y especificidad del NAFLD Fibrosis Score para la detección de fibrosis avanzada de 0,85, 90% y 97%.
Otro algoritmo simple que se desarrolló para excluir la presencia de fibrosis avanzada en pacientes con EHGNA es el BARD (de las siglas en inglés de body mass index [BMI]; aspartate transaminase/alanine aminotransferase ratio [AAR] y diabetes mellitus [DM]). Se basa en 3 variables combinadas en una suma ponderada (el índice de masa corporal ≥28 representa 1 punto, la relación AST/ALT≥0,8 representa 2 puntos y la DM representa 1 punto). Una puntuación de 2-4 tuvo una odds ratio de 17 (intervalo de confianza: 9,2-31,9) para determinar la fibrosis avanzada y un valor predictivo negativo del 96%20.
El índice APRI (AST to Platelet Ratio Index; índice AST/plaquetas) se calcula utilizando los niveles de AST y el recuento de plaquetas. En un estudio reciente21 en el que participaron 358 pacientes con EHGNA diagnosticada mediante biopsia, el AUROC, la sensibilidad y la especificidad del APRI (para un punto de corte>1) para la detección de fibrosis significativa fueron respectivamente: 0,67, 30% y 93%.
El índice FIB-4, diseñado inicialmente en una población de pacientes con virus de la hepatitis C, incluye el recuento de plaquetas, ALT, AST y edad. Posteriormente se ha evaluado en pacientes con EHGNA, encontrando un AUROC para el diagnóstico de fibrosis avanzada de 0,871. Se plantean 2 puntos de corte, de tal manera que los valores por debajo del punto inferior (1,45) permiten excluir fibrosis avanzada (sensibilidad 74%, especificidad 71%) y los valores por encima del punto de corte superior (3,25) indican la presencia de fibrosis avanzada (sensibilidad 26%, especificidad 98%)22.
El Enhanced Liver Fibrosis test (ELF) es una versión simplificada del panel original ELF (OELF) cuya utilidad diagnóstica ha sido validada para la detección de fibrosis en una amplia variedad de trastornos hepáticos. La prueba ELF es un algoritmo que incluye 3 biomarcadores, el ácido hialurónico (HA), el propéptido aminoterminal del procolágeno tipo iii (PIIINP) y el inhibidor tisular de la metaloproteinasa 1 (TIMP-1). En el primer estudio de validación del test ELF en una población de pacientes con EHGNA se establecieron 3 puntos de corte: 0,3576 para la detección de fibrosis avanzada (AUROC 0,90), –0,1068 para fibrosis significativa (AUROC 0,82) y –0,2070 para ausencia de fibrosis (AUROC 0,76)23.
El índice Hepascore incluye la edad, el sexo, la bilirrubina, la γ-glutamiltransferasa, el ácido hialurónico y la α2-macroglobulina. El algoritmo ha sido valorado en pacientes con EHGNA, demostrando su capacidad para la identificación de pacientes con fibrosis significativa (AUROC, sensibilidad y especificidad de 0,73, 50,5% y 88,3%), fibrosis avanzada (0,81, 75,5% y 84,1%) y cirrosis (0,90, 87% y 89%)24.
También se han desarrollado paneles patentados para evaluar la fibrosis en la EHGNA. Es el caso de FibroMeter™-EHGNA, que incluye 7 variables (edad, peso corporal, ferritina, plaquetas, AST, ALT y glucosa en ayunas) y FibroTest™, que se basa en la combinación de edad, sexo, bilirrubina, γ-glutamiltransferasa, apolipoproteína A1, haptoglobina y α2-macroglobulina. Ambos aportan valores óptimos de AUROC para la detección de fibrosis (0,94 Fibrometer y 0,86 Fibrotest)25,26.
En la tabla 1 puede observarse de manera resumida el rendimiento diagnóstico de los distintos índices matemáticos para la estimación del grado de fibrosis.
Índices matemáticos para la estimación del grado de fibrosis en pacientes con EHGNA
| Índices matemáticos | Variables incluidas | Puntos de corte | Referencia |
|---|---|---|---|
| NFS | Edad, IMC, DM o alteración de la glucosa en ayunas, AST/ALT, plaquetas y albúmina | ≤1,455: ausencia de fibrosis avanzada (S: 82%, E: 77%, VPP: 56%, VPN: 93%) >0,676: presencia de fibrosis avanzada (S: 51%, E: 98%, VPP: 90%, VPN: 85%) | Angulo et al.18 |
| BARD | IMC, AST/ALT, DM | 2-4: fibrosis avanzada (AUROC: 0,81, VPP: 43%, VPN: 96%) | Harrison et al.20 |
| APRI | AST, plaquetas | >1: fibrosis significativa (AUROC: 0,67, S: 30% y E: 93%) | Tapper et al.21 |
| FIB-4 | Plaquetas, ALT, AST, edad | <1,45: ausencia de fibrosis avanzada (AUROC: 0,87, S: 74%, E: 71%, VPP: 90%, VPN: 64%) >3,25: presencia de fibrosis avanzada (AUROC: 0,87, S: 26%, E: 98%, VPP: 48%, VPN: 95%) | Sumida et al.22 |
| ELF | HA, PIIINP, TIMP-1 | 0,3576: presencia de fibrosis avanzada (AUROC: 0,90, S: 80%, E: 90%, VPP: 71%, VPN: 94%) –0,1068: presencia de fibrosis significativa (AUROC: 0,82, S: 70%, E: 70%, VPP: 70%, VPN: 80%) –0,2070: ausencia de fibrosis (AUROC: 0,76, S: 61%, E: 80%, VPP: 81%, VPN: 79%) | Guha et al.23 |
| Hepascore | Edad, sexo, bilirrubina, GGT, HA, α2-macroglobulina | 0,37: fibrosis significativa (AUROC: 0,73, S: 50,5%, E: 88,3%) 0,44: fibrosis avanzada (AUROC: 0,81, S: 75,5%, E: 84,1%) 0,70: cirrosis (AUROC: 0,90, S: 87%, E: 89%) | Kaswala et al.24 |
| FibroMeter™-EHGNA | Edad, peso corporal, ferritina, plaquetas, AST, ALT, glucosa en ayunas | 0,490: fibrosis significativa (AUROC: 0,94, S: 78,5%, E: 95,9%, VPP: 87,9%, VPN: 92,1%) | Calès et al.25 |
| FibroTest™ | Sexo, bilirrubina, GGT, ApoA1, haptoglobina, α2-macroglobulina | 0,30: fibrosis avanzada (AUROC: 0,86, S: 77%, E: 77%, VPP: 54%, VPN: 90%) | Ratziu et al.26 |
ALT: alanino aminotransferasa; ApoA1: apolipoproteína A1; AST: aspartato aminotransferasa; AUROC: área bajo la curva ROC; DM: diabetes mellitus; E: especificidad; GGT: γ-glutamiltransferasa; HA: ácido hialurónico; IMC: índice de masa corporal; PIIINP: propéptido amino-terminal del procolágeno tipo iii; S: sensibilidad; TIMP-1: inhibidor tisular de la metaloproteinasa 1.
La glicosilación es la modificación postraduccional de proteínas secretadas con restos de hidratos de carbono que puede provocar cambios estructurales, así como en las interacciones celulares, la solubilidad y la unión a receptores. Debido a que muchas proteínas glicosiladas en el suero se generan en el hígado, se espera que una función hepática disminuida se relacione con los cambios en la glicosilación de proteínas, y estudios recientes sugieren que el N-glicol sérico puede ser un biomarcador valioso de enfermedad hepática crónica27,28.
De acuerdo con las diferencias en los patrones de N-glicosilación se han identificado 2 biomarcadores, el GlycoCirrhoTest y el GlycoFibroTest, para predecir la presencia de cirrosis y fibrosis respectivamente29,30, por lo que podrían ser útiles en la identificación de estadios avanzados de la EHGNA.
Marcadores de inflamaciónTeniendo en cuenta la fisiopatología de la EHGNA se ha evaluado la utilidad de diversos biomarcadores de inflamación para la valoración de la enfermedad, incluyendo citoquinas inflamatorias como el factor de necrosis tumoral alfa (TNF-α) y la interleuquina 6 (IL-6), así como la proteína C reactiva ultrasensible (hs-CRP) o la ferritina. La supresión de la señalización de citoquinas regula negativamente los receptores hepatocelulares de insulina y promueve la resistencia a la insulina hepática adquirida. Otras moléculas relacionadas con la inflamación hepática, como es la enzima catepsina D, también se han identificado como posibles biomarcadores para la valoración de esta enfermedad.
Existe una fuerte asociación entre la IL-6 y la EHGNA31, sin embargo la IL-6 se eleva en varias afecciones inflamatorias incluyendo resistencia a la insulina y desencadena fibrosis en múltiples órganos. Se ha demostrado que la IL-6 es significativamente mayor en los pacientes con EHGNA en comparación con población sana, sin embargo se observan resultados contradictorios cuando se comparan los niveles de IL-6 entre los pacientes con esteatosis simple y aquellos con esteatohepatitis32,33. Así, el papel de la IL-6 parece útil en la confirmación del diagnóstico de la enfermedad, mientras que su papel como marcador de estadificación es menos claro.
El TNF-α está implicado en la patogénesis de la esteatohepatitis no alcohólica, encontrándose sus niveles significativamente aumentados en estos pacientes con respecto a aquellos con esteatosis simple y en los controles sanos33,34.
La ferritina es una proteína intracelular que se une al hierro y lo libera de manera controlada. El nivel de ferritina aumenta en respuesta a la infección y a la inflamación. La ferritina sérica es un predictor independiente de fibrosis hepática avanzada en pacientes con EHGNA35. Otro marcador genérico de inflamación, la PCR, ha mostrado una asociación con la esteatohepatitis no alcohólica36.
Más recientemente se ha identificado que los niveles plasmáticos de la enzima lisosómica catepsina D, implicada en el procesamiento de las lipoproteínas ricas en colesterol, se incrementan de manera significativa en los pacientes con esteatohepatitis en comparación con los pacientes con un hígado sano o esteatosis simple. Además, los niveles de esta enzima correlacionan de manera específica con el grado de severidad de la EHGNA, incluso en las etapas iniciales de la enfermedad. Por otra parte, en pacientes con EHGNA sometidos a cirugía bariátrica se comprobó que después de la intervención, la catepsina D disminuyó de manera significativa paralelamente a la mejoría en el grado de hepatopatía. Estos datos sugieren que esta enzima podría utilizarse en el diagnóstico y seguimiento de la EHGNA37.
Marcadores de apoptosisLa citoqueratina 18 (CK-18) es la principal proteína de filamento intermedio del hígado. Las caspasas escinden CK-18 durante la apoptosis de hepatocitos y crean fragmentos de CK-18 que pueden ser detectados por inmunoensayo38. Se considera por tanto un marcador de la apoptosis de los hepatocitos, que aumenta significativamente en la esteatohepatitis no alcohólica en comparación con la esteatosis simple o el hígado sano.
Diversos estudios han mostrado respecto a la CK-18 resultados satisfactorios para la detección de esteatohepatitis no alcohólica, pero sin embargo se observan grandes diferencias en los puntos de corte establecidos, lo que supone un problema para la aplicación clínica. Un metaanálisis que evaluó 11 estudios recientes muestra que el AUROC para la detección de esteatohepatitis varió desde 0,71 a 0,93, con una sensibilidad y especificidad del 66% y 82% respectivamente. Se constató una amplia variación en los valores de corte reportados por cada investigador (punto de corte óptimo entre 136-338U/l)38. Además, sus niveles plasmáticos están alterados en varias afecciones inflamatorias que implican respuesta apoptótica, tales como hepatitis viral crónica, enfermedades pulmonares y renales crónicas39. Por estas razones la Asociación Americana para el Estudio de Enfermedades Hepáticas (AASLD) no ha recomendado el uso de CK-18 para el diagnóstico de la esteatohepatitis no alcohólica.
AdipoquinasLa asociación entre la obesidad y la EHGNA está bien descrita. Se sabe que el tejido adiposo segrega varias proteínas bioactivas, que se consideran implicadas en el desarrollo de la enfermedad.
La adiponectina es la proteína más abundante secretada por el tejido adiposo y tiene funciones en el metabolismo de la glucosa y los lípidos. Su secreción es estimulada por la insulina y es inducida durante la diferenciación de las células grasas. Los niveles circulantes de adiponectina se asocian negativamente con la resistencia a la insulina, la DM2, la dislipidemia y el síndrome metabólico. Varios estudios han demostrado niveles significativamente más bajos de adiponectina en el suero de pacientes con esteatohepatitis no alcohólica con respecto a pacientes sanos o con esteatosis simple16,40.
Otra adipoquina asociada con la EHGNA es la leptina, una proteohormona de 16kDa implicada en la regulación de la ingesta de alimentos, el balance energético y el peso corporal. Las concentraciones de leptina en la sangre reflejan la grasa corporal total41,42. Aunque son diversos los estudios que han abordado el papel de la leptina como biomarcador en la EHGNA, los resultados no son concluyentes. Por un lado se ha señalado que los niveles de esta adipoquina son significativamente más altos en los pacientes con EHGNA32,40, pero existen otros estudios que han reportado la ausencia de diferencias entre pacientes y grupo control43. En el trabajo de Lemoine et al.40 se indica que la ratio adiponectina/leptina en combinación con la evaluación de la resistencia a la insulina es útil para la predicción de la enfermedad. En otro estudio se ha señalado que los niveles de leptina y adiponectina son predictores independientes de esteatohepatitis no alcohólica en pacientes obesos44.
También se ha estudiado la relación de la resistina con la EHGNA, aunque los resultados han mostrado discrepancias en función de los estudios. Por un lado existen publicaciones que ponen de manifiesto la existencia de niveles más altos de esta citoquina en pacientes con EHGNA en estadios avanzados45, mientras que otras publicaciones indican que no existen diferencias significativas entre los pacientes con EHGNA y los controles sanos46,47.
Los niveles séricos de la proteína de unión al retinol 4 (RBP4), otra adipoquina asociada con resistencia a la insulina, también se han encontrado elevados en los pacientes con EHGNA en comparación con los controles48.
Está claro que las adipoquinas desempeñan un papel en el desarrollo y la patogénesis de la EHGNA, pero sin embargo se necesitan más estudios que presenten una evidencia robusta de su utilidad como marcadores de la enfermedad.
Marcadores de estrés oxidativoEl estrés oxidativo se ha establecido como un factor clave en el desarrollo de la esteatohepatitis no alcohólica, aunque las interacciones de este proceso complejo con el desarrollo y la progresión de la enfermedad no se conocen con exactitud. Varios estudios han evaluado marcadores tanto del aumento del estrés oxidativo como de la reducción de la capacidad antioxidante en pacientes con EHGNA.
Se ha demostrado que la lipoproteína de baja densidad (LDL) oxidada y las sustancias reactivas al ácido tiobarbitúrico (TBARS) son significativamente más altos en pacientes con esteatohepatitis no alcohólica. Además, ambos marcadores se asocian de manera independiente con la resistencia a la insulina y su interacción con las células estrelladas hepáticas favorece el desarrollo de fibrosis49,50.
Por otro lado, se han encontrado niveles más bajos de superóxido dismutasa, catalasa y glutatión peroxidasa (GSH-Px) en pacientes con EHGNA51,52.
El citocromo p450 2E1 desempeña un papel importante en el metabolismo de los ácidos grasos y conduce a la formación de peróxidos lipídicos tóxicos. Evidencias recientes muestran correlación positiva entre la actividad del citocromo p450 2E1, la sobreproducción de especies reactivas de oxígeno y la resistencia a la insulina, por lo que desempeña un papel importante en el desarrollo y la progresión de la EHGNA16,53.
Metabolómica y proteómicaLa metabolómica y proteómica son unas de las técnicas más utilizadas para identificar nuevos marcadores de la EHGNA. Generalmente se utiliza un enfoque de metabolómica exploratoria mediante cromatografía líquida-espectrometría de masas de alto rendimiento para identificar metabolitos cuyos niveles difieran en los pacientes con EHGNA54.
Metabolómica: Mediante análisis metabolómico se ha revelado que la EHGNA se asocia con mayores concentraciones plasmáticas de homocisteína y cisteína total, y menores concentraciones plasmáticas de glutatión total. Adicionalmente se han encontrado niveles más elevados de glicocolato, taurocolato y glicoconso-desoxicolato. Las concentraciones plasmáticas de ácidos grasos de cadena larga fueron menores, mientras que las de carnitina libre, butirilcarnitina y metilbutirilcarnitina fueron más altas en la esteatohepatitis no alcohólica55.
También mediante enfoque metabolómico, Li et al. identificaron los niveles séricos de glucosa, glutamato, lactato y taurina como biomarcadores de EHGNA y construyeron un modelo para predecir las diferentes etapas de la progresión de la enfermedad basado en los diferentes niveles de estos biomarcadores en cada individuo56.
Proteómica: Los estudios proteómicos usan el reconocimiento de patrones con sustracción. Varios estudios han reportado diferentes picos de proteínas en el suero de pacientes con esteatohepatitis que difieren de otros que únicamente presentan esteatosis simple57,58.
Dos estudios proteómicos importantes, utilizando tejido hepático y suero de pacientes adultos con y sin EHGNA, revelaron una mayor expresión de lumican (un proteoglucano de queratán sulfato implicado en la reticulación del colágeno y la transición epitelial-mesenquimal) en pacientes con esteatohepatitis no alcohólica59,60.
En otro estudio proteómico se encontró que diversas proteínas se regulan al alza y a la baja en pacientes con EHGNA en comparación con sujetos sanos. La afamina, la apolipoproteína E, la molécula CD5, el complemento C3, la proteína de unión al factor de crecimiento similar a la insulina 3, la proteína de unión a la vitamina D y la proteína citosólica 1 de los linfocitos se incrementaron en el suero de los pacientes con EHGNA. Además, la apolipoproteína E, la catalasa, la molécula CD5, la proteína citosólica 1 de los linfocitos y la proteína de unión a la vitamina D se incrementaron en aquellos pacientes con esteatohepatitis en comparación con los que únicamente presentaban esteatosis simple61.
GenéticaSe han constatado variaciones considerables tanto en la gravedad como en la progresión de la EHGNA en pacientes con características basales similares, así como diferente prevalencia de la enfermedad en función de la raza, e incluso en determinados individuos parece haber un componente familiar. Estos datos fundamentan la implicación de factores genéticos. Se ha estudiado la asociación entre varias mutaciones y polimorfismos y la sobreexpresión de genes proinflamatorios, proapoptóticos y profibrogénicos, lo que podría condicionar la variabilidad en las manifestaciones clínicas, así como la progresión y el curso de la enfermedad62.
El polimorfismo de nucleótido único rs738409 en el gen de la adiponutrina (PNPLA3), ubicado en el cromosoma 22, en que existe una transversión de citosina (C) por guanina (G), la que a su vez codifica la variante I148M (cambio del aminoácido isoleucina por metionina), ha sido identificado como un determinante genético de la EHGNA, asociándose a una esteatosis más grave, esteatohepatitis y fibrosis, así como con aumento del riesgo de desarrollar carcinoma hepatocelular63,64.
Otra variante genética en relación con la EHGNA descubierta más recientemente es la que ocurre en el gen Transmembrane 6 superfamily member 2 (TM6SF2), ubicado en el cromosoma 19, y que se ha asociado a la presencia de esteatosis, esteatohepatitis y fibrosis hepática. El polimorfismo de nucleótido único rs58542926 en el gen de TM6SF2 condiciona una transición de citosina por timina, que a su vez codifica una variante en que glutamato pasa a lisina en el residuo 167 (E167K) de la proteína65.
EpigenéticaLa epigenética, un fenómeno heredable que afecta a la expresión génica sin alterar la secuencia del ADN, proporciona una nueva perspectiva sobre la patogénesis de la EHGNA. Los cambios epigenéticos reversibles tienen lugar a nivel transcripcional y proporcionan una conexión fenotípica entre el huésped y el medio ambiente. Existen evidencias que sugieren la importancia del papel de la epigenética en la EHGNA, pudiendo identificarse en este campo biomarcadores útiles para determinar el riesgo inicial de EHGNA, así como el pronóstico e incluso posibles dianas terapéuticas.
Metilación del ADN: Los patrones de metilación aberrantes del ADN genómico representan uno de los principales cambios epigenéticos que pueden causar la expresión génica anormal en la EHGNA. También se ha sugerido que las variaciones epigenéticas en la metilación del ADN mitocondrial pueden ocurrir durante el desarrollo de la enfermedad.
Estudios epigenómicos han sugerido que las diferencias genéticas de metilación podrían ser útiles para distinguir a los pacientes con esteatohepatitis avanzada de aquellos con esteatosis simple. En los estadios más patológicos de la EHGNA se ha evidenciado que algunos genes reparadores de tejidos se encuentran hipometilados en el hígado, mientras que genes relacionados con rutas metabólicas están hipermetilados. También se han observado diferencias de metilación del ADN en genes pro y anti-fibrogénicos, lo que podría ser útil para predecir la progresión a fibrosis de la EHGNA. Además se ha sugerido que los perfiles de metilación del ADN en genes asociados con la homeostasis lipídica, la fibrosis y la carcinogénesis podrían ser útiles para investigar el papel etiológico de la metilación del ADN en la progresión de la EHGNA66,67.
Modificación de histonas: Se ha señalado que la modificación de histonas, concretamente la acetilación, influye en los perfiles de expresión génica en la EHGNA. De hecho, las modificaciones aberrantes de las histonas promueven el desarrollo de la DM2 junto con la resistencia a la insulina y, en consecuencia, se relacionan con la EHGNA. Esto abre un importante campo de investigación, donde ya se han identificado posibles biomarcadores de susceptibilidad de la enfermedad, así como estrategias terapéuticas potenciales67.
MicroARN: Se conoce que los microARN (miR) influyen en la expresión fenotípica mediante la modulación de la expresión génica y recientemente se han propuesto como biomarcadores potenciales y dianas terapéuticas atractivas para la EHGNA.
Son muchos los miR estudiados en este ámbito, de entre los que destacaremos la correlación negativa existente entre el nivel de expresión de miR-122 y el grado de daño histopatológico, específicamente con el grado de fibrosis, lo que permite distinguir a los pacientes con fibrosis más avanzada cuando los niveles de este miR están disminuidos67. Por otra parte, se ha identificado que la expresión hepática del miR-21 aumenta en pacientes con EHGNA, correlacionando además con la gravedad de la misma68.
Combinación de técnicas no invasivasCon el objetivo de mejorar el rendimiento de los biomarcadores y las técnicas de imagen, ya algunos autores han propuesto la combinación de ambos como una herramienta útil en la valoración de la hepatopatía crónica. La combinación de 2 métodos no invasivos distintos implica un enfoque más amplio y probablemente más adecuado, ya que a la hora de intentar limitar el número de biopsias realizadas, el hecho de utilizar de forma conjunta 2 métodos complementarios con bases biológicas diferentes supone una ventaja frente al uso de técnicas individuales y aumenta la seguridad diagnóstica.
Un estudio de Crespo et al.69 demostró que la combinación sincrónica de ELF con Arfi o Fibroscan aumenta los valores predictivos, tanto positivos como negativos, de los métodos individuales en la detección de fibrosis significativa y cirrosis en pacientes trasplantados y no trasplantados con hepatopatía crónica de diversa etiología.
También los estudios realizados en pacientes con hepatopatía crónica por virus C han señalado que la combinación de biomarcadores y técnicas de imagen supone un aumento del rendimiento diagnóstico frente al uso de las técnicas de manera individual en la detección de fibrosis70,71.
Discusión y conclusionesLa EHGNA es uno de los trastornos hepáticos crónicos más frecuentes en la actualidad, y con una incidencia creciente fuertemente ligada a la epidemia de obesidad existente en muchos países occidentales. La EHGNA se asocia con un aumento de la mortalidad por causas hepáticas y eventos cardiovasculares, y el riesgo es más alto en aquellos pacientes con esteatohepatitis y fibrosis avanzada.
Dentro de las opciones diagnósticas para la EHGNA los biomarcadores pueden considerarse los candidatos ideales. La principal ventaja frente a la biopsia, además de la obvia ausencia de invasividad, es la posibilidad de realizarlos de forma periódica, lo que permite un control evolutivo y continuo, ofreciendo una visión dinámica de la enfermedad. Esto supone la oportunidad de realizar una evaluación no invasiva, más continua y probablemente más fiel que el actual método de referencia. Sin embargo, aunque en principio estas características conviertan a los biomarcadores en una opción muy conveniente para la valoración de la EHGNA, existen varios puntos críticos que dificultan su implementación en la práctica clínica habitual, especialmente de los biomarcadores más novedosos.
Una de las limitaciones existentes a la hora de la normalización del uso de los biomarcadores en la valoración de la EHGNA radica en la incertidumbre sobre qué punto de la enfermedad debe detectarse exactamente. Inicialmente la mayoría de los estudios estaban planteados con el objetivo de detectar fibrosis, pero a medida que ha avanzado el conocimiento en la fisiopatogenia de la enfermedad, la esteatohepatitis ha ganado importancia, convirtiéndose en el objetivo diagnóstico. La ausencia de una referencia clara sobre el punto de la enfermedad que debe detectarse, ha originado que las investigaciones hayan ido por caminos relativamente diferentes, lo que implica resultados muy heterogéneos, cuyo contraste y comparación es difícil.
Por otro lado, tal como se muestra en esta revisión, hasta la actualidad son múltiples las moléculas que se han evaluado como posibles biomarcadores para el manejo de la EHGNA, obteniendo en muchos casos buenos resultados. Sin embargo, existen muchas lagunas en cuanto a los puntos de corte que deben utilizarse en la evaluación de la enfermedad, así como en referencia a los niveles normales de estos biomarcadores en individuos sanos dependiendo del sexo, etnia, edad, estado nutricional y comorbilidades. Además, de muchos de estos biomarcadores que no se utilizan todavía en la práctica clínica no se dispone de estándares de referencia, lo que implica que ante el uso de diferentes técnicas los resultados aportados puedan discrepar de manera significativa, lo que dificulta mucho las comparaciones entre estudios y por tanto su implementación en la práctica asistencial.
Estas son las razones por las que actualmente el seguimiento de la mayoría de los pacientes con EHGNA se realiza con biomarcadores clásicos de función hepática y, en algunos casos, con biomarcadores de fibrosis, de manera aislada o combinados mediantes algoritmos matemáticos. Los biomarcadores que valoran la función hepática tienen la ventaja obvia de estar disponibles en la mayoría de los laboratorios, aunque sin embargo, tal como ya se ha explicado, carecen de la especificidad suficiente para caracterizar la lesión hepática de estos pacientes y de la sensibilidad necesaria para detectar estadios iniciales de la enfermedad. En nuestra opinión, a día de hoy la mejor opción sería la utilización de algoritmos matemáticos, que mejoran el rendimiento diagnóstico frente al uso de biomarcadores individuales. Por otra parte creemos que la combinación de los biomarcadores con otra técnica no invasiva, como los estudios radiodiagnósticos, implica un enfoque más amplio y probablemente más adecuado a la hora de intentar limitar el número de biopsias realizadas, suponiendo un modelo diagnóstico apropiado.
Por tanto, la investigación futura tiene como reto fundamental determinar qué biomarcadores pueden establecerse como una opción fiable y precisa para la evaluación de la EHGNA, mediante el uso de estudios metodológicamente armonizados para poder asegurar la replicación independiente de los resultados. Además, una mayor comprensión de la fisiopatología de la enfermedad permitirá identificar nuevos biomarcadores.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses en relación con el artículo publicado.
Esta revisión corresponde a la memoria presentada por Iria Cebreiros López, al finalizar la Beca AEFA posresidencia que disfrutó durante el año 2016.