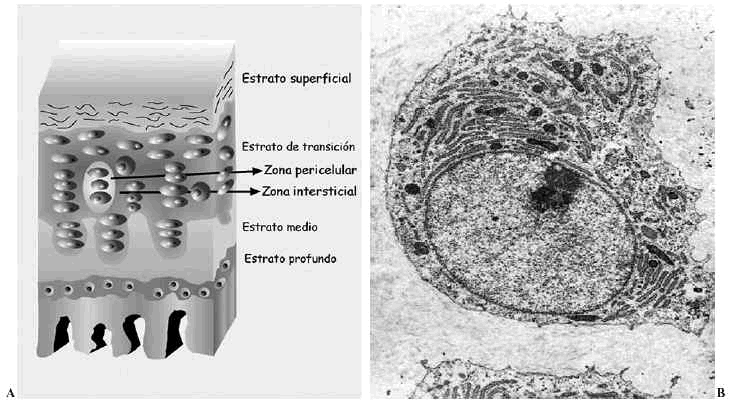
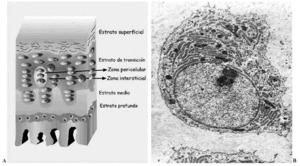
El cartílago articular es una variedad de tejido conectivo, avascular, aneural y alinfático que recubre las superficies articulares de las diartrosis. Está constituido por células, denominadas condrocitos, y por una matriz extracelular (MEC) que le confiere sus peculiares propiedades mecánicas. Desde la superficie hasta el hueso en el que se implanta, se distinguen cuatro estratos que difieren en la estructura, composición (proporción y tipos de proteoglicanos --PG-- y moléculas de adhesión), orientación y diámetro de las fibras de colágeno y volumen y forma de los condrocitos. Se denominan estratos superficial, de transición, medio o radial y profundo o del cartílago calcificado1,2. Además, dentro de cada estrato pueden establecerse tres zonas de acuerdo a la disposición de la MEC respecto a las células y su composición: zonas pericelular, territorial e interterritorial, cada una de ellas con funciones y composición diferentes2-4 (Fig. 1A).
Figura 1. Cartílago articular. A: Esquema de los estratos y sus zonas. B: Ultraestructura de un condrocito maduro.
ESTRUCTURA DEL CARTILAGO ARTICULAR
Células: los condrocitos
Los condrocitos (Fig. 1B) son células muy especializadas en la producción y mantenimiento de la MEC. Representan en torno al 10% del volumen tisular total, con variaciones de unas articulaciones a otras. Al conjunto formado por un condrocito y la zona de MEC que lo rodea (pericelular y territorial) se le denomina condrón o condrona, y constituye la unidad anatómica, citogenética y mecánica del cartílago. La forma, el tamaño y, probablemente, la actividad metabólica de los condrocitos difiere en cada uno de los estratos del cartílago, si bien todos contienen las organelas necesarias para sintetizar cada uno de los componentes de la MEC5.
Matriz extracelular
Toda la masa del cartílago articular, a excepción de los condrocitos, constituye la MEC. Su composición varía de unas personas a otras, entre las diferentes articulaciones de un mismo individuo y entre los estratos y zonas del cartílago articular de una misma articulación. Además, sufre remodelación constantemente por la acción de diferentes factores anabólicos y catabólicos. La MEC está formada por agua (entre el 60 y 80% del peso total) y macromoléculas de las que las más importantes son el colágeno y los proteoglicanos (PG) (Tabla 1). Las macromoléculas estructurales (colágeno, PG y proteínas no colágenas) representan el 20-40% del peso total (del peso seco corresponden al 60% el colágeno, 20-25% los PG y el 15-20% las diversas glicoproteínas y las proteínas no colágenas).
La MEC presenta variaciones de composición en los estratos de cartílago articular: en el superficial hay escasos PG (debido a que sufren una degradación más rápida y se sintetizan en menor cantidad), poco colágeno y la mayor concentración de fibronectina y agua; en el de transición hay una concentración superior de PG y menor de agua; en el medio o radial se encuentran las fibras de colágeno de mayor diámetro, la concentración de PG es la más elevada y la de agua la menor; finalmente, en el estrato de cartílago calcificado la MEC se encuentra calcificada2,5.
Por otro lado, la zona pericelular está constituida fundamentalmente por PG sulfatados, biglicanos, hialuronato, glicoproteínas y moléculas de adhesión (fibronectina y laminina) así como colágeno de tipo VI. La matriz territorial posee una alta concentración de PG ricos en condroitín-sulfato. Por último, la matriz interterritorial se caracteriza por su alta concentración en PG ricos en queratán sulfato.
METABOLISMO DEL CARTILAGO ARTICULAR
Aunque el cartílago articular presenta una baja actividad metabólica debido a su escasa celularidad, los condrocitos son células metabólicamente muy activas, capaces de responder a diversos estímulos (mediadores solubles, agentes farmacológicos, componentes de la matriz, cargas mecánicas y cambios de la presión hidrostática)5. Por otro lado, la funcionalidad y actividad de los condrocitos es diferente a lo largo de la vida. Así, durante el desarrollo, la densidad celular es alta y las células poseen máxima actividad metabólica, dividiéndose y sintetizando rápidamente grandes cantidades de MEC. Posteriormente, la actividad celular decae, disminuye la síntesis de MEC y la mayoría de los condrocitos no vuelven a dividirse. No obstante, continúan degradando y sintetizando macromoléculas de la MEC para mantener el remodelamiento de la superficie articular4.
La nutrición de los condrocitos se realiza a partir del líquido sinovial y durante el desarrollo y maduración del tejido también por difusión desde el estrato óseo subyacente. El paso de los nutrientes a través de la MEC depende de la concentración, composición y organización de los PG grandes, el tamaño y composición (máximo de 20 kDa) y la carga eléctrica de las moléculas que deben difundir6. Esta complejidad en la nutrición de los condrocitos hace que sus requerimientos de oxígeno sean mucho menores que los de otras células del organismo y que dependan primariamente de un metabolismo anaerobio.
BIOQUIMICA DEL CARTILAGO ARTICULAR
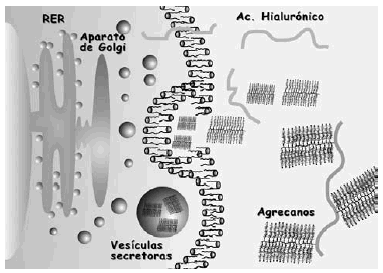
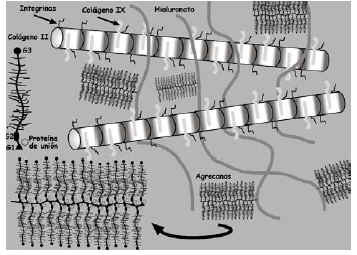
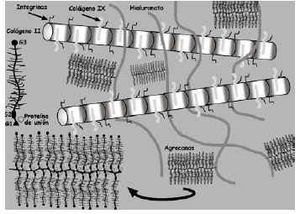
La bioquímica y biología celular del cartílago articular viene determinada por las moléculas que lo componen. Las principales son el colágeno, agrecanos y proteoglicanos (PG), las glicoproteínas y las proteasas (Fig. 2).
Figura 2. Representación esquemática de la matriz extracelular y sus principales componentes.
Colágenos
El colágeno es una proteína extracelular compuesta por tres cadenas polipeptídicas (cadenas α) que contienen una secuencia tripeptídica característica (gly-x-y) y forma una hélice levógira. En su secuencia abundan la prolina e hidroxiprolina y contiene también hidroxiprolina, hidroxilisina e hidroxilisina glicosilada. En cada molécula de colágeno las tres cadenas se enroscan entre sí formando una estructura «en soga» que se estabiliza mediante puentes de hidrógeno en la glicina y uniones covalentes determinadas por la hidroxilisina7.
El colágeno puede formar homotrímeros (las tres cadenas αson iguales entre sí), como en los tipos II y X, y heterotrímeros (las tres cadenas α son diferentes), caso de los tipos VI, IX y X. En el cartílago articular hay varios tipos de colágeno, siendo el de tipo II el predominante (90-95% del total) aunque también contiene los tipos I, V, VI, IX, X y XI. En general, la función principal del colágeno en el cartílago es proporcionar al tejido propiedades tensiles e inmovilizar los proteoglicanos en la MEC, si bien se le atribuyen otras funciones, en base a su estructura tridimensional7,8.
Biosíntesis y degradación del colágeno
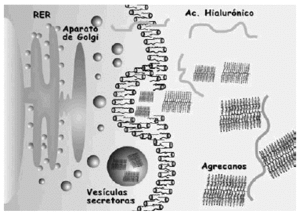
El colágeno se sintetiza como procolágeno por los condrocitos y al igual que cualquier proteína que se secreta; una vez transducido el mRNA para las cadenas α, pasa al retículo endoplasma tico rugoso y de allí al aparato de Golgi donde se lleva a cabo la glicosilación de algunos radicales y se forma la triple hélice. El ensamblaje se produce en las vesículas de transporte y a nivel extracelular. La degradación se produce por acción de metaloproteasas, colagenasas, específicas (ver más adelante) que rompen las cadenas en diferentes segmentos, y que son reguladas por factores de crecimiento e interleucinas.
Proteoglicanos
Los PG son macromoléculas complejas formadas por un núcleo proteico con varios dominios globulares al que se unen largas cadenas de polisacáridos denominados glicosaminoglicanos (Fig. 2). Estos están formados por una cadena larga, no ramificada, de unidades repetidas de polisacáridos. El 80-90% de los PG son grandes y se denominan agrecanos debido a sus propiedades de agregación9. Están formados por un centro proteico (2,25 kDa) que presenta tres dominios globulares (G1, G2, G3) al que se adhieren cadenas de condroitín sulfato y queratán sulfato (Fig. 2). En el extremo N-terminal de la proteína central, uno de los dominios globulares (G1) tiene la función específica de unión al hialuronato a través de la llamada proteína de unión, formando un complejo agrecano-hialuronato. Los principales agrecanos son el condroitín sulfato en sus distintas isoformas (principalmente el condroitín-6-sulfato), el queratán sulfato y el dermatán sulfato. El condroitín sulfato es el más abundante y cada cadena está formada por 25-30 unidades de disacáridos, con un peso promedio de 15-20 kDa. Las cadenas de queratán sulfato son más cortas y su peso molecular medio oscila entre 5-10 kDa10.
El hialuronato es también un glicosaminoglicano que se diferencia de los agrecanos por no estar sulfatado, no poseer proteína central y no formar PGs. Al no estar ramificado se unen a él múltiples moléculas de agrecano y se forman grandes macromoléculas que permanecen inmovilizadas dentro de la red de colágeno del cartílago. Atendiendo a la proporción condroitín sulfato/hialuronato, se diferencian proteoglicanos de baja y alta velocidad de sedimentación11. Los estratos superficiales del cartílago articular contienen principalmente agregados del primer tipo mientras que las regiones más profundas contienen ambos.
Otros PG de menor tamaño presentes en el cartílago articular son el biglicano y la decorina (que poseen una proteína central de 30 kDa), la fibromodulina y el colágeno IX (considerado un PG porque contiene una cadena de condroitín sulfato). La decorina y la fibromodulina se unen al colágeno tipo II y pueden actuar organizando y estabilizando el entramado de éste. El biglicano puede interactuar con el colágeno tipo VI12. El cartílago contiene, asimismo, grandes PG no agrecanos que podrían representar agrecanos degradados.
Biosíntesis y degradación de los proteoglicanos e hialuronato
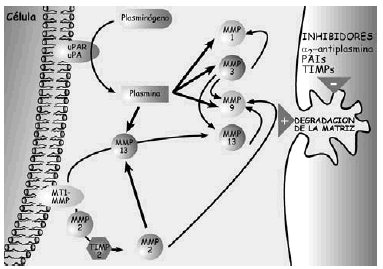
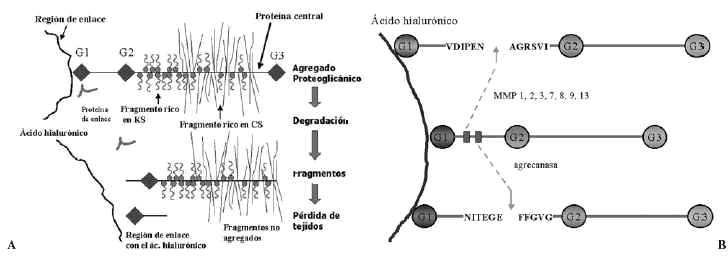
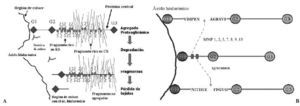
La síntesis, ensamblaje y sulfatación de los PG se realiza en los condrocitos en una secuencia en la que participan retículo endoplasma tico rugoso, aparato de Golgi y vesículas de transporte (Fig. 3). La síntesis de la cadena central está bajo control genético mientras que la de las cadenas de glicosaminoglicanos es un proceso post-transduccional. El proceso de ensamblaje del hialuronato se realiza directamente en la membrana celular del condrocito. En cuanto a la degradación de estas moléculas, se realiza mediante la rotura en sitios específicos de la proteína central de los PG, y del hialuronato, mediante metaloproteasas13 y agrecanasas14 (Fig. 4).
Figura 3. Esquema de las fases de síntesis de los proteoglicanos y del hialuronato.
Glicoproteínas
En el cartílago articular se encuentran diferentes tipos de glicoproteínas. Algunas son de transmembrana y actúan como receptores para moléculas de adhesión, factores de crecimiento o interleucinas. Otras glicoproteínas son extracelulares con funciones de unión y ensamblaje entre los componentes de la MEC y los condrocitos. En general, están constituidas por una base proteica a la que se unen algunos mono y oligosacáridos.
Las principales glicoproteínas estructurales son la ancorina CII, fibronectina, laminina y, sobre todo, las integrinas5. La ancorina CII es un miembro de la familia de calpactinas situada en la superficie del condrocito que liga al colágeno y ancla los condrocitos a las fibras colágenas de la MEC15. La fibronectina se presenta en forma de agregados en la MEC y la superficie de los condrocitos y tiene afinidad para unirse a fibrina, colágeno tipo II, heparina, hialuronato, etc.16. La laminina es una molécula polivalente presente en membranas basales y, unida a receptores, en la superficie de las células. Otra glicoproteína del mismo tipo es la oligomérica del cartílago, que se concentra en la MEC cerca del condrocito17.
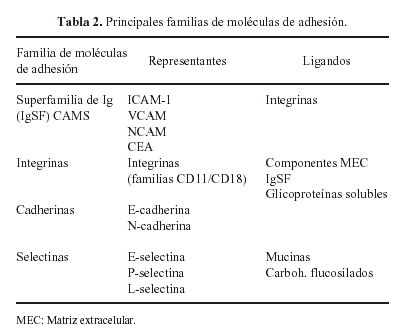
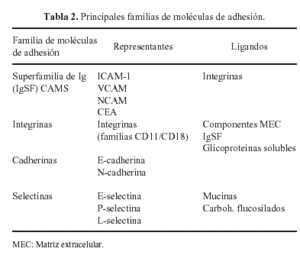
La interacción de todas estas glicoproteínas con los condrocitos se realiza por medio de otras glicoproteínas, denominadas moléculas de adhesión (Tabla 2) de las que las más importantes son las integrinas que regulan los procesos de adhesión, migración, proliferación y diferenciación celulares18.
Por otro lado, en la superficie de los condrocitos existen glicopoteínas que funcionan como receptores para las moléculas de adhesión (receptores de integrinas, ancorina CII, sindecanos, receptores de hialuronato) y los factores de crecimiento y citoquinas19. En conjunto, pues, las interacciones entre las glicoproteínas con otros componentes de la MEC, especialmente las macromoléculas, y la superficie de los condrocitos proporcionan estabilidad a todo el conjunto del cartílago articular.
Proteasas del cartílago
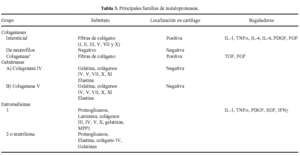
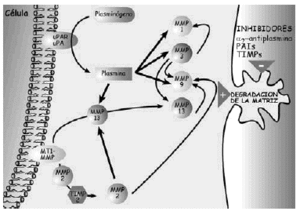
Las proteasas son una serie de enzimas presentes en la MEC cartilaginosa, de origen condrocitario y extracartilaginoso, responsables de la degradación y renovación permanente de los componentes de la misma, tanto en condiciones normales como patológicas. Hay tres grupos principales de proteasas, las metaloproteasas, serinaproteasas y las catepsinas (Tabla 3) (Figs. 4 y 5).
Figura 4. Esquemas sobre los mecanismos de degradación de los proteoglicanos.
Figura 5. Esquema de los mecanismos de acción de las metaloproteasas en la degradación de la matriz extracelular del cartílago.
Las metaloproteasas son las de mayor interés en la biología del cartílago articular y reciben esta denominación porque necesitan la presencia de zinc para su funcionamiento. Degradan PG, glicoproteínas y algunos tipos de colágenos. La familia de las colagenasas es altamente específicas del colágeno y rompen la molécula de la triple hélice a tres cuartas partes de distancia del extremo amino terminal de la misma. Una vez finalizada la acción de las colagenasas interviene la gelatinasa separando las cadenas αdesnaturalizadas. La estromelisina, por su lado, puede actuar sobre el colágeno (tipos II y IX) y degrada la proteína central del agrecano. De cualquier modo también se han encontrado proteasas que, en determinadas situaciones, pueden actuar sobre diferentes substratos20. Las metaloproteasas son sintetizadas como proenzimas, requieren para su activación modificación enzimática y pueden superactivarse entre ellas, aunque los mecanismos por los cuales se produce la activación de las proenzimas no se han identificado. Tras la activación, las proteasas pueden ser desactivadas o bloqueadas de forma irreversible por factores sintetizados por el propio condrocito y que reciben el nombre de TIMPs (Inhibidores Tisulares de Metaloproteasas21,22) y que, en condiciones de normalidad, se encuentran a niveles elevados en el cartílago articular. El otro grupo de proteasas articulares son las catepsinas, con capacidad para degradar los agrecanos. Se conocen dos tipos diferentes, denominados catepsina B y D y su papel en el cartílago articular es de menor relevancia.
BIOLOGIA DEL CARTILAGO ARTICULAR
La biología del cartílago articular es, en último término, la de los condrocitos contenidos en él y está encaminada a mantener la composición estable de la MEC. Ésta sufre un proceso permanente de renovación que determina el grado de actividad condrocitaria. Entre los factores implicados en la regulación de las relaciones entre los condrocitos y la MEC se encuentran una serie de moléculas, sistémicas y/o locales, denominadas factores de crecimiento que, en general, ejercen un efecto anabólico sobre los condrocitos y pueden potenciarse entre ellos23. También con carácter general, las acciones de los factores de crecimiento son antagonizadas por otro grupo de sustancias llamadas IL (interleucinas) (Tabla 4). Ambos tipos de moléculas transmiten la señal por medio de receptores de membrana cuya señal es mediada por oncoproteínas nucleares que actúan sobre genes específicos24-28.
Los mecanismos de acción de ambos grupos de factores, anabólicos y catabólicos, son múltiples (Tabla 4). A veces actúan directamente estimulando o inhibiendo la síntesis de los componentes de la MEC y de forma indirecta favoreciendo la acción de moléculas que degradan el cartílago (proteasas) o de las proteínas tampón de las mismas (TIMPs).
Factores de crecimiento
Los factores de crecimiento son polipéptidos, solubles y difusibles, producidos en cantidades limitadas, que regulan el desarrollo, proliferación, diferenciación y crecimiento celulares. Transmiten la señal a las células sensibles a ellos uniéndose a un receptor específico, en la mayoría de los casos productos de protooncogenes. La unión del factor de crecimiento a su receptor da lugar a un sistema transductor de señales constituido por proteínas citoplasmáticas que, en último término, determinan la activación o inhibición de genes intranucleares.
Los efectos de los factores de crecimiento sobre los condrocitos varían in vivo e in vitro, en función de la especie animal, la edad de los sujetos, etc. Pero se admite que, en general, estimulan la síntesis de los componentes de la MEC del cartílago, inhiben las proteasas y activan los sistemas de inhibición de éstas Sin embargo, en condiciones basales la mayoría de los factores de crecimiento no tienen ningún efecto sobre la síntesis de PG o la inhiben29. En los párrafos que siguen se describen las principales familias de factores de crecimiento que intervienen en la biología del cartílago articular (Tabla 4).
Factores de crecimiento de la familia del factor de crecimiento insulina-like (IGF)
El sistema del IGF comprende los factores de crecimiento IGF I, IGF II y la propia insulina, sus receptores y una serie de proteínas denominadas IGFBPs, que regulan la disponibilidad de los mismos. Los condrocitos del cartílago articular expresan receptores para el IGF-I y las acciones de los IGFs sobre ellos dependen de los niveles del factor y de su receptor, de la afinidad y disponibilidad del propio receptor y de IGFBP. Los IGFs estimulan la síntesis de PG, colágeno II e integrinas a la vez que inhiben la destrucción de la MEC. También favorecen la adhesión de los condrocitos a la fibronectina y al colágeno II25,30.
Factores de crecimiento de la familia del factor de crecimiento de los fibroblastos (FGF)
Son una familia de polipéptidos relacionados estructuralmente con los mitógenos «heparin-binding». Los mejor caracterizados son el FGF-1 o aFGF (ácido) y el FGF-2 o bFGF (básico). El FGF ha sido detectado en el cartílago articular y es un potente mitógeno y factor de diferenciación para los condrocitos, tanto in vitro como in vivo. Por otro lado, El bFGF regula la producción y degradación de los componentes de la MEC estimulando la síntesis de PG a la vez que suprime la síntesis de condroitín-6-sulfato. Además, potencia la acción de la IL-1, induce la expresión de su receptor y favorece la de colagenasa-331.
Factores de crecimiento de la familia del factor de crecimiento transformante β (TGFβ)
Son un grupo de factores reguladores del crecimiento celular y de la síntesis de componentes de la MEC. Se secretan como moléculas inactivas y la mayoría de sus funciones las ejercen actuando sobre otros factores tróficos o sobre las IL. El TGFβ se encuentra en el líquido sinovial y en el propio cartílago y los condrocitos expresan el receptor para él. El TGFβ es un potente mitógeno para los condrocitos articulares de manera bifásica dosis-dependiente31-33.
Las acciones del TGFβ sobre la síntesis de los componentes de la MEC son muy complejas ya que potencia la síntesis de PG, algunas integrinas y de los TIMPs, a la vez que inhibe la síntesis de colágeno II. Por otro lado, la administración intraarticular de TGFβ puede llevar, a largo plazo, destrucción del cartílago33.
Factores de crecimiento de la familia del factor de crecimiento derivado de las plaquetas (PDGF)
El PDGF es una citoquina de la que se conocen tres isoformas y que señalizan por medio de dos tipos de receptores34. Además, el PDGF y la IL-1 se liberan juntos durante los procesos inflamatorios y guardan complejas relaciones entre ellos, potenciando los efectos de las IL-1α e IL-1α sobre las metaloproteasas35.
Los condrocitos expresan receptores para el PDGF y, en general, se acepta que este factor ejerce sobre ellos un efecto mitógeno edad-dependiente y favorece la producción de algunos componentes de la MEC36.
En estrecha relación con el PDGF se encuentra la molécula asociada al factor de crecimiento que liga heparina --HB-GAM-- o pleiotrofina, una citoquina que media algunas de las acciones atribuidas al PDGF. Su mRNA se encuentra en las células progenitoras del cartílago durante el desarrollo y está ausente o en cantidades mínimas en el cartílago adulto37. Dado que la pleiotrofina es un potente factor angiogénico, su falta de expresión en el cartílago adulto posiblemente esté en relación con la ausencia de vasos en el cartílago (Deuel y Vega, datos no publicados).
Factor de crecimiento epidérmico (EGF)
Los datos disponibles sobre el sistema del EGF en el cartílago articular son muy escasos. El EGF es mitógeno para los condrocitos articulares y sobre los constituyentes de la MEC puede favorecer o inhibir la síntesis de PG. Además, los inhibidores de la síntesis de PG (ácido retinoico e IL-1β) aumentan la densidad de receptores para el EGF, mientras que los tratamientos con potenciadores de la síntesis (hormona paratiroidea y el dibutiril-cAMP) la reducen38.
Factor inhibidor de la leucemia (LIF)
Se trata de un factor de crecimiento con actividad pleiotrófica que estimula la liberación de PG e inhibe su síntesis en cultivo. Pero existe una forma soluble de su receptor, denominada proteína ligante del factor inhibidor de la leucemia --LIFBP-- que inhibe de manera dosis-dependiente la liberación de PG producida por el LIF y revierte la supresión de su síntesis.
Neurotrofinas
Las neurotrofinas son una familia de factores de crecimiento que ejercen sus funciones principalmente sobre algunos tipos específicos de neuronas actuando sobre dos tipos de receptores: p75 y proteínas Trk. El cartílago expresa neurotrofinas (sobre todo el NGF) durante el desarrollo y en el proceso de reparación de las fracturas, que aumentan la síntesis de DNA y glicosaminoglicanos por los condrocitos39. Además, expresa receptores Trk durante la etapa de diferenciación celular.
Factor de crecimiento derivado del endotelio vascular (VEGF)
El cartílago articular normal carece de vasos y ello es debido, al menos en parte, a que los condrocitos producen factores inhibidores de la proliferación de células endoteliales y la angiogénesis40 de acuerdo con su estado de diferenciación y de la presencia de MEC41,42. Sus receptores se expresan en las placas de crecimiento de las vértebras y en las costillas43.
Familias de las proteínas morfogenéticas óseas (BMPs) y derivadas del cartílago (CMPs)
Las BMPs forman parte de la superfamilia de citoquinas multifuncionantes del TGFβ. Se clasifican en diferentes grupos en base a las similitudes de sus secuencias de aminoácidos44 y actúan a través de dos tipos de receptores del tipo serina-treonina, denominados BMPR-I y BMPR-II, ambos necesarios para transducir las señales45. A través de ellos inducen la síntesis de factores de transcripción implicados en la regulación de las vías de diferenciación de las células mesenquimales multipotentes en células de fenotipo osteocondrogénico46. Entre sus efectos se incluyen la expresión de marcadores condroblásticos y formación de cartílago47. Los receptores para estas proteínas se expresan durante la diferenciación condral y en el cartílago maduro48. Las CMPs, por su lado, son poco conocidas aún pero parecen ser críticas en el desarrollo del cartílago articular44,49.
Interleucinas (IL)
Representan el otro gran sistema implicado en la regulación del metabolismo del cartílago articular, y que en líneas generales desempeñan acciones opuestas a los factores de crecimiento. Las más importantes en la biología del cartílago articular son las IL-1 e IL-6 y el TNFα50-52. Sus mecanismos de acción son muy variados y posiblemente incluyen la inducción de apoptosis en los condrocitos53.
IL-1
Es producida por los condrocitos, y se relaciona con la destrucción del tejido cartilaginoso por lisis de la MEC (acelera la degradación de PG) y disminución de los mecanismos de regeneración, mediante su potente capacidad de inhibir la proliferación condrocitaria y la síntesis de PG. Dicho efecto lo consigue estimulando la producción de enzimas proteolíticos. En cultivos aislados, produce un aumento en la degradación del colágeno tipo II54,55. Además, existen evidencias que sugieren que la IL-1β regula la expresión de algunas isoformas del TGF56. Esto representa un mecanismo de protección contra el catabolismo del tejido conectivo inducido por las citoquinas. Por su parte, el TGFβ, in vivo, puede inducir la producción de IL-6 por los condrocitos articulares57.
IL-6
En cuanto a la IL-6, además de estar implicada directamente en los procesos inflamatorios, regula la expresión de TGFβ y en consecuencia puede ser un mecanismo protector contra el catabolismo del cartílago inducido por las citoquinas. A su vez, el TGFβ puede inducir la producción de IL-6 en condrocitos articulares humanos in vitro56,57.
Factor de necrosis tumoral α(TNFβ)
Por otra parte el TNFα estimula la producción de enzimas proteolíticos, principalmente metaloproteasas58, e inhibe la síntesis de componentes de la MEC, permitiendo la degradación del cartílago. Recientemente se ha visto que la colagenasa-3 se expresa en los condrocitos durante el desarrollo y en determinadas patologías, y que su mRNA es inducido por el TNFα59,60.