El cartílago articular es un tejido elástico carente de nervios, vasos sanguíneos y linfáticos, localizado en las diartrodias y varía de grosor según las diferentes especies, desde 0,1 mm en el ratón hasta varios milímetros en el hombre1. El cartílago articular reduce la fricción, transfiere y distribuye las solicitaciones en distintas posiciones articulares2 y ofrece una superficie articular lubricada, que permite que los huesos se deslicen y giren uno sobre otro sin desgastarse. Sokoloff3 consideró al cartílago articular, el líquido sinovial, la membrana sinovial y el hueso subcondral como una unidad funcional a la que hoy se deben añadir otros aspectos, como son el intercambio de oxígeno y de nutrientes y la liberación de hormonas y factores de crecimiento4.
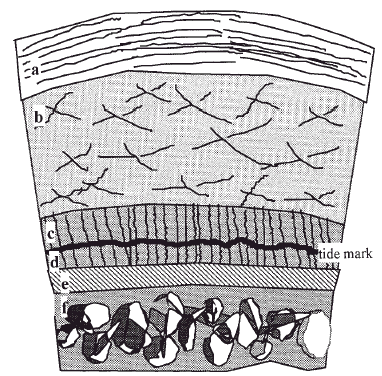
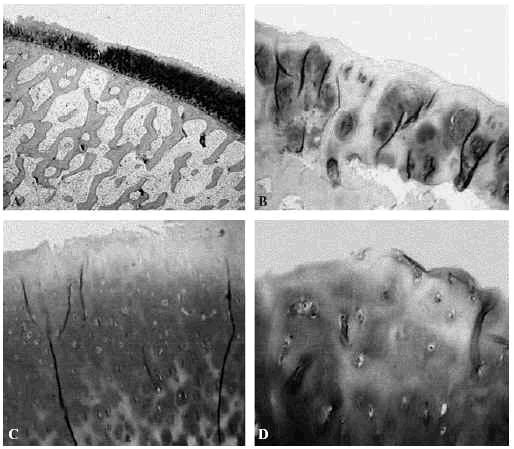
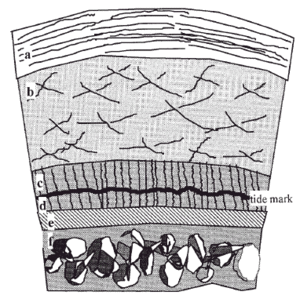
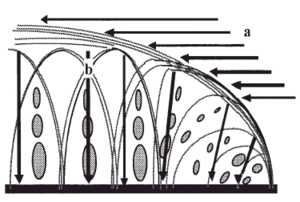
El cartílago es un tejido duradero y resistente, sometido a un promedio de 10 millones de ciclos de carga articular por año1. Macroscópicamente es blanco, brillante y firme. Se nutre del líquido sinovial, por un mecanismo de difusión que se realiza durante la carga articular. Clásicamente se divide en tres zonas, la capa superficial, la capa de transición media o radial y el cartílago calcificado. En cada una de ellas varían la estructura y composición, el volumen y la forma celular, el diámetro y la orientación de las fibras de colágeno, así como la concentración de proteoglicanos (Fig. 1).
Figura 1. Esquema del cartílago articular. a: Capa superficial (10-20%). b: Capa media (40-60%). c: Capa profunda (30%). d: cartílago calcificado. e: Hueso subcondral. f: Hueso esponjoso epifisario.
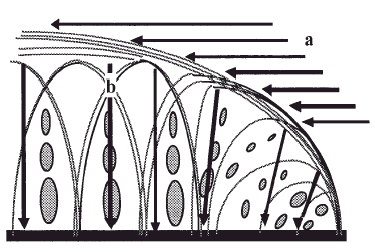
En la capa superficial del cartílago articular las fibras de colágeno se disponen paralelas a la superficie articular para soportar las solicitaciones de cizallamiento mientras que las capas más profundas, con una red de fibras de colágeno que proveen resistencia a la compresión y contribuyen a la cohesión del tejido, atrapando a las grandes moléculas de proteoglicanos (Fig. 2). En las regiones superficiales del cartílago los proteoglicanos están formados por los agregados más pequeños mientras que en las regiones profundas los forman tanto agregados, grandes como pequeños. Para Treppo et al5, la capa superficial del cartílago articular es más blanda y elástica para soportar cargas y distribuir las solicitaciones y se divide, a su vez, en otras dos capas, una superficial o «lámina splens», acelular formada por un manto de fibras de colágeno finas y otra más profunda, pobre en proteoglicanos pero con gran contenido de agua.
Figura 2. Adaptación de las fibras de colágeno a las solicitaciones tangenciales. a: En la capa superficial del cartílago y a las solicitaciones a compresión. b: En las capas media y profunda.
La zona de transición posee mayor espesor y sus fibras de colágeno adoptan una disposición con ángulos oblicuos y son de mayor diámetro que en la zona superficial. Hay menor número de fibras y agua que en la zona superficial. La zona media o radial contiene fibras de colágeno de mayor diámetro dispuestas de manera radial o perpendicular a la superficie articular. En esta zona la concentración de proteoglicanos es mayor y la de agua más baja que en las otras capas.
El cartílago calcificado es una capa delgada que separa el hueso subcondral del cartílago articular, constituida por condrocitos pequeños rodeados de cartílago calcificado. El cartílago articular es un tejido capaz de sintetizar y degradar constantemente todos los componentes de la matriz extracelular. Los mecanismos de acción de los factores de crecimiento y las interleuquinas6 potencian o inhiben la síntesis de los componentes de la matriz extracelular y favorecen la actuación de moléculas que degradan el cartílago como son las proteasas o los inhibidores tisulares de los mismos. Por su parte, las extensiones citoplasmáticas de los condrocitos se proyectan hasta la matriz extracelular para segregar macromoléculas y protegerlo de los cambios mecánicos7-9.
La matriz extracelular pericelular se encarga de satisfacer sus necesidades metabólicas, unir las membranas celulares a la matriz que la rodea, proteger las células del daño originado por las deformaciones mientras que la matriz extracelular interterritorial define las propiedades mecánicas al tejido. El área pericelular es rica en proteoglicanos sulfatados y proteínas no colagénicas, hialuronato10 y en colágeno tipo VI11 pues las fibras de colágeno forman como una canasta alrededor de los condrocitos para protegerlos frente a las cargas y las deformaciones. A la unidad formada por el condrocito y la matriz que lo rodea se denomina condrona y constituye la unidad anatómica y mecánica del cartílago.
La célula cartilaginosa: el condrocito
El cartílago es un tejido de baja densidad celular, sólo un 3-10 % de su volumen está ocupado por condrocitos, por lo que el volumen de matriz extracelular que debe ser mantenido metabólicamente por un condrocito es elevada. El condrocito es una célula altamente diferenciada y especializada que deriva de células mesenquimales con capacidad limitada de proliferación y una vida media muy larga2. Su tamaño, forma y, probablemente, actividad metabólica varían según las diferentes zonas del cartílago1 y, aunque de apariencia simple, es capaz de vivir con tensiones muy bajas de oxígeno2. Los condrocitos no tienen contacto entre sí, ni están vinculados con el exterior por lo que se nutre con el líquido sinovial que debe atravesar una doble barrera, la membrana sinovial y la matriz extracelular12.
Durante el desarrollo del cartílago, los condrocitos proliferan rápidamente y en el cartílago articular maduro pocos condrocitos presentan actividad mitótica aunque permanecen metobólicamente activos, sintetizando y degradando los productos de la matriz, con una actividad metabólica baja. En el cartílago maduro normal los condrocitos sintetizan macromoléculas que mantienen la matriz y pueden aumentar su tasa de síntesis ante una lesión o frente a cambios degenerativos, pero son incapaces de reparar defectos tisulares importantes.
Después de una lesión articular y, también, en los procesos degenerativos proliferan algunos condrocitos, pero esta respuesta es muy limitada y no hay evidencia de que emigren a través de la matriz hasta la zona lesionada. Esto explica la aparición de clones o grupos isogénicos de células cartilaginosas grandes que parecen tener la función de degradación y fagocitosis, funciones destructivas del cartílago. En los estados iniciales de una artrosis de cadera, cuando la superficie está más o menos intacta, el proceso patológico estimula la producción tanto de clones de síntesis y de destrucción que pueden proceder de los primeros. Los destructivos están más cerca de la superficie articular y los de síntesis permanecen en la profundidad del cartílago13.
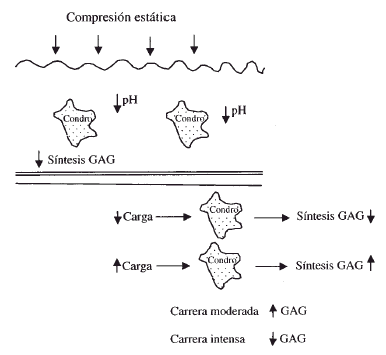
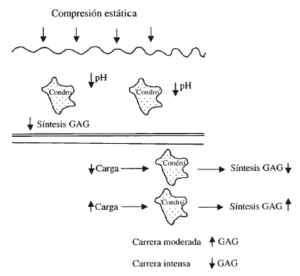
Los condrocitos son sensibles a los cambios estructurales de la matriz y a las demandas de carga de la superficie articular13. La carga y el movimiento articular favorecen el metabolismo del cartílago articular, estimulando la síntesis de las macromoléculas estructurales mientras que la inmovilización articular prolongada o la falta de carga deterioran la superficie articular provocando la pérdida de proteoglicanos. La utilización adecuada de una articulación permite mantener un equilibrio óptimo en la estructura, composición y función del cartílago (Fig. 3).
Figura 3. Efecto de la compresión sobre los condrocitos (modificado de Hallet y Andrish).4 (GAG = glucosaminoglicanos) (Condro = condrocito).
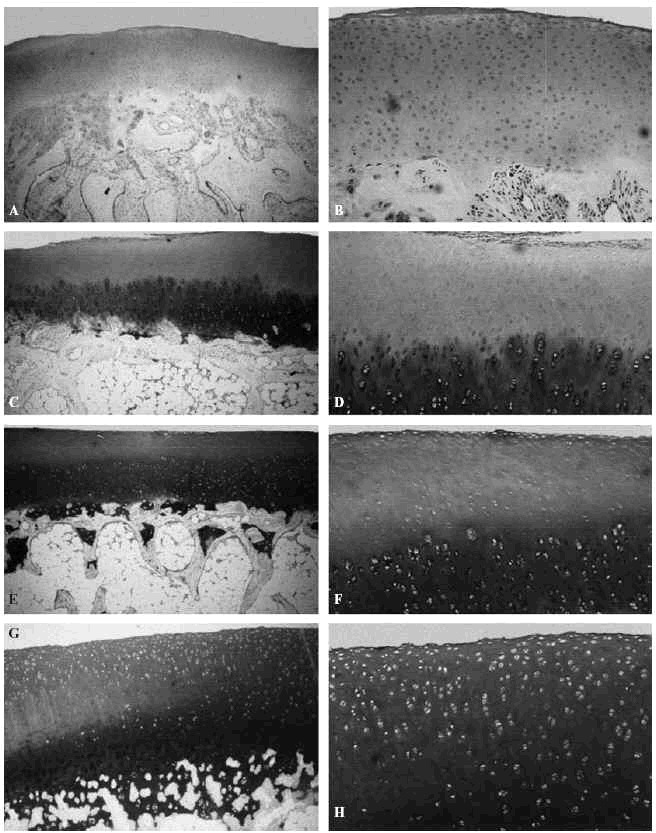
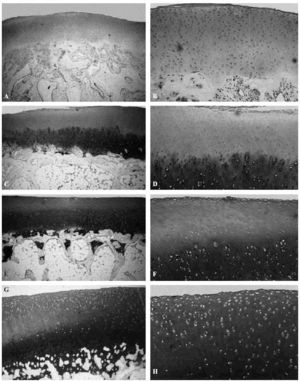
Los estudios de Kiviranta et al14 y Palmoski et al15 señalaron en perros jóvenes que los condrocitos transforman la estructura y composición del cartílago articular como respuesta a cambios en la carga y que el uso excesivo de una articulación recientemente lesionada o inmovilizada puede retrasar la recuperación del cartílago, o incluso provocar una lesión más grave (Fig. 4).
Figura 4. Efecto de diferentes solicitaciones sobre el cartílago articular del cóndilo femoral del cordero sometido a diferentes soliciataciones: en neutralización, A: (azul de toluidina,x4), B: (azul de toluidina, x10); a compresión, C: (azul de toluidina, x4); D: (azul de toluidina, x10); a tensión, E: (azul de toluidina, x4); F: (azul de toluidina, x10). Control G: (azul de toluidina, x4); H: (azul de toluidina, x10).
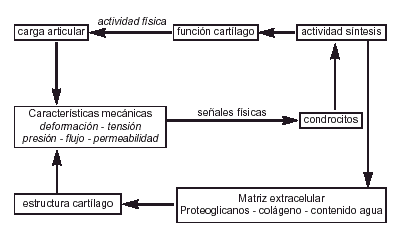
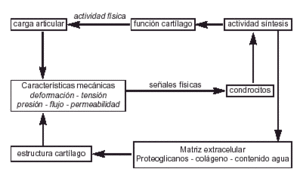
Si la salud del cartílago articular depende de las propiedades mecánicas y de su relación con el hueso subcondral; la adaptación del cartílago al ejercicio dependerá de los condrocitos pues es el único componente vivo del cartílago articular y el único elemento que puede modificar su respuesta ante las solicitaciones, sintetizando o degradando los componentes de la matriz4 (Fig. 5).
Figura 5. Efecto de la actividad física sobre la estructura del cartílago articular (modificado de Mow y Wang).29
La compresión deforma el núcleo de los condrocitos que están, en parte, unidos a los microfilamentos de actina los cuales conectan el núcleo con el citoesqueleto y la matriz extracelular16,17. El módulo de elasticidad del condrocito es tres veces menor y su permeabilidad cinco veces mayor que la de la matriz extracelular18.
Es evidente que los condrocitos responden a cambios en las cargas, pero no se sabe cómo perciben dichas modificaciones. La carga articular puede deformar las células o sus cilios, crear gradientes de presión hidrostática; cambios fisicoquímicos o eléctricos; alterar el flujo del fluido tisular, los nutrientes y metabolitos celulares o por otros mecanismos19. Los cambios en la presión hidrostática afectan al metabolismo de los condrocitos y modifican la estructura de los orgánulos intracelulares20, posiblemente alterando la bomba de Na+/K+21 o el citoesqueleto22.
Los condrocitos pueden responder, aparentemente, a los estímulos mecánicos y cambiar su medio mecánico regulando la composición y estructura de la matriz extracelular que la rodea20. Si se altera la actividad catabólica y anabólica de los condrocitos se puede producir una matriz extracelular débil y estructuralmente anormal con cambios en la respuesta a la carga.
La matriz extracelular
La matriz del cartílago articular presenta grandes diferencias según las localizaciones anatómicas y también en diferentes zonas de una misma superficie articular. Consta de dos componentes, el fluido tisular y una red de macromoléculas estructurales, como el colágeno, los proteoglicanos y, en menor medida, los lípidos, fosfolípidos, glicoproteínas y otras proteínas, que dan forma y estabilidad al tejido. El colágeno se distribuye uniformemente en toda la profundidad del cartílago, excepto en la zona superficial donde es mucho más abundante1, pues es donde soporta mayores tensiones. El colágeno proporciona al tejido propiedades tensiles e inmoviliza los proteoglicanos de la matriz extracelular.
El colágeno tipo II forma el volumen principal de la fibrilla y el tipo XI condiciona el diámetro de las mismas de forma proporcional a la concentración23 y se localiza en la condrona en los lugares donde el tipo II alcanza el diámetro mínimo necesario para formar la estructura de la cápsula pericelular10,23. El colágeno tipo II tiene un recambio muy lento en el cartílago articular maduro pero aumenta considerablemente en el cartílago artrósico24. El colágeno tipo X interviene en el soporte estructural del cartílago articular por lo que se localiza principalmente entre el cartílago calcificado y el no calcificado y se relaciona intímamente con los condrocitos hipertróficos o en fase de degeneración en los procesos patológicos degenerativos. Por su parte, el colágeno tipo IX facilita la interacción con las moléculas de proteoglicanos10,25.
Gran parte de las características mecánicas del cartílago son debidas a la relación de las macromoléculas de la matriz y el agua, dependiendo de esta interacción el volumen, la concentración de agua tisular y la capacidad de respuesta a los estímulos. Los proteoglicanos proporcionan al tejido un comportamiento mecánico característico y contribuyen a su duración pues poseen una estructura con cadenas de glicosaminoglicanos cargadas negativamente que se unen al líquido intersticial y a los cationes por lo que tienden a repelerse. Si se elimina la compresión, las moléculas pueden expandirse de nuevo. Cuando se rompe la red de colágeno, la matriz se hincha por la expansión de los proteoglicanos y aumenta la concentración de agua.
La estructura y composición de los proteoglicanos del cartílago articular cambian con la edad1, incrementando las cadenas de queratán sulfato y de monómeros; las cadenas de condroitín sulfato se acortan y el tamaño medio de los monómeros decrece y las proteínas de unión pueden fragmentarse disminuyendo su cantidad1,12,26,27. Todos estos cambios alteran las propiedades mecánicas del cartílago articular permitiendo una mayor deformación que lo hace más vulnerable a algunos tipos de lesión y dificulta la reparación de la matriz dañada28.
El agua puede moverse libremente por el tejido cartilaginoso hasta la cavidad articular y viceversa. El volumen, la concentración y la cantidad de agua en el tejido dependen de los grandes agregados de proteoglicanos que ayudan a mantener el fluido en la matriz y la concentración de electrolitos en el fluido.
El líquido sinovial
El líquido sinovial es claro, o ligeramente amarillento, de alta viscosidad y es secretado en la cavidad articular por la membrana sinovial. Se encuentra en pequeñas cantidades en las articulaciones humanas y animales. En una rodilla humana normalmente se encuentran entre 1 y 5 ml. Es un dializado del plasma, que en condiciones normales no contiene factores de coagulación, eritrocitos ni hemoglobina. Sin embargo, presenta hialuronato, un glicosaminoglicano extendido y una glicoproteína lubricante (GLP) que reducen la fricción. Su función es difícil de cuantificar ya que difiere según las circunstancias aunque interviene en la lubricación articular29.
El cartílago articular es un tejido permeable que, en condiciones normales, intercambia con el espacio articular un flujo constante de líquido intersticial. Esta permeabilidad permite que se lleve a cabo parte del metabolismo de los procesos de reparación y degradación, actividad que se considera un proceso normal para mantener la arquitectura del cartílago articular.
Las articulaciones diartrósicas se caracterizan por poseer una fricción muy baja con solicitaciones de magnitud elevada. La fricción de una articulación sinovial es 1/10 de la fricción que se produce entre un patín y el hielo por el que se desliza. Cuando en una máquina dos superficies en contacto están en movimiento siempre hay necesidad de lubricar con aceites para evitar su calentamiento y desgaste, que serán mayores cuanto mayores sean las fuerzas y la velocidad entre las superficies. Las superficies del cartílago articular, a diferencia de las superficies de una máquina, son rugosas con un índice de rugosidad normal entre 1 y 6 μ, mientras que los de una superficie metálica de una cabeza femoral son de 0,0025 μ30.
La tribología es la ciencia que estudia la fricción, la lubricación y las partículas que se desprenden de las superficies de contacto durante el movimiento. Se consideran dos grandes formas de lubricación, de película gruesa y lubricación límite. La lubricación de película gruesa tiene lugar cuando entre las dos superficies se dispone un líquido, más o menos viscoso que impide que las superficies estén en contacto. Dentro de este grupo se considera la lubricación hidrodinámica y elastohidrodinámica. Por otro lado, se llama lubricación límite cuando se dispone una capa de moléculas lubricantes que se activan cuando las dos superficies se ponen en contacto o cuando desaparece el lubricante por condiciones extremas de carga30,31.
Mecánica del cartílago articular
El cartílago es un material viscoelástico que se deforma al aplicar una solicitación de carga constante con relación al tiempo que actúa. El cartílago es permeable pues el agua fluye a través de él cuando se somete a un gradiente de presión, haciendo que el fluido salga del cartílago, determinado por la porosidad, la solidez y las solicitaciones. Existe una relación directa entre la permeabilidad y el contenido de agua e inversa entre la permeabilidad y el contenido de proteoglicanos. La respuesta del tejido a una solicitación sigue un comportamiento viscoelástico tiempo dependiente. Es decir, depende de la deformación de la matriz sólida y del fluido intersticial a través de los poros y de la matriz sólida permeable en el tiempo. Cuando desaparecen las cargas, el cartílago reabsorbe el fluido exudado y recupera sus dimensiones iniciales. El contenido de agua es en el cartílago humano del 79%, semejante al del perro (80%) y algo inferior al bovino (87%)31.
Desde el punto de vista mecánico, el cartílago es un material bifásico, formado por una fase sólida y otra líquida. La parte sólida se describe como porosa y permeable y la líquida tiene la capacidad de fluir a través de la fase sólida20. El agua constituye hasta un 80 % del peso húmedo del cartílago y su relación con las macromoléculas de la matriz incrementan las propiedades mecánicas del tejido. El fluido tisular contiene gases, pequeñas proteínas, metabolitos y una alta concentración de cationes que contrarrestan la carga negativa de los proteoglicanos. No es de extrañar que las propiedades mecánicas del cartílago articular están relacionadas con la composición bioquímica y la permeabilidad del tejido. Las deformaciones del cartílago articular se producen por fuerzas de fricción interna. En los plásticos estas fuerzas de fricción se producen por el movimiento de largas cadenas de polímeros que rozan y se deslizan entre sí al deformarse el material. La matriz sólida de colágeno y proteoglicanos del cartílago cuando se deforman exhiben una respuesta viscoelástica similar a la de los materiales plásticos20.
El cartílago articular y el hueso subcondral actúan como una unidad mecánica32. La degeneración del cartílago articular se asocia con cambios en las propiedades mecánicas del material, especialmente en su rigidez y elasticidad33. La artrosis es consecuencia de un mecanismo multifactorial donde intervienen aspectos mecánicos, bioquímicos y biofísicos que se relacionan entre sí. Las características del material cambian pues el contenido de agua es más bajo y, también la permeabilidad del tejido28. También se pierde la relación entre la resistencia del cartílago y del hueso subcondral. Ding et al32 vieron que las fisuras de la capa superficial del cartílago en los estadios artrósicos iniciales eran el resultado de los daños sufridos en la red de colágeno y de la reducción en la rigidez del tejido. La delgadez del cartílago es uno de los datos iniciales de la artrosis que produce una rotura de las fibras de colágeno17 y, consecuentemente, de la unidad funcional del cartílago y el hueso subcondral que presentan una respuesta inferior a las cargas mecánicas.
El cartílago artrósico sintetiza colágeno tipo I en las fases finales de la degeneración24 que se identifica con una transformación del cartílago en fibrocartílago. El colágeno tipos VI y XI también aumentan en las fases iniciales34, mientras que el tipo IX sólo aumenta si el fibrocartílago está presente. Von der Mark et al35 demostraron un aumento de síntesis de colágeno tipo X en los condrocitos aislados del cartílago articular lo que sugiere que su metabolismo está alterado.
Respuesta del cartílago a las variaciones mecánicas
Estudios epidemiológicos señalan que aproximadamente el 6% de los adultos tienen una afección degenerativa de la rodilla, porcentaje que aumenta al 10% en personas mayores de 65 años36. Treppo et al5, analizando la articulación del tobillo en 470 donantes entre 21 y 94 años, observaron que en el 62% de los tobillos y en el 35% de las rodillas no presentaron señales degenerativas y que los signos artrósicos en la rodilla son siempre de mayor gravedad que en el tobillo y en esta articulación no guardaban relación con la edad.
Esto es llamativo cuando el cartílago de la articulación del tobillo es más delgado que el de la rodilla18 y soporta más peso corporal en una superficie menor. Sin embargo, como ha señalado Simon et al31, las articulaciones con mayor congruencia muestran una capa de cartílago de menor grosor con menor incidencia de signos degenerativos.
También se han visto diferencias entre la estructura de ambos cartílagos. Los condrocitos del astrágalo responden menos que los de la rodilla a los mediadores catabólicos como son la IL-1 o la fibronectina, y tienen una menor expresión a los genes de algunas metaloproteinasas37. Además, cuanto más delgado es el cartílago la capa superficial del mismo es relativamente más gruesa y esto produce una acción protectora y una mayor resistencia al daño y su matriz cartilaginosa también es más densa con mayor contenido de glicosamonoglicanos y menor de agua5. También el hueso subcondral del astrágalo se afecta menos por las cargas que el de la rodilla y no aumenta su densidad como ocurre en la rodilla.
Como el hueso, también el cartílago articular se adapta a los cambios mecánicos38,39 pero a diferencia del hueso, las alteraciones de las estructuras articulares, sección del ligamento cruzado anterior, meniscectomía o la resección del platillo tibial en modelos experimentales producen cambios degenerativos en el cartílago articular34,39-41.
Generalmente los cambios mecánicos que se producen en la degeneración del cartílago articular incluyen la disminución de su rigidez y el aumento de la permeabilidad42,43. Uno de los primeros cambios, después de una meniscectomía, es la fibrilación y los módulos de elasticidad a compresión y a cizallamiento del cartílago disminuyen entre un 20 y un 50 % así como la concentración de glicosamonoglicanos sulfatados43.
La alteración de la red de fibras de colágeno disminuye la rigidez a cizallamiento pues hay menos fibras orientadas en dicha dirección que en el cartílago normal. La dependencia de la organización de la zona superficial y no de la zona profunda refuerza la importancia de la capa más superficial en la función del cartílago42-44 (fig. 6).
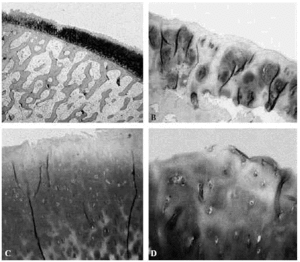
Figura 6. Imagen de artrosis del cartílago articular femoral: A: adelgazamiento del cartílago y aumento relativo de proteoglicanos (Safranina-O,x4), B: adelgazamiento, desfibrilación del cartílago y clones celulares con despegamiento del hueso subcondral (Safranina-O, x20), C: desfibrilación de la capa superficial, D: pérdida de la estructura del cartílago con algunos clones condrocíticos (Safranina-O, x20).
La inmovilización no favorece la regeneración del cartílago, siendo el movimiento pasivo beneficioso1,45-47. La inmovilización produce una atrofia del cartílago articular con disminución de la concentración de glicosaminoglicanos14,48-50 y la movilidad articular en descarga produce una atrofia del cartílago51 de lo que se puede deducir que la carga es necesaria para conseguir un cartílago morfológicamente normal.
Carter et al52 demostraron con el método de elementos finitos, que la degeneración y la osificación del cartílago articular es un proceso normal que está regido por las solicitaciones mecánicas ya que estos procesos se aceleran con el aumento de las solicitaciones en cizallamiento intermitentes. La ausencia de presión hidroestática lleva a una degeneración del cartílago y a un avance del frente de osificación desde el hueso subcondral hacia la superficie articular. Por su parte, Burton-Wurster et al53 vieron que cargas estáticas sobre el cartílago inhiben la síntesis mientras que las cargas intermitentes ayudan a mantener el índice de permeabilidad del tejido.
Palmoski y Brandt15 escayolando la pata posterior de perros, durante 6 semanas, vieron que el grosor del cartílago articular, la síntesis de proteoglicanos y la capacidad de éstos para formar agregados disminuían. Si se retiraba la escayola y se permitía al animal caminar libremente, en tres semanas se detenían los cambios. Sin embargo, el ejercicio rutinario tras la retirada de la escayola no evitaba que se mantuvieran los cambios derivados de la inmovilización.
Diversos autores14,48,50 escayolando la rodilla de perros jóvenes, durante 11 semanas, demostraron un descenso de la concentración de glucosaminoglicanos en el cartílago y una disminución del espesor del cartílago calcificado. Estas observaciones indican que el mantenimiento del cartílago articular requiere cargas fisiológicas acompañando al movimiento.
Además, igual que en el hueso, la sobrecarga del cartílago puede producir hipertrofia. Algunos investigadores48-50 encontraron que el incremento de carga en la articulación opuesta a una articulación amputada y el ejercicio moderado (4 km diarios de carrera) aumentaban la concentración de glicosaminoglicanos y el grosor del cartílago. Sin embargo, cargar las articulaciones no siempre es beneficioso pues en un cartílago lesionado evita su reparación y una carga excesiva puede deteriorar un cartílago normal. El ejercicio excesivo (20 km de carrera diarios) reduce el grosor y la concentración de glicosaminoglicanos de las articulaciones normales14.
Oettmeier et al54, en perros, aumentando la distancia gradualmente hasta alcanzar 40 km/día, durante 40 semanas y manteniendo este ritmo durante 15 semanas, no encontraron cambios en la superficie articular, si bien observaron histológicamente espacios entre el cartílago hialino y el hueso subcondral y aumento del grosor y penetración vascular en el cartílago calcificado, además de un incremento del volumen de hueso trabecular y un mayor ritmo de remodelación ósea.
Hay una adaptación poco llamativa del cartílago al ejercicio y la conocida como hipótesis de Leeds señala que el cartílago está condicionado para transmitir, sin que se produzcan daños, las solicitaciones a las cuales está sujeto habitualmente55 aunque, como señala Radin y Paul56, el cartílago articular es demasiado delgado para absorber todas las cargas con garantías y se puede pensar que el cartílago articular transmite las solicitaciones articulares a las estructuras óseas subyacentes57.
Son interesantes los estudios epidemiológicos efectuados sobre la evolución articular en deportistas de élite y en trabajadores que han sobreutilizado sus articulaciones. En el hombre se ha visto que hay un aumento de esclerosis asintomática y formación de osteofitos marginales, sin estrechamiento del espacio intraarticular en corredoras58 y un aumento de la esclerosis del hueso subcondral y formación de osteofitos en las caderas de antiguos corredores de élite59.
Un estado especial de sobrecarga son las elongaciones óseas. Se han descrito cambios morfológicos al poco tiempo de realizar una elongación femoral en perros60,61 y tras elongar la tibia en conejos62. Stanitski60 encontró después de una elongación del 30% de la longitud del fémur, con una velocidad de 0,75 mm/día, una fibrilación del cartílago articular, disminución de proteoglicanos en tres animales y necrosis del cartílago en otros dos. En otro estudio realizado por el mismo equipo, también en perros, protegiendo la articulación de la rodilla vieron una disminución de proteoglicanos sin evidencias de fibrilación o necrosis del cartílago articular61.
Nakamura et al62,63 realizaron elongaciones en conejos a 1 mm/día, en dos veces y dando 120 vueltas/día, con una elongación del 10, 20 y 30% de la longitud del hueso. En todos los grupos elongados se encontró un aumento de la concentración de glicosaminoglicanos. En nuestra experiencia65 no hemos encontrado alteraciones morfológicas del cartílago articular en las tibias elongadas de cordero que muestre signos de degeneración articular. Los cambios degenerativos iniciales del cartílago articular, cuando se aplican grandes fuerzas, se producen en la capa más superficial del mismo, sin embargo cuando se efectúa una elongación las solicitaciones aumentan de dentro hacia fuera lo cual explica las variaciones en las capas más profundas del cartílago articular, en el cartílago de crecimiento y en el hueso esponjoso tanto epifisario como metafisario.
Respuesta del cartílago frente a las lesiones
La composición y estructura del cartílago y del hueso cambian con la edad alterando la función del tejido. La edad produce cambios bioquímicos y biomecánicos en el cartílago articular caracterizado por una pérdida del tamaño de los agregados en los proteoglicanos y en su estabilidad, así como una pérdida del contenido de agua. También aumentan el número de los pequeños monómeros ricos en queratán sulfato y disminuyen las cadenas ricas en condroitín sulfato.
El colágeno disminuye con la edad y también la resistencia a tensión de las capas superficiales y medias del cartílago de la cabeza femoral28,66. Esto tiene consecuencias importantes, pues las personas activas y obesas o personas que engordan con la edad, si la actividad física permanece constante, tendremos un cartílago cada vez menos resistente y un hueso subcondral cada vez más rígido por los continuos microtraumatismos que debe soportar que llevará a cambios degenerativos irreversibles.
Las lesiones articulares no suelen ser por mecanismos directos. Son consecuencia de modificaciones en las magnitudes o direcciones de las solicitaciones en el tiempo con un cartílago, cada vez, en peores condiciones. El proceso reparativo del cartílago articular consiste en el reemplazo de la matriz extracelular y las células, dañadas o perdidas, por nuevo tejido. Los cambios histopatológicos del cartílago varían de acuerdo con el tipo de lesión. Si la lesión se relaciona con un mecanismo de contacto persistente en una zona de la articulación, se observa un reblandecimiento temprano de cartílago; fibrilación en el defecto articular; fisuras o grietas en la lesión hasta llegar a la exposición del hueso subcondral. Por el contrario, si el defecto es causado por una lesión penetrante, una lesión aguda por abrasión, o un traumatismo directo la reacción del cartílago es completamente diferente12.
Por la baja densidad celular y la incapacidad de los condrocitos para migrar hacia el defecto, la reparación requiere un considerable esfuerzo en un tejido ya de por sí comprometido por la falta de riego sanguíneo. Cuando la lesión se extiende hasta el hueso subcondral, las células de la médula ósea y los vasos sanguíneos tienen acceso al defecto por lo que algunas lesiones se pueden reparar aunque el resultado no sea un cartílago articular normal67,68. Experimentalmente se ha visto que estas lesiones no mantienen la integridad del tejido mas allá de 6 meses, después de los cuales aparece fibrilación del cartílago, fisuras y cambios degenerativos. El tejido de reparación es un tejido cicatricial, en el cual la macromolécula predominante de la matriz es el colágeno tipo I que no está diseñado para resistir solicitaciones a compresión. Además, las células encargadas de la reparación no son capaces de producir las macromoléculas características del cartílago articular en cantidad suficiente para crear una matriz extracelular fuerte y cohesionada.
Las lesiones más pequeñas curan mejor y de forma más completa que las grandes y sólo las lesiones que alteran la función articular o producen dolor tienen relevancia clínica, por lo que nos parece que es muy importante a la hora de definir las lesiones y de evaluar los tratamientos seguir una clasificación adecuada para enfocar el tratamiento y hacer un pronóstico correcto que es posible con la artroscopia y las técnicas de imagen. Se deben distinguir las lesiones que alteran la función articular causando pérdida de movimiento, dolor, inestabilidad o deformidad, de aquellas que no lo hacen, como son los pequeños defectos que afectan al espesor completo del cartílago en áreas que no soportan cargas o agujeros de pequeño diámetro. El tamaño de la lesión condral influye directamente en la reparación69. Lesiones menores de 1 mm de diámetro curan con facilidad mientras que cuando son mayores de 3 mm de diámetro es más complicado13. También los defectos osteocondrales que contactan con el cartílago de la superficie opuesta presentan una pobre reparación.
Las células cartilaginosas difieren en su actividad metabólica según la zona de la lesión. Las células de la zona superficial son aplanadas y tienen una mínima actividad metabólica1,68 mientras que las de la zona calcificada están degeneradas o muertas. Una lesión profunda produce un combinado de células en el interior del cartílago además de penetrar células de la membrana sinovial. El tejido cartilaginoso no posee terminaciones nerviosas; el dolor asociado con las lesiones degenerativas proviene de los tejidos cercanos, consecuencia de la tensión al cual está sometido el hueso subcondral o el tejido sinovial, frecuentemente inflamado, de los ligamentos y la cápsula articular que se tensan y estiran por la inestabilidad, o de los tendones y músculos, próximos a la articulación, que suelen presentar espasmos.
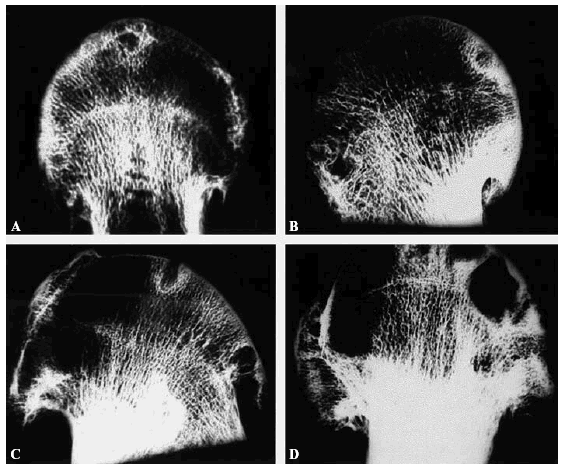
Según Buckwalter12 las lesiones agudas de cartílago pueden ser como consecuencia de la pérdida de macromoléculas de la matriz sin daño celular o del colágeno; la alteración mecánica celular y de la matriz cartilaginosa o una alteración mecánica celular, de la matriz cartilaginosa y también ósea (Fig. 7).
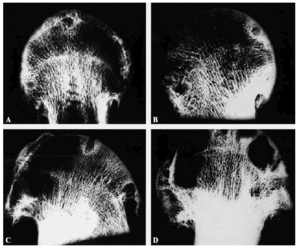
Figura 7. (A-D) Radiografías de contacto de cortes de cabeza femoral artrósicas. No se aprecia desestructuración de las trabéculas. Son más frecuentes las geodas y la esclerosis alrededor de las geodas en el hueso subcondral.
Cada tipo de lesión produce una respuesta de reparación diferente con un pronóstico distinto. Sin embargo, muchas veces se superponen, debido al tiempo transcurrido en una misma articulación pues la pérdida progresiva de macromoléculas de la matriz afecta a las células y a la red de colágeno y alteran la mecánica de la superficie articular.
La clasificación de Outerbridge71 desarrollada inicialmente para la valoración de la condromalacia patelar, puede ser útil para cualquier otro tipo de lesión ya que describe su forma y su extensión. Nos parece de mayor valor el sistema establecido por Noyes y Stabler72, que se basa en valorar los daños articulares según cuatro aspectos distintos, la descripción de la superficie articular, la profundidad, el diámetro y la localización de la lesión.
También es interesante conocer para los trabajos de tipo experimental las valoraciones histológicas de las lesiones y hallazgos del cartílago articular para conocer, medir y valorar la situación microscópica del cartílago. La más sencilla y utilizada es la de Mankin73,74, si bien hay otras como la de O'Driscoll75. Hoy nos enfrentamos ante uno de los grandes retos de la cirugía ortopédica, prevenir las alteraciones mecánicas del cartílago propias de la edad y repararlo devolviéndole sus propiedades mecánicas sin tener que recurrir a soluciones drásticas como es el recambio del tejido óseo y cartilaginoso por un sustituto metálico.