La evaluación de la remodelación ósea que se produce en el fémur proximal tras implantar una prótesis no cementada de cadera se realiza habitualmente mediante controles radiográficos seriados. Sin embargo, se conoce que esta técnica se ve influida por variables como el tipo de película utilizada, la técnica de exposición, la distancia al objetivo y la posición del fémur. Además, el ojo humano tan sólo puede detectar variaciones en la densidad ósea mayores del 30-40%. La incorporación de la densitometría ósea (DEXA) al estudio del remodelado periprotésico ha permitido detectar y cuantificar con mayor sensibilidad los cambios de masa ósea que tienen lugar en el fémur proximal. Se conoce que dichos cambios están influidos por factores dependientes del paciente, y factores dependientes del implante.11 Entre los primeros, el más destacado es la masa ósea preoperatoria, directamente relacionada con el sexo,20 influyendo también la carga y nivel de actividad a la que se somete el implante. Entre los otros, destaca el material, geometría y tamaño del implante que determinarán su rigidez, y la localización y extensión del recubrimiento poroso, en relación directa al tipo de anclaje que se pretende.
Uno de los implantes más estudiados desde el punto de vista densitométrico ha sido el AML8,9,18 que mostró una pérdida ósea en torno a todo el implante pero con un gradiente de proximal a distal. Los vástagos cementados también han determinado pérdidas significativas a largo plazo17 así como los implantes de recubrimiento poroso proximal de diferentes aleaciones.6
Sin embargo, estos hallazgos se obtuvieron a partir de estudios transversales en poblaciones protetizadas y estudiadas en diferentes períodos de evolución, o bien a partir de estudios prospectivos de corta evolución. En ambos, los diferentes autores señalaban que, para comprender mejor la remodelación periprotésica, son necesarios estudios prospectivos controlados con seguimiento a largo plazo.
Para cuantificar los cambios remodelativos a lo largo del tiempo se ha realizado un estudio prospectivo controlado con 32 pacientes en quienes se implantó una prótesis total de cadera no cementada, que fueron revisados periódicamente durante 7 años mediante densitometría ósea. Se acepta que diferentes diseños de vástago determinan diferencias en el remodelado óseo adaptativo y se ha buscado establecer qué tipo de remodelación induce un vástago anatómico, de fijación metafisaria y con recubrimiento de hidroxiapatita en su tercio proximal, así como las diferencias respecto a otros implantes ya estudiados. Del mismo modo, se ha intentado establecer la cronología de estos cambios adaptativos, buscando distinguir entre las pérdidas óseas precoces por desuso y las pérdidas tardías atribuibles a osteólisis, por partículas de polietileno en torno a un vástago con buen anclaje.
Material y método
Para el estudio del remodelado periprotésico en torno al vástago ABG-I se diseñó un estudio prospectivo controlado y de tipo mixto, en el que se utilizó como criterio de evolución la variación de la masa ósea en las 7 áreas de Gruen en el fémur. Se realizó el seguimiento de una cohorte de 35 pacientes intervenidos en el Hospital Miguel Servet de Zaragoza, entre febrero y junio de 1993, en quienes se implantó una prótesis ABG-I, tomando como control la cadera contralateral sana. Las determinaciones de masa ósea se realizaron con el densitómetro HOLOGIC QDR 1000 en ambas caderas en el preoperatorio, al año, 5 y 7 años; y además, en la cadera intervenida a los 15 días y 6 meses postoperatorios. Los criterios de inclusión en el estudio fueron la indicación quirúrgica para este tipo de implante, la cadera contralateral sana y la aceptación del estudio. Los criterios de exclusión fueron las fracturas, por traumatismo o patológicas, la afectación bilateral y la negativa a participar en el estudio. La recogida de datos se realizó a partir de la anamnesis y la historia clínica. Para la valoración funcional se utilizó la escala de Merle D'Aubigné. Las determinaciones densitométricas se realizaron con el densitómetro HOLOGIC QDR 1000, cuyas características técnicas son: error de precisión en fémur 1,5 a 2%, error de exactitud 2 a 4%, hasta un 10% en obesos; radiación al paciente menor de 3 mRem y tiempo de exploración 8 minutos.3 Se consideró fundamental para la fiabilidad de las determinaciones el establecer un protocolo de colocación de los pacientes. Así, fueron colocados en posición supina sobre la tabla del scanner, con las rodillas y caderas en extensión y todo el miembro en posición neutra adaptado a un dispositivo rígido al cual se fijaba con cintas de velcro.
Para la comparación del porcentaje se utilizó la prueba de Chi cuadrado, para las medias la «t» de Student-Fisher para datos libres o apareados, según conviniera y el coeficiente de correlación de Pearson.
Resultados
De los 35 pacientes incluidos en el estudio se pudo completar el seguimiento a 7 años en 32, ya que dos habían fallecido y otro resultó ilocalizable. Se trataba de 16 hombres y 16 mujeres, cuya edad media fue de 63 años (mínimo: 29 y máximo: 73). El lado afecto fue el derecho en 22 de ellos y el izquierdo en 10. El diagnóstico inicial fue coxartrosis primaria en 22, necrosis avascular en nueve y coxartrosis secundaria a displasia en otro. La evolución de los paramétros clínicos de la escala de Merle D'Aubigné mostraba en el preoperatorio: dolor 2,66; deambulación 2,80 y movilidad 3,30. Al final del seguimiento fueron 5,55; 5,66 y 5,60 respectivamente, sin apreciarse diferencias entre sexos o subgrupos de edad.
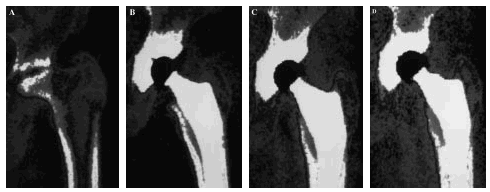
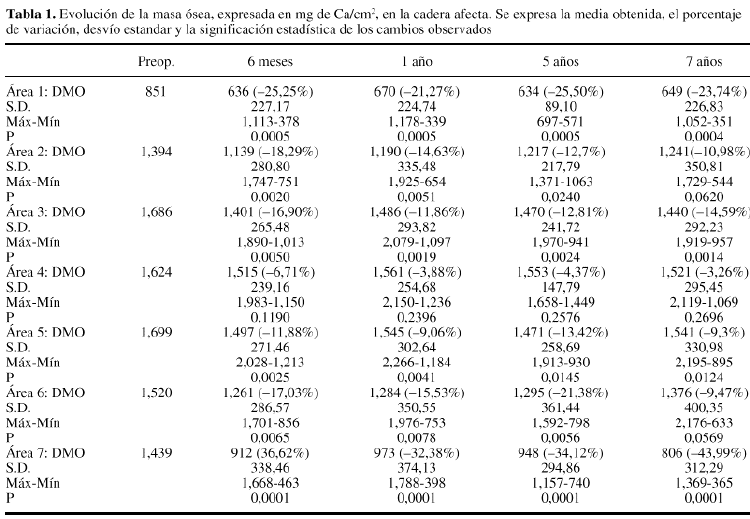
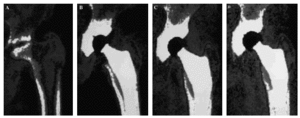
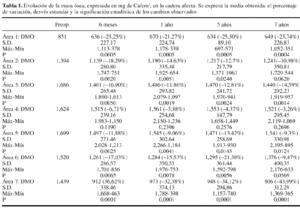
La evolución de la masa ósea femoral se recoge en la tabla 1. Se apreció una pérdida ósea generalizada en torno al implante, pero con un gradiente de proximal a distal y distinto comportamiento entre zonas a lo largo del tiempo (Fig. 1, a-d). La zona 1 mostró una pérdida de masa ósea del 25% a los seis meses, momento a partir del cual se estabilizaba, con una recuperación parcial al año, plazo en el que la pérdida era del 21% respecto a la preoperatoria. A los 7 años, la masa ósea final era un 24% inferior a la inicial. La zona 2 mostró una pérdida ósea significativa a los 6 meses, del 18%. A partir de este momento se producía un lento ascenso de la masa ósea a ese nivel, que a los 7 años presentaba un descenso del 11% respecto a la inicial. La zona 3 presentaba una evolución semejante, con un descenso a los 6 meses del 17%, momento a partir del cual se estabilizaba y tendía a recuperarse entre los 6 meses y 1 año, permaneciendo estable a partir de ese momento. La zona 4 mostró un descenso no significativo de la masa ósea a lo largo de todo el seguimiento. La zona 5 presentó un descenso del 12% de la masa ósea a los 6 meses, estabilizándose a partir de ese momento con una lenta recuperación que la situaba al final un 9% inferior a la preoperatoria. La zona 6 mostraba un descenso de masa ósea a los 6 meses del 17%, a partir de este momento se apreciaron cambios en dos fases: entre el primero y el quinto años se produjo una estabilización, presentando a los 5 años un déficit del 21%. Sin embargo, en coincidencia con pérdidas tardías en la zona 7 atribuibles a osteolisis, se produjo un ascensos relativo de la masa ósea en zona 6, que alcanzaba un déficit final de sólo un 9%. La zona 7 mostró una evolución en diferentes fases. A los 6 meses se apreció un descenso del 37%, momento a partir del cual se estabilizaron las pérdidas mostrando un leve ascenso al año que se mantuvo hasta el quinto. Sin embargo, a partir de ese momento se apreciaron nuevos descenso, con déficits finales del 44% respecto al preoperatorio. La evolución de la masa ósea en la cadera contralateral sana mostró pérdidas no significativas entre el 4% y el 7% atribuibles a osteoporosis senil involutiva.
Figura 1. Evolución densitométrica de la masa ósea periprotésica de una paciente de 63 años. La densidad calcio se muestra con color blanco, con tonos grises tendientes a negro cuanto menor masa ósea existe. Se aprecia la atrofia proximal y la conservación ósea metafisodiafisaria. A: preoperatorio. B: 1 año. C: 5 años. D: 7 años.
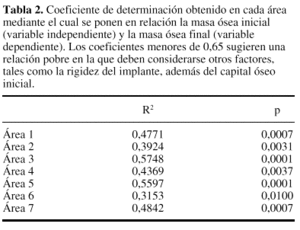
Para completar el estudio se buscó establecer la relación entre la densidad mineral ósea (DMO) final en cada zona (variable dependiente) en función de la DMO inicial (variable independiente o explicativa) mediante modelos de regresión lineal. Se consideró que estas expresiones matemáticas tendrían carácter predictivo cuando el coeficiente de determinación (R2) fuera mayor de 0,65. Sin embargo, esta condición no se cumplió en ninguna de las 7 zonas estudiadas (tabla 2).
Discusión
El remodelado óseo periprotésico tras la inserción de un vástago no cementado se debe a factores mecánicos y biológicos. Estos cambios se producen precozmente y en diferentes estudios se plantea que tienen lugar de forma más intensa hasta en los dos primeros años6,17,20 apreciándose a partir del cuarto año fenómenos de osteolisis relacionados con las partículas de desgaste. Los resultados obtenidos en este estudio sugieren que los cambios adaptativos a la nueva situación biomecánica que supone la protetización se producen fundamentalmente en los seis primeros meses, alcanzándose a partir de ese momento una situación de equilibrio que sólo se modifica con la aparición de nuevos factores tales como la osteolisis en zona 7 que desplaza la transmisión de cargas a zonas más distales.
La utilización de vástagos de anclaje proximal, eminentemente metafisario, se desarrolló con objeto de solucionar los dos problemas mayores que presentaban los vástagos de recubrimiento poroso extenso: a) la atrofia ósea proximal por puenteo de fuerzas («stress-shielding») y b) el dolor en tercio medio del muslo. Sin embargo, estos objetivos no se alcanzaron cuando se utilizaban de forma indiscriminada, y tan sólo conseguían reducir parcialmente la atrofia proximal cuando se implantaban en pacientes con muy buena calidad ósea preoperatoria.19
Podría decirse que el vástago ABG proporciona un buen anclaje en la zona de transición metafiso-diafisaria, zona en la que transmite eficazmente cargas y éstas constituyen un estímulo adecuado para la conservación ósea a ese nivel. En las zonas 2 a 6, la pérdida ósea a 7 años oscila entre el 3,2 al 14,5% y presentan mínimos cambios a partir de los 6 meses, que no son significativos. Únicamente la zona 6 presenta un aumento de masa ósea a partir del quinto año al producirse una pérdida ósea más intensa en la zona 7, probablemente por osteólisis secundaria a las partículas de desgaste del polietileno, que hace que la transmisión de cargas se desplace distalmente, aumentando a ese nivel la masa ósea de forma tardía.
En la zona 1 se aprecia una pérdida más intensa, ya evidente a los 6 meses, que se mantiene estable a lo largo del seguimiento, y que oscila entre el 20% y el 25%. Esta mayor pérdida se puede atribuir a que la zona 1 queda realmente desfuncionalizada desde el postoperatorio, y las cargas posteriores no constituyen un estímulo suficiente para recuperar el capital óseo. En la zona 7, las pérdidas se suceden en dos fases. En los primeros meses postoperatorios esta zona sufre una intensa pérdida debida a una doble agresión. La zona del cálcar suele quedar deplecionada de esponjosa con el paso de las raspas femorales, lo que destruye la circulación endostal;12 y por otro lado la disección del cirujano para realizar una correcta osteotomía causa una desperiostización excesiva lo que provoca su denervación y devascularización. A esta doble agresión se le añade después el que el vástago transmite las cargas realmente a un nivel más distal. Como resultado de todo ello se aprecia una pérdida media del 37% de masa ósea a los 6 meses. A estas pérdidas precoces se sucede un período de estabilidad, que se ve alterada a partir del quinto año con nuevas pérdidas por osteolisis que causan un descenso a los 7 años que ya alcanza el 44%.
Para evaluar la eficacia de este vástago en preservar la masa ósea femoral deben compararse los resultados obtenidos con los descritos para otros implantes. Los trabajos de Engh y cols. y McAuley y cols.8,15,16 han mostrado, a partir de fémures procedentes de autopsias, que tanto en vástagos AML de recubrimiento proximal o extenso las pérdidas con éste implante son mayores, paradójicamente más altas en los de recubrimiento poroso proximal, apreciándose una pérdida entre el 17% y el 76% en la zona 7 y del 32% en las zonas 2 y 5 de Gruen. Kilgus y cols.,10 en su estudio transversal con 46 vástagos AML de recubrimiento poroso extenso, observaron pérdidas a cinco-siete años del 60% en la zona 7, entre 18% y el 50% en zonas medias y entre 1% y el 17% en las zonas distales. Con el vástago AML de recubrimiento poroso proximal, las pérdidas en zona 7 oscilaban entre el 48% y el 60%, en zonas medias entre 4% y el 25% y a nivel distal en torno al 2%. Vidal y cols.23 en su estudio con vástagos AML a 6 meses, ya encontraron pérdidas del 31% en la zona del cálcar, del 17% en trocánter mayor, del 21% en zona 2 y del 12% en la zona 6. Con vástagos de recubrimiento completo de hidroxiapatita, Viladain y cols.24 apreciaron a 5 años pérdidas del 12% en la zona 1, 9% en zona 4 y 49% en la zona 7.
Los resultados aparentemente mejores encontrados en la literatura los aportan Martini y cols.13 quienes exponen los resultados a 21 meses de un grupo de 27 pacientes en los que se implantó un vástago de apoyo proximal diseñado a medida. En este estudio se apreció una pérdida del 21% en la zona 7, del 11% en zona 1, entre 5% y 11% en zonas medias y del 8% en la zona 4. Con el vástago ABG, Massari y cols.14 aportan un estudio densitométrico a 18 meses con 30 pacientes. En la zona del cálcar aprecian una pérdida del 38,7%, del 10,17% en cortical metafiso-diafisaria medial y del 8,02% en la lateral. Puede decirse que el vástago ABG se comporta eficazmente en cuanto a la conservación ósea a partir de las zonas 2 y 6, no así en las zonas más proximales. Es posible que esta percepción haya motivado los cambios en el diseño de este implante que presenta el modelo ABG-II, que introducen innovaciones para hacer más efectiva la carga metafisaria.
La trascendencia de la pérdida ósea proximal es objeto de preocupación para muchos autores aunque hay quienes minimizan su importancia. Entre los primeros se señala que la fragilización progresiva de la zona trocantérea hace más vulnerable al paciente en el caso de sufrir caídas, además de hacer mucho más difícil la revisión del vástago en caso de ser necesaria.15 Entre los menos pesimistas, se considera que la atrofia proximal traduce un anclaje metafiso-diafisario eficaz y, dado que en la mayoría de los casos no tiene repercusión clínica, se considera poco importante.
Acerca de la correlación existente entre el remodelado óseo y la masa ósea inicial, para este grupo de pacientes puede decirse que fue baja y no significativa, de modo que un porcentaje importante del remodelado se puede atribuir a factores no dependientes del paciente, como la rigidez del implante.
Sobre la influencia del recubrimiento de hidroxiapatita en la zona proximal del implante cabría recordar su papel osteoconductor, y no osteoinductor, así como su empleo para conseguir una fijación biológica precoz del implante.2,4,5,21 No se han determinado en estudios comparativos sobre vástagos de igual diseño con o sin hidroxiapatita las diferencias densitométricas en el remodelado óseo. Se conoce, sin embargo,7 que a igual diseño del vástago existen mejores resultados clínicos y radiológicos a corto plazo sugiriendo que la hidroxiapatita mejora la fijación del implante al aumentar la superficie de anclaje óseo del vástago. Pero es paradójico observar que los estudios radiológicos con este tipo de vástagos de anclaje proximal muestran mayoritariamente fenómenos de condensación esponjosa e hipertrofia cortical en zonas distales al recubrimiento de hidroxiapatita, que se producen por el estímulo mecánico determinado por el diseño y posición del implante.1,6,22 Aparte de la indudable ventaja que representa la hidroxiapatita en cuanto a mejorar la calidad de la fijación biológica del implante, parece lógico pensar que el remodelado óseo adaptativo es respuesta a la nueva situación biomecánica de la cadera en la que la presencia de hidroxiapatita no alterará los patrones de transmisión de cargas.
Conclusiones
El diseño anatómico y de anclaje eminentemente metafisario del vástago ABG proporciona una fijación ósea estable a partir de la transición metafisodiafisaria, pero no evita por completo el puenteo de fuerzas a nivel de fémur proximal. Las zonas 1 y 7 no reciben una transmisión adecuada de cargas capaces de preservar el capital óseo; sin embargo, las pérdidas de masa ósea observadas a ese nivel no se traducen en un deterioro de los resultados clínicos.
El remodelado óseo adaptativo tiene lugar de forma más intensa en los primeros 6 meses. Los cambios posteriores, de menor cuantía, son atribuibles a la carga y actividad del paciente. Sólo en fases más avanzadas se aprecian nuevos cambios como traducción de la pérdida ósea proximal por osteolisis que causa un desplazamiento de cargas a nivel más distal.