Los paradigmas de tratamiento para pacientes con metástasis de columna vertebral han evolucionado significativamente en las últimas 2 décadas. El cambio más transformador de estos paradigmas ha sido la integración de la radiocirugía estereotáctica espinal (sSRS). La sSRS permite la administración de dosis de radiación lítica con preservación de los órganos cercanos en riesgo, particularmente la médula espinal. La evidencia apoya la seguridad y la eficacia de la radiocirugía, ya que actualmente ofrece un control tumoral local duradero con bajas tasas de complicaciones, incluso para tumores que anteriormente se consideraban radiorresistentes a la radioterapia convencional de haz externo. El papel de la intervención quirúrgica sigue siendo consistente, pero se ha observado una tendencia hacia técnicas menos agresivas, a menudo mínimamente invasivas. Utilizando tecnologías modernas e instrumentación mejorada, los resultados quirúrgicos continúan mejorando con una morbilidad reducida. Además, los agentes dirigidos, como los productos biológicos y los inhibidores de puntos de control, han revolucionado la atención del cáncer al mejorar tanto el control local como la supervivencia del paciente. Estos avances han dado lugar a la necesidad de nuevas herramientas de pronóstico y a una revisión más crítica de los resultados a largo plazo. La naturaleza compleja de los esquemas de tratamiento actuales requiere un enfoque multidisciplinario que incluya cirujanos, oncólogos médicos, oncólogos radioterápicos, intervencionistas y especialistas en dolor. Esta revisión recapitula los datos actuales basados en la evidencia sobre el tratamiento de las metástasis espinales e integra estos datos en un marco de decisión, NOMS, que se basa en 4 pilares centinela de la toma de decisiones en tumores metastásicos de la columna vertebral: estado neurológico, comportamiento oncológico del tumor, estabilidad mecánica y carga sistémica de la enfermedad y comorbilidades médicas.
Treatment paradigms for patients with spine metastases have evolved significantly over the past two decades. The most transformative change to these paradigms has been the integration of spinal stereotactic radiosurgery (sSRS). sSRS allows for the delivery of tumoricidal radiation doses with sparing of nearby organs at risk, particularly the spinal cord. Evidence supports the safety and efficacy of radiosurgery as it currently offers durable local tumor control with low complication rates even for tumors previously considered radioresistant to conventional external beam radiation therapy. The role for surgical intervention remains consistent, but a trend has been observed toward less aggressive, often minimally invasive techniques. Using modern technologies and improved instrumentation, surgical outcomes continue to improve with reduced morbidity. Additionally, targeted agents such as biologics and checkpoint inhibitors have revolutionized cancer care by improving both local control and patient survival. These advances have brought forth a need for new prognostication tools and a more critical review of long-term outcomes. The complex nature of current treatment schemes necessitates a multidisciplinary approach including surgeons, medical oncologists, radiation oncologists, interventionalists and pain specialists. This review recapitulates the current state-of-the-art, evidence-based data on the treatment of spinal metastases and integrates these data into a decision framework, NOMS, which is based on four sentinel pillars of decision making in metastatic spine tumors: neurological status, Oocologic tumor behavior, mechanical stability and systemic disease burden and medical co-morbidities.
Las metástasis de columna vertebral son un reto oncológico común, ya que del 20 al 40% de los pacientes de cáncer se ven afectados durante el curso de su enfermedad, y hasta el 20% de ellos se volverán sintomáticos en cuanto a compresión de la médula espinal1–5. La magnitud de este problema se prevé que crezca de manera proporcional al incremento exponencial del uso de las terapias dirigidas, que se ha demostrado que mejoran notablemente la supervivencia, para casi todos los tumores malignos. Además, el incremento de la disponibilidad de imagen diagnóstica avanzada, tal como la imagen de resonancia magnética y el escáner de PET/TC con 18FDG servirán también para incrementar la detección de la enfermedad metastásica en la columna vertebral. A pesar de la ampliación de la supervivencia, expresada por los productos biológicos y los inhibidores de puntos de control inmunitarios, los objetivos terapéuticos para los pacientes con metástasis de columna vertebral siguen siendo paliativos, centrándose en la preservación o restauración de la función neurológica y la estabilidad de la columna vertebral, la mejora del control del dolor y de la calidad de vida relacionada con la salud (CVRS), y el control tumoral duradero. Los sistemas de puntuación, tales como las escalas Tomita6 y Tokuhashi revisada7 han sido utilizadas históricamente para calcular la supervivencia y dictar el tratamiento, aunque su obsolescencia se ha ido incrementando, debido a su incapacidad de incorporar y contabilizar los avances en todos los campos del tratamiento contra el cáncer.
Durante los últimos 15 años, el desarrollo de la radiocirugía estereotáctica de la columna vertebral (sSRS) ha cambiado fundamentalmente el paradigma del tratamiento del tumor espinal8–13. La capacidad de la sSRS para aportar una dosis de radiación ablativa, que es histológicamente independiente en términos de tasas de control, ha cambiado fundamentalmente las indicaciones y los tipos de cirugía requeridos10,14,15. Mientras que el tratamiento a principios de los años 2000 se basaba en los enfoques quirúrgicos agresivos, debido a las limitaciones del control local de la radioterapia de haz externo, la sSRS ha motivado que el péndulo se incline hacia la radiación, como modalidad terapéutica principal. Actualmente, la cirugía se utiliza en casos selectivos como adyuvante de la sSRS para la recuperación de la función neurológica, la mejora de la cobertura de volumen blanco de la radiación dentro de los límites de dosificación de la médula espinal, y la reconstrucción de la columna en los casos de inestabilidad8,16,17. La extirpación del bruto total intralesional o la resección en bloque ya no son necesarias, habiendo sido ampliamente sustituidas por la cirugía de separación, para crear un objetivo seguro para la sSRS mediante la descompresión del espacio epidural9,18.
A medida que han evolucionado la radiación y las técnicas quirúrgicas, lo han hecho también los algoritmos de tratamiento del paciente. El marco de decisión NOMS desarrollado en Memorial Sloan Kettering Cancer Center (MSKCC) en 2004 es de uso muy común, actualizándose cada 2 años, para integrar la medicina basada en nueva evidencia y avances tecnológicos19. La toma de decisiones de NOMS se basa en 4 pilares centinela: neurológico, oncológico, mecánico (estabilidad) y enfermedad sistémica. La evaluación neurológica considera los parámetros clínicos y radiográficos, incluyendo la presencia de mielopatía, radiculopatía funcional y grado de compresión de la médula espinal epidural (ESCC). La consideración oncológica refleja la estrategia más efectiva para lograr el control tumoral local, que se basa principalmente en la radiación prevista y las respuestas al tratamiento sistémico. La estabilidad mecánica evalúa el impacto de las fracturas patológicas sintomáticas para determinar la necesidad de un procedimiento intervencionista, o de órtesis externa. La consideración final es el alcance de la enfermedad sistémica y las comorbilidades médicas, que son grandes determinantes de la idoneidad de un paciente para la cirugía, o incluso la radioterapia basada en la estratificación del riesgo del procedimiento propuesto, y la supervivencia esperada. En este documento se evaluará la evolución de los avances críticos conducentes a los paradigmas actuales de tratamiento, en el contexto del marco de decisión NOMS (tabla 1).
Mapa actual de decisión NOMS
| La ESCC de bajo grado se define como el sistema de puntuación del Spine Oncology Study Group de grado 0 o 1. |
| La ESCC de alto grado se define como grados 2 o 3 en la escala ESCC. |
| Las opciones de descompresión incluyen cirugía abierta, MAS, SLITT. |
| Las opciones de estabilización incluyen aumento percutáneo de cemento, instrumentación percutánea del tornillo pedicular, e instrumentación abierta. Para los pacientes con comorbilidades sistémicas significativas que afectan a la capacidad de tolerar la cirugía abierta, la estabilización puede limitarse a aumento de cemento y/o aumento del tornillo percutáneo. |
| cEBRT: radiación de haz externo convencional; ESCC: compresión de la médula espinal epidural; MAS: cirugías de acceso mínimo; NOMS: neurológico, oncológico, mecánico y sistémico; SLITT: termoterapia intersticial por láser para columna; SRS: radiocirugía estereotáctica. |
| Puntuación | |
|---|---|
| Localización | |
| Articular (occipucio) | 3 |
| Columna móvil | 2 |
| Semirrígida | 1 |
| Rígida | 0 |
| Dolor | |
| Sí | 3 |
| Dolor ocasional, pero no mecánico | 1 |
| Lesión sin dolor | 0 |
| Lesión ósea | |
| Lítica | 2 |
| Mixta (lítica/blástica) | 1 |
| Blástica | 0 |
| Alineamiento espinal radiográfico | |
| Subluxación/traslación presente | 4 |
| Deformidad de novo (cifosis/escoliosis) | 2 |
| Alineamiento normal | 0 |
| Colapso del cuerpo vertebral | |
| >50% colapso | 3 |
| <50% colapso | 2 |
| No colapso con >50% de compromiso corporal | 1 |
| Ninguno de los casos anteriores | 0 |
| Compromiso posterolateral de los elementos espinales | |
| Bilateral | 3 |
| Unilateral | 1 |
| Ninguno de los casos anteriores | 0 |
| Puntuación total | |
| Estable | 0-6 |
| Indeterminado | 7-12 |
| Inestable | 13-18 |
Fuente: Adaptada de Laufer I et al.8. Reproducida y modificada con autorización.
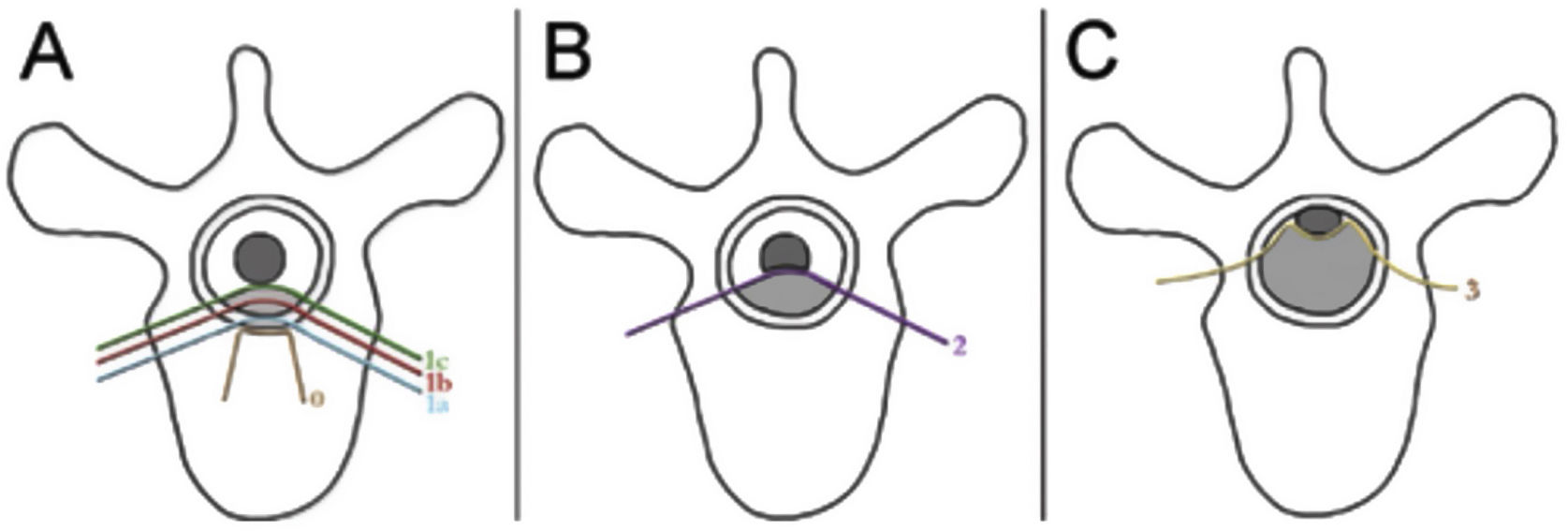
Las evaluaciones neurológica y oncológica se realizan en combinación con el objetivo situado en la preservación de la función neurológica y el control tumoral local. Las consideraciones neurológicas abarcan tanto los parámetros clínicos que reflejan la presencia de mielopatía, síndrome de cauda equina y radiculopatía funcional, y los parámetros radiográficos que evalúan el grado de compresión de la médula espinal epidural. El grupo de estudio Spine Oncology Study Group (SOSG) validó la puntuación Epidural Spinal Cord Compression (ESCC), homónimamente denominada puntuación Bilsky en la literatura, que utiliza imagen de RM axial ponderada en T2 para definir el grado de compresión de la médula espinal epidural para los tumores de la columna vertebral20. La puntuación ESCC es una escala de 6 puntos que fluctúa de 0 a 3, donde las puntuaciones de 0 a 1c constituyen compresión de bajo grado, y las puntuaciones de 2 y 3 constituyen compresión de alto grado (fig. 1). El sistema de puntuación fue desarrollado para estandarizar el reporte en la literatura, pero también para examinar de manera crítica los resultados de la SBRT, sobre una base de evaluación consistente del ESCC. Si bien la situación neurológica es una parte importante del algoritmo de la toma de decisión a la hora de planificar los tratamientos, muchos pacientes son sometidos a obtención de imagen de la columna antes de desarrollar déficits neurológicos. Por tanto, la puntuación ESCC proporciona la descripción radiográfica de la ESCC que cubre el rango completo de los tumores sintomáticos y asintomáticos.
Escala ESCC. The Epidural Spinal Cord Compression (ESCC Scale)10. Los grados 0 a 1c corresponden al tumor que compromete al hueso únicamente, o grados variables de compresión del saco tecal sin compresión de la médula espinal. Los grados 2 y 3 se consideran compresión de la médula espinal de alto grado, y se diferencian en función de la obliteración, o no, de la señal del líquido cefalorraquídeo en las imágenes ponderadas en T2.
Fuente: Adaptado de Bilsky MH et al.20. Reproducida con autorización.
La consideración oncológica se basa en la respuesta tumoral citotóxica, duradera y predicha a la radioterapia de haz externo tradicional (cEBRT) o sSRS21,22. En general, la quimioterapia sistémica y los nuevos agentes dirigidos (p. ej., productos biológicos e inhibidores de puntos de control) no son efectivos a la hora de tratar los tumores de la columna ósea, por lo que el control del tumor sigue dependiendo de la respuesta a la radiación. Históricamente, la cEBRT, definida a menudo como 30Gy en 10 fracciones, fue el pilar terapéutico para los tumores de columna vertebral8,23,24. Con la cEBRT, se administran 1-2 haces a un campo de tratamiento, pero los órganos en riesgo (OAR) permanecen dentro del campo de radiación. Por ello, la dosis de radiación queda limitada por la toxicidad de los OAR21. Se seleccionó un esquema de fraccionamiento de la dosis para minimizar la toxicidad de los OAR tales como la médula espinal, los riñones, el intestino y el esófago, pero no fue efectivo para controlar la amplia mayoría de metástasis espinales. Sobre la base de la respuesta terapéutica a cEBRT, los tumores se clasifican como radiorresistentes o radiosensibles. Los tumores de moderada a altamente sensibles a cEBRT incluyen la mayoría de neoplasias hematológicas (es decir, linfoma, mieloma múltiple y plasmacitoma), así como tumores sólidos seleccionados (es decir, carcinomas de mama, próstata, ovario, neuroendocrinos y seminomas)8,25. Sin embargo, muchos tumores sólidos son radiorresistentes a cEBRT incluyendo el carcinoma de células renales (CR), el cáncer de colon, el cáncer de pulmón de células no pequeñas (NSCLC), el cáncer de tiroides, el carcinoma hepatocelular, el melanoma y el sarcoma, con tasas de respuesta de cerca del 30% con control local a un año23–26.
Definir la capacidad de respuesta a la cEBRT es esencial para poder predecir los resultados clínicos. En determinadas series, los respondedores favorables (es decir, aquellos con tumores más radiosensibles) tienen mayor probabilidad de mantener la ambulación o seguir siendo ambulatorios por más tiempo que los pacientes con histologías desfavorables (es decir, aquellos con tumores radiorresistentes) tras el tratamiento de radioterapia25,27,28. Maranzano et al. demostraron prospectivamente que el 67% de los pacientes de cáncer de mama con compresión de la médula espinal epidural metastásica sintomática recuperaban la ambulación, en comparación con el 20% en el carcinoma hepatocelular24. Además, demostraron que el mieloma y las histologías de mama y próstata tenían duraciones de respuesta de 16, 12 y 10 meses, respectivamente. Otros autores encontraron una baja tasa de éxito de solo el 33% en tumores radiorresistentes, en comparación con el 72% en los pacientes con histologías favorables. Además, los pacientes con histologías favorables mostraron también mejoras en términos de fuerza motora, capacidad funcional y puntuaciones del dolor27. Por tanto, los pacientes con tumores radiosensibles pueden ser tratados de manera efectiva con cEBRT, obviando la necesidad de intervención quirúrgica, independientemente del grado de ESCC8,24. Sin embargo, en la práctica, los pacientes con neoplasias de tumores sólidos radiosensibles que son mielopáticos son considerados normalmente para cirugía primaria, ya que el potencial de lograr descompresión inmediata y maximizar la recuperación neurológica con cEBRT es limitado.
La radiocirugía es el «punto de inflexión»La evolución técnica e integración de la radiocirugía estereotáctica de la columna vertebral (sSRS) ha supuesto un cambio de paradigma cierto para el tratamiento de las metástasis de columna vertebral. La implementación segura y efectiva de la sSRS es resultado de los avances técnicos en la inmovilización del paciente no invasiva, los sistemas de administración de radiación ecoguiada de intensidad modulada (IMRT), y la sofisticación del software de planificación29,30. La administración de radiación hipofraccionada en altas dosis (es decir, sSRS) solventa la radiorresistencia observada en la cEBRT, creando en parte más roturas de doble cadena de ADN letales, pero también induciendo un cambio significativo en la vasculatura tumoral mediante la vía de la esfingomielinasa ácida15,31,32. Además, la sSRS se administra normalmente en una o 3 fracciones, acortando el tiempo terapéutico y mejorando el cumplimiento del paciente.
La radiocirugía como terapia definitivaLos datos recientes demuestran que la sSRS supone un beneficio clínico, independientemente de la histología y volumen del tumor, proporcionando respuestas sintomáticas duraderas y altas tasas de control local10,33,34. La sSRS hipofraccionada de alta dosis supera la radiorresistencia observada en muchas neoplasias de tumores sólidos con respecto a cEBRT, haciendo que todos los tumores se conviertan esencialmente en radiosensibles. En los pacientes sin compresión de la médula espinal (ESCC 0-1c), la sSRS puede utilizarse como terapia definitiva, habiendo sustituido ampliamente a la resección en bloque, favorecida por los sistemas de puntuación de Tokuhashi y Tomita, incluso para metástasis solitarias9,35 (fig. 2). Sobre la base de los fantásticos resultados del uso de la sSRS, Bilsky et al., en una revisión en Cochran del SOSG, recomendó encarecidamente que se sometiera a los pacientes con CR sin compresión de la médula espinal (es decir, ESCC de 0 a 1c) a radiocirugía estereotáctica en lugar de resección en bloque17. Dicha transición se basa en una plétora de datos de resultados que demuestran los excelentes efectos de la sSRS en las histologías tradicionalmente radiorresistentes tales como el carcinoma de células renales36–38, el sarcoma39 y el melanoma40. Se han mostrado prospectivamente tasas de control local del 88% en la columna no cervical, independientemente de la histología41. Un análisis retrospectivo multi-institucional de 387 casos tratados con SBRT, reportó un control local del 84% a 2 años. La cohorte incluyó diversas histologías tumorales sólidas, y la dosis terapéutica media fue de 8Gy en 3 fracciones42. Otras series han demostrado conclusiones similares43,44. Yamada et al. describieron una serie de casos de 811 lesiones con ESCC de 0 a 1c tratadas en 657 pacientes con SSRS de fracción única, en los que la dosis fue analizada como variable continua, fluctuando de 18 a 26Gy10. La dosis media que cubrió el 95% del volumen blanco de planificación (PTV D95) fue de 16,44Gy en el grupo de dosis baja, en comparación con 22,40Gy en el grupo de dosis alta. Las tasas de fracaso local para los grupos de dosis alta y baja fueron del 5 frente al 0,41% a 12 meses, del 15 frente al 1,6% a 24 meses, y del 20 frente al 2,1% a 48 meses, respectivamente. En este estudio, el 82% de los tumores fue tradicionalmente radiorresistente, aunque se encontró que las respuestas tumorales eran independientes de la histología del tumor y de la radiación previa para las cohortes de dosis altas. Por ello, la SSRS supone un beneficio clínico, independientemente de la histología, proporcionando una respuesta sintomática duradera y unas tasas altas de control local, aunque dichas respuestas parecen depender de las dosis10,33,34.
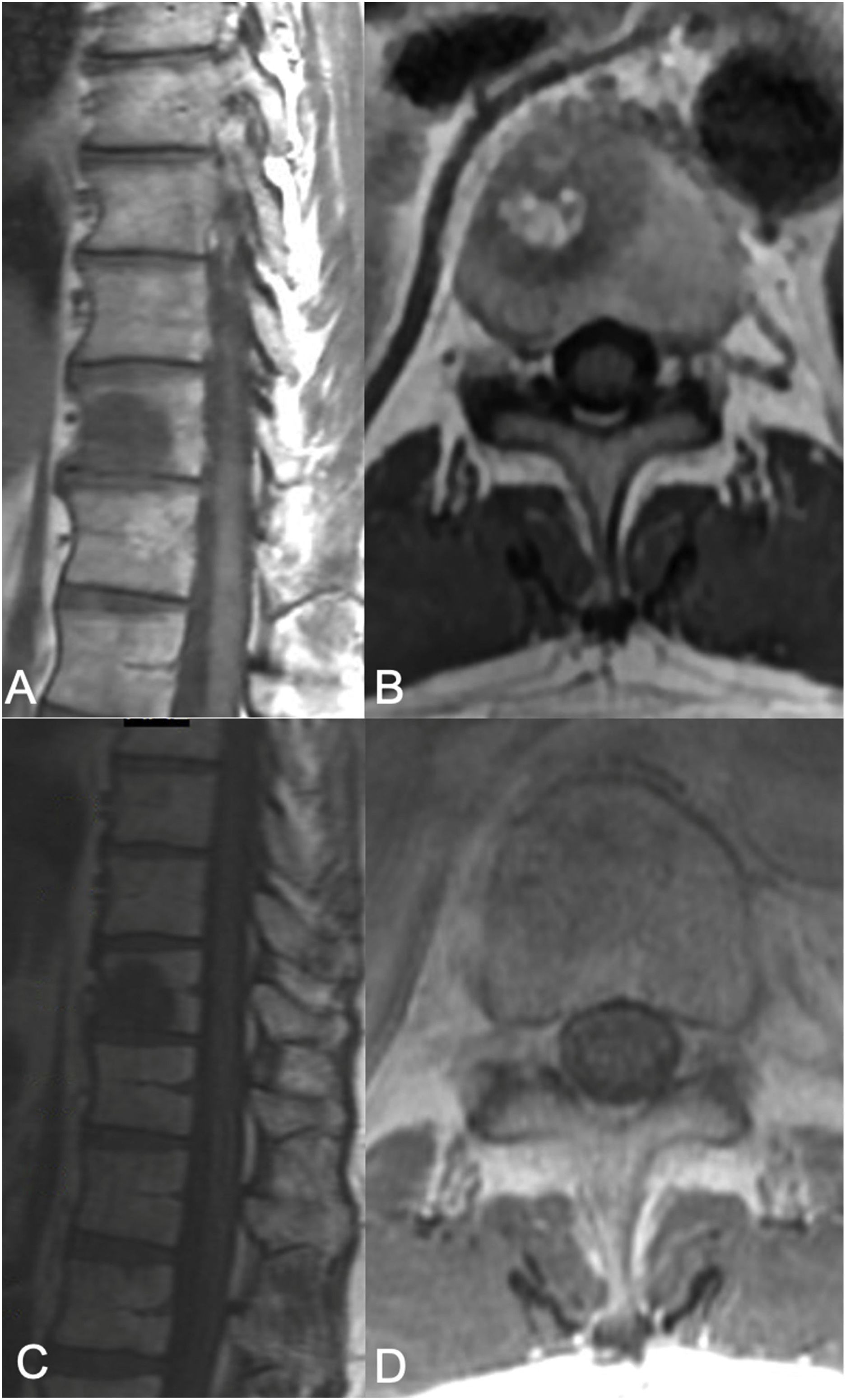
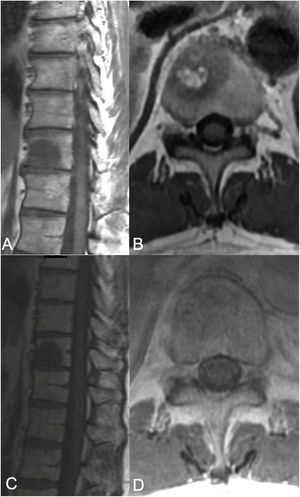
Terapia sSRS. Mujer de 68 años de edad, sin historia previa de cáncer, que acudió con dolor de espalda, encontrándose que presentaba una lesión en T8 y una lesión en el pulmón. Debido a su presentación sintomática, fue sometida a cifoplastia junto con biopsia de T8, que reflejó adenocarcinoma metastásico consistente con adenocarcinoma de pulmón. No se observó extensión tumoral epidural (ESCC grado 0), pero se advirtió extensión paraespinal izquierda. Junto con el tratamiento sistémico, la paciente fue sometida a tratamiento SSRS de 24Gy en fracción terapéutica única. A) RM axial con administración de contraste en T8, que muestra la lesión del cuerpo vertebral con extensión a los elementos posteriores izquierdos con un componente paraespinal. No se observó compresión de la médula epidural. B) RM de seguimiento a los 13 meses que reflejó buen control tumoral local. C) Distribución de color del plan de radiocirugía. La dosis mínima en la distribución de color (azul oscuro) se establece en 1920cGy, o el 80%.
Se han establecido límites de dosis para los grandes OAR45,46. El equilibrio entre subdosificar los márgenes tumorales, originando la progresión del tumor, frente a sobredosificar y dañar los OAR, es extremadamente delicado. Afortunadamente, la toxicidad de alto grado tras la sSRS se produce raramente, siendo leves muchas de las complicaciones observadas, incluyendo esofagitis, mucositis, disfagia, diarrea, parestesias, laringitis transitoria y radiculitis41,47–52. Se han descrito fracturas por compresión vertebral (FCV) tras la SSRS en hasta un 40% de los tratamientos, en comparación con menos del 5% de riesgo tras la cEBRT53. En un análisis de seguimiento del mismo grupo, la tasa de fractura del 40% captura todas las fracturas radiográficas, pero la tasa de fractura sintomática que requiere intervención fue de solo el 7% durante el seguimiento a 5 años54. Un análisis multi-institucional encontró que las FCV tras la SSRS son más probables de producirse tras el tratamiento con dosis altas55. Saghal et al. sugirieron que debía existir cautela en los tratamientos con ≥20Gy por fracción, y en particular a los pacientes de alto riesgo56. Los factores de riesgo identificados son la edad avanzada, la lesión lítica, la mala alineación vertebral o la presencia de FCV preexistente. Como resultado, algunos profesionales defienden la cifoplastia previa al tratamiento en pacientes seleccionados53,57,58. Todavía debe resolverse una controversia continua relativa al riesgo de fractura dependiente de la dosis, pero las tasas de control demostradas a dosis mayores, junto con la capacidad de estabilización de muchas fracturas con bajo riesgo de morbilidad asociado al aumento de cemento percutáneo pueden justificar una dosificación más agresiva.
La preocupación más significativa con respecto a la toxicidad de la sSRS es la mielitis inducida por la radiación (es decir, lesión de la médula espinal). Gibbs et al. reportaron resultados de una revisión multi-institucional de sSRS, en la que el 0,6% (6/1075) desarrolló mielitis59. De igual modo, el MSKCC revisó una serie de 476 pacientes sometidos a sSRS, donde la dosis para la médula espinal se limitó a Dmáx de 14Gy, reportando un riesgo del 0,42% de lesión de la médula espinal reversible10. Sin embargo, este límite de la médula espinal impide el tratamiento efectivo de los tumores con ESCC de alto grado, incluso en ausencia de mielopatía o síndrome de cauda equina. Michael Lovelock et al. realizaron un análisis del fracaso de la dosis en el que encontraron que todos los pacientes con progresión tumoral tras la sSRS habían recibido menos de 15Gy con respecto a un pequeño porcentaje de volumen blanco de planificación21. Aceptando un Dmáx para médula de 14Gy, con un 10% de descenso de dosis por mm, la consecuencia sería, bien subdosificar en el margen de la médula espinal con alto riesgo de progresión del tumor epidural y ESCC progresiva o, por el contrario, sobredosificar la médula espinal con resultado de mielitis. En 2010, Ryu et al. revisaron una serie de 62 pacientes que presentaron tumores ESCC de alto grado tratados con una dosis media de fracción simple de 16Gy, reportando un riesgo del 20% de progresión neurológica60, con casi un 50% de pérdida durante el seguimiento. Sin embargo, el uso de radiación hipofraccionada a dosis altas puede mejorar la ventana terapéutica y permitir el tratamiento seguro y efectivo de los ESCC de mayor grado. Rothrock et al. reportaron recientemente resultados en 31 tumores presentados con ESCC de grado 2 tratados con dosis de radiación hipofraccionada (es decir, de 24 a 50Gy en 3 o 5 fracciones)61. La incidencia a uno y 2 años de fracaso locorregional en su estudio fue del 10,4 y 22%, respectivamente, y la incidencia de cirugía de rescate del mismo nivel a 1 y 2 años fue del 6,8 y 14,5%, respectivamente. Las fracturas radiográficas relacionadas con el tratamiento se produjeron en el 12% de los pacientes. Este estudio sugiere que el tratamiento de ESCC 2 metastásico de alto grado es posible, aunque el progreso en este ámbito ha sido incremental hasta la fecha. La compresión ESCC de grado 3, y aquellas que se presentan con mielopatía en neoplasias de tumores sólidos siguen requiriendo intervención quirúrgica.
Indicaciones neurológicas/oncológicas: ESCC de alto grado de tumores resistentes a radioterapiaDada la pobre respuesta observada tras la cEBRT, y la incapacidad para administrar una dosis de sSRS citotóxica dentro de los límites de la médula espinal, el grupo SOSG utilizó una revisión de Cochrane para realizar una sólida recomendación de descompresión quirúrgica y estabilización tras la radioterapia para los pacientes con ESCC de alto grado, con tumores radiorresistentes9. Esta recomendación se basó ampliamente en el estudio histórico realizado por Patchell et al., que reportaron resultados de un ensayo aleatorizado prospectivo comparando la cEBRT y la cirugía tras cEBRT para los pacientes que presentaban compresión de médula espinal de alto grado, debido a neoplasias de tumores sólidos radiorresistentes62. De manera excelente, se excluyeron las neoplasias hematológicas radiosensibles y los tumores de células germinales. En cada variable del resultado, el brazo quirúrgico demostró mejores resultados, en comparación con la cohorte de cEBRT, incluyendo el mantenimiento o la recuperación de la ambulación y la función intestinal y vesical, el menor requisito de narcóticos, y la mejora de la supervivencia. Si bien los resultados neurológicos fueron mejores con la cirugía, también quedó claro que la cEBRT no aportó control tumoral duradero. Klekamp y Samii revisaron una serie de 101 pacientes sometidos a resección parcial o completa agresiva, seguida de cEBRT adyuvante63. La tasa de recidiva local fue del 70% a un año y del 96% a 4 años. Los factores predictivos de recidiva más significativos fueron la situación no ambulatoria, la totalidad de la resección y la histología tumoral. Dichas tasas de alta recurrencia son reflejo de la no efectividad de la cEBRT con respecto a la superación de las histologías tumorales radiorresistentes, aún después de la cirugía citorreductora.
La presencia de mielopatía o síndrome de cauda equina debido a ESCC cambia el paradigma de la toma de decisión. Mientras que en ausencia de déficits neurológicos algunos pacientes con ESCC de alto grado pueden ser candidatos a radioterapia únicamente, la presencia de déficits incrementa la probabilidad de que la descompresión quirúrgica de urgente a emergente sea necesaria para la función de preservación o recuperación, ya que estos pacientes pueden experimentar descompensación neurológica rápida. Además, si bien los tumores relativamente radiosensibles, tales como los carcinomas de mama y próstata, puedan ser tratados con cEBRT para lograr el control tumoral duradero en el contexto de la ESCC de alto grado, dichos tumores sólidos pueden no responder con normalidad y prontitud suficientes para lograr la recuperación neurológica en el contexto de mielopatía o síndrome de cauda equina. Puede apreciarse una respuesta tumoral apoptótica en neoplasias hematológicas exquisitamente radiosensibles (p. ej., mieloma múltiple y linfoma), causando la descompresión bastante inmediata de la médula espinal y derivando en una alta probabilidad de recuperación neurológica. Sin embargo, este fenómeno no se aprecia con las neoplasias de tumores sólidos radiosensibles, ya que a menudo se necesitan meses para observar una respuesta radiográfica, aún con la enfermedad bien controlada.
El segundo escenario que debe abordarse específicamente es un paciente que presenta mielopatía, pero sin antecedentes de cáncer, y por tanto sin histología tumoral conocida. Un tumor desconocido podría ser cualquier cosa: desde una neoplasia hematológica radiosensible a un tumor sólido radiorresistente, incluyendo los tumores óseos primarios tales como el cordoma. Establecer un diagnóstico definitivo en un paciente que acude con una urgencia neurológica es a menudo muy difícil. Recientemente, realizamos una biopsia a un paciente neurológicamente intacto con un tumor ESCC de grado 3, que se apreció radiográfica e histológicamente en la palpación preparatoria de la biopsia, siendo consistente con linfoma. Cuarenta y ocho horas después de la prueba, la citometría de flujo determinó definitivamente que el tumor no era un linfoma, y 10 días después, la enfermedad final confirmó que se trataba de un tumor neuroblástico radiorresistente. El paciente no reflejó resolución radiográfica de la compresión de médula espinal durante el seguimiento a un mes y, por tanto, no se produjo descompresión efectiva, aunque el paciente permaneció en la fase neurológica basal.
Otra cuestión surge cuando un tumor de nuevo diagnóstico tiene una histología consistente con un tumor óseo primario, tal como cordoma, que tradicionalmente es considerado para su resección en bloque, para lograr márgenes amplios. Los cordomas que derivan en ESCC de alto grado y mielopatía no son candidatos por definición a resección en bloque curativa. Sin embargo, el cordoma puede ser tratado de manera efectiva con resección intralesional segura, seguida de sSRS. Jin et al. demostraron tasas de control local del 90% a 5 años para cordomas tratados con 24Gy de fracción única, utilizando sSRS como adyuvante postoperatorio tras una resección intralesional y neoadyuvante, seguida de resección en bloque, o radiación definitiva sin resección64. En nuestra práctica, los pacientes con mielopatía de etiología primaria desconocida son considerados radiorresistentes, a menos que se pruebe lo contrario, siendo descomprimidos quirúrgicamente de manera urgente o emergente para garantizar la mejor opción de recuperación neurológica. Este paradigma de tratamiento funciona, porque muchos tumores radiorresistentes, incluido el cordoma, pueden tratarse de manera efectiva con sSRS postoperatoria para lograr un control tumoral duradero.
Terapia híbrida: cirugía de separación y SSRS postoperatoriaSi bien el estudio realizado por Patchell aporta una hoja de ruta para la cirugía descompresiva de la ESCC de alto grado con tumores radiorresistentes, la sSRS como adyuvante postoperatorio ha cambiado los objetivos de la cirugía y, por tanto, el enfoque quirúrgico adoptado. En los últimos años, hemos visto la transición desde el tratamiento con cirugías citorreductoras agresivas, tales como la espondilectomía en bloque, o la resección bruta total, a la confianza en la sSRS para proporcionar el objetivo oncológico del control tumoral9. La terapia híbrida hace referencia a la combinación de la cirugía de separación, seguida de sSRS14. El término «cirugía de separación» describe un enfoque posterolateral que permite la estabilización y la descompresión circunferencial del saco tecal y las raíces nerviosas. La descompresión de la médula espinal queda garantizada mediante la resección del ligamento longitudinal posterior, con la reconstitución subsiguiente del saco tecal. Para administrar una dosis de radiación adecuada con seguridad, los pacientes con ESCC de alto grado causada por los tumores radiorresistentes son sometidos a cirugía de separación14,18,65. Debido a la naturaleza altamente conformada de la sSRS, no se necesita resecar grandes masas paraespinales y tumores del cuerpo vertebral, a fin de administrar dosis ablativas del volumen del tumor y lograr un control tumoral duradero. La importancia de lograr una descompresión quirúrgica adecuada para reconstituir el saco ha sido resaltada por Al-Omair et al., quienes reflejaron que los pacientes postoperatorios con compresión continua de la médula espinal (es decir, ESCC residual de grados 2 o 3) tenían un riesgo considerablemente mayor de recidiva local tras la SSRS postoperatoria, en comparación con los pacientes con separación suficiente entre el tumor y la médula espinal66.
En una revisión retrospectiva de 186 pacientes, Laufer et al. encontraron que la sSRS postoperatoria adyuvante tras una cirugía de separación es segura y efectiva para lograr el control tumoral local duradero18. En esta serie, los pacientes que recibieron sSRS hipofraccionada de alta dosis (es decir 24-30Gy en 3 fracciones) mostraron unas tasas de progresión local a un año inferiores al 5%. En los pacientes que recibieron sSRS de fracción única (es decir, 24Gy), la tasa de progresión local fue inferior al 10%. No hubo impacto de histología tumoral radiorresistente previa a la radiación o el grado de extensión epidural preoperatoria en las tasas de recidiva, no sufriendo ningún paciente ninguna complicación neurológica; sin embargo, debe resaltarse que estos resultados fueron superiores a los resultados de la sSRS hipofraccionada de dosis baja (es decir, 30Gy en 5 fracciones). De igual modo, Molding et al. reportaron un riesgo de fracaso local a un año de solo el 6,3% utilizando dosis altas (1.824Gy) de sSRS de fracción única tras la cirugía de separación65, y Rock et al. reportaron una tasa de control del 92% en los pacientes tratados con radiocirugía tras los procedimientos quirúrgicos abiertos67 (fig. 3). Más recientemente, Hussain et al. reportaron terapia híbrida para CR, utilizando las mismas estrategias de dosis, con una dosis postoperatoria media de 27Gy en 3 fracciones (es decir, sSRS hipofraccionada de dosis alta)14. Las incidencias acumuladas de recidiva a uno y 2 años fueron del 4,6 y 8,2%, respectivamente. En general, el 90% de los pacientes siguieron siendo ambulatorios, con ECOG de 0 a 2 a durante el seguimiento a un año. De igual modo, Chakravarthy et al. reportaron terapia híbrida para carcinoma de pulmón de células no pequeñas en 103 pacientes, con una dosis postoperatoria media de 27Gy en 3 fracciones68. En su serie, la incidencia acumulada de recidiva a 2 años fue del 5,4%. Cabe destacar que la mutación de EGFR en el tumor metastásico supuso una ventaja del 50% en cuanto a supervivencia en aquellos pacientes no previamente tratados con un inhibidor de EGFR.
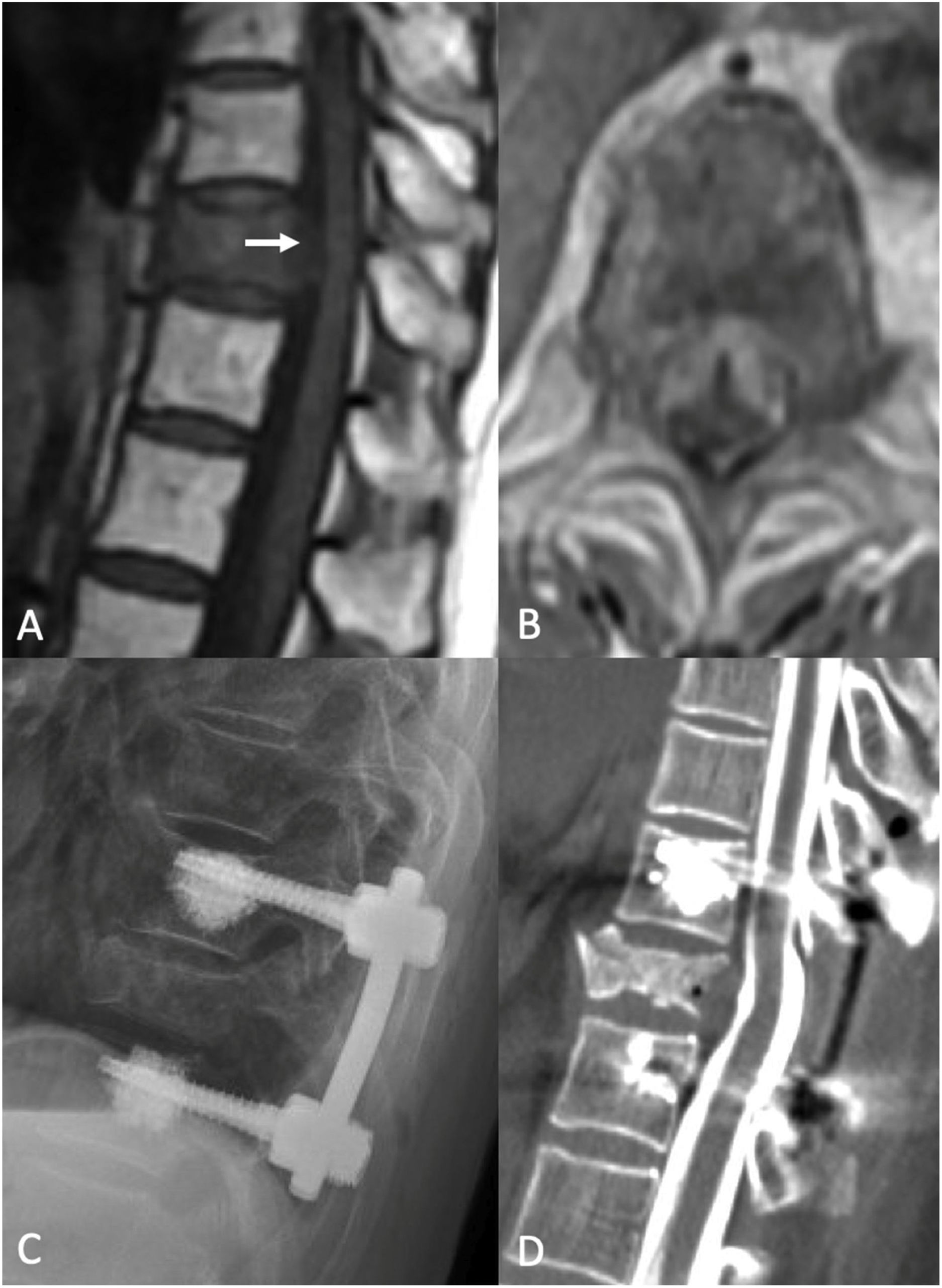
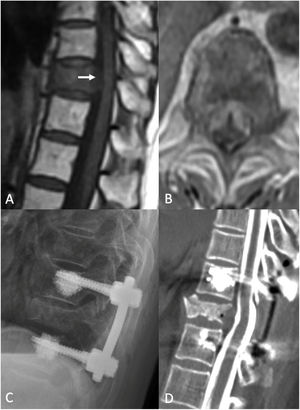
Cirugía de separación. Mujer de 83 años de edad con historia de cáncer de pulmón de células no pequeñas (NSCLC). Se le realizó PET/TC rutinario, que reflejó fractura patológica de T10 y lesión ávida de PET con erosión del córtex posterior del cuerpo vertebral, sugerente de compromiso del canal espinal. La IRM reflejó compresión de la médula espinal de alto grado (ESCC 3) en T10. Estaba neurológicamente intacta cuando acudió, con leve dolor de espalda crónico. Debido a la compresión de la médula de alto grado, con tumor radiorresistente, fue sometida a cirugía de separación tras sSRS. A) IRM sagital sin contraste sagital en T1 preoperatoria. Obsérvese la compresión en T10 (flecha blanca). B) IRM axial preoperatoria con administración de contraste, demostrativa de compresión ESCC3. C) Radiografía postoperatoria que refleja un constructo que se extiende de un nivel por encima a un nivel por debajo del nivel índice, con aumento de cemento en los tornillos pediculares fenestrados. D) Mielograma TC postoperatorio que muestra la reconstitución del saco tecal en el nivel índice.
La cirugía de separación requiere a menudo descompresión ventral del saco tecal. En la columna cervical y torácica, el acceso al espacio epidural ventral desde el abordaje posterolateral requiere resección pedicular, mientras que en la columna lumbar la facetectomía medial puede ayudar a lograr dicho acceso14,16. Históricamente, la pérdida de estabilidad de la columna que acompaña a las resecciones pediculares y las facetectomías mediales se manejó con fijación posterior del segmento largo, a fin de distribuir la carga soportada por la instrumentación y reducir el riesgo de fracaso del hardware —en particular la retención del tornillo— debido a la mala calidad ósea del paciente. Dichas cirugías del segmento largo se situaron normalmente a un mínimo de 2 niveles por encima y 2 niveles por debajo del nivel índice, y estuvieron asociadas a una hemorragia significativa y a un incremento de los tiempos quirúrgicos, contribuyendo ambos factores a la morbilidad del paciente. Utilizando esta estrategia, en un análisis de 318 pacientes sometidos a cirugía de separación por neoplasias sólidas, el 2,8% experimentó fracaso del hardware16.
El avance tecnológico de los tornillos fenestrados ha permitido la instilación de polimetacrilato de metilo (PMMA) a través de las fenestraciones de los tornillos, y dentro del cuerpo vertebral, incrementando por tanto la fuerza de retención del tornillo69–72. Este incremento de la fuerza de retención del tornillo permitió la consideración de constructos posteriores más cortos para estabilización de la columna73–75. Ello nos ha permitido acortar los constructos a un nivel único por encima y debajo del nivel índice. Los tornillos aumentados con PMMA solventan la osteoporosis y la progresión de la fractura de nivel adyacente. En una serie de 44 pacientes sometidos a cirugía de separación reconstruida con tornillos aumentados con PMMA de único nivel adyacente, la tasa de fracaso de la fijación, que requirió reintervención, fue del 2,2%75. De forma preliminar, dichos constructos más cortos y aumentados con PMMA no parecen estar asociados a un incremento del riesgo de fracaso del hardware, aunque son necesarios más estudios.
Desde un punto radiográfico, los implantes quirúrgicos están también diseñados para mejorar la calidad de la imagen postoperatoria, a fin de poder evaluar mejor la recidiva tumoral local. El poliéter éter cetona (PEEK) y el PEEK reforzado con fibra de carbono son materiales actualmente disponibles, utilizados para los sistemas de tornillo-vástago pedicular y las jaulas de reemplazo del cuerpo vertebral. Sus propiedades radiolucentes generan imagen postoperatoria con reducción significativa del artefacto comúnmente visto con constructos con base de titanio. El módulo de elasticidad para PEEK es similar al del hueso, disminuyendo el riesgo de subsidencia a la vez que aporta una fuerza similar a la de los constructos de titanio76.
En caso de que fuera necesario soportar o reconstruir la columna anterior, el cemento óseo de PMMA puede crear soportes y constructos adaptados al paciente77. Los informes preliminares demuestran la seguridad y la eficacia de la radiación, utilizando tanto materiales PEEK78 como PMMA79, haciendo que estos sean adecuados para su uso en la población oncológica. La reconstrucción con PEEK es particularmente atractiva, debido a sus beneficios relacionados con la planificación de radioterapias con haz de protones, que van adquiriendo un interés incrementado, aún en el campo de los tumores metastásicos.
Tiempo de radiación postoperatoriaEs sabido que la radioterapia altera la reparación tisular de la herida a través de múltiples mecanismos, y que las complicaciones de la herida quirúrgica tras la radioterapia siguen siendo una complicación mayor80,81. Keam et al. evaluaron las tasas de complicaciones de la herida ocurridas en pacientes que recibieron cEBRT, en comparación con la sSRS antes de la realización de cirugía de columna, y no encontraron diferencias significativas82. De manera importante, ellos concluyeron que la sSRS preoperatoria está asociada a unas tasas de morbilidad debida a la herida clínicamente aceptables.
Los cirujanos tienden a esperar diversas semanas antes de operar tras la cEBRT. Una revisión sistemática subrayó la falta de reporte de datos uniformes, aunque sugirió una semana de intervalo entre la cirugía y la sSRS, sobre la base de modelos animales y estudios limitados en humanos83. Keam et al. reportaron una tasa de dehiscencia/infección de la herida en aquellos pacientes sometidos a radiación tras la cirugía del 16% con cEBRT frente al 6% con sSRS82. Dicho hallazgo es consistente con la noción de que la sSRS evita grandemente el corredor operativo, reduciendo por tanto las tasas de complicación de la herida.
Inestabilidad de la columna NOMSEn NOMS, la inestabilidad mecánica es una consideración separada de las evaluaciones neurológica y oncológica, ya que la radiación no juega un papel en el tratamiento de las fracturas patológicas. Utilizando un enfoque de Delphi modificado, el SOSG definió, codificó y validó la puntuación Spine Instability Neoplastic Score (SINS) para evaluar las fracturas relacionadas con el tumor84. El sistema ponderado combina la presencia de dolor mecánico y los 5 criterios radiográficos, que incluyen localización del tumor, calidad ósea, fractura del cuerpo vertebral, compromiso del elemento posterior y grado de deformidad. La puntuación SINS ha sido esencialmente importante para estandarizar la evaluación y el tratamiento de las fracturas patológicas. Las altas puntuaciones SINS (de 13 a 18) predicen fiablemente la necesidad de estabilización quirúrgica, mientras que las bajas puntuaciones SINS (de 0 a 6) se consideran estables. Los tumores con SINS intermedia (de 7 a 12) necesitan evaluación adicional, basándose la necesidad de intervención quirúrgica en la discreción y experiencia del cirujano de columna84. La inestabilidad mecánica puede abordarse con órtesis externa, pero los pacientes de cáncer tienen restricciones físicas que limitan la tolerancia a la órtesis: por tanto, se trata a menudo a los pacientes con aumento de cemento percutáneo, bien cifoplastia o vertebroplastia, tornillos pediculares percutáneos, o cirugía abierta.
Los procedimientos de aumento percutáneo de PMMA mínimamente invasivos fueron desarrollados a principios del año 2000, para estabilizar el estallido torácico y lumbar y las fracturas por compresión. Las técnicas más comúnmente utilizadas, vertebroplastia y cifoplastia, son controvertidas en cuanto a alivio del dolor en el tratamiento de las fracturas osteoporóticas. Dos ensayos prospectivos demostraron la no diferencia entre el aumento percutáneo de cemento óseo y el mejor manejo médico85,86. Por contra, en 2011, Berenson et al. reportaron resultados del estudio CAFE, un ensayo aleatorizado prospectivo que comparó cifoplastia y terapia no quirúrgica para fracturas de compresión vertebral patológica87. Los pacientes sometidos a cifoplastia mostraron reducción significativa del dolor, mejora de la calidad de vida y recuperación funcional a un mes, que se mantuvo durante el seguimiento a un año.
Un análisis del fracaso del aumento percutáneo de cemento óseo autónomo demostró que los pacientes con FCV y enfermedad del elemento posterior adicional, no experimentaron mejora significativa del dolor. Este problema llevó a realizar estrategia de cifoplastia al nivel índice de la fractura y colocación percutánea de tornillos pediculares con aumento de cemento, para aportar una banda de tensión posterior adicional. En una revisión de 44 pacientes, Moussazadeh et al. reportaron resultados que demostraron que todos los pacientes con dolor severo experimentaron dolor mínimo o nulo postoperatoriamente73. Este constructo fue duradero, con excepción de una retención de tornillo asintomática y una fractura del cuerpo vertebral en el nivel adyacente.
Enfermedad sistémica NOMLa consideración final en el manejo de las metástasis de columna es la evaluación de la enfermedad sistémica y las comorbilidades médicas. Dichos factores tienen un impacto directo en la capacidad de los pacientes para tolerar un tratamiento propuesto, y determinar también si la intervención propuesta es razonable dentro del contexto de su enfermedad. Por tanto, aun cuando un paciente tiene una indicación firme de cirugía, basada en las consideraciones NOM, puede ser excluido sobre la base de su incapacidad para tolerar la cirugía, o incluso la radiación, desde un punto de vista médico o de atención del cáncer. Sin embargo, debe reconocerse que muchas decisiones terapéuticas se realizan de manera urgente o emergente, creando situaciones en las que dichas decisiones deben tomarse con información limitada y rutina médica incompleta. En la enfermedad metastásica, la supervivencia esperada se utiliza a menudo como un gran determinante para el tipo de tratamiento ofrecido. La supervivencia se ha ampliado para casi cualquier histología tumoral metastásica, debido al desarrollo e integración de los productos biológicos y los inhibidores de puntos de control. Rothrock et al. demostraron el impacto de los nuevos agentes sistémicos en una revisión de datos quirúrgicos sobre columna metastásica durante 20 años en MSKCC88. Su trabajo demostró un 20% de mejora en términos de supervivencia durante dicho periodo de tiempo. Se han desarrollado y validado nuevos modelos predictivos de la supervivencia en la era de los productos biológicos e inhibidores de puntos de control, tales como el nomograma SORG89 y la puntuación «New England Metastatic Spine Score»90,91. Massad et al. demostraron que dichos modelos eran mejores para predecir la supervivencia a un año, en comparación con los sistemas de puntuación tradicionales tales como las puntuaciones Tomita, Tokuhashi revisada y Bauer revisada92. Además, Massad et al. desarrollaron algoritmos de aprendizaje automático (machine learning) para evaluar la fragilidad, la mortalidad y las complicaciones relacionadas con la cirugía de tumores de columna metastásicos93. Este análisis demostró que los pacientes con sarcopenia y adiposidad visceral y subcutánea inferior tenían resultados postoperatorios significativamente peores y una supervivencia más limitada.
Aunque parece algo contradictorio que la radiación local pueda repercutir en el control de la enfermedad sistémica, la integración de la sSRS en el tratamiento de los tumores oligometastásicos (es decir, de 1 a 5 metástasis) ha demostrado en muchos estudios actuales que mejora la supervivencia12,13,94,95. Palma et al. reportaron resultados del ensayo SABR-COMET, un ensayo aleatorizado de fase 2 que evaluaba la supervivencia general en pacientes con un tumor primario controlado, que fueron tratados con un estándar de cuidado (SOC) frente a SOC más radioterapia ablativa estereotáctica (SABR) para 1-5 metástasis95. La tasa de supervivencia general a 5 años fue del 17,7% en los pacientes que recibieron SOC, frente al 42,3% en aquellos que recibieron SABR adicional (p=0,006). Zelefsky et al. reportaron resultados de un ensayo aleatorizado de fase 3 que examinó la utilidad de la radiación de fracción simple de altas dosis (24Gy), en comparación con la radiación hipofraccionada de altas dosis (9Gy×3 fracciones) en el tratamiento de la enfermedad ósea oligometastásica13. La radiación de fracción simple demostró tasas inferiores de recidiva local en comparación con el régimen hipofraccionado, con tasas del 2,7 y 5,8% a 2 y 3 años, frente al 9,1 y 22%, respectivamente (p=0,0048). También se observó una diferencia significativa en la incidencia acumulada de progresión metastásica a distancia a 2 y 3 años, que fue del 5,3% en la cohorte de fracción única, y del 10,7 y 22,5% en la cohorte hipofraccionada, respectivamente (p=0,010).
ConclusionesA pesar de que los grandes avances en cuanto a radiación y de tipo médico en el cuidado del cáncer, la cirugía sigue jugando un gran papel en el paradigma de tratamiento para los pacientes con metástasis de columna vertebral. La cirugía es particularmente importante para aquellos pacientes con ESCC de alto grado que necesitan separación del tumor epidural de la médula espinal, pero también para la estabilización espinal, según la facilitación de SINS. Las técnicas MAS y los implantes y técnicas mejorados ofrecen una mejor morbilidad relacionada con la cirugía, y una rápida continuación de las terapias sistémicas. La integración de la sSRS ha revolucionado el tratamiento, solventando la radiorresistencia y aportando un control tumoral local duradero. Las terapias dirigidas están redefiniendo la atención del cáncer, aunque debe determinarse completamente la precisión de su papel para los tumores de columna.
El manejo óptimo de las metástasis de columna vertebral requiere el esfuerzo del equipo multidisciplinario. El marco NOMS aporta un marco de decisión en el que la innovación médica puede incorporarse fácilmente, en aras de lograr una atención óptima al paciente.
Nivel de evidenciaNivel de evidencia ii.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.