El cáncer es en España la segunda causa de muerte en mujeres (22%) y la primera en varones (31%). En este capítulo describimos los tipos más frecuentes de metástasis raquídeas, sus localizaciones más habituales dentro de la columna vertebral, así como su comportamiento clínico. Analizamos también los cuadros neurológicos más comúnmente asociados a las metástasis de columna: compresión radicular, compresión medular, cauda equina y afectación medular.
Cancer is in Spain the second cause of death in women (22%) and the first in men (31%). In this chapter we describe the most frequent types of spinal metastases, their most frequent locations within the spine, as well as their clinical behavior. We also analyze the neurological conditions most frequently associated with spinal metastases: root compression, spinal cord compression, cauda equina, and spinal cord involvement.
El cáncer es en España la segunda causa de muerte en mujeres (22%) y la primera en varones (31%). El cáncer de pulmón, mama, próstata y colon son los más frecuentes. En la mayoría de los casos, la muerte ocurre como resultado de metástasis y complicaciones más que por el tumor primario.
Las localizaciones más frecuentes de las metástasis son el hígado, el pulmón y el hueso, por ese orden1. El 70-80% de los tumores malignos originarán metástasis óseas; de ellas, el 70% serán en la columna vertebral2. Dentro del raquis, las localizaciones más frecuentes son: torácicas (60-80%), lumbares (15-30%) y cervicales (<10%)3. Se estima que casi la mitad de los pacientes con metástasis espinal tendrán metástasis en múltiples niveles de la columna4. Las metástasis espinales pueden localizarse a nivel intradural (intramedulares o extramedulares) o extradural. Aproximadamente el 95% son extradurales5.
En 2013 realizamos una revisión de 279 casos de metástasis atendidos en nuestro Centro entre 2006 y 2010. La edad media fue de 65 años, con un 60% de varones. En el momento del diagnóstico, el 55,6% realizaban vida normal (Karnofsky>80), el 33,7% requerían asistencia (Karnofsky 50-70) y el 10,7% estaban encamados (Karnofsky 10-40). Un 80,4% de los casos tenían lesiones óseas extrarraquídeas y se presentó afectación de órganos internos en el 58,7%. Los primarios más frecuentes fueron: pulmón 26,1% (n=73), mama 21,8% (n=61) y próstata 10,7% (n=30). Hubo lesión medular en el 16% (30 incompletas y 17 completas). Un 10,2% empezaron con fractura patológica, presentando el 82,8% dolor como síntoma inicial. Se operaron 30 pacientes (10,7%).
FisiopatologíaDiseminación metastásicaLas células cancerosas se diseminan a la columna a través de varios mecanismos: a través del sistema arterial, el plexo venoso de Batson, el líquido cefalorraquídeo (LCR) y por continuidad anatómica directa desde una neoplasia cercana a la columna. La forma más relevante de diseminación al hueso es a través del sistema circulatorio, particularmente el sistema venoso6. Existe una comunicación entre las venas de la mama y el plexo de Batson en la región torácica y, por lo tanto, los cánceres de mama a menudo hacen metástasis en las vértebras torácicas. Los pulmones drenan su sangre a través de las venas pulmonares hacia el lado izquierdo del corazón, que puede diseminar células cancerígenas a todo el cuerpo7. La próstata drena a través del plexo pélvico hacia la región lumbar, por lo que los cánceres de próstata hacen metástasis en las vértebras lumbosacras7. El cáncer de colon hace metástasis primero en el hígado y los pulmones a través del sistema portal y de la cava, respectivamente7. En la mayoría de los casos, el cuerpo vertebral posterior es el sitio inicial de afectación, diseminándose posteriormente a los pedículos.
Mecanismos celularesA nivel celular y molecular, el desarrollo de una metástasis ósea es un proceso complejo. Las células neoplásicas primero deben diseminarse en el sitio primario a expensas de las células preexistentes y el estroma del órgano de origen y los tejidos que rodean a este; luego se desprenden de él por la reducción de las moléculas de adhesión de unas células con otras; posteriormente alcanzan los vasos sanguíneos y penetran en ellos atravesando la lámina y el endotelio, y a continuación migran con el torrente sanguíneo. Todos estos procesos dependen de la expresión aumentada o disminuida de diferentes proteínas, fundamentalmente integrinas, cadherinas, inmunoglobulinas y selectinas8. La médula ósea, sobre todo del esqueleto axial, reúne las condiciones de microcirculación que enlentece el flujo sanguíneo, espacio disponible, expresión de receptores, capacidad de neoangiogénesis, ideal para el asiento de estas células neoplásicas, etc.9.
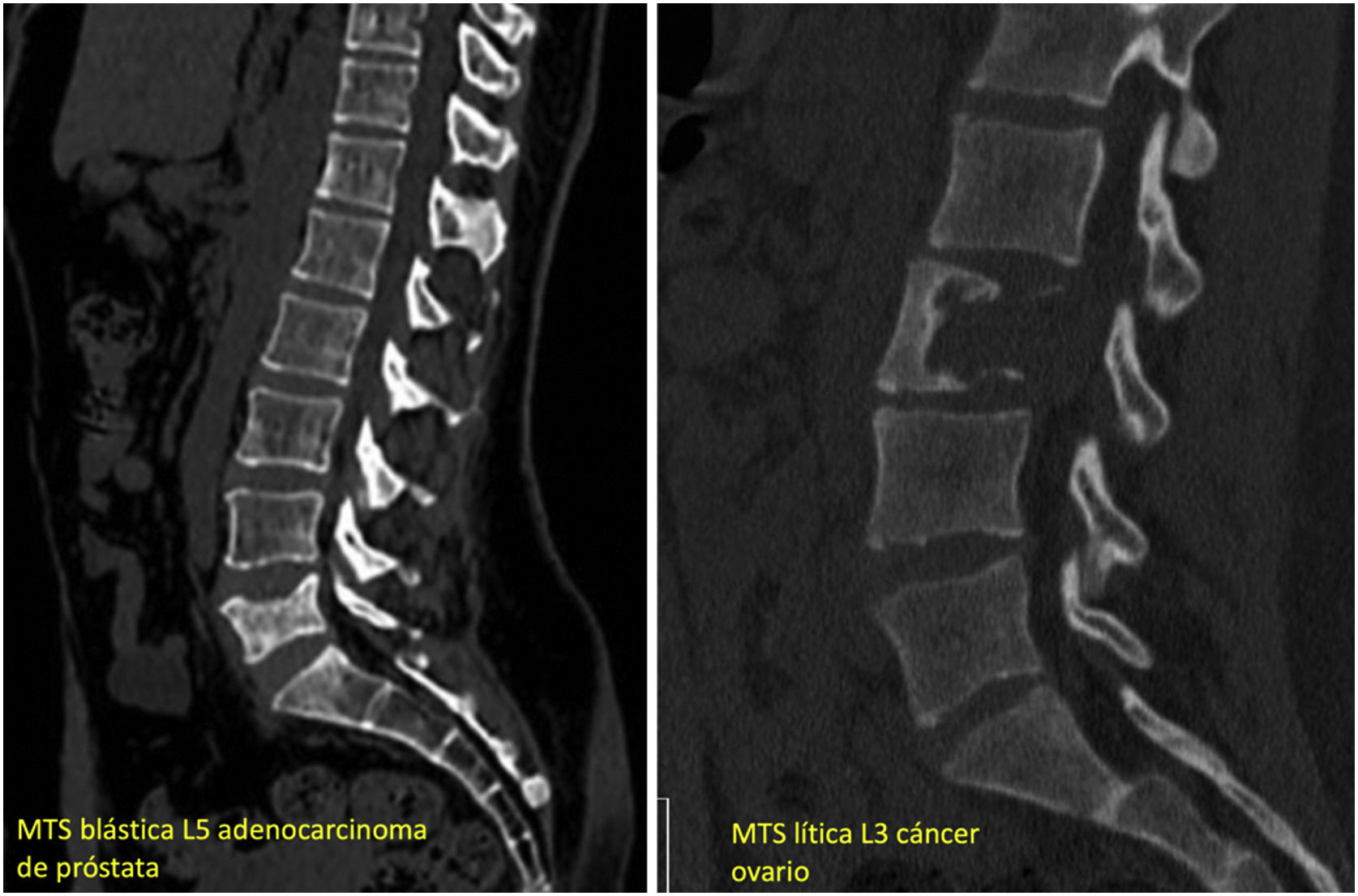
En individuos normales, existe un proceso continuo y equilibrado de reabsorción ósea llevado por los osteoclastos, y de formación ósea realizado por los osteoblastos. En las células cancerosas, este equilibrio se pierde y se crean lesiones en el hueso de carácter líticas, blásticas o mixtas10. Cuando las células metastásicas invaden el hueso, producen factores de crecimiento que estimulan directamente la actividad osteoclástica y/o la actividad osteoblástica, alterando el equilibrio de formación/destrucción de hueso. Por tanto, las lesiones osteolíticas son causadas por un exceso de actividad osteoclástica acompañada de una actividad osteoblástica reducida, y no por los efectos directos de las células tumorales metastásicas sobre el hueso11. Las lesiones osteoblásticas son expresión de un aumento de la formación ósea por los osteoblastos alrededor de las células tumorales, acompañadas de una disminución de la formación de hueso. Como ejemplo, en el cáncer de mama predominan las lesiones osteolíticas, aunque se cree que al menos una cuarta parte de las lesiones son osteoblásticas12. En el cáncer de próstata, la mayoría de las lesiones son de naturaleza osteoblástica. Sin embargo, una lesión puede contener tanto osteoblastos como osteoclastos. Estas lesiones se visualizan de manera diferente en los estudios radiológicos: las lesiones osteoclásticas aparecen líticas (aspecto oscuro por destrucción del hueso), y las lesiones osteoblásticas aparecen escleróticas (aspecto claro por formación de tejido óseo); cuando ambos componentes están presentes, la lesión muestra un patrón mixto (fig. 1).
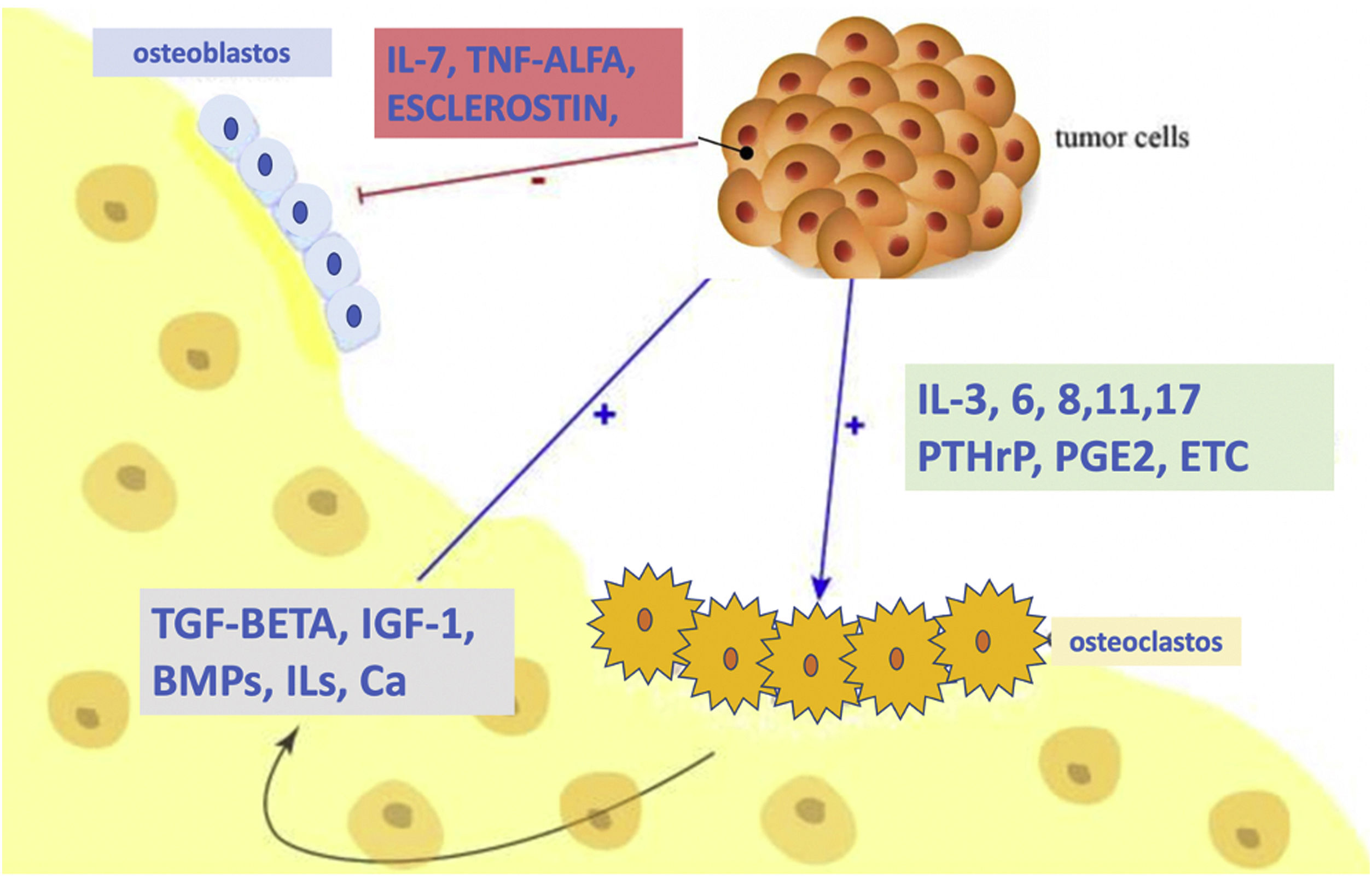
Equilibrio RANKL y OPGLos efectores finales de la remodelación ósea son: el ligando del receptor activador del factor nuclear kbκβ (RANKL), su receptor natural (RANK) y la osteoprotegerina (OPG), pertenecientes todos a la familia de los factores de necrosis tumoral (TNF). El RANKL es una proteína expresada por los osteoblastos y sus precursores bajo el control de hormonas, citoquinas y factores de crecimiento prorresortivos. La unión del RANKL a su receptor natural en la superficie celular de osteoclastos y sus precursores, el RANK, aumenta por distintos mecanismos las osteólisis: estimula la fusión de los preosteoclastos, aumenta su adherencia al hueso, estimula su función e incrementa su supervivencia al evitar la apoptosis13. La OPG es una proteína sintetizada por los osteoblastos y las células estromales. Actúa impidiendo la unión de RANKL con su receptor natural RANK. De este modo, la OPG bloquea todas las acciones del RANKL, teniendo el efecto final de inhibir la osteólisis14. Debido a los efectos antagónicos de las proteínas RANKL y OPG, la remodelación ósea depende del equilibrio entre ambas, y este está regulado por múltiples factores.
Como hemos comentado, la remodelación ósea normal mantiene un equilibrio adecuado entre la acción de los osteoclastos (células que reabsorben hueso) y los osteoblastos (células formadoras de hueso). Las neoplasias malignas esqueléticas, incluidas las metástasis óseas, interrumpen la vía de transducción de señales OPG-RANKL-RANK y promueven una mayor formación de osteoclastos, lo que acelera la resorción ósea e induce la pérdida ósea. Esta osteólisis, a su vez, conduce a la liberación de factores de crecimiento derivados del hueso, lo que contribuye a un «círculo vicioso» en el que las interacciones entre las células tumorales y los osteoclastos no solo conducen a un aumento de la osteoclastogénesis y la actividad osteolítica, sino también al crecimiento y comportamiento agresivos de las células tumorales10. Por tanto, las complicaciones osteolíticas asociadas a las metástasis óseas son causadas por alteraciones inducidas por el tumor en el sistema OPG-RANKL-RANK (fig. 2).
Metástasis osteoblásticasLas metástasis osteoblásticas se encuentran principalmente en el cáncer de próstata, pero también en el cáncer de pulmón de células pequeñas, el linfoma de Hodgkin y el meduloblastoma. En el cáncer de próstata el aumento de la actividad formadora de hueso da lugar a un hueso entretejido, que se caracteriza por un aspecto osteoesclerótico distinto de la estructura lamelar típica que se observa en el hueso normal. Un análisis histopatológico de estas metástasis óseas generalmente muestra una gran cantidad de osteoblastos adyacentes a las células del cáncer de próstata15. Por el contrario, los osteoblastos casi siempre están ausentes en el hueso normal o en las metástasis óseas de otros cánceres (como el de mama, pulmón y riñón), que en su mayoría contienen osteoclastos16. Se ha establecido un aumento en el nivel de OPG sérica en pacientes con cáncer de próstata avanzado17.
Manifestaciones clínicas de las metástasis óseasIntroducciónLas metástasis óseas tienen un impacto muy significativo en la calidad de vida y en la supervivencia de los pacientes que la padecen, por lo que la evaluación del estado funcional general del paciente es de gran importancia. Existen diversas escalas utilizadas para valorar el estado general del paciente: la escala de Karnofsky (KPS), la escala de evaluación de síntomas de Edmonton, el índice de independencia de Katz en las actividades de la vida diaria (ADL de Katz), etc. La escala de Karnofsky (KPS) es la más usada; fue definida por Bruchenal y Karnofsky en 1949. El estado funcional de un paciente se evalúa en una escala de 0 a 100 puntos, que va desde el bienestar total (100%) hasta la muerte (0%), disminuyendo 10 puntos en cada nivel. Según los resultados, los pacientes se dividen en tres grupos: el grupo A (100-80%) puede realizar las actividades diarias de forma independiente; el grupo B (70-50%) puede realizar las actividades diarias con ayuda, y el grupo C (<40%) requiere asistencia continua y se acerca a la muerte progresivamente18 (tabla 1).
Escala de Karnofsky (KPS) de 0 a 100 puntos, clasificando el estado funcional en grupos A, B y C
| Escala Karfnosky resumida | |
|---|---|
| Grupo A 100-80% | Puede realizar las actividades diarias de forma independiente |
| Grupo B 70-50% | Puede realizar las actividades diarias con ayuda |
| Grupo C <40% | Requiere asistencia continua y se acerca a la muerte progresivamente |
Las metástasis pueden causar dolor óseo, fracturas, déficit neurológico y síntomas asociados con enfermedad sistémica (astenia, anemia, pérdida de peso, hipercalcemia, etc.). En algunos, también se puede encontrar una masa palpable, especialmente en el caso de metástasis sacras grandes.
DolorEl dolor es la manifestación más común en pacientes con metástasis espinal. Se estima que aproximadamente el 80-95% de los pacientes se quejarán de dolor17. Será el síntoma inicial de metástasis raquídea en el 10% de los pacientes. Los pacientes con metástasis espinal pueden tener uno de los 3 tipos de dolor: dolor local, dolor mecánico o dolor radicular.
Este dolor local está relacionado con el tumor y se produce como resultado del estiramiento del periostio, la ingurgitación venosa, el crecimiento del tumor o la inflamación e infiltración inducidas por el tumor. Los tumores secretan mediadores inflamatorios que provocan dolor. Cuando la secreción de corticosteroides endógenos se reduce durante la noche, los pacientes experimentan una exacerbación de la inflamación que mejora drásticamente a lo largo del día. Este dolor no se alivia incluso cuando el paciente está acostado en la cama. Por lo general, responde a los medicamentos antiinflamatorios no esteroideos (AINE), los esteroides y la radiación. Los signos clínicos clásicos son poco específicos. Se encontró sensibilidad a la percusión local en solo el 43% de los pacientes con metástasis vertebrales con TC positiva, y solo en el 65% con enfermedad epidural. Sin embargo, cuando está presente, el signo ayuda a localizar la metástasis. Como regla general, el sitio del dolor local puede ayudar a distinguir la metástasis vertebral de la lesión degenerativa de la espalda más común. Como regla general, la mayoría de las enfermedades degenerativas de la espalda son cervicales o lumbares y causan dolor en el cuello o en la parte baja de la espalda, mientras que la mayoría de las compresiones epidurales de la médula espinal son torácicas (60-80%)4 y producen dolor torácico local.
El dolor mecánico resulta de la inestabilidad de la columna, fracturas patológicas o fracturas vertebrales inminentes, es decir, por lesiones que han resultado en una destrucción ósea significativa y que tienen un alto riesgo de colapso vertebral patológico. Las fracturas patológicas a veces pueden ser el primer signo de enfermedad ósea metastásica. Se asocian comúnmente con pérdida ósea focal dentro de lesiones líticas que surgen de cánceres de mama, pulmón, riñón y tiroides. El dolor mecánico suele estar relacionado con la bipedestación o sedestación prolongada, y con acciones como en el cambio de posición de acostado a sentado, de sentado a parado y al girar en la cama. La estabilización de la columna con corsés ortopédicos puede mejorar notablemente la calidad de vida de estos pacientes .El dolor mecánico no se alivia con AINE, esteroides, quimioterapia o radioterapia. El dolor significativo puede precisar estabilización quirúrgica o técnicas de aumentación percutáneas (cementación o radiofrecuencia).
Afectación neurológica en las metástasisIntroducciónLa disfunción motora es la segunda manifestación clínica más común en pacientes con metástasis espinal. El dolor suele ser la primera manifestación de aquellos pacientes con metástasis epidurales. Autores con Gilbert et al. comunican que, de 130 metástasis epidurales detectadas, el dolor fue el primer síntoma en 125 de ellas. Se ha publicado que transcurre menos tiempo entre la aparición del dolor y la lesión neurológica en tumores más agresivos, siendo por ejemplo menor en el cáncer de pulmón que en el de mama19.
Compresión radicularLa compresión de las raíces nerviosas dentro del canal espinal, o en los forámenes, genera dolor radicular. Aunque la radiculalgia compresiva suele seguir al dolor local, a veces lo precede o es independiente de él. El dolor radicular está presente en el 80% de los pacientes con lesiones cervicales. Por lo general, se irradia hacia un brazo o, a veces, hacia ambos brazos. De los pacientes con compresión torácica, el 55% tiene característicamente dolor irradiado intercostal, en una banda apretada alrededor del tórax o el abdomen, muchas veces bilateral. El 90% de los pacientes con afectación de la columna lumbar tienen dolor que se irradia hacia una o ambas piernas. La mayoría de estos pacientes también tienen dolor local20.
Compresión medularLa compresión de la médula espinal generalmente causa debilidad que comienza en las piernas, independientemente del sitio de compresión de la columna. El paciente suele quejarse de dificultad para caminar y especialmente para subir escaleras o levantarse de sillas bajas o asientos de inodoro. En las lesiones de la médula torácica superior o cervical, el paciente puede notar una tos débil, y solo al final del desarrollo de la compresión de la médula cervical los brazos se vuelven sustancialmente débiles.
Aunque la debilidad suele ser bilateral y simétrica, en ocasiones puede predominar en una pierna o un brazo. El examen en las etapas iniciales de la compresión puede no revelar espasticidad o reflejos exaltados. Es más frecuente observar una debilidad moderada de la musculatura proximal de miembros inferiores (iliopsoas e isquiotibiales), con una fuerza aparentemente normal en los músculos distales (tibial anterior, sóleo, etc.). Incluso en este momento, los reflejos patelar y de Aquiles suelen ser un poco más activos que los reflejos de las extremidades superiores. A medida que la enfermedad progresa y aumenta la debilidad, se desarrollan espasticidad, reflejos hiperactivos y respuestas plantares extensoras. Estos signos suelen ser bilaterales y simétricos, aunque en ocasiones un lado puede estar más afectado que el otro. Es importante conocer que, si el paciente ha recibido quimioterapia previa, los reflejos pueden estar disminuidos o ausentes debido a una neuropatía tóxica que reduce su valor de localización. Si el inicio de la compresión es agudo, y lleva a una paraplejía completa, la mayoría de los pacientes están flácidos y con arreflexia.
Cauda equinaCuando está comprometida la cauda equina en lugar de la médula espinal, la debilidad refleja una disfunción de la neurona motora inferior. Encontraremos hipotonía, atrofia, fasciculaciones y arreflexia. La debilidad suele ser más marcada distalmente que proximalmente, aunque los músculos de los glúteos y los isquiotibiales también suelen verse afectados. La debilidad distal comienza con la caída del pie y continúa hasta convertirse en debilidad por debajo de las rodillas. Con la compresión de la cauda equina, la pérdida sensorial es generalmente bilateral, y afecta el área perianal, la parte posterior del muslo y la cara lateral de la pierna. La anomalía autonómica más característica es la disfunción vesical. Los pacientes suelen desarrollan retención urinaria indolora, generalmente asociada a debilidad severa y pérdida sensorial.
Afectación sensorialLa afectación sensitiva sin dolor es rara con la compresión de la médula espinal o la cauda equina21. Las anomalías sensoriales suelen comenzar en los dedos de los pies y ascienden en forma de media, alcanzando finalmente el nivel de la lesión. El signo más precoz suele ser una ligera disminución del sentido de la vibración y la posición, y posteriormente dolor y pérdida de la sensibilidad térmica. En el momento del diagnóstico, encontramos que la pérdida sensorial tanto para el tacto como para el pinchazo se encuentra entre uno y 5 niveles por debajo del sitio de compresión real de la médula espinal, aunque a veces es más craneal.
Nivel de evidenciaNivel de evidencia IV.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.