Valorar la incidencia de necrosis avascular de cadera (NAVC) en pacientes con leucemia sometidos a altas dosis de corticoides tratados en nuestro hospital para evaluar si es necesaria la creación de un protocolo de detección precoz.
Material y métodosEstudio observacional-descriptivo y retrospectivo de 2005 a 2016 de 253 pacientes diagnosticados de leucemia en edad pediátrica. Se identificaron los pacientes con patología osteomuscular y se analizaron los pacientes con necrosis avascular.
ResultadosUn total de 26 pacientes (10%) presentaron síntomas osteomusculares. Se analizaron 3 pacientes con NAVC (1,2%). Una niña, de 7 años, se trató de forma conservadora con tracción-suspensión y descarga. Dos niños de 11 y 15,4 años, que desarrollaron una enfermedad de injerto contra huésped secundaria al trasplante de médula ósea, cuyo tratamiento incluye altas dosis de corticoides, desarrollaron necrosis avascular de cadera. Uno se trató con bifosfonatos y forage y el otro terminó con una artroplastia total de sustitución.
DiscusiónLa aparición de síntomas musculoesqueléticos durante el tratamiento de la leucemia es diferente según la serie bibliográfica (0,43-12,6%). Algunos autores observan un incremento del riesgo en pacientes de sexo femenino entre los 10 y 17 años. Un estudio retrospectivo observa que existe una demora de 3,9 meses en el diagnóstico de la NAVC desde el comienzo del dolor. Otros autores relacionan la NAV con las articulaciones de carga, la edad y las altas dosis de corticoides.
ConclusiónBasado en la baja incidencia de NAVC en nuestra población de pacientes menores de 14 años tratados de leucemia, pensamos que no es rentable la creación de protocolos de diagnóstico. Sin embargo, sí que es recomendable la vigilancia estricta de los pacientes con factores de riesgo potenciales reconocidos en la literatura.
To evaluate the incidence of avascular necrosis of the hip in leukaemia patients treated in our hospital with high doses of corticosteroids in order to evaluate the necessity for an early detection protocol.
Material and methodsObservational-descriptive and retrospective study from 2005 to 2016 of 253 patients diagnosed with paediatric leukaemia. Patients with musculoskeletal pathology were identified and patients with avascular necrosis were analysed.
ResultsA total of 26 patients (10%) had musculoskeletal symptoms. Three patients with avascular necrosis (1.2%) were analysed. One girl, 7 years old, was treated conservatively with traction - suspension and discharge. Two boys, an 11 and a 15.4 year-old,who developed graft-versus-host disease secondary to bone marrow transplantation, and whose treatment included high doses of corticosteroids, developed avascular necrosis of the hip. One was treated with bisphosphonates and forage and the other ended up with a total hip arthroplasty.
DiscussionThe occurrence of musculoskeletal symptoms during the treatment of leukaemia is different according to the bibliographic series (0.43 -12.6%). Some authors observe an increased risk in female patients between the ages of 10 and 17. A retrospective study reveals that there is a delay of 3.9 months in the diagnosis of CAP since the onset of pain. Other authors relate NAV to loading joints, age and high doses of corticosteroids.
ConclusionBased on the low incidence of avascular necrosis of the hip in our 14-year-old population treated for leukaemia, the creation of diagnostic protocols seems not to be necessary. However, close monitoring of patients with potential risk factors recognized in the literature, is advisable.
La leucemia es el cáncer infantil más frecuente1. Con el tratamiento actual ha aumentado la tasa de curación, pero los pacientes presentan a medio y largo plazo un incremento de las complicaciones osteomusculares derivadas principalmente de las altas dosis de corticoides que incluye la medicación antileucémica2.
La asociación entre necrosis avascular ósea (NAV) y la administración de corticoides a altas dosis está bien establecida3.
En la literatura no existe un consenso sobre la necesidad de realizar un cribado de necrosis avascular de cadera (NAVC) en los pacientes tratados de una lecucemia para el diagnóstico precoz de esta patología.
La importancia del diagnóstico precoz reside en una modificación del pronóstico, dado que, si la NAVC se detecta en estadios precoces la descompresión o forage puede evitar su progresión hacia la artrosis avanzada4,5. Cuando la afectación es mayor con hundimiento, irregularidad de la cabeza y artrosis el único tratamiento posible es la artroplastia de sustitución, y los riesgos que esta conlleva, como el aumento de la tasa de revisión al implementarla en población joven6.
El objetivo de nuestro trabajo es estudiar la incidencia de la NAVC en pacientes con leucemia sometidos a altas dosis de corticoides tratados en nuestro hospital para evaluar si es necesaria la creación de un protocolo de detección precoz que nos permita identificar y tratar de forma temprana esta patología.
Material y métodosSe realizó una revisión retrospectiva de los pacientes tratados por leucemia en nuestro centro entre los años 2005-2016. Se revisaron, de forma retrospectiva, todos los pacientes pediátricos con diagnóstico de leucemia aguda tratados en nuestro hospital en el citado periodo que habían recibido altas dosis de corticoides como parte del tratamiento.
Se examinaron los casos de pacientes con patología musculoesquelética, analizando aquellos afectos de NAV de cadera. Para ello se revisó la historia de cada paciente, analizando las pruebas de imagen solicitadas y si precisaron atención por ortopedia infantil.
A partir de dicha información se elaboró una base de datos y se recogieron las siguientes variables en pacientes afectos de síntomas osteomusculares: edad, sexo, tiempo desde el diagnóstico de leucemia hasta la aparición de síntomas, diagnóstico nosológico, tratamiento y evolución.
Además, se realizó una revisión de la literatura sobre el tema.
ResultadosEn el periodo estudiado, 253 pacientes fueron tratados de una leucemia en nuestro hospital. De estos pacientes, 213 pacientes fueron diagnosticados de leucemia linfoblástica aguda (LLA) y recibieron corticoides a altas dosis como parte del tratamiento quimioperápico. El resto, 40 pacientes, fueron diagnosticados de leucemia mieloblástica aguda; estos pacientes también recibieron altas dosis de corticoides, no como parte de su tratamiento quimioterápico, sino como tratamiento antiemético de segundo escalón (34 pacientes) o por haber desarrollado una enfermedad de injerto contra huésped (EICH) tras un trasplante de progenitores hematopoyéticos (6 pacientes).
De estos 253 pacientes, 113 eran de sexo femenino (44,7%) y 140 de sexo masculino (55,3%). La edad media fue de 6,4 (0,1-15,4) y la mediana de edad de 6,43.
En 26 de los 253 pacientes (9%) se identificó algún síntoma relacionado con patología del aparato locomotor (tabla 1).
El síntoma más frecuente fue el dolor óseo focalizado o generalizado, relacionado con la infiltración de células leucémicas en metáfisis distal de huesos largos y las infecciones tanto óseas como de partes blandas relacionadas con la inmunodepresión de estos pacientes.
Del total de la muestra en 3 casos se diagnosticó necrosis avascular de la cabeza femoral, lo que representa una incidencia del 1,2% (tabla 2); dos de ellos eran varones y el otro caso era una niña.
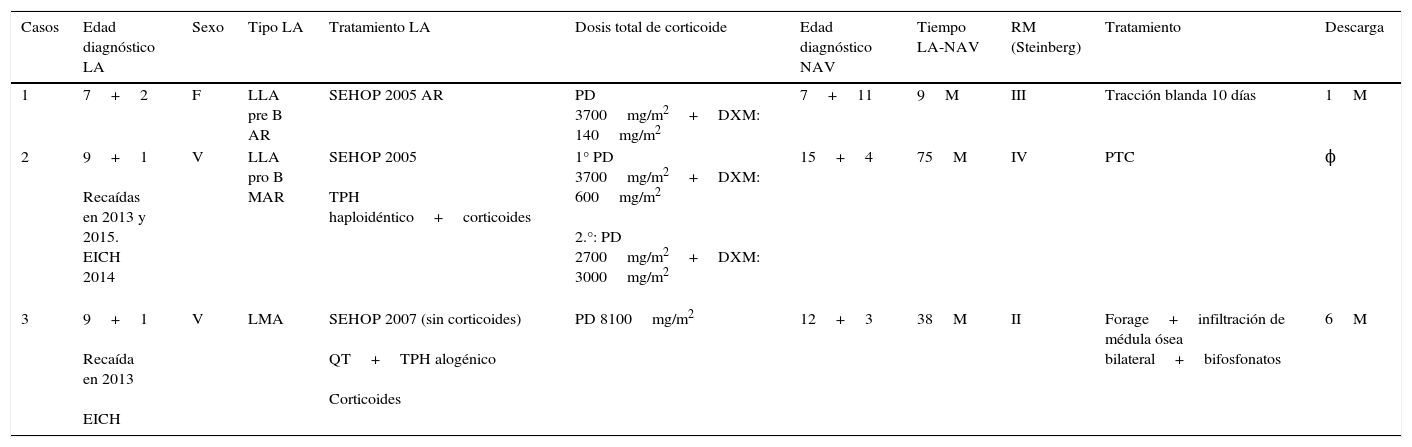
Serie de casos con NAV de cabeza femoral incluidos en nuestro estudio
| Casos | Edad diagnóstico LA | Sexo | Tipo LA | Tratamiento LA | Dosis total de corticoide | Edad diagnóstico NAV | Tiempo LA-NAV | RM (Steinberg) | Tratamiento | Descarga |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 7+2 | F | LLA pre B AR | SEHOP 2005 AR | PD 3700mg/m2+DXM: 140mg/m2 | 7+11 | 9M | III | Tracción blanda 10 días | 1M |
| 2 | 9+1 Recaídas en 2013 y 2015. EICH 2014 | V | LLA pro B MAR | SEHOP 2005 TPH haploidéntico+corticoides | 1° PD 3700mg/m2+DXM: 600mg/m2 2.°: PD 2700mg/m2+DXM: 3000mg/m2 | 15+4 | 75M | IV | PTC | ϕ |
| 3 | 9+1 Recaída en 2013 EICH | V | LMA | SEHOP 2007 (sin corticoides) QT+TPH alogénico Corticoides | PD 8100mg/m2 | 12+3 | 38M | II | Forage+infiltración de médula ósea bilateral+bifosfonatos | 6M |
DXM: dexametasona; LA: leucemia aguda; LLA: linfática; LMA: mieloide; M: meses; PD: prednisona; TPH: trasplante de progenitores hematopoyéticos.
La edad media de diagnóstico de NAV fue de 11 años y 10 meses (7, 11 y 15,4).
El tiempo medio entre el diagnóstico de leucemia y el de osteonecrosis de cadera fue de 40 meses con una variabilidad de 9 a 75 meses.
El tiempo medio desde la aparición de los síntomas (dolor, cojera y/o restricción de la movilidad) y el diagnóstico de NAV fue de 4,7 meses (1-12).
El caso 1 es una niña de 7 años con LLA de alto riesgo que comenzó con dolor poliarticular. En la resonancia magnética (RM) se observó infiltración leucémica en hombros, raquis y caderas. Inició tratamiento con el protocolo SEHOP 2005 AR que incluyó 3.700mg/m2 de prednisona más 140mg/m2 de dexametasona, con buena evolución de las lesiones.
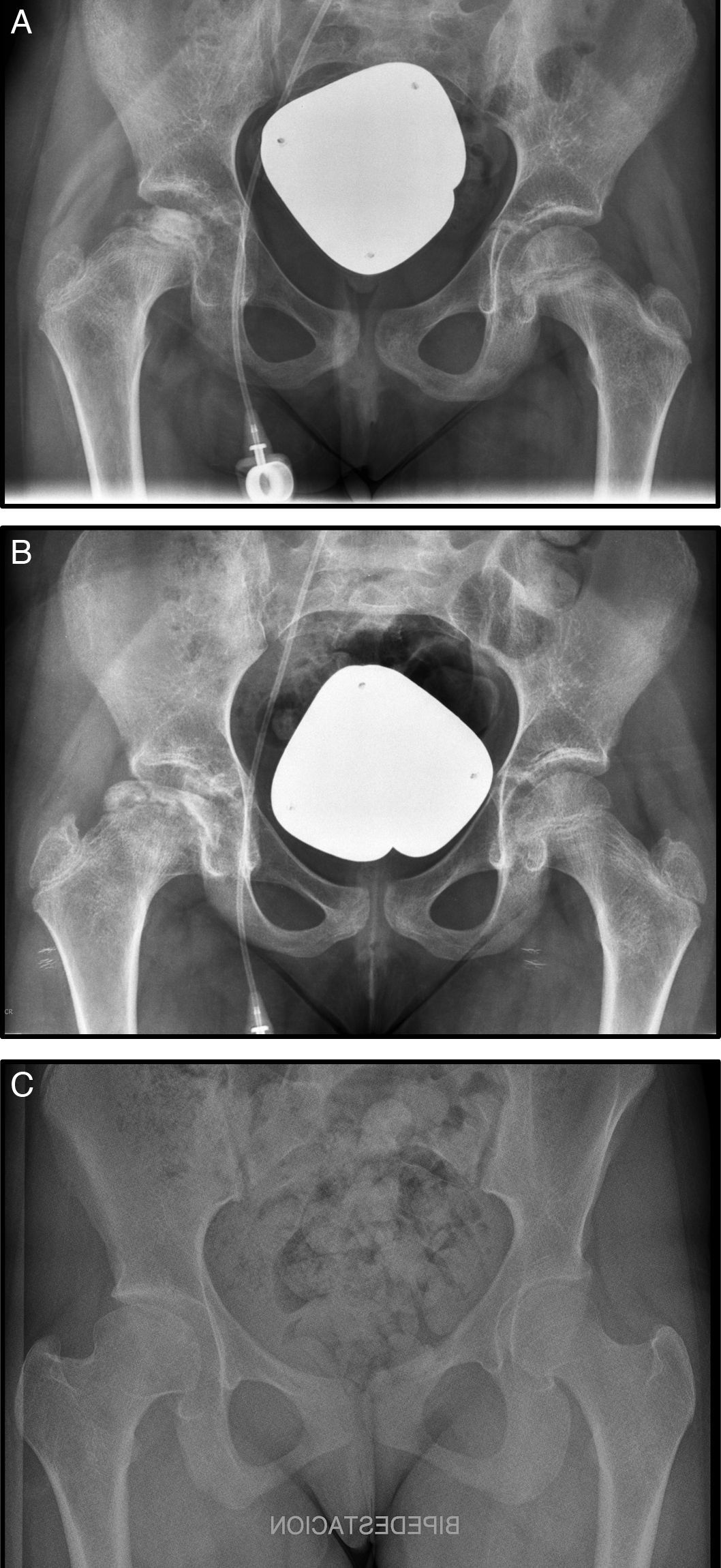
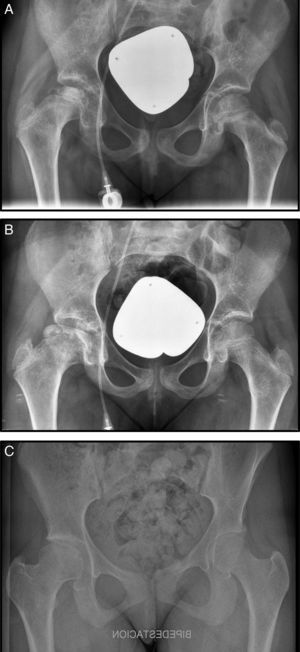
A los 9 meses del diagnóstico inició dolor en cadera derecha, se realizó un estudio radiográfíco y resonancia diagnosticándose de NAV estadio III de Steinberg (fig. 1 A). En este caso se optó por tratamiento conservador con reposo, analgesia, tracción-suspensión 10 días y descarga durante un mes (fig. 1, B). La evolución fue buena y actualmente la cabeza femoral se ha remodelado con una buena congruencia. La paciente se encuentra asintomática y presenta una dismetría no significativa clínicamente de 7mm (fig. 1 C).
A) Radiografía anteroposterior (Rx AP) de pelvis donde se observa una condensación de la epífisis femoral derecha. B) Rx AP de pelvis, un año más tarde, donde se observa un colapso subcondral en la cabeza femoral derecha. C) Rx AP de pelvis, a los 6 años tras tratamiento conservador donde se observa remodelación completa de la cabeza.
El caso 2 es un niño de 9 años con diagnóstico de LLA de muy alto riesgo tratado con protocolo SEHOP 2005 AR con 3.700mg/m2 de prednisona y 600mg/m2 de dexametasona.
Sufrió una recaída a los 2 años de haber finalizado el tratamiento, que se trató con trasplante de progenitores hematopoyéticos haploidéntico. Tras ello, desarrolló una EICH cutánea e intestinal y nueva recaída leucémica al año siguiente. Durante ese periodo fue tratado con dosis aproximadas de prednisona de 2.700mg/m2+3.000mg/m2 en 2 periodos.
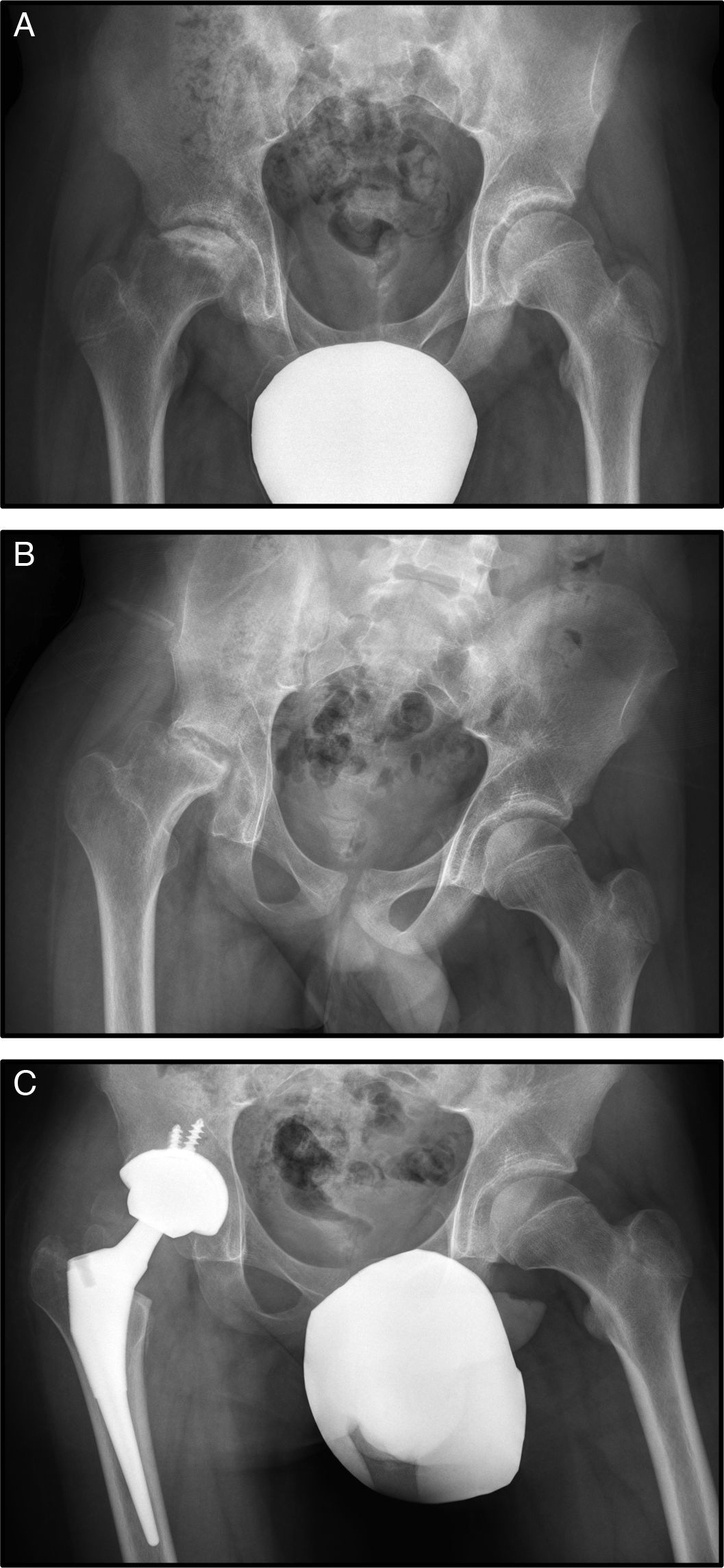
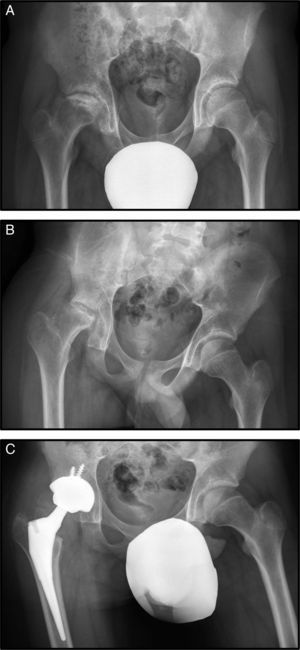
Con 15 años consulta por dolor de cadera derecha mecánico de un año de evolución (fig. 2 A).
En la radiografía simple y en la RM se observa necrosis de cadera derecha estadio IV (fig. 2 B.), por lo que se desestimó realizar un tratamiento conservador mediante forage. La evolución no fue buena, produciéndose un deterioro progresivo de la cabeza femoral, con mayor aplastamiento de la misma y un empeoramiento de la clínica con aumento del dolor y disminución de la movilidad de la cadera. Esta evolución tórpida condujo a la realización de una artroplastia de sustitución a los 16 años (fig. 2 C).
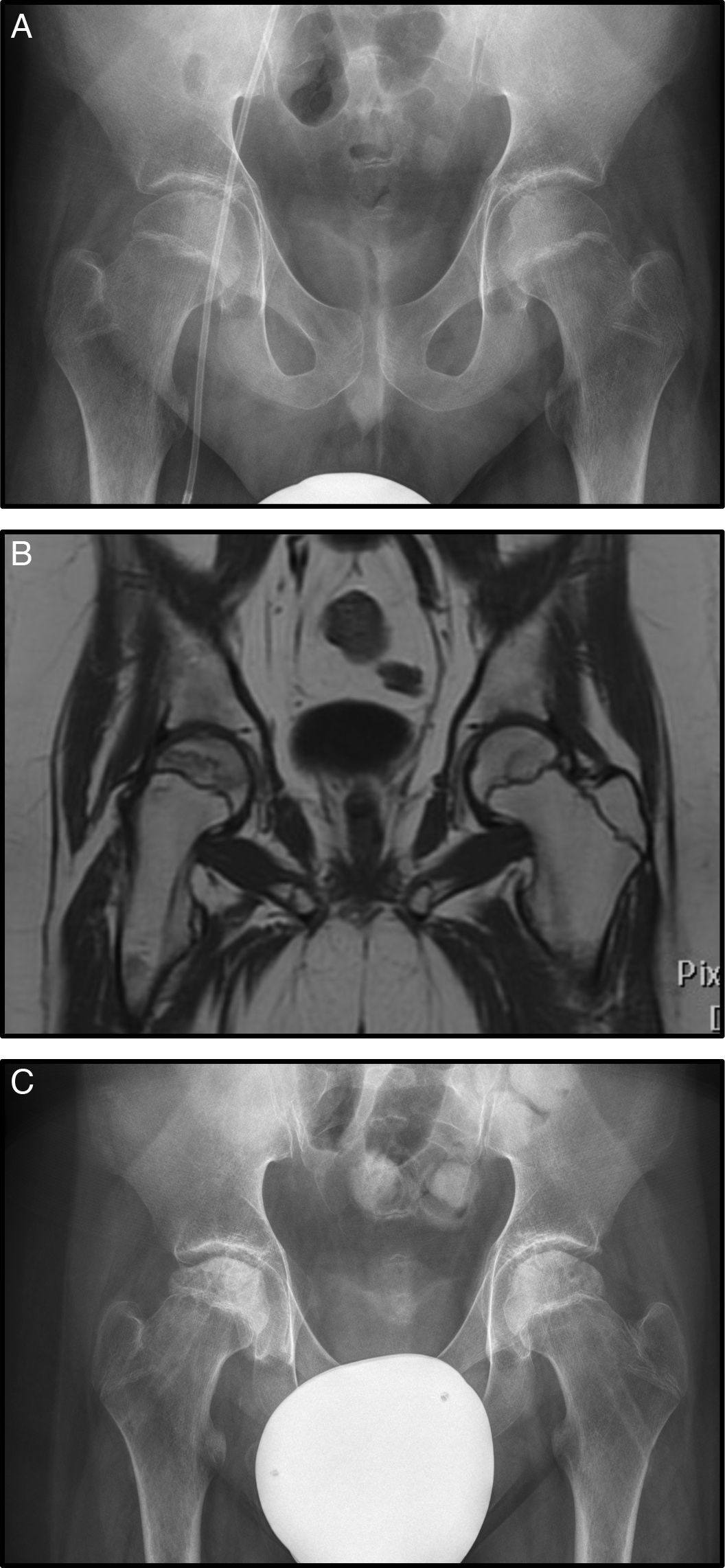
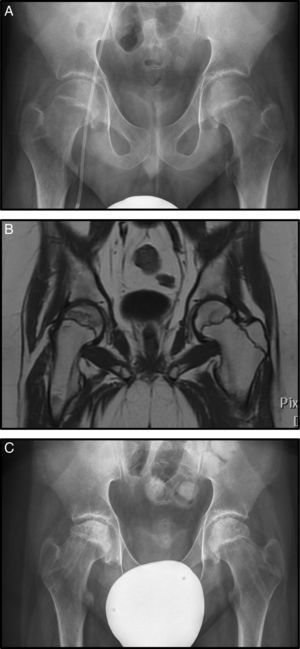
El caso 3 es un varón con diagnóstico de LMA que inició tratamiento con protocolo SHOP 2007. Sufrió una recaída tratada con agentes quimioterápicos más trasplante de precursores hemopoyéticos alogénico. Tras ello, desarrolló una EICH de tracto digestivo alto que fue tratada con corticoides a altas dosis (en total 8.100mg/m2 de prednisona). En el transcurso de su enfermedad, presentó dolores óseos en ambos miembros inferiores sobre todo en caderas. El estudio radiográfico fue normal sin observarse signos de necrosis (fig. 3 A), en cambio en la RM se apreció signos de necrosis bilateral, más avanzada en la derecha, por lo que inició tratamiento con bifosfonatos (fig. 3 B).
A) Rx AP de pelvis donde no se observan alteraciones en la cabeza femoral (Steinberg I). B) Imagen coronal de RM con signos de necrosis bilateral, con mayor afectación de la cadera derecha pero sin signos de hundimiento, estadio Steinberg II. C) Rx AP tras realizar forage+infiltración con médula ósea de forma bilateral.
A los 5 meses se observó progresión radiológica (Steinberg II) sin mejoría clínica, motivo por el cual se realizó forage-descompresión más infiltración con autoinjerto de médula ósea bilateral (fig. 3 C).
A los 6 meses de evolución postoperatoria el paciente se encuentra estable clínicamente realizando tratamiento fisioterápico y sin cambios radiológicos.
DiscusiónLa leucemia aguda es una afección sistémica que produce una sintomatología muy variada, por lo que es difícil de reconocer en estadios precoces. En algunos casos las leucemias pueden comenzar con una afectación osteomuscular. Debemos tener en consideración que los dolores musculoesqueléticos y las alteraciones radiográficas persistentes deben hacernos pensar en una posible leucemia, en cuyo caso deberíamos solicitar una valoración por parte de pediatría o descartar la sospecha diagnóstica7.
Los protocolos de tratamiento de la LLA pueden variar según el centro pero la mayoría incluyen una fase de tratamiento intensivo que dura de 6 a 9 meses y se subdivide en: inducción, consolidación e intensificación; más una fase de mantenimiento de 2 años. En la fase de inducción se incluyen altas dosis de corticoides, lo que conlleva diversos efectos adversos a nivel osteoarticular destacando la osteopenia/osteoporosis, necrosis avascular y aumento del riesgo de infecciones7. Los protocolos de la LMA no incluyen corticoides a altas dosis pero muchas veces se utilizan como tratamiento antiemético de segundo escalón. Además si estos pacientes precisan de TPH pueden desarrollar una EICH que precise de corticoides a altas dosis y por lo tanto se convierten en pacientes con riesgo de desarrollar las mismas complicaciones que los pacientes tratados de LLA.
Riccio et al. realizan una descripción de las afectaciones más frecuentes a nivel musculoesquelético en el contexto del desarrollo de una leucemia. Estos autores recogen en su estudio una muestra de 328 pacientes en un periodo de 21 años de los cuales un total de 74 pacientes presentaron síntomas osteomusculares durante su enfermedad (22,5%). La afectación más frecuente fue la osteoporosis, que se observa mejor a nivel de la columna vertebral. Otros signos menos frecuentes relacionados con la enfermedad fueron las clásicas bandas radiolucientes metafisarias, la reacción perióstica, que suele estar en relación con áreas líticas más frecuente en pacientes jóvenes y en huesos largos, la osteoesclerosis y la necrosis avascular epifisaria8,9.
En nuestra muestra existe un menor porcentaje de afectación (9% de incidencia de patología osteomuscular) que en la muestra de Riccio et al. Cuyo porcentaje de afectación fue del 22,5%. Además, la afectación más frecuente fue la infiltración leucémica y en menor medida la osteopenia8.
En los diferentes estudios revisados la incidencia de aparición de patología osteomuscular es heterogénea. Probablemente esto esté en relación con la diversidad en las formas de aparición y la evolución de la leucemia. Contribuyen, sin duda, la variedad de protocolos que incluyen dosis de corticoides desiguales según la presentación de la enfermedad hematológica.
La NAVC se ha relacionado con la exposición a los corticoides. La evidencia que une los corticoides y la necrosis avascular no está totalmente clarificada en la literatura. En gran medida se basa en la aparición de esta asociación en diversas patologías respiratorias y reumáticas y en pacientes sometidos a trasplantes de órganos así como en el hecho de que los pacientes con enfermedad de Cushing tienen una prevalencia algo más elevada de NAVC9,10.
Con respecto a la dosis de corticoides necesaria para el desarrollo de una NAVC no está establecida hasta la fecha, incluso se ha descrito la aparición de la enfermedad tras la inhalación de corticoides11, su aplicación tópica12 o tras una inyección intraarticular13. Las dosis más elevadas, incluso durante cortos periodos, presentan mayores riesgos. Dosis de corticoides superiores a 20mg/día parecen asociarse a un riesgo mayor de osteonecrosis. Durante los primeros 6 meses de tratamiento corticoideo, cada incremento de 10mg/día de prednisona vía oral aumenta la posibilidad de desarrollo de ON en un 4,6%14.
En nuestra serie, los dos varones recibieron mayores dosis de corticoides, ya que por el curso de su enfermedad requirieron un trasplante y desarrollaron una EICH.
La etiopatogenia de la NAVC causada por corticoides es multifactorial y poco conocida, hay trabajos que la relacionan con alteraciones de las enzimas del metabolismo corticoideo, con la aparición de émbolos lipídicos, con la alteración en la diferenciación de la serie osteoblástica, con la disminución de la producción de óxido nítrico endotelial y con la alteración del metabolismo lipídico o de la coagulación15–17. Los corticoides son metabolizados en el hígado por la enzima hepática P450 3A por lo que se piensa que una baja actividad de dicha enzima desencadenaría un aumento de corticoide libre en sangre, con el consiguiente aumento de probabilidad de sufrir NAVC18. Además, se han identificado polimorfismos que estarían en relación con una mayor predisposición a padecer esta patología19.
Se ha estudiado la interacción de otros fármacos antileucémicos con los corticoides que parece favorecer el desarrollo de NAVC. La interacción de los corticoides con la asparaginasa induce un estado de hipercoagulabilidad20. Con el metrotexate se elevan los niveles de homocisteína lo que favorece la oclusión venosa21. Los estudios no son concluyentes para limitar por el momento la dosis de estos fármacos y evitar de esta forma el desarrollo de NAVC22.
Diferentes estudios examinan la relación entre corticoides y NAVC, analizando posibles factores de riesgo para su desarrollo (tabla 3). Aricó et al.23 recogen en su estudio 1.431 pacientes tratados de LLA, de los cuales 15 desarrollan NAVC (IA: 1,1%). La edad media al diagnóstico de la NAVC fue de 10 años y la mediana de tiempo desde el diagnóstico de leucemia y la aparición de NAV fue 17 meses (8-45). Estos autores concluyen que existe un aumento significativo de la incidencia en pacientes con edad mayor de 10 años, sexo femenino y que han recibido mayor dosis de corticoides.
Principales estudios que relacionan NAVC y corticoides
| n | Tipo leucemia | IA NAVC | Sexo | Edad media | Tiempo tras Dg | |
|---|---|---|---|---|---|---|
| Aricó14 | 1421 | LLA | 1,1% | Mujeres | 10 | 17 (8-45) |
| Madadi15 | 865 | LLA | 0,8% | = | 10,2 | 20 (10-91) |
| Salem16 | 105 | LLA, LMA, Linfoma | 7,6% | = | >9 | 16,8 (8-49) |
| Wei17 | 202 | LLA | 4% | Varones | − | 30 (8-74) |
| Nuestra serie | 253 | LLA, LMA | 1,2% | Varones | 11 | 40 (9-75) |
LLA: linfática; LMA: mieloide; NAVC: necrosis avascular de cadera.
El estudio de Madadi et al.24 incluye una muestra de 865 pacientes tratados de LLA con una incidencia de 0,8% de NAVC, sin encontrar diferencias significativas respecto al sexo, con una media de edad de 10 años y un lapso de tiempo de aparición de 20 meses.
En el estudio de Salem et al.25 se incluyen 105 pacientes menores de 18 años, el 76% tratados por una LLA, el 16% de un linfoma no Hodgkin y un 8% de una LMA. De ellos, 8 casos son diagnosticados de NAVC lo que supone un 7,6% de incidencia y una misma distribución por sexo (4 varones y 4 mujeres). En este estudio la tasa de incidencia es mayor, debido a que la edad media de los pacientes incluidos es mayor respecto al resto.
Wei et al.26 incluye 202 pacientes, de los cuales 8 desarrollan NAVC (4%), en un promedio de 30 meses tras el inicio de la quimioterapia. De los 202, 58 fueron catalogados de alto riesgo; y de estos 6 tuvieron NAVC (10,3%). Estos autores concluyen que en pacientes con leucemia catalogada de alto riesgo, la osteonecrosis aparece más temprano, con un estadio más avanzado al diagnóstico y con una progresión más rápida.
Aricó et al. es el grupo con mayor muestra en su serie, 1.421 pacientes con diagnóstico de LLA. La incidencia acumulada de NAVC en su estudio es de 1,1% 15. En nuestra serie, si tenemos en cuenta solo las LLA de nuestro estudio, 2 casos de NAVC entre 213 pacientes, la incidencia fue parecida 0,9%. Otros autores que obtienen una incidencia mayor de NAVC en sus series 17,18 podría deberse, principalmente, a que incluyen pacientes de mayor edad. Nuestra serie solo incluye pacientes menores de 14 años en el momento del diagnóstico de la leucemia.
El metaánalisis de Winkel et al.2 de 2014 analiza la evidencia publicada hasta el momento para el manejo de los corticoides y concluye que la disminución de la dosis acumulada de corticoides puede disminuir la tasa de NAVC, pero aumenta el riesgo de eventos relacionados con la leucemia. La incidencia de NAVC aumenta considerablemente en los tres primeros años tras el diagnóstico de LLA y después alcanza fase de meseta. Parece que la administración intermitente de corticoides en pacientes de mayor riesgo de NAVC como aquellos con edad avanzada o sexo femenino podría reducir la incidencia. Por último, la variación genética podría determinar la susceptibilidad a la toxicidad de los fármacos e influir en el perfil de riesgo de osteonecrosis.
En definitiva, la mayoría de los estudios apuntan a un aumento de la probabilidad de padecer NAV durante la terapia con corticoides para aquellos pacientes con más de 9-10 años y que padezcan una variante de la enfermedad agresiva que conlleve protocolos de tratamiento con corticoides a altas dosis. No queda demostrada la relación con el sexo. En cuanto al tiempo que pasa desde el diagnóstico de la leucemia hasta la aparición de la necrosis avascular, es heterogéneo y abarca desde los 8 meses hasta 91 meses en los diferentes estudios.
Tampoco hay consenso sobre la necesidad de protocolos de diagnóstico precoz utilizando un cribado mediante pruebas de imagen durante el tratamiento con corticoides27. Los estudios que no recomiendan el uso de la RM en pacientes asintomáticos se basan en que los hallazgos encontrados en las mismas corresponden con estadios de NAV que regresan espontáneamente sin llegar a causar síntomas28,29. Esto implica que no sea coste-beneficioso y además dejamos de someter a los pacientes pediátricos a una prueba que muchas veces conllevará algún tipo de anestesia para poderse llevar a cabo con éxito28.
Kaste et al.30 en su estudio de 462 pacientes con LLA recogidos de un periodo de tiempo de 20 años, en los cuales realizaron una RM a los 3, 6 y 9 meses del inicio del tratamiento con corticoides concluyen que aunque en la población menor a 10 años no es rentable la aplicación de un cribado por imagen, solo lo sería en pacientes mayores de 10 años. Estos autores son los únicos que recomiendan un seguimiento por imagen al cumplir un año del tratamiento en pacientes mayores de 10 años. Ellos defienden que si la RM es normal en este tiempo de evolución no desarrollarán NAVC. Posteriormente no habría que hacer seguimiento salvo en caso de aparición de síntomas. Aún así sería necesario realizar un estudio de coste-beneficio del cribado que proponen estos autores.
Con los resultados de nuestro estudio y la literatura revisada creemos que no está indicado realizar un cribado por imagen en nuestra área de trabajo por dos motivos: la baja incidencia de nuestra serie (1,2%) que coincide con la recogida en al literatura (1,1-9%) y la existencia de casos asintomáticos o con síntomas leves y autolimitados. Así evitamos someter a los pacientes a pruebas que no están exentas de efectos adversos potenciales.
Coincidimos con las conclusiones de literatura disponible en que es aconsejable un seguimiento estricto por el equipo médico de pacientes con especial predisposición a desarrollar una NAVC.
La evolución de los pacientes de mayor edad (>10 años) y sometidos a mayores dosis de corticoides se debe vigilar de cerca y en caso de que presenten dolor, cojera o restricción de la movilidad de la cadera u otros síntomas sugerentes de afectación osteomuscular solicitar pruebas de imagen para realizar un diagnóstico y tratamiento precoz que puede modificar el pronóstico de la enfermedad.
Nivel de evidencia III.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.