El sarcoma de partes blandas (SPB) incluye una variedad de diferentes tumores que afectan a tejidos blandos, como los rabdomiosarcomas, los liposarcomas o los neuroblastomas. Dos tercios de los SPB se producen en las extremidades y tradicionalmente se han considerado difíciles de tratar. Aunque suponen menos del 1% de los cánceres, tienen una gran importancia, ya que el pronóstico es desalentador, y con frecuencia conllevan una desfiguración grave, la pérdida de la función de la extremidad y a menudo su amputación.
El tratamiento convencional para el SPB que afecta a una extremidad consiste en la combinación de una amplia excisión quirúrgica y radioterapia, siendo la quimioterapia habitualmente ineficaz en esta enfermedad. Sin embargo, la cirugía puede resultar insuficiente si el tumor infiltra profundamente o afecta a vasos sanguíneos, nervios o articulaciones; en tales casos, la amputación constituye la opción de tratamiento más radical1.
La técnica de la perfusión regional con citostáticos de una extremidad aislada (PEA) mediante un circuito extracorpóreo, fue ideada y utilizada por primera vez por Creech2, en la Universidad de Tulane, New Orleans, en un paciente con metástasis en tránsito de melanoma en una pierna, y fue publicada en 1958. Esta técnica consigue el aislamiento sanguíneo de la extremidad con respecto a la circulación sistémica, logrando su oxigenación mediante un circuito sanguíneo extracorpóreo, en el que se introducen los fármacos antineoplásicos. Así, se pueden administrar altas dosis de quimioterapia en el miembro afecto por la tumoración, evitando los efectos secundarios sistémicos. Con la PEA se alcanzan concentraciones regionales del citostático de 15 a 20 veces superiores a las que se consiguen con su administración sistémica endovenosa3.
TÉCNICA DE LA PERFUSIÓN DE EXTREMIDAD AISLADA
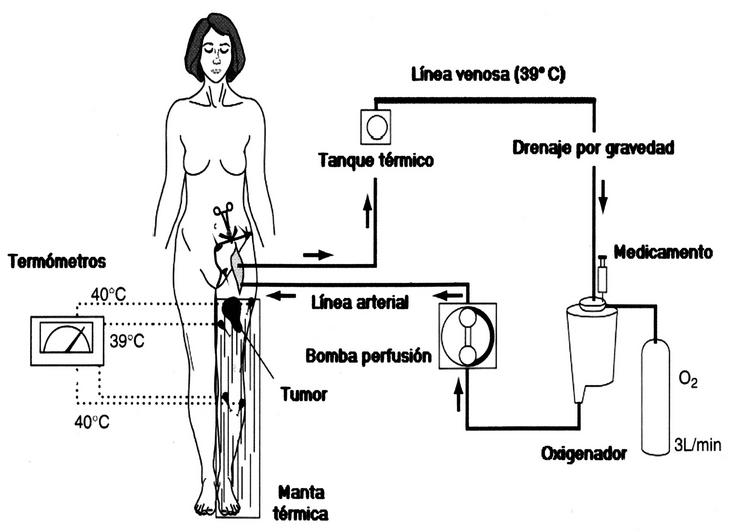
El aislamiento de la circulación sanguínea de un miembro con respecto a la circulación sistémica se consigue mediante el clampaje de los vasos principales de dicha extremidad, la ligadura de la vasculatura colateral, y para cerrar también los capilares musculares y cutáneos, la aplicación de una banda de Esmarch como torniquete en la base del miembro. Tras la canulación de los vasos principales, la extremidad aislada presenta una circulación sanguínea propia a través de un circuito extracorpóreo en el que se incluye una bomba motora de perfusión, un intercambiador de calor y un oxigenador; en dicho circuito es donde se inyecta el fármaco citostático (fig. 1).
Figura 1. Esquema del circuito extracorpóreo de la perfusión de extremidad aislada. L/min: litros por minuto; O2: oxígeno.
La PEA se puede lograr en 4 niveles vasculares diferentes en la pierna (ilíaco externo, femoral alto, femoropoplíteo, o poplíteo), y en el brazo, en dos niveles diferentes (axilar o braquial), dependiendo de la localización de la tumoración.
La dosis de los citostáticos se calcula con relación al volumen del miembro que se va a perfundir, el cual puede medirse sencillamente mediante la inmersión de la extremidad en agua4, o también mediante cálculos aritméticos que consideran el miembro como una superposición de cilindros de diferentes diámetros. La dosis habitual de melfalán en una PEA es de 10-13 mg/l de tejido perfundido, y la de factor de necrosis tumoral (TNF) de 2-4 mg. Transcurrida una hora y media de perfusión con citostáticos de la extremidad aislada, se procede al drenaje del perfusado, lavado de la extremidad con sueros hidroelectrolíticos (para evitar que los fármacos residuales en la extremidad se difundan hacia el resto del organismo al reinstaurar la circulación sanguínea natural), las cánulas vasculares se retiran y los vasos se reparan.
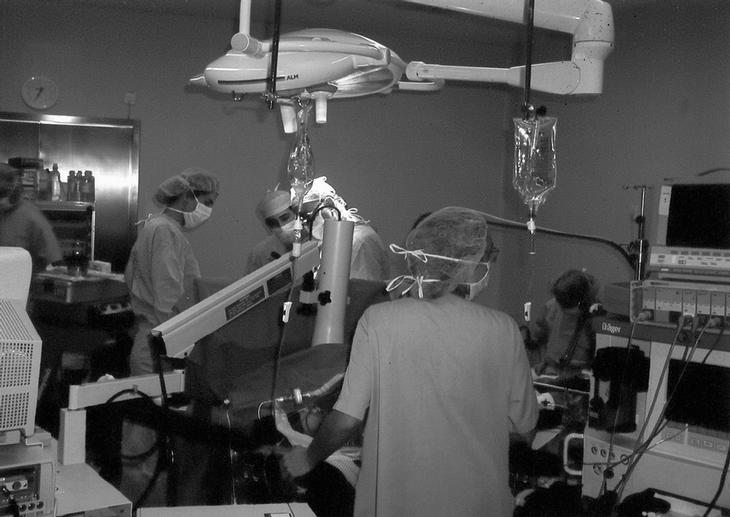
Es importante detectar durante el procedimiento la existencia de algún posible escape de los citostáticos hacia la circulación sanguínea. Para ello, dentro del circuito extracorpóreo se administra también albúmina marcada con yodo radiactivo de forma que, en caso de producirse un escape o fuga de sangre hacia la circulación sanguínea sistémica, se detecte con una sonda gammagráfica portátil colocada continuamente durante la PEA a nivel precordial (fig. 2). Si la técnica quirúrgica es realizada por un equipo experto la fuga del medicamento rara vez supera el 5%5. Sin embargo, la monitorización isotópica continua es obligatoria ya que, habida cuenta la elevada concentración del citostático en el perfusado, una fuga excesiva del mismo hacia el resto del organismo sería muy tóxica, especialmente por la administración del TNF, que podría dar lugar a un shock hemodinámico, insuficiencia renal, edema pulmonar y distrés respiratorio.
Figura 2. Cirugía de perfusión de extremidad aislada. Monitorización de fuga sistémica de fármacos mediante sonda gammagráfica portátil, situada a nivel precordial.
Este procedimiento, realizado correctamente por un equipo experto en PEA, es habitualmente bien tolerado, siendo excepcional la toxicidad grave, incluso con fármacos agresivos6. Habitualmente, los efectos secundarios son leves y consisten preferentemente en síntomas inflamatorios regionales; a veces, también se aprecia un cuadro clínico pseudovírico (fiebre, escalofríos), autolimitado y de corta duración.
Transcurridas 4-8 semanas de la PEA, comprobado en los estudios evolutivos que el tumor ha remitido en tamaño y ya no infiltra estructuras cruciales para el mantenimiento de la función de la extremidad, se realiza en un segundo tiempo la exéresis quirúrgica del tumor residual, conservando la extremidad y su función, lo cual redunda en la calidad de vida del paciente.
Hipertermia
La aplicación de hipertermia para mejorar la eficacia de la PEA se ha desarrollado durante las últimas tres décadas. Se fundamenta en dos hechos demostrados; por un lado, la captación in vivo del medicamento por el tumor es el doble a 39,5° C que a 37,0° C7, en segundo lugar, se sabe que el calor tiene un efecto citotóxico intrínseco sobre las células tumorales8. Estos fenómenos son muy significativos a partir de los 41° C, y de hecho, producen un aumento drástico de la sensibilidad de las células tumorales a algunos medicamentos citostáticos como son el melfalán, el TNF, el cisplatino, o a sus diferentes combinaciones, como se ha visto en estudios in vitro9,10.
La temperatura tisular se monitoriza continuamente durante la PEA mediante la colocación de sondas termométricas insertadas en los compartimentos subcutáneo e intramuscular de la extremidad, existiendo 4 rangos de hipertermia.
El nivel de temperatura conocido como «normotermia» (37° C a 38° C) se consigue evitando que la extremidad se enfríe, que conllevaría su vasoconstricción superficial durante la cirugía y una peor distribución de los citostáticos en el miembro. Para ello se calienta el perfusado con el intercambiador de calor del circuito y se envuelve la extremidad con una manta térmica. Los citostáticos se administran al perfusado en cuanto se alcanzan los 37° C en las sondas termométricas insertadas en la extremidad11.
Aunque algunas publicaciones parecen mostrar un aumento de beneficio en «hipertermia moderada» (38° C a 40° C)12-16, en pacientes con melanoma hay un estudio comparativo que no muestra beneficio significativo en el tiempo libre de recurrencia o progresión de la enfermedad de la hipertermia moderada con respecto a la normotermia17, si bien la tasa de respuestas mejora levemente.
A la temperatura de 40° C-41° C, conocida como «hipertermia verdadera límite» o border-line, se obtiene una mayor tasa de respuestas completas, pero posiblemente también con una toxicidad regional aumentada18-20.
Por último, hay estudios in vitro que muestran que la curva de aumento de eficacia del melfalán con el calor aumenta su pendiente fundamentalmente por encima de los 41° C, en el rango de temperaturas de la «hipertermia verdadera» (41° C a 43° C). De hecho, clínicamente aumentan las posibilidades de responder al tratamiento, pero también se asocia a una toxicidad regional inaceptable, que incluye amputaciones21,22.
La PEA con TNF y melfalán se realiza con hipertermia moderada, en el rango de 38°-39° C, para lograr más eficacia sin producir toxicidad inaceptable.
PERFUSIÓN DE EXTREMIDAD AISLADA EN EL TRATAMIENTO DE SARCOMAS DE PARTES BLANDAS LOCALMENTE AVANZADOS
Los resultados de la PEA con melfalán u otros fármacos como la adriamicina o el cisplatino en el tratamiento del SPB de extremidad, son decepcionantes23-31. Esta situación ha cambiado completamente con la administración del TNF. Desde abril de 1999 la European Agency for the Evaluation of Medicinal Products (EMEA) autorizó este fármaco para su administración mediante perfusión de extremidad aislada en pacientes con SPB de extremidad localmente avanzado.
Factor de necrosis tumoral-α
En 1988 los cirujanos Lejeune y Lienard, del Instituto Jules Bordet (Bruselas), fueron los pioneros en la administración del TNF en la perfusión de extremidad aislada. Desde entonces, comprobada la actividad antitumoral intrínseca del TNF y su actividad sinérgica con el melfalán, esta modalidad terapéutica ha generado un renovado interés en Oncología, no sólo por su eficacia, sino además por su validez como modelo paradigmático de bioquimioterapia.
El TNF es un agente pleiotrópico mediador del shock séptico, que además produce efectos antitumorales directos e indirectos32. Sin embargo, la administración sistémica endovenosa de TNF en pacientes oncológicos se asocia con la aparición de toxicidad severa y, desgraciadamente, efectos antitumorales insignificantes. Se realizaron estudios clínicos fase I/II33 que establecieron en 350mcg/m2 la dosis máxima tolerable de TNF administrado a través de una vía venosa. Esta dosis contrasta con la requerida para producir efectos antitumorales en modelos murinos, deduciéndose que es necesaria una dosis de 10 a 50 veces mayor que la administrada en los estudios fase I/II para poder alcanzar efectos antitumorales también en humanos34. Esta dosis superior sólo puede alcanzarse en el contexto de la perfusión de extremidad aislada, lo que le convierte en un fármaco ideal para ser administrado mediante esta técnica. Los efectos del TNF consisten en una necrosis hemorrágica del tumor, que se empieza a producir entre una y 4 horas después de su administración, y están relacionados con el daño que produce en el endotelio de los vasos tumorales35.
Perfusión hipertérmica de extremidad con TNF y melfalán en sarcomas: resultados clínicos
La PEA con TNF en combinación con melfalán es un tratamiento eficaz de bioquimioterapia en el manejo de pacientes con sarcoma de partes blandas localmente avanzado de las extremidades. Se asocia con una tasa de respuestas completas del 20% al 30%, y una tasa adicional de respuestas parciales de aproximadamente el 50%, consolidándose tasas de respuestas globales superiores al 75% en la experiencia creciente de múltiples centros36-38. Los resultados de un estudio europeo multicéntrico (270 perfusiones en 246 pacientes, en un período de 7 años) dieron lugar a que el TNF fuera aprobado y registrado en Europa en 1999, para el tratamiento de sarcomas38. En dicho estudio, se trataron 246 pacientes con SPB localmente muy avanzados, 55% de ellos eran tumores primarios, y el 45% recidivas locales; un 22% de los pacientes presentaba recidivas o primarios multifocales. El 15% de los pacientes además tenía metástasis a distancia, el 46% presentaba tumores mayores de 10 cm, y el 66% de los tumores era de grado histológico III. El 13% de los pacientes había recibido radioterapia previa, y el 15% quimioterapia. El tratamiento consistió en una PEA (n = 222) o dos PEA (n = 24) de 90 minutos a una temperatura de 39° a 40° C, con 2 a 4 mg de TNF más melfalán (10 a 13 mg/l volumen de extremidad). Los primeros 62 pacientes también recibieron interferon-gamma (IFN-gamma). En el 75% de los casos se objetivó una respuesta tumoral importante que permitió la realización de una resección del tumor remanente a los 2-4 meses de la perfusión. Las respuestas objetivas tumorales fueron: respuestas completas, 28%; respuestas parciales, 47%; estabilización de la enfermedad, 22%; y progresión del tumor, 3%. Dos comités evaluadores independientes coincidieron en que en el 80% de los casos (n = 196), solamente la PEA con TNF y melfalán ofrecía de inicio alguna posibilidad de conservación del miembro afecto, ya que el 67% eran incuestionablemente subsidiarios de amputación, y el 13% de resección local más radioterapia a expensas de una severa pérdida de función en dicha extremidad. Como consecuencia del tratamiento con la PEA, se conservó la extremidad en el 71% de esos 196 pacientes. Así pues, la administración del TNF en combinación con melfalán mediante la técnica de perfusión de extremidad aislada representa un nuevo estándar en el manejo de sarcomas de partes blandas irresecables de extremidad, subsidiarios de amputación física o funcional.
Se han obtenido resultados clínicos muy similares por grupos de perfusión italianos, con el TNF en combinación con adriamicina, pero a expensas de una mayor toxicidad locorregional asociada a la adriamicina e hipertermia39. La eficacia del TNF más melfalán ha sido asimismo demostrada, además de en 20 subtipos histológicos de SPB y melanoma40,41, en otros tumores malignos cutáneos y sarcomas óseos refractarios42,43, reflejando la importancia de la diana vascular tumoral del TNF en su actividad, independiente de la histología tumoral.
Análisis histológicos y radiológicos
Los efectos antitumorales de la PEA con TNF en combinación con melfalán e hipertermia pueden llegar a ser extremadamente rápidos, lo cual indica que el colapso del árbol vascular mediado por el TNF puede desempeñar un papel esencial en el mecanismo antitumoral. Los efectos destructivos selectivos de la PEA con TNF sobre los vasos tumorales han sido puestos de manifiesto mediante angiografías comparativas preperfusión y postinfusión44. Además, se han realizado estudios de resonancia magnética con espectroscopia en pacientes con sarcomas que objetivan la inactivación metabólica del tumor a las 16 horas del procedimiento, lo cual confirma de nuevo que el efecto más importante del TNF es sobre la vasculatura tumoral45.
Desde un punto de vista histopatológico se han descrito efectos intravasculares consistentes en agregación de plaquetas, estasis eritrocitaria y destrucción endotelial vascular, que corresponden a cambios tempranos tras la PEA, que remedan las observaciones en sistemas tumorales experimentales46,47.
Clínicamente, se reconocen dos modelos de respuesta tumoral tras la PEA: la necrosis hemorrágica aguda «típica» de la respuesta a TNF, concordante con los hallazgos histopatológicos y radiológicos descritos, y la remisión lenta de las lesiones sin los fenómenos típicos asociados al TNF48.
Modelos experimentales murinos
Se han desarrollado modelos animales de perfusión de extremidad usando el fibrosarcoma no inmunogénico BN175 en ratas Brown Norway, y el osteosarcoma ROS-1 en ratas WAG, buscando un mejor entendimiento de los mecanismos subyacentes a los resultados positivos objetivados con la PEA en humanos.
En ambos modelos se demuestra que la PEA con TNF como agente único no tiene impacto significativo sobre el crecimiento tumoral, ya que las células tumorales son resistentes al TNF. Sin embargo, con la administración conjunta de TNF y melfalán, se observa un potente efecto sinergístico antitumoral, produciendo respuestas tumorales completas en el 60% y el 70% de las ratas49,50. El TNF en solitario produce sólo necrosis central, sin remisión tumoral, como también se ha visto en el ámbito clínico51. De la misma forma, desde el punto de vista histopatológico, se aprecia una mayor necrosis hemorrágica en las biopsias realizadas tras la PEA con ambos fármacos en combinación52, consistente en daños endoteliales precoces y agregación plaquetaria en los vasos tumorales, que producen necrosis isquémica (coagulativa). Todo ello concuerda con lo observado en humanos.
Estas observaciones en modelos murinos confirman también que el TNF tiene un efecto mayor en tumores grandes, con vasculatura bien desarrollada, en contraste con los tumores pequeños, de diámetro menor de 3 mm, ya que no presentan una red capilar tumoral establecida53,54. Es más, en virtud del proceso angiogénico similar que se produce en la generación del estroma tumoral y en la cicatrización de heridas, se ha observado que en las zonas angiogénicas no tumorales (heridas cutáneas recientes, o piel peritumoral) también sufren un proceso de necrosis tras la PEA con TNF y melfalán, cosa que no ocurre con la administración de melfalán como agente único.
Aparte de la destrucción de vasos tumorales ya descrita se han identificado en estos modelos murinos diversos elementos responsables de la fuerte sinergia entre el TNF y citostáticos como el melfalán en la PEA.
Aumento de la captación de medicamentos por el tumor
Con altas dosis de TNF administrado en el perfusado del circuito extracorpóreo de la PEA se produce un aumento de la captación de fármacos en el tumor del orden de tres a 6 veces, que es específico del tumor y no se produce en los tejidos benignos circundantes55,56. Es posible que la disminución aguda de presión intersticial en el tumor tras la exposición a TNF pueda desempeñar un papel esencial en la selectividad tumoral del aumento de captación de fármacos57, lo cual es además concordante con los postulados de Jain58.
Acción de los leucocitos
En la rata leucopénica el efecto del TNF se pierde y no se observa la sinergia entre TNF y melfalán59. Esto se ha visto en ratas que recibieron irradiación corporal total y una PEA con TNF y melfalán en el momento de leucopenia máxima, en las que el efecto antitumoral era muy similar al producido con melfalán únicamente.
Dosis eficaz de TNF
El dintel inferior de dosis de TNF eficaz en los modelos murinos de perfusión de extremidad es en realidad 5 veces menor que la considerada estándar (50 μg), desapareciendo todos los efectos a dosis inferiores a 10 μg60. Este descubrimiento, junto con los resultados obtenidos en una serie pequeña de pacientes publicada por Hill et al61, sugiere que se podría explorar también una reducción de dosis del TNF en el contexto clínico.
Duración de la perfusión
Teniendo en cuenta la farmacocinética del melfalán la duración mínima de una PEA efectiva debería ser de 30 minutos, que es el tiempo que tarda el tumor en captar el fármaco. De hecho, períodos de perfusión más cortos se asocian con una disminución de las tasas de remisión tumoral, mientras que períodos de más de 30 minutos no parecen mejorar los resultados60.
Lógicamente, si el procedimiento de la PEA se puede hacer con menor dosis de TNF y con una menor duración que en la actualidad, se conseguiría un procedimiento más barato y con menos efectos secundarios.
Hipertermia
Se ha demostrado que temperaturas de 38° a 39° C son fundamentales para obtener una buena respuesta antitumoral; además a estas temperaturas no hay un daño significativo de los tejidos normales de la extremidad. A mayor temperatura se asocia efectos secundarios graves regionales, y a temperatura ambiente se pierde completamente la eficacia antitumoral en los modelos murinos de PEA60.
Efecto de la hipoxia
En la PEA con TNF o con melfalán como agentes únicos, la hipoxia puede aumentar el efecto antitumoral. Sin embargo, en la PEA con TNF más melfalán en combinación, la hipoxia ya no aumenta significativamente la eficacia del procedimiento, posiblemente debido a que la sinergia entre ambos medicamentos enmascara cualquier mínima mejora en los resultados dependiente de la disminución de oxígeno en el tumor60.
DESARROLLOS EXPERIMENTALES
Nuevos medicamentos
Interferón-gamma
Se ha demostrado que el interferón-gamma y el TNF son sinérgicos, tanto in vitro como en modelos tumorales murinos, donde se objetiva un leve aumento en la tasa de respuestas completas, entorno a un 10% adicional62, semejante a los hallazgos clínicos en melanomas63, pero a expensas de una mayor toxicidad.
Inhibidores de óxido nítrico
El óxido nítrico (NO) es una molécula que inhibe la agregación plaquetaria y mantiene el tono vascular y la integridad de su pared. Por lo tanto, su inhibición podría dar lugar a hipoxia y agregación plaquetaria, y como consecuencia, aumento de los efectos antitumorales del TNF.
Se ha estudiado en el modelo murino BN175 la PEA con TNF en combinación con dos inhibidores de la síntesis de NO, los análogos de arginina L-NAME y LNA. Se observa necrosis importante e inmediata, tanto en el tumor como en la piel del peritumoral, que normalmente sólo se ven cuando se añade melfalán o hipoxia al TNF, poniendo de manifiesto que la inhibición del NO puede aumentar los efectos vasculares del TNF sobre el tumor64.
Terapia génica
La perfusión aislada de extremidad es una técnica de administración regional de medicamentos, lo cual la convierte en una modalidad muy interesante para la terapia génica mediada por vectores adenovíricos. Se ha demostrado que la PEA es el mejor método para la administración efectiva y homogénea de genes mediante vectores adenovíricos. Diversos experimentos con modelos murinos de PEA en sarcomas de partes blandas y osteosarcomas, mediante un marcador génico, la luciferasa65, lo han puesto de manifiesto, apreciándose además que la PEA con interleukina-3 administrada mediante un vector génico adenovírico produce remisiones tumorales en algún caso, en contraste con la ineficacia derivada de la utilización de otras vías para esta terapia génica, como la endovenosa, intraarterial o intratumoral directa66.
En conclusión, con la incorporación del TNF, gracias a sus efectos antitumorales directos y sinérgicos con el melfalán, la PEA ha mejorado dramáticamente su eficacia en el tratamiento de diferentes tumores. En este sentido, ha sido muy importante descubrir que el TNF aumenta enormemente la captación de medicamentos por el tumor.
Como resultado de ello, la PEA con TNF y melfalán, en hipertermia, es hoy el tratamiento estándar en pacientes con sarcomas de partes blandas irresecables de extremidad y subsidiarios de amputación física o funcional del miembro afecto, ya que consigue su conservación en la gran mayoría de los casos. Ningún otro tratamiento disponible en la actualidad produce resultados comparables en esta indicación.
El potencial de otros medicamentos vasoactivos y sinérgicos, o con mecanismos de acción singulares, está siendo explorado en la actualidad dentro de este contexto.